Способ определения полимерных молекул хитозана в препаратах хитозана
Иллюстрации
Показать всеИспользование: биотехнология, для определения содержания полимерных молекул хитозана, хитозан-хитиновых полимерных молекул и молекул хитозан-белкового комплекса в готовых формах хитозана. Сущность изобретения: используют высокоэффективную хроматографическую колонку, заполненную полидивинилбензольным сорбентом, с рефрактометрическим детектором. В качестве элюента и для растворения проб препарата хитозана используют водный раствор уксусной кислоты. Определение молекулярно-массового распределения полимерных молекул хитозана осуществляют по первому хроматографическому пику, а содержание полимерных молекул рассчитывают по площадям первого, второго и третьего хроматографических пиков, разделенных до нулевой линии и принадлежащих, соответственно, полимерным молекулам хитозана, хитозан-хитиновым полимерным молекулам и молекулам хитозан-белкового комплекса. Для расчета молекулярно-массового распределения полимерных молекул хитозана отдельно получают калибровочную кривую с помощью стандартов полимера декстрана. 3 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к биотехнологии - получению хитозана, и может быть использовано для определения методом эксклюзионной хроматографии полимерных молекул хитозана, смешанных хитозан-хитиновых молекул и молекул хитозан-белкового комплекса в готовых формах препаратов хитозана.
Хитозан получают путем деацетилирования природного полимера хитина - линейного аминополисахарида, состоящего из N-ацетил-2-амино-2-дезокси-D-глюкозопиразных звеньев, выделяемого из панцирей ракообразных и других природных источников, содержащих белок до 25-55% [1].
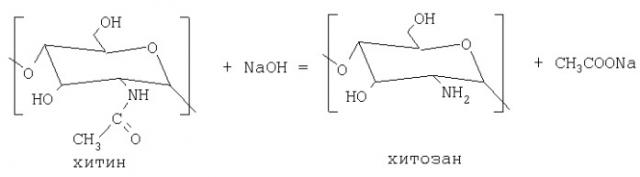
Деацетилирование хитина осуществляют обработкой его концентрированным раствором щелочи при повышенной температуре. При этом от структурной единицы хитина отщепляется ацетильная группировка, благодаря чему хитин превращается в хитозан, представляющий собой высокомолекулярный полимер глюкозамина (2-амино-2-дезокси-D-глюкозы) по схеме:
Так как реакция деацетилирования сопровождается одновременным разрывом части гликозидных связей полимера хитина, то образующийся хитозан представляет собой полидисперсный по молекулярной массе полимер D-глюкозамина, содержащий 5-15% ацетамидных групп, а содержание белка уменьшается до значения менее 1%, который присутствует в виде хитозан-белкового комплекса [1]. Поэтому необходимо иметь также методики определения полимерных молекул хитозана, в которых содержащиеся примесные гетерогенные молекулы с хитозан-хитиновыми звеньями и хитозан-белковые комплексы выходили бы отдельными от хитозана хроматографическими пиками.
Известны различные способы получения экспериментальных данных, необходимых для расчета ММР полимерных молекул по результатам эксклюзионно-хроматографического разделения пробы разбавленного раствора полимера [2, с.139-145].
Недостатком известного способа [2] является то, что в нем не рассматриваются способы эксклюзионно-хроматографического разделения полимерных молекул хитозана.
Известны также методы [3, 4] для определения параметров ММР полимеров, в которых параллельно определяются гидродинамический объем молекул, внутренняя вязкость раствора и масса полимерной молекулы, позволяющие построить универсальную молекулярно-массовую калибровочную кривую для любого типа полимеров.
Недостатком известных методов [3, 4] является то, что они применимы только для растворов молекул полимеров, имеющих молекулярную массу не менее 2200 дальтон, а в случае определения ММР полимерных молекул хитозана, интерес представляют молекулярные массы олигомеров и полимеров хитозана также и до 2200 дальтон.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому способу, выбранным в качестве ближайшего аналога, является способ определения полимерных молекул хитозана с помощью метода высокоэффективной эксклюзионной хроматографии [5].
В этом способе применяют колонку из нержавеющей стали, состоящей из секций общей длины 5,5 м, внутренним диаметром 3,18 мм, заполненную зернами пористого стекла, зернением 37-74 мкм, диаметром пор от 2500 до 40 Å. На пористое стекло наносили ковалентно связанное глицероловое покрытие, чтобы инактивировать группы свободной кремниевой кислоты на поверхности пористого стекла. Выбор комбинаций колонок был основан на требовании выделения более высокой по молекулярной массе фракции хитозана и чтобы получить линейную калибровочную кривую по декстранам в пределах необходимых молекулярных масс. Лучшей комбинацией размеров пор стекла и длин колонок, объединенных в секции по 61 см, была: 2500 Å (61 см), 1500 Å (121,9 см), 550 Å (182,9 см), 250 Å (61 см), 100 Å (61 см) и 40 Å (61 см).
В качестве элюента и для растворения проб препарата хитазана и стандартов декстрана использовали 2%-ный водный раствор уксусной кислоты. В колонку пробы хитозана вводили по 500 мкг (100 мкл 0,5% или 50 мкл 1% раствора), а пробы стандартов декстрана по 250 мкг (50 мкл 0,5% раствора).
Разделяемые на колонке полимерные молекулы хитозана и стандарты дестрана детектировали, пропуская элюент через детектор - проточную оптическую кювету дифференциального рефрактометрического детектора, сигналы которого записывали на диаграммной ленте самописца, движущейся со скоростью - 1 см/мин.
В отдельных экспериментах, используя стандарты полимеров декстрана Т-серии с молекулярной массой от 10000 (Т-10) до 2000000 (Т-2000) дальтон, получали калибровочную зависимость, определяющую зависимость объема удерживания стандартов декстрана от их молекулярной массы (MM). MM повторяющегося элементарного звена полимерной молекулы хитозана (2-амино-2-дезокси-D-глюкозы) приближенно приравнивали к MM элементарного повторяющегося звена полимера декстрана (D-глюкозы) и таким образом получали калибровочную зависимость для полимерных молекул хитозана. На основе полученной таким образом калибровочной зависимости полимерных молекул хитозана и полученной хроматограммы пробы хитозана, с использованием существующих программ рассчитывали ММР полимерных молекул хитозана, а также средневесовые (MW) и среднечисленные (МN) молекулярные массы хитозана.
Недостатком ближайшего аналога является следующее:
- не достигается разделение полимерных молекул хитозана на отдельные разделенные до нулевой линии фракции составных частей исходного препарата хитозана, вся область хроматограммы приписана одному веществу - полимерным молекулам хитозана без обнаружения полимерных молекул с различным химическим составом, а признается только наличие молекул хитозана с различными ММ;
- получаемые значения MW и MN являются значениями для смешанных фракций, содержащих одновременно и полимерные молекулы хитозана, и полимерные молекулы с хитозан-хитиновыми звеньями, и белково-хитозановые комплексы;
- сорбент имеет активные центры - группы свободной кремниевой кислоты на поверхности пористого стекла, которые полностью не дезактивируются глицероловым покрытием, эти группы сорбируют полимерные молекулы хитозана, гетерогенные молекулы с хитозан-хитиновыми звеньями и молекулы хитозан-белковых комплексов, что препятствует их разделению.
Задача, решаемая данным изобретением, - определение полимерных морлекул хитозана в препаратах хитозана.
Решение поставленной задачи обеспечивается тем, что в способе определения полимерных молекул хитозана в препаратах хитозана, заключающемся в растворении в элюенте приготовляемой пробы препарата хитозана, введении ее в высокоэффективную хроматографическую колонку с сорбентом для эксклюзионно-хроматографического разделения, элюировании разделяемых молекул из колонки и детектировании их при прохождении пробы через рефрактометрический детектор, сигналы которого регистрируют, при этом для расчета ММР полимерных молекул хитозана отдельно получают калибровочную кривую с помощью стандартов полимера декстрана, в качестве элюента и для растворения проб препарата хитозана используют 3-4%-ный водный раствор уксусной кислоты, а для эксклюзионно-хроматографического разделения - хроматографическую колонку, заполненную высокосшитым полимерным сорбентом - полидивинилбензолом, при этом на хроматограмме регестрируются три хроматографических пика, разделенных до нулевой линии и принадлежащих, соотвественно, полимерным молекулам хитозана (1 пик), гетерогенным полимерным молекулы с хитозан-хитиновыми звеньями (2 пик) и молекулам хитозан-белкового комплекса (3 пик). Определение ММР полимерных молекул хитозана осуществляют по первому хроматографическому пику, а содержание полимерных молекул расчитывают по площадям первого, второго и третьего хроматографических пиков, разделенных до нулевой линии и принадлежащих, соответственно, полимерным молекулам хитозана, смешанным хитозан-хитиновым полимерным молекулам и молекулам хитозан-белкового комплекса.
Для этого может быть использована хроматографическая колонка длиной 150 мм, внутренним диаметром 3 мм (150 мм × 3 мм), заполненная высокосшитым полидивинилбензольным сорбентом в виде моносферических зерен диаметром 10 мкм, характеризующаяся высокой эффективностью разделения.
Пример 1. Калибровка хроматографической колонки для расчета ММР полимерных молекул хитозана в препаратах хитозана.
Калибровка хроматографической колонки из стекла (150 мм × 3 мм), заполненной моносферическими зернами диаметром 10 мкм высокосшитого полидивинилбензольного (ПДВБ) сорбента [6, с.68], приготовленная по методике [7], заключается в установлении зависимости между объемом удерживания и логарифмом молекулярной массы (ММ) стандартов полимеров декстрана в линейном диапазоне.
При выполнении калибровки хроматографической колонки должны быть соблюдены следующие условия:
Пробы в концентрации 0,05 мас.% стандартов декстрана Т-серии с молекулярной массой от 504 дальтон (мальтотриоза) до 2000000 (Т-2000) дальтон готовят в 4%-ном водном растворе уксусной кислоты и предварительно фильтруют через фильтр с размером пор 0,25 мкм.
Хроматографируемые на колонке стандарты полимеров декстрана детектируют при прохождении пробы через проточную оптическую кювету дифференциального рефрактометрического детектора RIDK-102 (с проточной кварцевой кюветой объемом 10 мкл), сигналы детектора записывают с помощью копъютерной программы "Экохром" [8] или на диаграммной ленте самописца TZ-4620 (скорость - 6 мм/мин).
Объемная скорость потока элюента - 4%-ного водного раствора уксусной кислоты - 0,2 мл/мин. Температура термостата колонки, инжектора, рефрактометра - 25°С. Объем дозирующей петли инжектора - 10 мкл. Чувствительность рефрактометрического детектора RIDK-102 - 4-8×10-7 ед. рефракции.
Калибровку осуществляют последовательным введением с помощью инжектора жидкостного хроматографа в колонку с ПДВБ сорбентом по 10 мкл 0,05%-ного раствора каждого стандарта полимера декстрана.
После введения пробы стандарта полимера декстрана в инжектор жидкостного хроматографа, проба из инжектора вводится элюентом в колонку с ПДВБ сорбентом и после колонки проходит через проточную кювету рефрактометра, сигналы которого записывают с помощью компьютера или на диаграммной ленте самописца в виде сначала нарастающего, а затем уменьшающегося сигнала - так называемого хроматографического пика. На хроматографическом пике находят максимум значения и соответствующий ему объем прошедшего через колонку элюента, который называется объемом удерживания (Vr, мл).
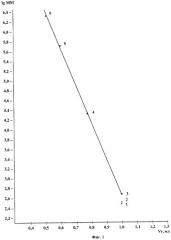
Строят калибровочный график зависимости между объемом удерживания и логарифмом молекулярной массы стандартов полимеров декстрана, представленный на фиг.1. Хроматографическая колонка из стекла (150 мм × 3 мм), заполненная высокосшитым ПДВБ сорбентом в виде моносферических зерен диаметром 10 мкм. 1 - глюкоза (ММ 180), 2 - мальтоза (MM 342), 3 - мальтотриоза (MM 504), 4 - дестран T-20 (MM 20000), 5 - дестран Т-500 (MM 500000), 6 - дестран Т-2000 (MM 2000000). Линейный диапазон находится в пределах ММ от 504 до 2000000 дальтон.
Пример 2. Определение полимерных молекул хитозана в коммерческом препарате хитозана. Приготавливают 0,05%-ный раствор препарата хитозана в 4%-ном водном растворе уксусной кислоты и эту пробу объемом 10 мкм вводят в хроматографическую колонку из стекла (150 мм × 3 мм), заполненную моносферическими зернами диаметром 10 мкм высокосшитого ПДВБ сорбента при следующих условиях хроматографического анализа.
Разделяемые на колонке полимерные молекулы хитозана, гетерогенные полимерные молекулы с хитозан-хитиновыми звеньями и хитозан-белковые комплексы детектируют при прохождении пробы через проточную оптическую кювету дифференциального рефрактометрического детектора RIDK-102 при чувствительности - 4×10-7 ед. рефракции, сигналы детектора записывают на диаграммной ленте самописца TZ-4620 при скорости диаграммной ленты - 6 мм/мин.
Скорость потока элюента - 4%-ного водного раствора уксусной кислоты - 0,2 мл/мин. Температура термостата колонки, инжектора, рефрактометра - 25°С. Объем дозирующей петли инжектора - 10 мкл.
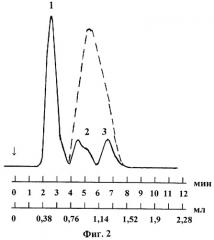
На фиг.2 представлена полученная хроматограмма полимерных молекул различного химического состава коммерческого препарата хитозана. На хроматограмме получены три хроматографических пика, разделенных до нулевой линии рефрактометра. 1 - полимерные молекулы хитозана (Vr=0,475 мл), 2 - гетерогенные полимерные молекулы с хитозан-хитиновыми звеньями (Vr=0,855 мл), 3 - молекулы хитозан-белкового комплекса (Vr=1,267 мл). Эти хроматографические условия позволяют определять ММР полимерных молекул хитозана в препарате хитозана (см. таблицу 1), содержание полимерных молекул расчитывают по площадям первого, второго и третьего хроматографических пиков, разделенных до нулевой линии и принадлежащих, соответственно, полимерным молекулам хитозана, смешанным хитозан-хитиновым полимерным молекулам и молекулам хитозан-белкового комплекса.
Для идентификации химических соединений, присутствующих в разделенных хроматографических пиках, то есть для отнесения хроматографических пиков к полимерным молекулам определенного химического состава, проводят хроматографическое разделение пробы препарата хитозана в тех же условиях, но с использованием ультрафиолетового детектора (спектрофотометр фирмы Хитачи с проточной кварцевой кюветой объемом 7 мкл), измеряющего поглощение электромагнитных колебаний при длине волны 235 нм. Других полос поглощения в ультрафиолетовой области спектра в коммерческом препарате хитозана не обнаружено. Хроматогорамма, полученная с использованием ультрафиолетового детектора с длиной волны 235 нм, приведена на фиг.2 в виде штриховой линии.
Сравнение хроматограмм, полученных с рефрактометрическим и ультрафиолетовым детекторами, показывает, что полимерные молекулы, присутствующие в пике 1, не поглощают электромагнитные колебания в ультрафиолетовой области спектра с длиной волны 235 нм, в то время как полимерные молекулы в пиках 2 и 3 поглощают в ультрафиолетовой области спектра с длиной волны 235 нм. Эти данные позволяют отнести хроматографический пик 1 к чистому хитозану, поскольку алифатические амины не поглощают в ультрафиолетовой области спектра [9, с.147].
Полимерные молекулы в хроматографическом пике 2 поглощают в ультрафиолетовой области спектра при длине волны 235 нм значительно интенсивнее, чем молекулы в пике 3, в то время как площади этих пиков различаются незначительно. Это соответствует тому, что молекул недеацетилированного хитина (N-ацетил-2-амино-2-дезокси-D-глюкозы) в препарате хитозана значительно больше (5-15%), чем молекул хитозан-белкового комплекса (до 1% белка) [1]. Молекулы хитина поглощают в ультрафиолетовой области спектра благодаря наличию группировки пептидной связи -СО-NH- [9, с.250]; молекулы хитозан-белкового комплекса поглощают также благодаря пептидным связям, имеющимся в молекуле белка.
Бимодальная форма хроматографического пика 2 указывает, что в этом пике содержатся неравномерные наборы полимерных молекул, содержащих в своей линейной цепи элементарные повторяющиеся звенья молекул как хитозана, так и хитина. При этом соотношение повторяющихся единиц хитина и хитозана различно для разных полимерных молекул. Унимодальная форма пика 3 указывает на большую однородность химического состава молекул хитозан-белковых комплексов.
По хроматограмме (фиг.2, рефрактометрический детектор) определены площади трех хроматографических пиков и расчитаны относительные содержания, которые равны (в %):
| для полимерных молекул хитозана (пик 1) | 67 |
| для хитозан-хитиновых полимерных молекул (пик 2) | 17 |
| для молекул хитозан-белковых комплексов (пик 3) | 16 |
Вычисления ММР полимерных молекул хитозана по данным разделения методом эксклюзионной хроматографии и калибровочной кривой проводили с помощью компьютерной программы "Экохром" [8] и по программе, приведенной в монографии [10, с.318-322]. Результаты вычисления ММР полимерных молекул хитозана в коммерческом препарате хитозана приведены в таблице 1.
| Таблица 1Данные по ММР полимерных молекул хитозана в коммерческом препарате хитозана | ||||||||
| i | Vi, мл | hi, мм | lg Mi | Mi, г/моль | hi/Mi | hi·Mi | ||
| 11 | 0,355 | 0 | 272 | 6,4786 | 3,01·106 | 0 | 0 | 0 |
| 10 | 0,396 | 18 | 272 | 6,0492 | 1,12·106 | 1,61·10-5 | 2,08·107 | 0,018 |
| 9 | 0,434 | 37 | 254 | 5,7118 | 5,15·105 | 7,18·10-5 | 1,91·107 | 0,136 |
| 8 | 0,475 | 63 | 217 | 5,4997 | 3,16·105 | 2,0·10-4 | 2,0·107 | 0,262 |
| 7 | 0,512 | 65 | 154 | 5,1206 | 1,32·105 | 4,92·10-4 | 8,62·106 | 0,239 |
| 6 | 0,554 | 40 | 89 | 4,8202 | 6,61·104 | 6,04·10-4 | 2,64·106 | 0,147 |
| 5 | 0,592 | 27 | 49 | 4,6998 | 5,01·104 | 5,39·10-4 | 1,35·106 | 0,099 |
| 4 | 0,633 | 11 | 22 | 4,3997 | 2,51·104 | 4,38·10-4 | 2,76·106 | 0,0405 |
| 3 | 0,674 | 7 | 11 | 4,1004 | 1,26·104 | 5,56·10-4 | 8,81·104 | 0,0257 |
| 2 | 0,712 | 4 | 4 | 3,8998 | 7,94·103 | 0,504·10-3 | 3,18·104 | 0,0147 |
| 1 | 0,740 | 0 | 0 | 3,6998 | 5,01·103 | 0 | 0 | 0 |
| Σ=0,007957 | Σ=75389900 | |||||||
| MW=277169 г/моль, MN=34184 г/моль, MW/MN=8,1 |
Уравнения для расчета средневесовой (MW) и среднечисленной (МN) молекулярных масс были следующие:
, , - дисперсия молекулярных масс.
где: i - номер фрагмента хроматографического пика
Vi - объем удерживания, мл;
hi - есть высота при каждом 10-секундном интервале хроматографического пика;
Mi - молекулярная масса полимерных молекул хитозана i;
Wi=hi/Σhi - доля полимерных молекул хитозана с заданной ММ в исходной пробе;
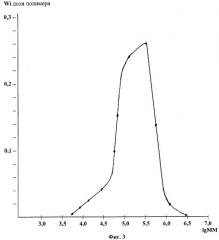
Полученное ММР полимерных молекул хитозана в коммерческом препарате хитозана показано на фиг.3.
Пример 3. Определение полимерных молекул хитозана в коммерческом препарате хитозана производят по условиям примера 2, с той разницей, что для растворения пробы препарата хитозана и в качестве элюента используют 2%-ный водный раствор уксусной кислоты. Хроматографический анализ с использованием рефрактометрического детектора показывает, что на хроматограмме регистрируются два хроматографических пика. 1 - полимерные молекулы хитозана, 2 - гетерогенные полимерные молекулы с хитозан-хитиновыми звеньями, молекулы хитозан-белкового комплекса и низкомолекулярный хитозан. По площади второй Хроматографический пик больше, чем первый, что подтверждает присутствие во втором хроматографическом пике низкомолекулярного хитозана.
При использовании в качестве элюента - 2%-ного водного раствора уксусной кислоты на высокоэффективной хроматографической колонке (150 мм × 3 мм) с ПДВБ сорбентом не достигается достоверное определение ММР хитозана и гетерогенные полимерные молекулы с хитозан-хитиновыми звеньями и молекулы хитозан-белкового комплекса на колонке не делятся.
Пример 4. Способ определения полимерных молекул хитозана в коммерческом препарате хитозана производят по условиям примера 2, с той разницей, что для растворения пробы хитозана и в качестве элюента использовали 3%-ный водный раствор уксусной кислоты. Хроматографический анализ с использованием рефрактометрического детектора показывает, что препарат хитозана выходит тремя хроматографическими пиками: 1 - полимерные молекулы хитозана, 2 - гетерогенные полимерные молекулы с хитозан-хитиновыми звеньями, 3 - молекулы хитозан-белкового комплекса, которые разделяются на колонке до нулевой линии. По этой хроматограмме также можно вычислять ММР полимерных молекул хитозана в препарате хитозана и содержание полимерных молекул хитозана, смешанных хитозан-хитиновых полимерных молекул и молекул хитозан-белкового комплекса.
Пример 5. Способ определения полимерных молекул хитозана в коммерческом препарате хитозана производят по условиям примера 2, с той разницей, что для растворения пробы хитозана и в качестве элюента использовали 5 и 6%-ный водный раствор уксусной кислоты. Хроматографический анализ с использованием рефрактометрического детектора показывает, что препарат хитозана выходит тремя хроматографическими пиками: 1 - полимерные молекулы хитозана, 2 - гетерогенные полимерные молекулы с хитозан-хитиновыми звеньями, 3 - молекулы хитозан-белкового комплекса, которые не разделяются на колонке до нулевой линии, так как чувствительность анализа снижается, что не позволяет с высокой точностью определять ММР полимерных молекул хитозана и содержание молекул хитозана, хитозан-хитиновых полимерных молекул и молекул хитозан-белкового комплекса.
Источники информации
1. Быкова В.М., Немцев С.В. Сырьевые источники и способы получения хитина и хитозана. В кн.: Хитин и хитозан. Получение, свойства и применение. Под ред. Скрябина К.Г., Вихоревой Г.А., Варламова В.П. М.: Наука, 2002, с.7-23.
2. Беленький Б.Г., Виленчик Л.З. Хроматография полимеров. - М.: Химия, 1978, с.139-145.
3. Патент США №3837217 (24.09.1974), НКИ 73-61.1 С. Измерение молекулярно-весового распределения полимеров.
4. Патент США №4775943 (04.10.1988), НКИ 364-497. Метод и аппарат для молекулярно-весового распределения параметров полимера.
5. А.С.М.Wu, W.A.Bough, E.C.Conrad, K.E.Alden. Determination of molecular-weight distribution of chitosan by high-performace liquid chromatography. J. of Chromatography, 128 (1976) 87-99.
6. Яшин Я.И., Яшин А.Я. Высокоэффективная жидкостная хроматография. Состояние и перспективы. Ж. Рос. хим. общества им. Д.И.Менделеева, 2003, т.47, №1, с.64-79.
7. Заявка на патент России №2005102875 от 07.02.2005 г., МКИ G 01 N 15/08. Способ приготовления высокоэффективных колонок с полимерными сорбентами для жидкостной хроматографии. /Хабаров В.Б., Пронин А.Я., Ермаков В.В., Буряк А.К., Хабаров М.В.
8. Пограмма "Экохром", разработана ведущим конструктором Института органической химии им. Н.Д.Зелинского РАН Бойцовым В.Н.
9. Химическая энциклопедия. Москва, 1988, т.1, с.147, 250
10. W.W.Yau, J.J.Kirkland, D.D.Biy. Modem Size-Exclusion liquid chromatograhy. Practice of Gel permleation and Gel Filtration Chromatograhy. New York - Chichester - Brisban - Toronto, 1979. P.77, 318-322, 391-393.
1. Способ определения полимерных молекул хитозана в препаратах хитозана, заключающийся в приготовлении пробы путем растворения навески препарата хитозана в растворе кислоты, введении ее в высокоэффективную хроматографическую колонку с сорбентом для эксклюзионного хроматографического разделения, промывании колонки элюентом - раствором кислоты, детектировании разделяемых молекул при прохождении пробы через рефрактометрический детектор, сигналы которого регистрируют в виде хроматограммы, расчете молекулярно-массового распределения полимерных молекул препарата хитозана, причем для расчета молекулярно-массового распределения используют калибровочную зависимость величин логарифма молекулярных масс эталонов декстрана от объема их выхода из хроматографической колонки, отличающийся тем, что в качестве сорбента для эксклюзионно-хроматографического разделения полимерных молекул препарата хитозана используют высокосшитый полидивинилбензольный сорбент и определение молекулярно-массового распределения полимерных молекул хитозана осуществляют по первому хроматографическому пику, а содержание полимерных молекул рассчитывают по площадям первого, второго и третьего хроматографических пиков, разделенных до нулевой линии и принадлежащих соответственно полимерным молекулам хитозана, смешанным хитозан-хитиновым полимерным молекулам и молекулам хитозан-белкового комплекса.
2. Способ определения полимерных молекул хитозана в препаратах хитозана по п.1, отличающийся тем, что используют полидивинилбензольный сорбент в виде моносферических гранул диаметром 10 мкм.
3. Способ определения полимерных молекул хитозана в препаратах хитозана по п.1, отличающийся тем, что в качестве элюента и для растворения препарата хитозана используют 3-4%-ный водный раствор уксусной кислоты.
4. Способ определения полимерных молекул хитозана в препаратах хитозана по п.1, отличающийся тем, что для идентификации хроматографических пиков используют ультрафиолетовый и рефрактометрический детекторы.