Фармацевтический препарат, содержащий оксикодон и налоксон
Иллюстрации
Показать всеПредложена фармацевтическая композиция для лечения боли, содержащая оксикодон и налоксон в матрице с использованием этилцеллюлозы, и аналогичная в матрице с использованием этилцеллюлозы и жирного спирта. Изобретение отличается тем, что активные соединения выделяются из препарата длительно, неизменно и независимо друг от друга, при этом композиция стабильна при хранении. 2 н. и 23 з.п. ф-лы, 7 ил., 11 табл.
Реферат
Изобретение касается стабильного при хранении фармацевтического препарата, содержащего оксикодон и налоксон.
Лечение острой боли, которая возникает при таких болезнях, как рак, ревматизм и артрит, является основной проблемой при лечении этих болезней. Боли, чувствуемые пациентами, страдающими от опухолей, включают боль периоста и боль самой кости, а также висцеральную боль и боль в мягких тканях. Все такие виды боли делают повседневную жизнь пациентов непереносимой и часто приводят к депрессивным состояниям. Эффективная терапия боли, приводящая к продолжительному улучшению качества жизни пациентов, является поэтому так же важной для успеха общей терапии, как и лечение действительных причин болезни.
С учетом важности успешного лечения боли, Всемирная организация здравоохранения (ВОЗ) создала четырехстадийную модель лечения пациентов, страдающих от боли при наличии опухолей. Было доказано, что это модель является эффективной в каждодневной рутинной практике и может быть распространена на пациентов, страдающих от хронической боли и других видов боли, вызванных заболеваниями, не включающими рак. При этой терапии в зависимости от интенсивности, качества и локализации боли различаются четыре стадии, причем каждая следующая стадия показана в случаях, когда эффект от использования агента, облегчающего боль, использовавшегося до сих пор, более не является достаточным (Ebell, H.J., Bayer A. (Ed): Die Schmerzbehandlung von Tumorpatienten, Thieme 1994 (Supportive Massnahmen in der Onkologie, Band 3) и Zech, D.; Grond, S.; Lynch, J.; Hertel D.; Lehmann, K.: Validation of World Health Organisation Guidelines for Cancer Pain Relief: a 10-year prospective study. Pain (1995), 63, 65-76).
В соответствии с этой четырехстадийной моделью ВОЗ опиодные анальгетики играют центральную роль при лечении боли. Группа опиоидных анальгетиков, помимо морфина, который является прототипом этих фармацевтических агентов, включает также оксикодон, гидроморфон, никоморфин, дигидрокодеин, диаморфин, папаверетум, кодеин, этилморфин, фенилпиперидин и их производные, литадон, декстропропоксифен, бупренорфин, пентазоцин, тилидин, трамадол и гидрокодон. В АТС-классификации (Anatomical Therapeutic Chemical Classification) ВОЗ указано, какой фармацевтически активный агент является опиоидньм анальгетиком. Выраженный эффект облегчения боли, проявляемый опиоидным анальгетиком, обусловлен имитацией действия эндогенных морфиноподобных действующих веществ ("эндогенных опиоидов"), физиологическая функция которых состоит в контролировании приема и переработки болевых раздражителей.
Опиоиды подавляют распространение болевых раздражителей. Помимо немедленного ингибирования трансдукции нейронного возбудительного сигнала в спинном мозге, вызванного опиоидами, релевантной является активация таких нервных трактов, которые проектируют ствол мозга в спинной мозг. Эта активация приводит к ингибированию распространения боли в спинном мозге. Более того, опиоиды ограничивают прием боли таламусом и, влияя на лимфосистему, они влияют на оценку аффективной боли.
Опиоидные рецепторы обнаружены на различных участках тела. Рецепторы интестина и мозга имеют особенное значение для терапии боли при помощи опиоидов, особенно потому, что их наличие приводит к различным побочным эффектам. Считают, что опиоидные анальгетики являются сильньми агонистами, если они связываются с высоким сродством с опиоидными рецепторами и вызывают сильное ингибирование восприятия боли.
Вещества, которые также с высоким сродством связываются с опиоидньми рецепторами, но не провоцируют уменьшение ощущения боли и которые при этом противодействуют опиоидным агонистам, называют антагонистами. В зависимости от характера связывания и индуцированной активности опиоиды можно подразделить на чистые агонисты, смешанные агонисты/антагонисты и чистые антагонисты.
Чистые антагонисты включают, например, налтрексон, налоксон, налмефен, налорфин, налбуфин, налоксонеазинен, метилналтрексон, кетилциклазоцин, норбиналторфимин, налтриндол, 6-β-налоксол и 6-β-налтрексол (Forth W.; Henschler D.; Rummel W.; Starke K.: Allgemeine und Spezielle Pharmakologie und Toxikologie, 7. Auflage, 1996, Spektrum Akademischer Veriag, Heidelberg Berlin, Oxford).
Благодаря их хорошей анальгетической эффективности такие соединения, как оксикодон, тилидин, бупренорфин и пентазоцин, использовались в виде лекарственных препаратов для лечения боли. Такие препараты, как Oxigesic® (где анальгетически активным соединением является оксикодон) и Valoron® (где анальгетически активным соединением является тилидин) оказались ценньми для терапии боли.
Однако применение опиоидных анальгетиков для терапии боли может сопровождаться нежелательными побочными эффектами. Так, длительное применение опиоидных анальгетиков может привести к физиологической и физической зависимости. Физическая зависимость пациентов, страдающих от боли, от опиоидных анальгетиков приводит к развитию толерантности, означающей, что при продолжительном применении пациент должен принимать все более увеличивающиеся дозы агентов, облегчающих боль. Эйфоригенный эффект опиоидных анальгетиков часто приводит к злоупотреблению веществами, облегчающими боль. Злоупотребление лекарствами и физиологическая зависимость являются распространенными явлениями, особенно среди подростков.
Эти опасные явления особенно часто вызываются веществами с сильной анальгетической активностью, они могут меняться от нежелательных привычек до развития опиомании. Однако эти вещества применяются в медицине на законных основаниях и медицина не может без них обойтись.
Помимо упомянутых недостатков сильные опиоидные анальгетики при их применении для терапии боли также часто приводят к нежелательным побочным эффектам, таким как стойкий запор, подавление дыхания, тошнота и седативный эффект. Реже наблюдаются побуждение или неспособность пропускать воду. Были сделаны различные попытки противодействовать появлению привычек и других побочных эффектов, возникающих в процессе терапии боли.
Это может быть сделано, например, традиционными методами лечения. В случае зависимости от лекарств это может быть метод выведения лекарства, и в случае стойкого запора можно принимать слабительные средства. Другие попытки направлены на минимизацию зависимости и привычек, образующих потенциал опиоидных анальгетиков, а также их других побочных эффектов путем введения антагонистов, которые противодействуют опиоидному анальгетику. Такими антагонистами могут быть налтрексон или налоксон.
Было немало предложений и предположений, как можно применить введение вышеупомянутых активных соединений для того, чтобы избежать нежелательных привычек и зависимости или даже аддикции.
В патентах США 3773955 и 3966940 предложено получать препараты анальгетиков в комбинации с налоксоном, чтобы предотвратить возникновение эффектов, способствующих возникновению зависимостей, таких как эйфория и т.п., при парентеральном применении лекарства. Однако подавление побочных эффектов, таких как стойкий запор, не являлось целью изобретений.
Для того, чтобы ограничить парентеральное злоупотребление оральными формами, в патенте США 4457933 предлагалась комбинация морфина с налоксоном в определенных соотношениях. Устранение побочных эффектов, таких как стойкий запор, также не упоминается.
В патенте США 4582835 для того, чтобы избежать злоупотреблений, предложен препарат, включающий комбинацию бупреморфина и налоксона, который должен вводиться или парентерально, или сублингвально.
В заявке ЕР 0352361 А1 описан метод лечения стойкого запора в процессе терапии боли путем орального введения опиоидного анальгетика и одного антагониста, причем антагонистом является пролекарственная форма налтрексона или налоксона. Однако устранение злоупотребления опиоидным анальгетиком не является целью заявленного изобретения.
Заявка DE 4325465 А1 также касается способа лечения стойкого запора во время терапии боли с использованием препарата, который содержит опиоидный анальгетик и антагонист. Отличительной чертой этого способа является то, что антагонист, которым может быть налоксон, должен содержаться в большем количестве, чем опиоидный анальгетик, которьм, предпочтительно, является морфин. Это должно быть для того, чтобы обеспечить действие антагониста против стойкого запора без снижения анальгетической активности агониста. Отсутствие злоупотребления опиоидным анальгетиком не является предметом указанной заявки.
Для преодоления побочных эффектов, таких как стойкий запор и подавление дыхания во время терапии боли, на рынке должны быть препараты, которые можно принимать перорально и которые включают опиоидный анальгетик и опиоидный антагонист, налоксон. Препарат Talwin®, Windrop/Sterling, содержит пентозоцин и налоксон. Препарат Valoron®, Godeke, содержит комбинацию тилидин - налоксон.
Препараты, используемые для успешной терапии боли, должны обладать дополнительными характеристиками помимо сильного анальгетического эффекта, снижения появления зависимости и побочных эффектов. Обычно препараты должны иметь такой состав, чтобы обеспечивать как можно длительную стабильность активных компонентов при стандартных условиях хранения. Препараты также должны быть такими, чтобы желательные профили высвобождения активных соединений не менялись при длительном хранении. Кроме того (также в случае комбинаций агонист/антагонист), профиль высвобождения каждого отдельного активного соединения должен быть селективным, как это требуется. Меры, принимаемые для этого, не должны менять или даже препятствовать тому, чтобы профили высвобождения дополнительных активных соединений (например, в случае комбинаций различных активных соединений) могли выбираться так, как это требуется. Соответственно, не должно быть взаимозависимых профилей высвобождения.
Препараты, пригодные для терапии боли, должны или содержать активные соединения в таких количествах, или вообще должны быть получены такими, чтобы пациенты могли принимать их только редко. Чем легче схема приема агента, облегчающего боль, и чем более очевидно для пациента, почему и как часто он должен принимать таблетку, тем более точно он сможет выполнить предписания врача. Необходимость принимать нечасто агент, облегчающий боль, приведет к желанию принимать это лекарство (к уступчивости).
Благодаря применению составов с так называемым длительным высвобождением, то есть составов, из которых активные соединения высвобождаются в течение продолжительного периода времени, пытались уменьшить частоту приема лекарственных препаратов, облегчающих боль, и тем самым увеличить уступчивость пациентов. Такие препараты с длительным высвобождением также имеют преимущество в том, что длительное высвобождение опиоидного анальгетика снижает появление зависимости от этого активного соединения.
Это обусловлено тем, что способность активного соединения вызывать зависимость не определяется соединением самим по себе, а скорее путем его введения и его фармакодинамическими свойствами. Помимо психотропного действия опиоида более решающим критерием риска появления зависимости является скорость, с какой мозг получает опиоид (Nolte, Т.: STK - Zeitschrift fur angewandte Schmerztherapie, 2001, vol.2). Лекарство Oxigestic®, Purdue, является препаратом, из которого опиоидный анальгетик оксикодон высвобождается в течение длительного периода. Благодаря этому препарату частота приема лекарства, а также способность вызывать зависимость уменьшаются, однако побочные эффекты остаются, и опасность появления зависимости исключить нельзя, так как Oxigestic не содержит опиоидных анальгетиков.
Согласно уже упоминавшейся заявка ЕР 0352361 А нет препаратов, в которых опиоидный анальгетик и антагонист высвобождаются в течение продолжительного времени. Соответственно, период времени, в течение которого такие препараты эффективны, ограничен и препараты должны приниматься многократно в день. Желаемая комфортность пациента не достигнута. В этой заявке не раскрыты преимущества составов препаратов, которые характеризуются стабильными во времени и независимым высвобождением активных веществ. Стабильность при хранении таких препаратов в этой заявке также не предусмотрена.
В заявке DE 4325465 А1 описаны составы, при применении которых во время терапии боли стойкий запор предотвращается за счет длительного высвобождения опиоидного агониста, в то время как антагонист, который содержится в избытке, не должен высвобождаться в течение продолжительного промежутка времени. Следовательно, благодаря высокому эффекту первого прохождения налоксана должны быть применены сравнительно большие количества этого соединения. В этой заявке не описаны ни преимущества, ни составы препаратов, которые характеризуются стабильным и независимым высвобождением активных соединений. Стабильность при хранении таких препаратов также не является предметом этой заявки. Следовательно, врач, использующий препараты согласно этой заявке, должен осуществлять достаточное количество опытов по титрованию каждый раз, когда он хочет увеличить дозу.
Компания Godeke под товарным знаком Valoron® предлагает препарат, облегчающий боль, который включает комбинацию тилидин - налоксон. Согласно известным источникам используется состав, из которого оба активных соединения высвобождаются в течение продолжительного периода времени. Используемая матрица включает релевантную часть набухающего в воде материала (НРМС) и поэтому должна рассматриваться как способная к набуханию (и, возможно, частично выделяющая) диффузионная матрица. Недостаток этого известного состава состоит в том, что тилидин и налоксон, взятые в одинаковых массовых отношениях, но различных абсолютных количествах, характеризуются различными профилями высвобождения. Скорости высвобождения агониста и антагониста не являются независимыми друг от друга, что, вероятно, обусловлено длительным высвобождением состава. Соответственно, врачу нужно проводить многочисленные опыты по титрованию для каждого отдельного пациента, если он хочет увеличить дозу, даже если он меняет массовое отношение тилидин:налоксон, так как он не может предположить, что профили высвобождения обоих компонентов останутся постоянными. Следовательно, интервал терапевтически используемых количеств анальгетика, доступный врачу, ограничен.
Одной из целей данного изобретения является создание фармацевтического препарата для терапии боли, который, обладая высокой анальгетической активностью, характеризуется пониженной способностью вызывать злоупотребление и уменьшенными побочными эффектами, причем этот препарат также характеризуется уменьшенной частотой его приема и, следовательно, удобен для пациента, а также он имеет способность к индивидуальной адаптации дозы для каждого пациента.
Другой целью данного изобретения является создание составов фармацевтических препаратов, используемых в терапии боли, которые обеспечивают стабильность в течение длительного времени хранения, при этом высвобождение активных соединений остается воспроизводимо неизменным и независимым друг от друга даже после длительного хранения.
Указанные цели достигаются настоящим изобретением благодаря созданию фармацевтического препарата для лечения боли, содержащего оксикодон и налоксон в диффузионной матрице, отличающегося тем, что оксикодон содержится в избытке по отношению к налоксону в соотношении от 25:1 до 2:1 предпочтительно 20:1, 15:1, особенно предпочтительно 5:1, 4:1, 3:1, 2:1, активные соединения высвобождаются из препарата длительно, неизменно и независимо друг от друга, а матрица выполнена с использованием этилцеллюлозы.
В другом варианте настоящего изобретения матрица наряду с эти целлюлозой содержит, по меньшей мере, один жирный спирт. Совместно с этилцеллюлозой они определеяют характер высвобождения активных веществ.
Сочетанием оксикодона (в анальгетически эффективном количестве) и налоксона достигается то, что препараты по изобретению проявляют эффективную анальгетическую активность и что в то же время подавляются или, по меньшей мере, значительно уменьшаются обычные побочные эффекты, такие как стойкий запор, угнетение дыхания и развитие зависимости. Матричный состав, являющийся стабильным в течение длительного периода, обеспечивает неизменно то, что агонист, как и антагонист всегда высвобождаются в заданных количествах и что скорости их высвобождения не влияют друг на друга.
При этом возникновение зависимости (злоупотребления лекарством), которое требует, чтобы оксикодон мог селективно экстрагироваться из состава, предотвращается. Состав согласно данному изобретению не дает осуществиться селективной экстракции агониста из препарата без соответствующего количества антагониста, независимо от абсолютных и относительных количеств выбранных агониста и антагониста.
Более того, состав лекарственного препарата по изобретению обеспечивает при идентичных относительных количествах активных соединений одинаковые профили их высвобождения независимо от их абсолютного количества. Такое независимое поведение при высвобождении обеспечивает широкий интервал используемых абсолютных количеств анальгетически активного вещества для врача, при условии, что оптимальное отношение агонист/антагонист известно. Таким образом, можно отрегулировать дозу для каждого пациента, или при постадийном увеличении дозы, или, ели это необходимо, при постадийном уменьшении дозы. Эта возможность адаптировать дозы для отдельного пациента чрезвычайно полезна с медицинской точки зрения.
Характерные признаки данного изобретения, которые обеспечивают длительное, неизменное и независимое высвобождение активных соединений, дополнительно обеспечивают получение фармацевтических препаратов по изобретению, характеризующихся низкой частотой введения, поэтому у пациентов достигается комфортность. Далее, препараты по изобретению позволяют врачу подбирать дозы для индивидуальных пациентов. Препараты по изобретению позволяют применять широкий интервал абсолютных количеств активных соединений и обеспечивают даже после длительного хранения эффективность активных соединений с равными профилями высвобождения.
Согласно настоящему изобретению длительное высвобождение активных соединений означает, что фармацевтически активные вещества высвобождаются из препаратов в течение более длительного времени, чем из известных препаратов с немедленным высвобождением. Предпочтительно, чтобы высвобождение имело место в течение периода времени от двух до двадцати четырех часов, от двух до двадцати часов, особенно предпочтительно в течение промежутка времени от двух до шестнадцати часов или от двух до двенадцати часов, что удовлетворяет предъявляемым требованиям.
Согласно изобретению составы препаратов, которые обеспечивают такое длительное высвобождение активных соединений из препарата, называются ретардными формами, формами с длительным высвобождением или формами с пролонгированным действием. В контексте данного изобретения "длительное высвобождение" не означает, что активные соединения высвобождаются из состава или препарата в зависимости от значения рН. Согласно изобретению высвобождение активных веществ скорее происходит независимо от значения рН. Согласно изобретению термин "длительное высвобождение" относится к выделению активных соединений из препарата в течение длительного периода времени. Он не подразумевает регулируемое высвобождение в определенном месте, следовательно, он не означает, что активные соединения выделяются только в желудке или только в кишечнике (Конечно, такое высвобождение в определенном месте может быть достигнуто индивидуально, например, с применением энтеропокрытия препарата. Однако в данном случае это не является преимущественным). В соответствии с данным изобретением "независимое высвобождение" означает, что при наличии, по меньшей мере, двух активных соединений, изменение абсолютного количества одного соединения не влияет на вид профилей высвобождения других соединений, поэтому профили высвобождения других соединений не меняются. Для составов по изобретению такой характер высвобождения не зависит от величины рН, при которой оно определяется, или от способа изготовления. Независимость от величины рН особенно относится к кислой среде, то есть к области, в которой величины рН<7. Профиль высвобождения (или характер высвобождения) определяется как изменение высвобождения активного соединения из состава во времени, причем количество каждого выделившегося активного соединения выражается в процентах от общего количества активного соединения. Профиль высвобождения определяется известными методами.
Конкретно это означает, что, например, профиль высвобождения оксикодона, когда имеет место комбинация оксикодон/налоксон, содержащая 12 мг оксикодона и 4 мг налоксона, не меняется, если соответствующий препарат того же состава содержит 12 мг оксикодона, но 6 мг налоксона. Независимый характер высвобождения, предпочтительно, относится к ситуации, когда сравниваются препараты с практически одинаковым составом. Препараты с практически равным составом содержат разные количества активных соединений, но в остальном они, в основном, похожи в отношении компонентов композиции, которые существенно влияют на характер высвобождения.
Если, например, вышеупомянутые препараты сравниваются (первый препарат содержит 12 мг оксикодона и 4 мг налоксона, а второй препарат содержит 12 мг оксикодона и 6 мг налоксона), то оба эти препарата при условии, что они имеют одинаковый общий вес, характеризуются тем же профилем высвобождения для оксикодона и налоксона, если разница в количестве налоксона восполнена другим компонентом состава, который обычно не влияет на характер высвобождения. Как показано в примерах, разница в количестве налоксона может быть компенсирована типичным фармацевтически инертным наполнителем, таким как лактоза, без изменения профилей высвобождения.
Специалисту в данной области хорошо известно, что если количество активного соединения, которое является различным для обоих препаратов, компенсируется веществом, которое имеет значение для процесса высвобождения, таким как этилцеллюлоза или жирный спирт, различие в характере высвобождения может возникнуть. Таким образом, независимый характер высвобождения, предпочтительно, относится к составам, которые содержат различные количества активных соединений, но в остальном идентичны или, по меньшей мере, очень похожи по отношению к компонентам, которые существенно влияют на характер высвобождения (при условии, что сравниваются препараты с одинаковым общим весом).
Согласно изобретению термины "неизменный характер высвобождения" или "неизменный профиль высвобождения" обозначают, что абсолютное количество каждого активного вещества, выделившегося в единицу времени, выраженное в процентах, не меняется значительно и остается практически постоянным (таким образом, практически не меняется), если изменились абсолютные количества. Практически постоянное количество означает, что количество, выделившееся в единицу времени и выраженное в процентах, отклоняется от среднего значения не более чем на 20%, предпочтительно, не более чем на 15% и, особенно предпочтительно, не более чем на 10%. Среднее значение определяют, исходя из шести определений профиля высвобождения. Конечно, количество, выделившееся в единицу времени, должно удовлетворять всем требованиям, предусмотренным инструкциями и правилами.
Конкретно это означает, например, что в случае комбинации оксикодон/налоксон, содержащей 12 мг оксикодона и 4 мг налоксона, в течение первых 4-х часов высвобождаются 25% оксикодона и 20% налоксона. Если же комбинация оксикодон/налоксон содержит 24 мг оксикодона и 8 мг налоксона, то в течение первых 4-х часов выделится также 25% оксикодона и 20% налоксона. В обоих случаях отклонение будет составлять не более 20% от среднего значения (которое в данном случае составляет 25% оксикодона и 20% налоксона).
Как указано для понятия "независимый характер высвобождения", неизменный характер высвобождения также предпочтительно относится к ситуации, когда сравниваются препараты практически одинакового состава. Такие препараты отличаются по количествам активных соединений, но одинаковы или, по меньшей мере, похожи по составу компонентов, влияющих на процесс высвобождения. Обычно разница в количестве активного соединения будет компенсироваться количеством фармацевтически инертного эксципиента, который не влияет заметно на характер высвобождения. Таким фармацевтическим эксципиентом может быть лактоза, являющаяся типичным наполнителем фармацевтических препаратов. Специалисту в данной области хорошо известно, что понятие "неизменный характер высвобождения" нельзя относить к препаратам, в которых разница в количестве активного соединения восполняется веществами, которые, как известно, существенно влияют на характер высвобождения, такими как этилцеллюлоза или жирные спирты.
В примерах показано, что если один препарат содержит 20 мг оксикодона и 1 мг налоксона или 20 мг оксикодона и 10 мг налоксона, и разница в количестве налоксона компенсируется лактозой, эти два препарата с идентичным весом характеризуются одинаковыми профилями высвобождения и обладают длительным, неизменным и независимым характером высвобождения.
Согласно данному изобретению термины "стабильный при хранении" или "стабильность при хранении" означают, что при хранении в стандартных условиях (по меньшей мере, два года при комнатной температуре и обычной влажности) количества активных соединений фармацевтического препарата не отклоняются от первоначальных количеств более чем на величины, указанные в руководстве или описании к обычным Фармакопеям. Согласно изобретению стабильность при хранении означает также, что препарат, полученный согласно изобретению, может храниться в стандартных условиях (60%-ная относительная влажность, 25°С), как это требуется для продажи препарата.
Согласно изобретению "стабильный при хранении" или "стабильный во времени" также означает, что после хранения в стандартных условиях активные соединения проявляют такие профили высвобождения, которые они имели бы при немедленном применении без хранения. В соответствии с изобретением допустимые отклонения в отношении профиля высвобождения характеризуются тем, что количество вещества, выделяющееся в единицу времени, отклоняется не более чем на 20%, предпочтительно не более чем на 15%, и, особенно предпочтительно не более чем на 10% от средней величины. Средняя величина рассчитывается по результатам шести измерений профиля высвобождения.
Предпочтительно определять высвобождение активных соединений из составов с длительньм высвобождением при помощи Basket Method согласно USP при рН 1,2 или рН 6,5 методом ЖХВР.
Стабильность при хранении, предпочтительно, определяют при помощи Basket Method согласно USP при рН 1,2 методом ЖХВР.
Согласно изобретению термины "не набухающая" или "практически не набухающая" диффузионная матрица означают состав матрицы, для которой высвобождение активных соединений не зависит (или, по меньшей мере, зависит незначительно) от набухания матрицы (особенно, в физиологических жидкостях релевантных мишеней в организме пациента).
Согласно изобретению термин "практически не набухающая" диффузионная матрица также относится к матрице, объем которой будет увеличиваться примерно на 300%, предпочтительно, примерно на 200%, более предпочтительно, примерно на 100%, примерно на 75% или примерно на 50%, более предпочтительно, примерно на 30% или примерно на 20% и наиболее предпочтительно, примерно на 15%, примерно на 10%, примерно на 5% или примерно на 1% в водных растворах (и особенно, в физиологических жидкостях релевантных мишеней в организме пациента).
В контексте данного изобретения термины «агонист» или «анальгетик» всегда относятся к оксикодону. В контексте настоящего изобретения термин «антагонист» всегда относятся к налоксону.
Препараты, полученные согласно данному изобретению, можно применять орально, назально, ректально и/или путем ингаляции в процессе терапии боли. Парентеральное применение согласно изобретению не предусмотрено. Особенно предпочтительным является состав для орального применения.
Даже хотя это может не отмечаться, термины «агонист» или «антагонист» всегда охватывают фармацевтически приемлемые и так же действующие производные, соли и т.п. Если, например, упоминаются оксикодон или налоксон, то подразумеваются, кроме свободных оснований, их гидрохлорид, сульфат, бисульфат, тартрат, нитрат, цитрат, битартрат, фосфат, малат, малеат, гидробромид, гидроиодид, фумарат, сукцинат и т.п.
Согласно изобретению агонисты и антагонисты объединяют в препарат таким образом, что они высвобождаются из полученного фармацевтического препарата длительным, независимым и неизменным способом. Это не означает, что антагонист содержится в избытке по отношению к агонисту. Напротив, предпочтительно, чтобы в составах, содержащих комбинацию агонист/антагонист, которая проявляет профиль высвобождения по изобретению, агонист был в избытке по отношению к антагонисту.
Избыток агониста определяется на основе количества единичной дозы антагониста, содержащегося в препарате. Избыток опиоидного агониста обычно выражается в виде весового отношения агониста к антагонисту.
В случае оксикодона и налоксона предпочтительное весовое отношения агониста к антагонисту равно максимум 25:1, особенно предпочтительны величины 15:1, 10:1. 5:1, 4:1, 3:1, 2:1.
Абсолютные количества агониста и антагониста, которые должны быть использованы, зависят от выбора активных соединений. Согласно изобретению следует обращать внимание на то, чтобы агонист и антагонист высвобождались из фармацевтического препарата, предназначенного для длительного высвобождения, только независимым и неизменным способом.
Если для комбинационного препарата используют оксикодон и налоксон, то в единичной дозе, предпочтительно, содержится 10-150 мг, особенно предпочтительно, 10-80 мг оксикодона (типичное количество при использовании) и, предпочтительно, 1-50 мг налоксона.
Согласно другим предпочтительным вариантам изобретения препараты могут содержать 5-50 мг оксикодона, 10-40 мг оксикодона, 10-30 мг оксикодона и примерно 20 мг оксикодона. Предпочтительные варианты изобретения предусматривают препараты, содержащие 1-40 мг налоксона, 1-30 мг налоксона, 1-20 мг налоксона или 1-10 мг налоксона.
Согласна изобретению соотношение между оксикодоном и налоксоном должно выбираться таким образом, чтобы профили высвобождения обоих активных веществ согласно изобретению гарантировались, агонист проявлял анальгетический эффект и количество антагониста выбирается таким образом, чтобы эффект привыкания или зависимости и побочные эффекты агониста уменьшались или устранялись, без существенного влияния на анальгетический эффект агониста.
Согласно изобретению развитие привыкания и зависимости, а также стойкого запора и угнетения дыхания должны рассматриваться как побочные эффекты действия анальгетически эффективных опиоидных агонистов.
Согласно изобретению могут быть использованы обычные рецептуры при условии, что эти рецептуры обеспечивают длительное, независимое и неизменное высвобождение активных соединений. Согласно изобретению эти рецептуры должны быть выбраны таким образом, чтобы активные соединения были стабильными при хранении.
Ретардные препараты на основе матрицы, предпочтительно, могут быть применены как составы, которые обеспечивают высвобождение агониста и антагониста согласно изобретению. В соответствии с изобретением особенно предпочтительны препараты на основе практически не набухающей диффузионной матрицы. К настоящему времени препараты с эрозивной матрицей или набухающей диффузионной матрицей не являются предпочтительными.
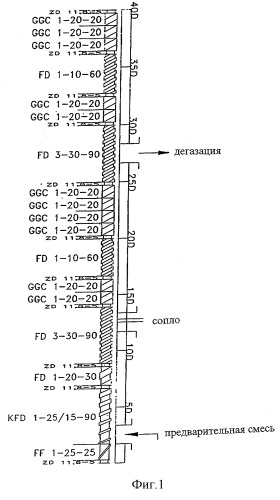
Согласно изобретению матрица, которая обеспечивает длительное высвобождение активных соединений, должна быть выбрана таким образом, чтобы происходило длительное, независимое и неизменное высвобождение активных соединений. Предпочтительно, такие матрицы включают полимеры на основе этилцеллюлозы, причем этилцеллюлоза является особенно предпочтительным полимером. Особенно предпочтительны матрицы, содержащие полимеры, доступные в продаже под товарньм знаком Surelease®. Более предпочтительно применение Surelease® E-7-7050.
Препараты, характеризующиеся высвобождением по изобретению, содержат, в частности, матрицы, которые включают этилцеллюлозу и, по меньшей мере, один жирный спирт в качестве компонентов, которые существенно влияют на характеристики высвобождения из матрицы. Количества этилцеллюлозы и, по меньшей мере, одного жирного спирта могут значительно меняться, поэтому могут быть получены препараты с различными профилями высвобождения. Хотя препараты по изобретению обычно содержат оба вышеназванных компонента, в некоторых случаях может быть предпочтительным, чтобы препараты содержали только этилцеллюлозу или жирный спирт(-ы) в качестве компонентов, определяющих высвобождение.
Матрицы на основе полиметакрилата (например, Eudragit® RS30D и Eudragit® RL30D) или матрицы, которые содержат релевантные количества набухающего в воде материала, особенно производных гидроксиалкилцеллюлозы, таких как НРМС, согласно изобретению предпочтительно не использовать.
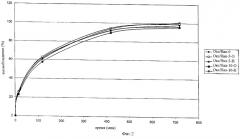
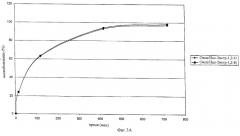
Матрицы, охватываемые данным изобретением, могут быть использованы для получения препаратов, которые высвобождают активные соединения длительно, независимо и неизменно и которые высвобождают равные количества активных соединений в единицу времени. Это особенно означает, что в случае комбинации оксикодон/налоксон, содержащей 12 мг оксикодона и 4 мг налоксона, 25% оксикодона и 25% налоксона высвобождается в течение первых четырех часов. Соответственно, в случае комбинации оксикодон/налоксон, содержащей 24 мг оксикодона и 8 мг налоксона, в течение первых четырех часов высвобождается 25% оксикодона и 25% налоксона, причем в обоих случаях отклонение составляет не более 20% от среднего значения (которое в данном случае составляет 25% оксикодона или налоксона).
Такой одинаковый характер высвобождения для обоих активных соединений может быть желательным с медицинской точки зрения.
Предпочтительный вариант данного изобретения относится к препаратам, которые высвобождают 1-40%, предпочтительно, 5-35%, более предпочтительно, 10-30%, еще более предпочтительно, 15-25% оксикодона и/или налоксона через 15 минут. Согласно другим предпочтительным вариантам изобретения 15-20%, 20-25%, примерно 15%, примерно 20% или примерно 25% оксикодона и/или налоксона высвобождается через 15 минут.
Другой предпочтительный аспект изобретения относится к препаратам, которые высвобождают 25-65%, предпочтительно 30-60%, более предпочтительно 35-55% и еще более предпочтительно 40-50% оксикодона и/или налоксона через час. Предпочтительные варианты изобретения относятся также к препаратам, которые высвобождают 40-45%, 45-50%, примерно 40%, примерно 45% или примерно 50% оксикодона и/или налоксона через час.
Еще один предпочтительный вариант изобретения относится к препаратам, которые высвобождают 40-80%, предпочтительно 45-75%, более предпочтительно 45-70%, еще более предпочтительно 45-50%, 50-55%, 55-60%, 60-65%, 65-70% оксикодона и/или налоксона через 2 часа. Предпочтительные варианты изобретения включают также препараты, которые высвобождают примерно 45%, примерно 50%, примерно 55%, примерно 60%, примерно 65% или примерно 70% оксикодона и/или налоксона через 2 часа.
Один предпочтительный вариант изобретения относится к препаратам, которые высвобождают 70-100%, предпочтительно, 75-95%, более предпочтительно, 80-95% и еще более предпочтительно 80-90% оксикодона и/или налоксона через 4 часа. Предпочтительные варианты изобретения относятся также к препаратам, которые высвобождают примерно 80-85%, примерно 85-90%, примерно 80%, примерно 85% или примерно 90% оксикодона и/или налоксона через 4 часа.
Один предпочтительный вариант изобретения относится к препаратам, которые высвобождают 70-100%, предпочтительно, 75-100%, более предпочтительно, 80-95% и даже более предпочтительно 80-85%, 85-90% или 90-95% оксикодона и/или налоксона через 7 часов. Предпочтительные в