Способ и установка для производства легкой воды
Иллюстрации
Показать всеИзобретение может быть использовано при проведении технологических процессов, получении лекарственных, парфюмерно-косметических средств и питьевой воды. Установка включает ректификационную колонну с контактным устройством для увеличения поверхности для взаимодействия пар-жидкость, узел приготовления водяного пара из исходной воды с концентрацией 1H2 16O, равной C1, узел подачи водяного пара в ректификационную колонну, узел конденсации водяного пара с концентрацией 1Н2 16O, равной C2, в конденсаторе, установленном в верхней части ректификационной колонны, причем C2>C1. Способ по изобретению предусматривает накопление части конденсата в виде конденсированной легкой воды. Ректификационная колонна представляет собой узел взаимодействия пар-жидкость между нисходящим потоком жидкости и восходящим потоком пара на поверхности расположенного внутри контактного устройства, при направлении основного потока жидкости и основного потока пара вдоль оси колонны. Давление пара в ректификационной колонне 0,05-0,6 бар, выход конденсированной легкой воды - 0,001-0,25 от общего объема водяного пара, прошедшего через ректификационную колонну. Контактное устройство может быть выполнено в виде тарелок, структурированной или рандомизированной насадки. Изобретение позволяет получить в промышленных масштабах легкую воду с содержанием 1Н2 16O не менее 997,13 г/кг и суммарным содержанием 1Н2 17O, 1Н2 18O, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O не более 2,87 г/кг от общего количества H2O. 2 н. и 8 з.п. ф-лы, 1 ил., 2 табл.
Реферат
Изобретение относится к способу и устройству для очистки воды от примесей в виде молекул воды, содержащих в своем составе тяжелые изотопы водорода и кислорода, а более конкретно - к способу и установке для получения легкой, особо чистой воды с повышенным содержанием в ней доли молекул 1Н2 16О.
Вода с точки зрения химии является веществом, состоящим из молекул Н2О. В природе совершенно чистой воды не существует. Природная вода всегда в той или иной мере содержит механические, химические и биологические примеси.
На сегодняшний день проблема очистки воды для ее использования в различных отраслях промышленности стоит очень остро.
В зависимости от предполагаемого применения вода подвергается разным способам очистки. Фильтрация, дистилляция, использование эффекта обратного осмоса позволяют получать воду с необходимой степенью чистоты: дистиллированную, деионизированную, при этом стерильную или нестерильную, апирогенную и т.д. и т.п. Количество механических, химических, биологических примесей может быть снижено до весьма низких уровней, например, при использовании методов с применением процесса осмоса. Однако традиционные способы очистки не изменяют изотопный состав молекул Н2О, в результате чего остаются молекулы воды, содержащие тяжелые изотопы водорода и кислорода, в среднем в природной воде суммарно по весу до 2,97 г/кг (расчеты приведены далее).
Общеизвестно, что молекула воды Н2О состоит из двух химических элементов - водорода Н и кислорода О. В свою очередь каждый элемент представляет собой совокупность нескольких изотопов [1].
В дальнейшем в тексте:
- понятие «водород» (буквенное обозначение: H) подразумевает под собой химический элемент как совокупность всех возможных изотопов водорода;
- понятие «кислород» (буквенное обозначение: O) подразумевает под собой химический элемент как совокупность всех возможных изотопов кислорода;
- понятие «вода» подразумевает под собой любую реальную воду, в том числе природную или полученную промышленным способом, представляющую собой смесь Н2О и большого числа различных веществ в виде механических примесей, растворенных газов, солей, биологических примесей и т.д., подлежащих или не подлежащих удалению в зависимости от дальнейшего применения воды;
- буквенное обозначение Н2О подразумевает под собой совокупность всех возможных изотопных разновидностей молекул воды, образованных изотопами химических элементов - водорода H и кислорода O;
Водород в природе представлен стабильными нерадиоактивными изотопами:
- протием (буквенное обозначение 1Н);
- дейтерием (буквенное обозначение 2H, историческое обозначение D, далее по тексту используются буквенные обозначения D, либо равнозначное 2Н).
Кислород, в свою очередь, представлен тремя стабильными нерадиоактивными изотопами:
- кислородом-16 (буквенное обозначение 16О);
- кислородом-17 (буквенное обозначение 17О);
- кислородом-18 (буквенное обозначение 18О).
Данное изобретение касается только вышеперечисленных стабильных нерадиоактивных изотопов.
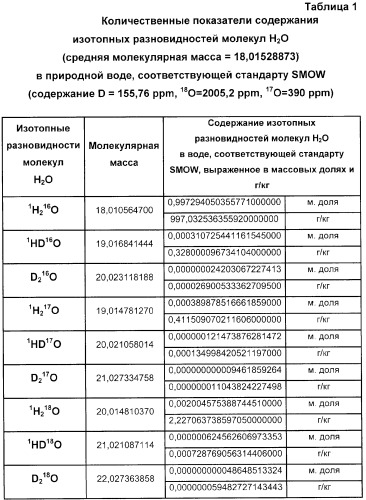
Стабильные изотопы водорода со стабильными изотопами кислорода образуют 9 изотопных разновидностей молекул воды, а именно: 1Н2 16О, 1Н2 17О, 1H2 18O, 1HD16О, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O. В количественном отношении основная масса воды природных источников представлена молекулами 1Н2 16О, состоящими из легких изотопов 1Н и 16О. Количество молекул воды, содержащих тяжелые изотопы: D, 17O, 18O, зависит от концентрации указанных изотопов, которая в природной воде колеблется в пределах, зафиксированных в основных стандартах изотопного состава гидросферы SMOW и SLAP.
Объем запасов воды в различных резервуарах гидросферы Земли равен примерно 1834 млн м3. Из них доля вод Мирового океана составляет 1370 млн м3, речных и озерных вод - 0,231 млн м3, ледниковых вод - 24 млн м3 и т.д. [2].
Поскольку основная часть воды на Земле сосредоточена в Мировом океане и океаническая вода весьма стабильна по изотопному составу, количественное содержание тяжелых изотопов D и 18O в ней принято в качестве международного стандарта SMOW (стандарт среднеокеанической воды).
Для стандарта SMOW отношение содержания в воде дейтерия к протию составляет D/H=155,76×10-6, а отношение содержания изотопов кислорода составляет 18О/16О=2005,20×10-6 [3].
Концентрация изотопов D, 17О, 18О в воде может выражаться либо в долях, либо в атомных процентах (ат. % или 0/00), либо в единицах ppm (part per million - часть на миллион) [2, 4]. Сумма концентраций протия и D, равно как и сумма концентраций трех изотопов кислорода, равна 100 ат.% или миллиону (в единицах ppm).
По международному стандарту SMOW абсолютное содержание дейтерия и кислорода-18 в океанической воде составляет:
DSMOW/1HSMOW=(155,76±0,05)×10-6, или 155,76 ppm
18OSMOW/16OSMOW=(2005,20±0,45)×10-6, или 2005 ppm [3].
Именно эти значения в стандарте SMOW приняты за точку отсчета. Существуют относительные единицы, выражающие содержание дейтерия и кислорода-18 в молекулах воды, приравненные к нулю и обозначаемые для дейтерия как δD=00/00 (или 155,76 ppm), для кислорода-18 δ18O=00/00 (или 2005,2 ppm).
В образцах проб воды с содержанием изотопных разновидностей молекул Н2О отличающимся от SMOW, величины δD и δ18O выражаются в 0/00 в виде относительного отклонения от нулевого значения в большую (со знаком +) или меньшую (со знаком -) сторону.
Для расчета единиц δD и δ18O используется следующая формула [5]:
В результате проведения математических преобразований и подстановок значений вышеуказанных величин получаем следующую формулу для пересчета концентрации из относительных величин δD и δ18O в единицы ppm:
(D) ppm=155,76 (δD/1000+1)
(18О) ppm=2005,2 (δ18O/1000+1),
где (D) ppm и (О) ppm содержание соответственно D и 18О, выраженное в ppm.
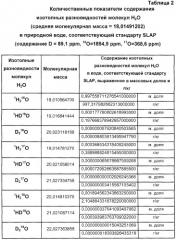
Наименьшие концентрации дейтерия и кислорода-18, обнаруженные в природной воде, описываются международным стандартом SLAP (стандарт легких антарктических осадков). Концентрация дейтерия по SLAP составляет D/H=89×10-6 (89 ppm или δD=-4280/00). Концентрация кислорода-18 по SLAP составляет 18O/16O=1894×10-6 (1894 ppm или δ18O=-55,50/00) [3].
Изменение концентрации кислорода-17 в природных водах в связи с его физико-химическими свойствами достаточно жестко связано с изменением концентрации кислорода-18. По данным разных авторов соотношение концентраций 18О/17О находится в пределах от 4,9 до 5,5 [6, 7]. Таким образом, концентрация кислорода-17 в природных водах по SMOW составляет 390 ppm (0,039 ат.%), а по SLAP может снижаться до 368 ppm (0,0368 ат.%) [2, 3, 6].
Вышеприведенные стандартные значения концентраций тяжелых изотопов дают возможность подсчитать процентное и, в конечном итоге, весовое количество изотопных разновидностей молекул в воде из природных источников в рамках стандартов SMOW и SLAP.
В воде между молекулами Н2О происходит интенсивный изотопный обмен атомами водорода (протием и дейтерием). При этом устанавливается термодинамическое равновесие между изотопными разновидностями молекул воды, содержащими дейтерий. В результате этого процесса наибольшую в количественном отношении долю молекул воды, содержащих дейтерий, составляют молекулы 1HD16О. В водах, близких по изотопному составу к природным, количественная доля молекул D2 16O, D2 17O, D2 18O, HD17O, HD18O мала и составляет в сумме менее 0,0009 г/кг. В дальнейших расчетах доля этих молекул присоединяется к доле 1HD16О.
В результате перераспределения атомов дейтерия между молекулами воды величина 1HD16O/1H16O удваивается по сравнению с величиной D/1H.
Например, для SMOW при соотношении концентрации D/1H=155,76×10-6 соотношение концентраций 1HD16О/1H2 16O удваивается и составляет 311,52×10-6.
Таким образом, в природных водах в 1000000 молекул Н2О в среднем содержится 997284 молекулы 1Н2 16O, 311 молекул 1HD16O, 390 молекул 1H2 17O и около 2005 молекул 1Н2 18О. Массовая доля и соответствующее ей весовое количество изотопных разновидностей молекул Н2O в природной воде, соответствующей стандарту SMOW, приведено в таблице 1. Аналогичные показатели для природной воды, соответствующей стандарту SLAP, приведены в таблице 2.
При расчете молекулярных масс изотопных разновидностей молекул воды использовались следующие значения атомных масс в международных углеродных единицах:
масса 1Н равна 1.007825035,
масса D равна 2,014101779,
масса 16О равна 15,99491463,
масса 17О равна 16,9991312,
масса 18О равна 17,9991603 [9].
Как видно из результатов, представленных в таблицах, в совокупности в природной воде весовая концентрация молекул 1H2 17O, 1Н2 18O, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17О, D2 18O, может составлять до 2,97 г/кг, что является значимой величиной, сопоставимой с содержанием в природной воде других характерных компонентов. Например, общая минерализация питьевой воды может составлять от 1 до 5 г/кг. Такой переход от условных атомарных единиц к весовым показателям количества изотопных разновидностей молекул Н2О позволяет оценить чистоту и однородность воды по изотопному составу.
В соответствии с приведенными данными можно условно определить понятия изотопно-легких и изотопно-тяжелых вод.
К изотопно-легким относят природную воду, в которой содержание молекул, включающих в себя тяжелые изотопы, приближается к стандарту SLAP. Также к этой категории относятся искусственно полученные воды с пониженной концентрацией дейтерия, но с природным изотопным составом кислорода в Н2О. Такими водами являются «Талая вода», «Реликтовая вода» и ряд других [9-14]. Автором патентов [13, 14] для воды, из которой определенным методом удаляется дейтерий, предлагается собственное название DDW (Deuterium Depleted Water - вода, обедненная по дейтерию) [4].
Традиционно в литературе в отношении изотопно-тяжелых вод употребляется несколько терминов.
Тяжелой водой называется вода с повышенным содержанием дейтерия и природным изотопным составом кислорода.
Тяжелокислородной водой называется вода с повышенным содержанием кислорода-18 и природным изотопным составом водорода.
Тяжелокислородной по кислороду-17 водой называется вода с повышенным содержанием кислорода-17 и природным изотопным составом водорода.
Таким образом, изотопно-тяжелой, в целом, может считаться вода с увеличенным содержанием, как минимум, одной из разновидностей молекул: 1H2 17О, 1H2 18O, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O, и соответственно уменьшенным содержанием молекул 1Н2 16О, а изотопно-легкой - вода с уменьшенным содержанием, как минимум, одной из разновидностей молекул: 1H2 17O, 1H2 18O, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O, и соответственно увеличенным содержанием молекул 1H2 16О. При этом увеличение или уменьшение количества молекул 1Н2 16O, а также молекул, содержащих тяжелые изотопы, может быть не только абсолютным (выше или ниже стандартных показателей SMOW и SLAP), но и относительным - по отношению к этому показателю, характерному для питьевой воды в конкретном регионе проживания человека.
Молекула 1H2 16О является наиболее легкой из совокупности изотопных разновидностей молекул воды. Поэтому вода с существенно увеличенной долей 1Н2 16О характеризуется меньшим молекулярным весом, обладает меньшей плотностью и является наиболее легкой в категории изотопно-легких вод. Такая вода в заявленном изобретении терминологически определяется как легкая очищенная или легкая особо чистая вода.
Физические, химические и биологические свойства изотопно-тяжелых вод (тяжелой по D, тяжелой по кислороду 17O и кислороду 18O) существенно отличаются друг от друга и от свойств природной воды. Например, изменяются температуры кипения и замерзания, плотность скорость химических и биохимических реакций [2, 9, 10, 11]. Это позволяет рассматривать вышеперечисленные тяжелые изотопные модификации Н2О как различные самостоятельные вещества, которые по отношению к воде 1Н2 16О являются примесями.
Реакция биосистем при воздействии на них Н2О, может изменяться в зависимости от количественных и качественных изменений изотопного состава Н2О. Применение воды с повышенной концентрацией тяжелых изотопов, в частности дейтерия, вызывает выраженные токсические эффекты на уровне организма, ограничивая возможность ее использования в лечебно-профилактических целях [12]. В то же время на разных объектах зарегистрирована положительная биологическая активность вод, полученных с помощью различных технологических процессов, относящихся к категории изотопно-легких, со сниженной в той или иной мере по сравнению с исходной концентрацией дейтерия [4, 13-21]. То есть количественные и качественные показатели изотопного состава воды существенным образом отражаются на ее эффективности при использовании воды в качестве растворителя или ингредиента. Поэтому очевидна необходимость в зависимости от целей применения регулирования изотопного состава воды, употребляемой человеком для технологических процессов, питья, в составе лекарственных, косметических, гигиенических, парфюмерных средств и т.д. Наличие примесей в виде изотопно-тяжелой воды, уменьшая долю 1H2 16O, изменяет некоторые характеристики и, следовательно, качество воды, так как первичным активным действующим началом является именно вода с молекулярным составом 1Н2 16O, т.е. собственно «вода по определению» в химическом, физическом и биологическом смыслах. В природных водах количественное соотношение изотопных разновидностей молекул Н2О зависит от географического положения региона, климатических условий, осадков, сезона года [3]. Океаническая вода, которая составляет основную массу воды на Земле, содержит меньшее количество 1Н2 16O по сравнению с основными запасами пресных вод. Для пресноводных источников этот показатель колеблется, но в целом имеет тенденцию к увеличению по сравнению с океанической водой. Однако природные источники воды с наибольшим содержанием 1Н2 16O (антарктические и высокогорные ледники), находятся в местах малонаселенных или практически незаселенных человеком.
Хотя изотопный состав атмосферной влаги поверхностных и подземных вод континентов колеблется в довольно широких пределах, эти колебания, однако, подчиняются определенным закономерностям [3]. Например, при уменьшении концентрации дейтерия в атмосферных осадках содержание кислорода-17 и кислорода-18 также снижается. Это обусловлено физико-химическими процессами испарения-конденсации воды, протекающими в природе. Корреляционная зависимость между δD и δ18О для природной воды, построенная на основании большого количества опытных данных, впервые была установлена Крейгом [5] и уравнение регрессии δD=8δ18O+10%o носит его имя.
Поэтому предпочтительнее, чтобы увеличение содержания 1Н2 16О в воде при ее промышленном производстве происходило за счет удаления молекул, содержащих не только дейтерий, но и тяжелые изотопы кислорода (17О и 18О).
Уровень техники по вопросам производства изотопно-легкой воды представлен рядом патентов, однако все они касаются способов и установок, позволяющих снизить в воде в той или иной мере только количество тяжелых изотопов водорода, в основном дейтерия, при сохранении исходного изотопного состава кислорода в Н2О.
Так, описаны способ и установки для получения «талой» и «реликтовой» воды с пониженным содержанием тяжелых изотопов дейтерия и трития [13-15]. Сущность предлагаемого способа состоит в том, что он включает операции охлаждения воды и последующего оттаивания замороженной воды [13]. Однако степень снижения количества дейтерия при этом весьма невелика. Существует установка, позволяющая методом электролиза достигать довольно значительного обеднения воды изотопами дейтерия в условиях отсутствия гравитации с целью использования такой воды в обитаемых космических объектах [16]. Но производительность такой установки крайне мала.
Наиболее близким техническим решением к объектам наших изобретений является патент RU 2125817 [17].
Согласно этому патенту воду с пониженным содержанием дейтерия получают методами дистилляции и/или стандартного электролиза. Из описания следует, что дистилляция происходит путем кипячения дистиллированной воды в перегонной колонке на 30-50 тарелок при давлении 50-60 мбар с флегмовым числом 12-13 и 10-кратным кубовым остатком. При использовании таких параметров концентрация дейтерия в первых фракциях составляет 20-30 ppm. Увеличивая число тарелок, можно еще снизить содержание дейтерия в воде до 1-10 ppm. В этом же патенте [17] предлагается способ производства D-обедненной воды с использованием электролиза. При этом концентрация D в полученной таким образом воде составляет 30-40 ppm. Далее предлагается смешивать приготовленную такими способами воду с обычной водой до получения содержания дейтерия между 111 и 135 ppm. To есть основной задачей является снижение в получаемой воде только содержания тяжелого изотопа водорода - дейтерия.
Хотя снижение содержания дейтерия в воде и приводит к некоторому увеличению доли 1Н2 16O в H2O, тем не менее обеднение воды только по дейтерию ограничивает возможность дальнейшего увеличения в ней содержания 1Н2 16О. Как показали наши расчеты, максимально возможное содержание 1Н2 16О в DDW, как и в любой воде, из которой удаляются только тяжелые изотопы водорода, составляет не более 997,36 г/кг (при минимальном остаточном содержании дейтерия 0,01 ppm), что находится в пределах, близких к природному уровню по стандарту SLAP.
Таким образом, предложенные способы и установки не дают возможности, тем более в промышленном масштабе, существенным образом увеличить долю 1Н2 16О в исходной воде. Существенное возрастание доли 1H2 16O в Н2О возможно лишь при удалении всех разновидностей тяжелых изотопов D, 17О, 18О, точнее при удалении максимального числа молекул, содержащих вышеназванные изотопы: 1Н2 16О, 1Н2 17О, 1Н2 18О, 1HD16О, 1HD17О, 1HD18O, D2 16O, D2 17О, D2 18O.
Задачей настоящего изобретения является создание способа и установки для производства воды с повышенным содержанием 1H2 16O в промышленном масштабе. Исходной водой для производства воды с повышенным содержанием 1Н2 16О может служить натуральная природная вода, водопроводная вода, вода любой степени очистки (дистиллированная, деионизированная и т.д.).
Решение поставленной задачи достигается за счет разработки способа получения легкой воды, предусматривающего ректификацию исходной воды с помощью ректификационной колонны, содержащей контактное устройство, увеличивающее площадь поверхности для взаимодействия пар-жидкость, при этом содержание 1Н2 16О в легкой воде составляет не менее 997,13 г/кг от общего количества Н2О, а суммарное содержание 1Н2 17О, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляет не более 2,87 г/кг от общего количества Н2О, при этом ректификация включает в себя следующие этапы:
- приготовление водяного пара из исходной воды с концентрацией 1Н2 16О, равной C1;
- подача водяного пара в ректификационную колонну;
- взаимодействие пар-жидкость между нисходящим потоком жидкости и восходящим потоком пара на поверхности контактного устройства внутри ректификационной колонны, путем противотока жидкости и пара при направлении основного потока жидкости и основного потока пара вдоль оси колонны;
- конденсация водяного пара с концентрацией 1Н2 16О, равной С2, в конденсаторе, установленном в верхней части ректификационной колонны, и накопление части конденсата в виде конденсированной легкой воды, при этом С2>C1;
предпочтительно, чтобы давление пара в ректификационной колонне составляло от 0,05 до 0,6 бар;
предпочтительно, чтобы выход сконденсированной легкой воды составлял от 0,001 до 0,25 от общего объема водяного пара, прошедшего через ректификационную колонну.
Контактное устройство может быть представлено в виде тарелок.
Предпочтительнее, чтобы контактное устройство представляло собой структурированную или рандомизированную насадку.
Предпочтительнее, чтобы содержание 1Н2 16О в полученной легкой воде составляло не менее 997,36 г/кг от общего количества Н2О, а суммарное содержание 1Н2 17О, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляло не более 2,64 г/кг от общего количества Н2О.
Более предпочтительно, чтобы содержание 1Н2 16О в легкой воде составляло не менее 997,51 г/кг от общего количества Н2О, а суммарное содержание 1Н2 17О, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляло не более 2,49 г/кг от общего количества Н2О.
Поставленная задача также решается за счет создания установки для получения легкой воды, включающей в себя ректификационную колонну, которая содержит контактное устройство для увеличения поверхности для взаимодействия пар-жидкость, при этом содержание 1Н2 16О в легкой воде составляет не менее 997,13 г/кг от общего количества Н2О, а суммарное содержание 1H2 17O, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляет не более 2,87 г/кг от общего количества Н2О, при этом установка включает в себя:
- узел приготовления водяного пара из исходной воды с концентрацией 1Н2 16О, равной C1;
- узел подачи водяного пара в ректификационную колонну;
- ректификационную колонну, представляющую собой узел взаимодействия пар-жидкость между нисходящим потоком жидкости и восходящим потоком пара на поверхности контактного устройства внутри ректификационной колонны путем противотока жидкости и пара при направлении основного потока жидкости и основного потока пара вдоль оси колонны;
- узел конденсации водяного пара с концентрацией 1Н2 16О, равной С2, в конденсаторе, установленном в верхней части ректификационной колонны, и накопление части конденсата в виде конденсированной легкой воды, при этом С2>С1;
предпочтительно, чтобы давление пара в ректификационной колонне составляло от 0,05 до 0,6 бар;
предпочтительно, чтобы выход сконденсированной легкой воды составлял от 0,001 до 0,25 от общего объема водяного пара, прошедшего через ректификационную колонну.
Контактное устройство может быть представлено в виде тарелок.
Предпочтительнее, чтобы контактное устройство представляло собой структурированную или рандомизированную насадку.
Предпочтительнее, чтобы содержание 1Н2 16О в полученной легкой воде составляло не менее 997,36 г/кг от общего количества Н2О, а суммарное содержание 1H2 17O, 1H2 18O, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляло не более 2,64 г/кг от общего количества H2O.
Более предпочтительно, чтобы содержание 1Н2 16О в легкой воде составляло не менее 997,51 г/кг от общего количества Н2О, а суммарное содержание 1Н2 17О, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляло не более 2,49 г/кг от общего количества Н2О.
Иллюстративным примером материала насадки является медь, никель, нержавеющая сталь или сплавы.
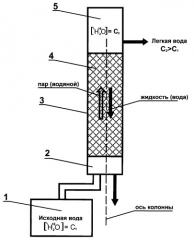
Процесс ректификации исходной воды с целью получения воды с повышенным содержанием 1Н2 16О иллюстрируется фиг.1, где схематично изображена установка, состоящая из узла приготовления водяного пара из исходной воды с концентрацией 1Н2 16О, равной С1 (1), узла подачи водяного пара в ректификационную колонну (2), узла взаимодействия пар-жидкость, представляющего собой ректификационную колонну (3) с контактным устройством внутри нее (4), узла конденсации водяного пара с концентрацией 1Н2 16О, равной С2 (5), где С2>С1; стрелками показаны направления потоков восходящего пара и нисходящей жидкости.
Варьируя количество ступеней разделения в колонне, рабочее давление, а также отношение отбора части конденсата в виде воды с повышенным содержанием 1Н2 16О к потоку жидкости в ректификационной колонне, получаем заданную степень обогащения воды ее наиболее легкой составляющей 1Н2 16О. Степень обогащения зависит от конкретной цели применения легкой воды.
Техническим результатом настоящего изобретения является создание эффективного способа и установки для промышленного производства легкой особо чистой воды с повышенным содержанием 1Н2 16О. Способ и установка для производства легкой воды, предложенные в патенте, позволяют промышленным путем достигать весьма значительной степени удаления из исходной воды совокупности молекул, содержащих тяжелые изотопы водорода и кислорода: 1Н2 17О, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O и, следовательно, значительного увеличения содержания Н2 16О. В результате этого получается новый продукт - легкая особо чистая вода с высокой степенью однородности по изотопному составу. Работ по созданию целенаправленной технологии получения воды с увеличенным содержанием доли 1H2 16O в патентной и периодической литературе не обнаружено.
Процесс производства легкой очищенной воды с повышенным содержанием 1Н2 16О с применением способа и установки, заявленных в изобретении, продемонстрирован в примере. Пример приведен только для иллюстрации эффективности и возможностей данного изобретения, ни в коей мере не ограничивая области его применения.
Пример 1 Процесс производства легкой особо чистой воды с повышенным содержанием 1Н2 16О с применением способа и установки, заявленных в изобретении.
Исходная дистиллированная вода с содержанием 1Н2 16О, равным 997,0927 г/кг (концентрация С1), поступает в отдельную емкость для приготовления водяного пара (1, фиг.1). Пар вырабатывается с помощью тепло-электронагревательных элементов общей мощности 12 кВт. Полученный водяной пар направляется в ректификационную колонну через специальный узел подачи и распределения водяного пара (2, фиг.1), примыкающий к основанию ректификационной колонны. Отсюда водяной пар поступает непосредственно в ректификационную колонну, представляющую собой узел взаимодействия между восходящим потоком пара и нисходящим потоком жидкости (3, фиг.1). Процесс происходит путем противотока жидкости и пара при направлении основного потока жидкости и основного потока пара вдоль оси колонны. Колонна представляет собой полый цилиндр, выполненный из нержавеющей стали 02Х12Т, толщина стенки 2 мм, высотой 6000 мм, диаметром 100 мм. Внутреннее пространство колонны засыпным способом заполнено рандомизированной насадкой (4, фиг.1) для увеличения поверхности взаимодействия между восходящим потоком пара и нисходящим потоком жидкости в ректификационной колонне.
Насадка представляет собой 3-миллиметровые спирально-призматические элементы, выполненные из нержавеющей проволоки диаметром 0,2 мм. Удельная поверхность насадки составляет 2550 м2/м3, доля свободного объема 0,84 м2/м3, масса единицы объема 1100 кг/м3.
Процесс обогащения водяного пара наиболее легкими молекулами происходит в ректификационной колонне на поверхности контактного устройства (насадки) при температуре 60°С и давлении 0,2 бар. Полученный водяной пар с повышенным содержанием 1Н2 16О в объеме 16 л/час конденсируется в узле конденсации (5, фиг.1), расположенном в верхней части ректификационной колонны. Выход сконденсированной легкой воды составляет 0,025 часть от общего объема водяного пара, прошедшего через ректификационную колонну, и равен 0,4 л/час. Готовый продукт - легкая вода с повышенным содержанием 1Н2 16О, равным 997.65 г/кг (концентрация С2; при этом С2>C1).
Источники информации
1. Глинка. Общая химия. М.: «Химия», 1975 г., стр.102.
2. Андреев Б.М., Зельвенский Я.Д., Катальников С.Г. Тяжелые изотопы водорода в ядерной технике. Москва: ИздАТ, 2000 г., с.186.
3. Ферронский В.И., Поляков В.А. Изотопия гидросферы. М.: Наука, 1983 г., стр.47., стр.10, 47, 46, 10.
4. Somlyai G. «Let's Defeat Cancer!». Akademiai Kiado, Budapest, 2001.
5. Creig H. «Standard for reporting concentration of deuterium and oxygen-18 in natural water». Science, 1961, vol.133, p.1833-1834.
6. Шатенштейн А.И. Варшавский Я.М. и соавт. Изотопный анализ воды. Москва: Издательство Академии Наук, 1954 г., стр.15.
7. ACOS Bulletin, №21, October 1979, стр.14.
8. Куликов И.С. Изотопы и свойства элементов. Справочник. Москва: Металлургия, 1990.
9. Кульский Л.А., Гороновский И.Т., Когановский А.М., Шевченко М.А. Справочник по свойствам, методам анализа и очистке воды. Киев: Наукова думка, 1980.
10. Лобышев В.И., Калиниченко Л.П. Изотопные эффекты D2O в биологических системах. Москва: Наука, 1978 г.
11. Лобышев В.И. Механизмы термодинамических и кинетических изотопных эффектов D2O в биологических системах Автореф. докт. диссертации. Москва, - 1987 (биофак МГУ).
12. Kushner D.J., Baker F., Dunstall T.G. Can. J. Physiol. Pharmacol. 1999, Feb.77(2): 79-88.
13. Патент RU 2031085. Способ получения биологически активной питьевой воды и установка вин-6 для его осуществления. Варнавский И.И. и др.
14. Патент RU 2091335. Установка ВИН-7 "Надiя" для получения целебной питьевой воды с пониженным содержанием дейтерия и трития "Реликтовая вода". Варнавский И.Н. и др.
15. Патент RU 2091336. "Способ получения целебной питьевой воды с пониженным содержанием дейтерия и трития "Реликтовая вода". Варнавский И.Н. и др.
16. Патент RU 2182562. Способ получения биологически активной питьевой воды с пониженным содержанием дейтерия устройство для ее получения. Государственный научный центр Российской Федерации Институт медико-биологических проблем, Синяк Ю.Е.
17. Патент RU 2125817. Пищевой продукт для профилактики развития заболеваний и способ производства пищевых продуктов, пригодных для профилактики развития опухолевых заболеваний. Шомяи Г. (Hu).
18. Патент RU 2139062. Гигиенические и косметические препараты для профилактики и лечения заболеваний кожи. Шомяи Г. (Hu).
19. Синяк Ю.Е., Левинских М.А., Гайдадымов В.Б., и др. Организм и окружающая среда: жизнеобеспечение и защита человека в экстремальных условиях (материалы Российской конференции) Москва, 26-29 сентября 2000 г., стр.90-92.
20. Синяк Ю.Е., Гурьева Т.С., Гайдадымов В.Б., и др. Космическая биология и авиакосмическая медицина. (Тезисы док. 11 конференции), Москва, Россия, 22-26 июня, 1998 г., стр.201-202.
21. Родимов Б.Н. Действие снеговой воды на живые организмы. «Сельскохозяйственное производство Сибири и Дальнего Востока». Омск 4, 1965 г., стр.56-57.
1. Способ получения легкой воды, предусматривающий ректификацию содержащей исходной воды с помощью ректификационной колонны, содержащей контактное устройство, увеличивающее площадь поверхности для взаимодействия пар-жидкость, при этом содержание 1Н2 16О в легкой воде составляет не менее 997,13 г/кг от общего количества H2O, а суммарное содержание 1H2 17O, 1H2 18O, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляет не более 2,87 г/кг от общего количества Н2O, при этом ректификация включает в себя следующие этапы:
приготовление водяного пара из исходной воды с концентрацией 1Н2 16O, равной С1;
подачу водяного пара в ректификационную колонну;
взаимодействие пар-жидкость между нисходящим потоком жидкости и восходящим потоком пара на поверхности контактного устройства внутри ректификационной колонны путем противотока жидкости и пара при направлении основного потока жидкости и основного потока пара вдоль оси колонны;
конденсацию водяного пара с концентрацией 1Н2 16O, равной С2, в конденсаторе, установленном в верхней части ректификационной колонны, и накопление части конденсата в виде конденсированной легкой воды, при этом С2>С1;
при этом давление пара в ректификационной колонне составляет от 0,05 до 0,6 бар и выход конденсированной легкой воды составляет от 0,001 до 0,25 общего объема водяного пара, прошедшего через ректификационную колонну.
2. Способ по п.1, отличающийся тем, что контактное устройство представлено в виде тарелок.
3. Способ по п.1, отличающийся тем, что контактное устройство представлено в виде структурированной или рандомизированной насадки.
4. Способ по п.1, отличающийся тем, что содержание 1Н2 16O в легкой воде составляет не менее 997,36 г/кг от общего количества Н2О, а суммарное содержание 1Н2 17О, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляет не более 2,64 г/кг от общего количества Н2О.
5. Способ по п.1, отличающийся тем, что содержание 1Н2 16О в легкой воде составляет не менее 997,51 г/кг от общего количества Н2О, а суммарное содержание 1Н2 17O, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляет не более 2,49 г/кг от общего количества Н2О.
6. Установка для получения легкой воды, включающая ректификационную колонну, которая содержит контактное устройство для увеличения поверхности для взаимодействия пар-жидкость, при этом содержание 1H2 16О в легкой воде составляет не менее 997,13 г/кг от общего количества Н2О, а суммарное содержание 1H2 17O, 1Н2 18О, 1HD16O, 1HD17O, 1HD18O, D2 16O, D2 17O, D2 18O в легкой воде составляет не более 2,87 г/кг от общего количества Н2О,
при этом установка включает в себя
узел пригот