Смесь ацилированной целлобиозы, способ ее получения, косметическая композиция на ее основе и применение смеси ацилированной целлобиозы
Иллюстрации
Показать всеИзобретение относится к новой смеси ацилированной целлобиозы общей формулы (I), которая может быть использована для загущения или структурирования не смешивающейся с водой жидкости, к способу ее получения, к косметической композиции на ее основе, к применению косметической композиции для нанесения на кожу и к способу загущения или структурирования не смешивающейся с водой жидкости.
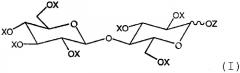
где Х представляет ацильную группу (R-CO-) или Н, Z представляет ацильную группу (R'-CO-) или Н, и, по меньшей мере, 50% радикалов Z ацилированы и в среднем более чем 6 радикалов X+Z ацилированы, где R представляет углеводородный радикал с насыщенной или ненасыщенной, линейной или разветвленной цепью, содержащий от 5 до 31 атомов углерода, и R' представляет радикал, отличный от R и который представляет собой: (i) углеводородный радикал с насыщенной или ненасыщенной, линейной или разветвленной цепью, содержащий от 1 до 31 атомов углерода, необязательно замещенный фтором, аминогруппой, амидогруппой, фенильной группой, нафтильной группой, бифенильной группой, циклогексильной или циклооктильной группой, или (ii) ароматический углеводородный радикал, содержащий не более 26 атомов углерода, включающий фенильную, нафтильную или бифенильную группу, необязательно замещенную алкильной или алкоксигруппой, содержащей до 20 атомов углерода, или галогеном, или нитрогруппой, или группой сложноалкильного эфира алкиламина или алкиламида, или (iii) циклоалифатический углеводород, включающий циклогексильную или циклооктильную группу, необязательно замещенный алкильной или алкоксигруппой, содержащей до 20 атомов углерода, или фенильной, нафтильной или бифенильной группой. 5 н. и 44 з. п. ф-лы, 20 табл.
Реферат
Настоящее изобретение относится к сложным эфирам целлобиозы, к содержащим их композициям и к их применению в качестве структурообразователей.
Многие композиции, предназначенные для топического нанесения на кожу, включая ряд композиций для различных частей тела, таких как лицо, десны, руки, конечности, ступни, торс, подмышки, грудь, гениталии, волосы и другие части тела, включают одно или несколько активных веществ, которые распределены в жидкости-носителе или иным образом поддерживаются ею. Хотя возможно, что во многих случаях такие композиции находятся в форме лосьонов, часто желательно, чтобы активный ингредиент таких композиций, будь то для медицинских или для косметических целей, оставался в основном локализованным в той области тела, на которую он был топически нанесен. Для этого, а также чтобы сделать возможным применение альтернативных раздаточных устройств для композиции, жидкость-носитель может быть загущена или структурирована путем, например, ввода для этой целей одного или нескольких веществ. Загущенные или структурированные композиции обычно принимают форму твердых косметических карандашей или мягких твердых веществ и кремов. В таких обстоятельствах материалы часто называют структурообразователями или гелеобразователями и могут иногда альтернативно называть загустителями, в зависимости от конечной формы композиции. Жидкий носитель может включать воду и/или смешивающуюся с водой органическую жидкость и, альтернативно, или дополнительно, не смешивающуюся с водой жидкость.
В принципе, выбор структурообразователей или загустителей имеет тенденцию варьироваться в соответствии с физической природой жидкости-носителя и в особенности от того, является ли она смешивающейся или не смешивающейся с водой. Настоящее изобретение относится в особенности к материалам, которые способны структурировать не смешивающуюся с водой жидкость, которая способна действовать сама по себе как носитель для активных ингредиентов или включает не смешивающуюся с водой жидкость в эмульсии или микроэмульсии.
Многие материалы были предложены для структурирования или загущения не смешивающейся с водой жидкой фазы композиций, предназначенных для топического нанесения человеку. Они включали воски, природные воски, такие как парафиновые воски или воски, обычно экстрагируемые из растений, такие как канделильский воск, или глицеридные воски, или полученные химической переработкой натуральных масел, например, гидрировании касторового масла, или полученные экстракцией из животного сырья, такие как пчелиный воск или спермацетовый воск, или их производные или синтетические варианты. Другие включают линейные спирты, например линейные спирты С18 или С20. Другие материалы являются полимерными, такими как полисилоксановые спирты, или полисилоксановые эластомеры или различные сополимеры полиамид/полисилоксан.
В последние годы 20-го века был найден ряд структурообразователей, которые авторы настоящего изобретения классифицируют как волокнообразующие. Они включают 12-гидроксистеариновую кислоту, различные амиды аминокислот, включающие, в частности, стеролы и сложные эфиры стеролов, включая, в частности, β-ситостерол и γ-оризонол, производные треитола, диамидные производные циклогексана и ацилированные производные целлобиозы. Каждый из различных структурообразователей имеет в большей или меньшей степени свои конкретные достоинства и свои характерные недостатки либо в абсолютных, либо в относительных величинах. Такие свойства могут включать способность вещества гелировать или иным образом структурировать жидкость-носитель, включая получаемые твердость, и стабильность, и сенсорные свойства, и внешний вид получаемой композиции, причем последнее очень важно для косметических композиций.
Один из наиболее предпочтительных классов структурообразователей включает ацилированную целлобиозу, как описано в находившейся на рассмотрении заявке РСТ № PCT/GB 00/01228, ныне опубликованной как WO 00/61079, в частности для структурирования не смешивающейся с водой жидкости в косметических композициях, включающих, в особенности, антиперспираторные и дезодорирующие композиции. Указанная заявка РСТ описывает различные преимущества структурообразователя из ацилированной целлобиозы и приводит примеры многих композиций, демонстрирующих такие преимущества. В указанной заявке РСТ указано, что целлобиоза может принимать или α- или β-конфигурацию, предпочтительно первую, и приведены различные предпочтительные варианты и для ряда ацильных заместителей ядра целлобиозы, и для химических составляющих заместителей. Описание альтернатив включало выбор алифатического ацильного заместителя, будь он линейным или разветвленным, и длину его цепи. Были приведены примеры ацилированных целлобиоз, в которых применялись идентичные ацильные заместители. Наиболее предпочтительной ацилированной целлобиозой, описанной здесь, является октанонаноат целлобиозы.
Продолжающиеся исследования свойств ацилированных целлобиозных материалов и композиций, структурированных с их использованием, показали, что вариации структурообразователей могут привести к изменениям различных свойств структурированных композиций, включая среди прочего термическую стабильность конечного структурированного материала, резистентность структурообразователя кристаллизации in situ, и прозрачность, и твердость композиции.
Было показано, что октанонаноат α-целлобиозы является весьма хорошим структурообразователем для не смешивающихся с водой жидкостей, включая силиконовые жидкости и не смешивающиеся с водой жидкие смягчающие вещества, применяемые во многих косметических композициях. Однако последние исследования ацилированных целлобиозных структурообразователей показали, что их термическая стабильность может быть улучшена и что длительное хранение может приводить к постепенному понижению прозрачности. Это должно быть ясно из исследований, связанных с кристаллизацией структурообразователя. Любой эффект приносит самоочевидные недостатки. Потеря структурной прочности во времени ограничивает время хранения продукта, а уменьшение визуальной прозрачности может быть воспринято покупателем как видимый сигнал того, что эффективность ухудшилась. Может потребоваться длительное время для того, чтобы продажные формы прошли по обычным каналам производства и дистрибьюции, и эти формы могут провести долгое время на полке покупателя до или во время применения, так что желательно найти пути улучшения или устранения любых отрицательных эффектов, которые могут так или иначе возникнуть во время хранения.
Следует, конечно, понимать, что при любых сделанных изменениях следует стремиться не принести в жертву какое-либо из других благоприятных свойств продуктов.
Однако многие композиции желательно являются пропускающими свет или прозрачными, и заданная твердость композиции остается важной характеристикой. Соответственно, при любом изменении, сделанном в рецептуре или сделанном альтернативном выборе из класса ацилированных целлобиозных материалов, следует стремиться минимизировать или даже преодолеть и обернуть вспять любые ухудшения других свойств структурообразователя, которые могут возникнуть при попытке улучшить одно из свойств. В качестве примера, при улучшении стабильности в отношении кристаллизации in situ может уменьшиться твердость. Могут быть рассмотрены смеси материалов, и тогда наблюдается некоторое изменение в поведении смеси структурообразователей по сравнению с их составляющими.
Задачей настоящего изобретения является создание ацилированной целлобиозы, которая демонстрирует привлекательное сочетание свойств, в особенности в качестве структурообразователя для не смешивающейся с водой жидкости.
Следует, однако, понимать, что, хотя материал по настоящему изобретению рассматривается, в частности, для применения в косметических композициях, его потенциальное использование намного шире, включая структурирование не смешивающейся с водой жидкости для приготовления крема, мягкого твердого вещества или карандаша для любых других целей. Они могут включать топические медикаменты, топически наносимые ветеринарные продукты или косметические средства для животных и воски или полировочные средства.
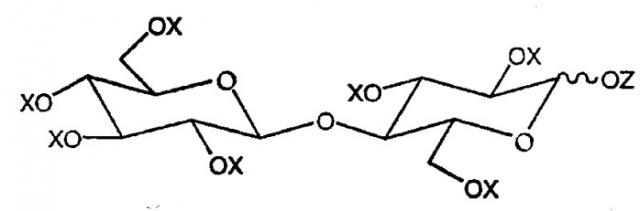
Настоящее изобретение относится к новому соединению, ацилированной целлобиозе, соответствующей общей формуле:
в которой X представляет ацильную группу (R-CO-) или H, Z представляет ацильную группу (R'-CO-) или H, и не более чем меньшая часть радикалов X + Z представляет H;
R представляет углеводородный радикал с насыщенной или ненасыщенной, линейной или разветвленной цепью, содержащий от 5 до 31 атомов углерода, и
R' представляет радикал, отличный от R, который представляет собой:
(i) углеводородный радикал с насыщенной или ненасыщенной, линейной или разветвленной цепью, содержащий от 1 до 31 атомов углерода, необязательно замещенный, или
(ii) ароматический углеводородный радикал, необязательно замещенный, или
(iii) циклоалифатический углеводород, необязательно замещенный.
Заместитель Z находится в аномерном положении.
Такой сложный эфир, в котором R отличается от R', иногда обозначают здесь как CHME.
Такие материалы, т.е. СНМЕ, проявляют превосходное сочетание свойств, делающее эти материалы особо пригодными для структурирования или загущения не смешивающихся с водой жидкостей, делая возможным их применение при производстве базовых гелей для косметических или медицинских активных веществ и, в частности, для прозрачных базовых гелей. Преимущества могут быть увеличены выбором замещения R' по аномерному углероду, которое отличается от замещения других алкильных групп R.
При сравнении, например, с применением различных целлобиозных октаэфиров, можно благоприятно видеть улучшение одного или нескольких из следующих свойств, а именно прозрачности, термической стабильности и устойчивости к кристаллизации in situ, в то же время без ухудшения твердости.
Согласно второму аспекту настоящего изобретения предложен способ получения ацилированной целлобиозы, описанной здесь выше, включающий стадию реакции ацилированной целлобиозы, имеющей общую формулу 2:
в которой X представляет ацильную группу (R-CO-) или H, причем Н представляет не более чем меньшую часть радикалов X, и R представляет углеводородный радикал с насыщенной или ненасыщенной, линейной или разветвленной цепью, содержащий от 5 до 31 атомов углерода, с ацилирующим агентом, содержащим радикал R', как он описан здесь выше, предпочтительно по аномерному углероду целлобиозы.
Согласно настоящему способу проводят ацилирование гидроксильной группы аномерного атома углерода либо проводят переэтерифицию ацильной группы R-CO- у аномерного атома углерода.
Настоящее изобретение относится также к применению ацилированной целлобиозы, как она описана здесь выше, для загущения или структурирования не смешивающейся с водой жидкости с образованием в результате крема, мягкого твердого вещества или твердого вещества.
Настоящее изобретение, кроме того, относится к базовой композиции в форме крема, мягкого твердого вещества или твердого вещества, содержащей в качестве структурирующего агента или загустителя ацилированную целлобиозу, определенную выше.
Согласно настоящему изобретению базовая композиция дополнительно содержит активный косметический, медицинский или ветеринарный агент.
Подробное описание изобретения и предпочтительных осуществлений
Ацилированные соединения целлобиозы соответствуют формуле, показанной ниже:
Когда X и Z представляют в данной формуле соответственно -COR и -COR', R представляет углеводородный радикал с насыщенной или ненасыщенной, линейной или разветвленной цепью, который содержит от 5 до 31 атомов углерода, часто до 18 атомов углерода, предпочтительно от 7 до 12 атомов углерода и особо предпочтительно 8 или 9 атомов углерода. Предпочтительно радикалы R являются насыщенными и желательно линейными. Наиболее желательно, все группы R являются одинаковыми. Следует понимать, что на практике алкильный заместитель с заданной длиной цепи в ацилирующем агенте может содержать на уровне примеси изомеры и близкие гомологи. Например, если R номинально представляет октил, заместитель может включать в качестве примесей небольшие количества, обычно не более 5%, изооктильных и н-гептильных/н-нонильных групп.
В данной формуле R' представляет алифатический, ароматический или циклоалифатический радикал. R' может быть алкилом, алкарилом, арилом или аралкилом, необязательно замещенным. Предпочтительно, когда R' является неалифатическим, если R является алифатическим.
Радикал R', если он алифатический, может включать насыщенный или ненасыщенный углеводородный радикал с линейной или разветвленной цепью, содержащий от 1 до 31 атомов углерода, более желательно линейный и предпочтительно с числом атомов углерода от 2 до 22. Радикалы R и R' отличаются друг от друга, так что R' часто выбирают из радикалов, имеющих максимальную длину цепи в интервале до R-2 атомов углерода или от R+2 атомов углерода и обычно в интервалах от 1 до 6 и от 13 до 22 атомов углерода. Особенно предпочтительные алкильные радикалы R' включают метил, этил и пропил. Алкильные группы внутри R' могут быть, необязательно, фторированы или замещены арильной группой, такой, как будет определено здесь далее, или циклоалифатической группой, такой, как будут описаны здесь далее, или аминной, или амидной группой. Замещенный алифатический радикал R' желательно содержит не более 31 и предпочтительно не более 22 атомов углерода.
Если R' представляет или содержит ароматический радикал, в частности арильный радикал, подходящие примеры включают фенильный, нафтильный и бифенильный радикалы. Арильная группа может включать 1 или множество ядер, которые могут быть конденсированными или неконденсированными. Арильное кольцо или кольца в ней могут быть замещенными, например, алкильной или алкокси группой, содержащей до 20 атомов углерода, или галогенной группой, такой как фторгруппой, или нитрогруппой, или группой алкильного сложного эфира, алкиламина или алкиламида. Замещенный алкильный радикал R' желательно содержит не более 26 атомов углерода.
Если R' представляет циклоалифатический углеводородный радикал, подходящие примеры включают циклогексан и циклооктан. Циклоалифатическое кольцо может быть замещено, например, алкильной или алкоксигруппой, содержащей до 20 атомов углерода, или арильной группой, такой, как описана выше.
R' может включать алкильный, арильный, циклоалкильный, алкарильный, аралкильный или циклоалкиларильный радикал.
Ацилированные целлобиозные материалы согласно настоящему изобретению могут представлять или α-, или β-аномерные формы или их смеси. В ряде особо предпочтительных осуществлений, например, в тех, в которых R' является насыщенным углеводородным радикалом, таким как циклогексил или линейный алкил С4-С10, который отличается от радикала R, CHME является, по меньшей мере, на 60 мол.% в β-аномерной форме, предпочтительно, по меньшей мере, на 80 мол.%, и особо предпочтительно, по меньшей мере, на 90 мол.% СНМЕ находится в β-аномерной форме. В других предпочтительных осуществлениях, например, в тех, в которых R' включает ненасыщенный углеводородный радикал, такой как бензоил или 4-бифеноил, предпочтительно, по меньшей мере, 90 мол.% CHME находится в β-аномерной форме.
Предпочтительно ацилированная целлобиоза ацилирована суммарно более чем шестью и во многих случаях более чем семью ацильными заместителями R-CO- + R'-CO-, в среднем, и предпочтительно составляющими, по меньшей мере, 95 мол.% от общего ацилирования. На практике было найдено, что ацилирование часто происходит преимущественно по атомам углерода целлобиозы, отличным от ее аномерного атома углерода, так что первые атомы углерода имеют склонность быть полностью ацилированными, обычно представляя R-CO-, по меньшей мере, в шести из семи местоположений X, и, во многих случаях, представляя R-CO- во всех или почти всех семи местоположениях Х, тогда как аномерный атом углерода может быть и обычно является ацилированным в меньшей пропорции.
Желательно, чтобы аномерный углерод был ацилирован, по меньшей мере, на 50%, предпочтительно, по меньшей мере, на 60%, более предпочтительно был ацилирован, по меньшей мере, на 75%, и наиболее желательно, в сочетании с Х, представляющим на 100% или почти на 100% R-CO- (обычно, по меньшей мере, в 6 из семи местоположений и предпочтительно более чем 97%). Особо желательно применять СНМЕ, в котором имеется не только высокая степень ацилирования по аномерному углероду, но также одновременно высокая мольная доля эфира находится в β-аномерной форме; каждый из данных характерных признаков был подробно описан здесь выше.
Особо подходящий подкласс СНМЕ включает сложные эфиры, в которых: i) каждый заместитель R представляет линейный октильный радикал; ii) аномерное положение ацилировано в высокой степени и предпочтительно, по меньшей мере, на 75 мол.%; и iii) большая часть и, по меньшей мере, 80 мол.% СНМЕ находится в β-аномерной форме.
Когда рассматривается применение сложных эфиров целлобиозы в общем и сложных эфиров по изобретению, в частности, для приготовления полупрозрачных гелей не смешивающихся с водой жидкостей, таких как силиконовые жидкости или другие упомянутые здесь не смешивающиеся с водой жидкости, желательно выбирать такие материалы, которые имеют относительно высокую температуру растворения волокон (ТРВ). Благоприятно то, что многие из эфиров по данному изобретению имеют ТРВ, по меньшей мере, 48°С, и особо предпочтительными эфирами являются эфиры, имеющие ТРВ, по меньшей мере, 51°С, поскольку они проявляют тенденцию давать гели, имеющие более высокую стабильность при хранении.
Ацилированные целлобиозы по настоящему изобретению могут быть использованы как единственные или первичные структурообразователи или могут быть использованы как не основной или дополнительный структурообразователь в сочетании с одним или несколькими из классов структурообразователей, которые упомянуты здесь далее. В качестве примера, структурообразователи по изобретению могут быть использованы вместе с ацилированной целлобиозой, описанной в PCT/GB 00/01228, в которой аномерная ацильная групп является такой же, как, по меньшей мере, некоторые из других ацильных групп, т.е. R=R', такой как октанонаноат целлобиозы или предпочтительно октадеканоат.
Особенно предпочтительно применять ацилированные целлобиозы, идентифицированные здесь (СНМЕ), в которых все заместители R являются одинаковыми и представляют н-нонил или предпочтительно н-октил, и, по меньшей мере, 75% заместителей у аномерного углерода представляют R' (т.е., по меньшей мере, 75 мол.% замещения в аномерном положении) и представляют циклогексил, фенил, нафтил или метил и предпочтительно циклогексил. Такие особенно желательные СНМЕ материалы предпочтительно, по меньшей мере, на 80 мол.% находятся в β-аномерной форме.
Приготовление материалов
Один удобный и общий способ получения ацилированных целлобиоз по настоящему изобретению включает стадию переэтерификации соответствующей ацилированной целлобиозы, в которой ацильные заместители -COR и -COR' являются одинаковыми. Такой процесс на практике может быть двухстадийным, первая стадия которого включает получение октаэтерифицированной целлобиозы, например, описанным здесь ниже способом. Вторая стадия такого процесса включает реакцию октаэфира с ацилирующим агентом, содержащим радикал -COR', способный, если необходимо, заместить радикал -COR в присутствии сильного ацилирующего катализатора. Полученный продукт часто включает часть остаточных радикалов R-CO- у аномерного атома углерода.
Аналогичный способ включает ацилирование соответствующей частично ацилированной целлобиозы ацилирующим агентом, содержащим радикал -COR', где требуется в присутствии ацилирующего катализатора, чтобы аномерный углерод был частично или предпочтительно полностью или почти полностью замещен гидроксильной группой. Такой субстрат может быть получен, например, полным или частичным деацилированием октаэфира целлобиозы. Соответственно, смешанные эфирные соединения целлобиозы по изобретению могут быть получены в трехстадийном процессе, включающем стадии: во-первых, получения октаэфира, у которого ацильный заместитель -COR' у аномерного углерода является таким же, как и у других углеродов целлобиозы, R-CO-; во-вторых, удаления аномерного ацильного заместителя; и затем переацилирования по аномерному положению отличным ацильным заместителем.
По одному способу осуществления первой стадии, будь то двух- или трехстадийный процесс, указанный выше, целлобиозу (обычно D-(+)-целлобиозу) вводят в реакцию с мольным избытком, часто со значительным избытком, ацилирующего агента, такого как хлорангидрид кислоты, RCOCl, карбоновая кислота RCO2H или ангидрид кислоты (RCO)2O, и, если необходимо, катализатором ацилирования. Группы R являются такими, как описаны здесь выше. Например, если в качестве ацилирующего агента используют кислоту, катализатор может быть предпочтительно полученным из кислоты, имеющей низкую pKа, таким как ангидрид (R"CO)2O, часто в значительном мольном избытке. Группа R" желательно является полихлорированным или предпочтительно, полифторированным алкилом, таким как трифторметил. Ацилирующий агент, например карбоновую кислоту, предпочтительно используют в мольном отношении к целлобиозе в интервале от, по меньшей мере, 50:1 и особо предпочтительно от 60:1 до 100:1. Катализатор предпочтительно используют с кислотой при мольном отношении к целлобиозе, по меньшей мере, 20:1 и предпочтительно от 22:1 до 50:1. Ацилирование желательно проводить при повышенной температуре, такой как выше 70°С и особо предпочтительно, около 100°С в течение, по меньшей мере, 2 часов и особо предпочтительно от 3 до 10 часов. Полученный продукт является преимущественно или полностью ацилированным, т.е. можно сказать, что было ацилировано, по меньшей мере, 90% и часто, по меньшей мере, 95% способных к ацилированию гидроксильных групп целлобиозы.
На первой стадии целлобиозу (обычно D-(+)-целлобиозу) вводят в реакцию с мольным избытком, часто со значительным избытком, ацилирующего агента, такого как хлорангидрид кислоты, RCOCl, в растворе летучего хлоруглеводорода, такого как хлороформ, в присутствии избытка сильного основного катализатора, такого как пиридин, и наиболее предпочтительно в сухой инертной атмосфере. Предпочтительно ацилирующийагент используют в мольном отношении к целлобиозе в интервале от 12:1 до 24:1, в 1,5-3 раза выше стехиометрического количества для октаацилирования. Основный катализатор обычно применяют в мольномсоотношении к целлобиозе от 6:1 до 12:1. Стадию ацилирования желательно проводить при умеренно повышенной температуре, такой как от 40 до 75°С, и часто от 45 до 60°С. Ход реакции хорошо контролировать методом ЖХВР и/или протонной ЯМР и дать ей продолжаться до тех пор, пока гептаацилированная целлобиоза не будет больше обнаруживаться. Такой период реакции часто находится в интервале от10 до 30 часов. Продукт ацилирования может быть извлечен охлаждениемдо комнатной температуры и осаждением в метаноле. Данный метод особенно применим для получения сложных эфиров преимущественно в β-аномерной форме.
На второй стадии вышеупомянутого трехстадийного процесса ацилированную целлобиозу, полученную на первой стадии, т.е. преимущественно α- или β-аномерную форму или их смесь, частично деацилируют предпочтительно по аномерному углероду. Способ включает реакцию полностью ацилированной целлобиозы со смесью алифатической кислоты низкого молекулярного веса (C1-C4) и предпочтительно уксусной кислоты с алкилендиамином, таким как предпочтительно этилендиамин, при низкой концентрации в ТГФ (тетрагидрофуране), такой как от 4 до 15% от массы ацилированной целлобиозы. Кислота, используемая на второй стадии, имеет более высокое значение pKa, чем катализатор на первой стадии. При реакции предпочтительно применяют примерно эквимольное отношение кислоты к ацилированной целлобиозе, такое как в интервале от 0,9 до 1,2:1, и небольшой мольный избыток диамина к ацилированной целлобиозе, такой как от 1,6 до 2,5:1. Реакцию обычно можно проводить при комнатной температуре или близкой, например от 20° до 30°С, в течение продолжительного времени реакции, часто, по меньшей мере, 12 часов и предпочтительно от 24 до 60 часов, или при умеренно повышенной температуре, такой как до 45°С, в течение соответственно более короткого периода времени, такого, как выбранное в интервале от 5 до 10 часов. Полученное частично деацилированное вещество может быть извлечено экстракцией в галогеноалкановом растворителе, таком как дихлорметан, и промыто кислотой. После сушки его можно перекристаллизовать из смеси ТГФ/метанол. На третьей стадии частично ацилированную целлобиозу переацилируют. Переацилирование можно проводить, используя карбоновую кислоту, хлорангидрид кислоты или ангидрид кислоты.
По первому варианту третьей стадии целлобиоза реагирует с, по меньшей мере, эквимольным количеством хлорида кислоты формулы R'COCl, предпочтительно с небольшим мольным избытком от 1,1 до 1,5:1 в присутствии, по меньшей мере, эквимольного количества триэтиламина и предпочтительно с небольшим мольным избытком от 1,1 до 1,5:1. Реакцию желательно проводить при температуре кипения с обратным холодильником или в пределах 10°С от нее, предпочтительно в течение, по меньшей мере, 1 часа и предпочтительно от 2 до 4 часов. Желательно дать реакции продолжаться до тех пор, пока не будет достигнута, по меньшей мере, предварительно заданная степень ацилирования по аномерному углероду, такая как, по меньшей мере, 80% и часто, по меньшей мере, 90%. По данному первому варианту полученный СНМЕ находится преимущественно в β-аномерной форме, точное соотношение α- и β-форм зависит от ацилирующего заместителя и принятых условий процесса.
По второму варианту данной третьей стадии частично деацилированная целлобиоза реагирует со значительным избытком карбоновой кислоты формулы R'CO2H, таким как при мольном отношении, по меньшей мере, 50:1 и предпочтительно от 60 до 100:1 в присутствии значительного мольного избытка сильного кислотного катализатора, такого как катализатор, используемый на первой стадии, и предпочтительно при мольном отношении к целлобиозе, по меньшей мере, 20:1 и предпочтительно от 22:1 до 50:1. Реакцию предпочтительно ведут при повышенной температуре, такой как предпочтительно выше 90°С и более предпочтительно около 100°С. Время реакции составляет предпочтительно, по меньшей мере, 4 часа и более предпочтительно от 5 до 10 часов. Реакция желательно должна продолжаться до тех пор, пока не будет достигнута, по меньшей мере, предварительно заданная степень ацилирования по аномерному углероду, такая как, по меньшей мере, 80% и часто, по меньшей мере, 90%. По данному второму варианту полученный СНМЕ находится преимущественно в α-аномерной форме, точное соотношение α- и β-форм зависит от ацилирующего заместителя и принятых условий процесса.
По третьему варианту осуществления третьей стадии, частично деацилированная целлобиоза реагирует с ангидридом формулы (R'CO)2O. Реакцию обычно ведут в углеводородном растворителе, имеющем температуру кипения, по меньшей мере, 80°С, таком как толуол. При реакции обычно используют избыток ангидрида, предпочтительно при мольном отношении к целлобиозе, по меньшей мере, 2:1 и часто от 2,5 до 10:1.
Косметические композиции
Косметические композиции настоящего изобретения могут включать вспомогательные компоненты, в частности гелеобразователь. Количество гелеобразователя в косметических композициях согласно изобретению может быть выбрано в интервале от 0,1 до 20 мас.% и предпочтительно от 0,5 до 15 мас.% в комбинации с водонесмешиваемой жидкости.
Косметическая композиция может дополнительно содержать один или более активных агентов, выбранных из агентов для ухода за кожей, агентов личной гигиены, лекарственных средств, солнцезащитных средств или средств, способствующих загару, предпочтительный агент личной гигиены обладает антиперспирантной активностью.
Не смешивающаяся с водой жидкость
Не смешивающаяся с водой жидкость, которая во многих осуществлениях действует как носитель дисперсной твердой или жидкой фазы, обычно включает одно из веществ или смесь веществ, которые являются настолько гидрофобными, что не смешиваются с водой. В не смешивающуюся с водой жидкость могут быть включены некоторое количество гидрофильной жидкости в такой степени, чтобы она была растворимой или смешивающейся с не смешивающейся с водой жидкостью и давала общую смесь жидкости-носителя, которая была бы не смешивающейся с водой. Обычно желательно, чтобы такой носитель был жидким (в отсутствие структурообразователя) при температуре 15°С и выше. Она может иметь некоторую летучесть, но ее давление паров обычно должно быть ниже 4 кПа (30 мм рт.ст.) при 25°С так, чтобы вещество могло считаться маслом или смесью масел. Более конкретно, в некоторых осуществлениях желательно, чтобы, по меньшей мере, 80% мас.гидрофобного носителя состояло из веществ с давлением паров, не превышающим величину 4 кПа при 25°С.
Предпочтительно, например, для использования в косметических рецептурах, чтобы гидрофобное вещество-носитель включало летучий жидкий силикон, например жидкий полиорганосилоксан. Чтобы быть классифицированным как "летучий", такое вещество должно иметь измеримое давление пара при 20° или 25°С. Обычно давление паров летучего силикона лежит в интервале от 1 или 10 Па до 2 кПа при 25°С.
Летучий силикон желательно включать из-за того, что он придает "осушающее" ощущение нанесенной пленке после нанесения композиции на кожу.
Летучие полиорганосилоксаны могут быть линейными, или циклическими, или их смесью. Предпочтительные циклические силоксаны включают полидиметилсилоксаны и, в частности, те, которые содержат от 3 до 9 атомов кремния, предпочтительно не более 7 атомов кремния и наиболее предпочтительно от 4 до 6 атомов кремния, часто называемые иначе циклометиконами. Предпочтительные линейные силоксаны включают полидиметилсилоксаны, содержащие от 3 до 9 атомов кремния. Летучие силоксаны обычно сами по себе имеют вязкость ниже 10-5 м2/сек (10 сантистокс) и предпочтительно выше 10-7 м2/сек (0,1 сантистокс), линейные силоксаны обычно имеют вязкость ниже 5×10-6 м2/сек (5 сантистокс). Летучие силиконы могут также включать разветвленные линейные или циклические силоксаны, такие как вышеупомянутые линейные или циклические силоксаны, замещенные одним или несколькими подвешенными -O-Si(CH3)3 группами. Примеры доступных на рынке силиконовых масел включают масла, имеющие марки 344, 345, 244, 245 и 246 от Dow Corning Corporation; Silicon 7207 и Silicon 7158 от Union Carbide Corporation и SF1202 от General Electric.
Гидрофобный не смешивающийся с водой жидкий носитель, применяемый во многих композициях, может здесь альтернативно или дополнительно включать нелетучие силиконовые масла, которые включают полиалкилсилоксаны, полиалкиларилсилоксаны и полиэфиросилоксановые сополимеры. Они могут быть удачно выбраны из диметикона и сополиолов диметикона. Выбранные полиалкиларилсилоксаны включают полисилоксаны с короткой цепью, например три- или тетрасилоксаны, содержащие в среднем, по меньшей мере, одну фенильную группу на силоксановое звено, например тетрафенилтрисилоксаны. Доступные на рынке нелетучие силиконовые масла включают Dow Corning 556, серию Dow Corning 200 и DC704.
Не смешивающийся с водой жидкий носитель может содержать от 0 до 100 мас.% одного или нескольких жидких силиконов. Некоторые осуществления содержат жидкие силиконы в количестве, по меньшей мере, 10%, лучше, по меньшей мере, 15% от массы всей композиции. Если используют силиконовое масло, в некоторых осуществлениях летучий силикон предпочтительно составляет от 10 до 100 % от массы жидкости-носителя. Во многих случаях, если присутствует нелетучее силиконовое масло, его массовое отношение к летучему силиконовому маслу выбирают в интервале менее чем 3:1, такое как от 1:3 до 1:40, тогда как в некоторых других осуществлениях доля летучих силиконовых масел составляет от 0 до менее чем 10% так, что массовое отношение нелетучих к летучим силиконовым маслам больше чем 10:1, такое как от 15:1 до ∞:1. В других осуществлениях жидкие силиконы отсутствуют или присутствуют лишь в малых долях от не смешивающейся с водой фазы, таких как до 7 или 8 мас.%. Соответственно, для структурирования сложными эфирами СНМЕ по изобретению в качестве носителя может быть использован ряд смесей силиконовых масел и несиликоновых масел. Во многих из таких смесей применяют массовое соотношение силиконовых масел к несиликоновым маслам от 4:1 до 1:4. Выбор жидкости-носителя часто делают, принимая в расчет показатель преломления компонентов смеси жидкости-носителя и показатель преломления конкретного активного составляющего, такого как антиперспирант, или не смешивающейся с водой фазы.
Вместо жидких силиконов, а в некоторых осуществлениях в добавление к жидким силиконам могут быть использованы не содержащие силиконы гидрофобные жидкости. Не содержащие силиконы гидрофобные органические жидкости, которые могут быть введены, включают летучие или нелетучие жидкие алифатические углеводороды, такие как минеральные масла или гидрированный полиизобутен, часто выбранные так, чтобы они имели низкую вязкость. Дополнительными примерами жидких углеводородов являются полидецен, парафины и изопарафины с, по меньшей мере, 10 атомами углерода.
Другими гидрофобными носителями являются жидкие алифатические или ароматические сложные эфиры, но для некоторых применений, например для антиперспираторных композиций, они должны использоваться только как часть жидкого носителя, желательно не более 20%, и, возможно, менее 10% от массы не смешивающегося с водой жидкого носителя.
Подходящие алифатические сложные эфиры содержат, по меньшей мере, одну алкильную группу с длинной цепью, такие как эфиры, полученные из алканолов С1-С20, этерифицированных алкановой кислотой от С8 до С22 или алкандиоевой кислотой от С6 до С10. Алканольную и кислотную группы или их смеси предпочтительно выбирают так, чтобы каждая из них имела температуру плавления ниже 20°С. Такие сложные эфиры включают изопропилмиристат, лаурилмиристат, изопропилпальмитат, диизопропилдисебацинат и диизопропиладипинат.
Подходящие жидкие ароматические сложные эфиры, предпочтительно имеющие температуру плавления ниже 20°С, включают жирные алкилбензоаты. Примеры таких эфиров включают подходящие С9-С18 алкилбензоаты или их смеси.
Дополнительные примеры подходящих гидрофобных носителей включают жидкие алифатические простые эфиры, полученные из, по меньшей мере, одного жирного спирта, такие как производные миристиловые эфиры, например PPG-3 миристиловый эфир, или низшие алкиловые эфиры полигликолей, например С2-С4 алкильные простые эфиры PPG, такие как промышленные продукты, имеющие CFTA с номинальным обозначением PPG-14 бутиловый эфир.
Алифатические спирты, являющиеся твердыми при 20°С, такие как стеариловый спирт, предпочтительно отсутствуют или присутствуют в низких концентрациях, таких как менее 5% от массы всей композиции, поскольку они приводят к видимым белым отложениям при использовании композиции.
Однако могут применяться алифатические спирты, являющиеся жидкими при 20°С. Они включают спирты с разветвленной цепью с, по меньшей мере, 10 атомами углерода, такие как изостеариловый спирт и октилдодеканол.
Не содержащие силикон жидкости могут составлять от 0 до 100% несмешивающегося с водой жидкого носителя. Предпочтительно, чтобы присутствовало силиконовое масло и/или углеводородное масло и чтобы общее кол