Гетерополициклические соединения (варианты), фармацевтическая композиция и способ лечения заболеваний, ассоциированных с метаботропными глутаматными рецепторами
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы II
где X, Y представляют собой N, Z представляет собой О; Ar1 представляет собой 2-пиридил; Ar2 представляет собой фенил; причем по крайней мере один из остатков Ar1 и Ar2 замещен по меньшей мере одним остатком, выбранным из группы, состоящей из -F, -CI, -Br, -I, -SR, -CN, -C(O)R, -CH(OR)R', -CH2(OR), -CF3, C1-С10-алкила и арила, где R или R' выбраны из группы, включающей в себя Н, -CF3, C1-С10-алкил и арил, где R или R' могут быть объединены с образованием кольца, и при условии, что соединение не является 3-(2-пиридил)-5-(2-хлорфенил)-1,2,4-оксадиазолом или 3-(2-пиридил)-5-[3-(трифторметил)фенил]-1,2,4-оксадиазолом; или к новым соединениям, перечисленным в формуле изобретения, а также относится к фармацевтической композиции, обладающей активностью в отношении метаботропных глутаматных рецепторов на их основе, и к способу модулирования метаботропных глутаматных рецепторов. 3 н. и 11 з.п. ф-лы, 1 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к соединениям, активным в отношении метаботропных глутаматных рецепторов и которые могут быть использованы для лечения неврологических и психических заболеваний и нарушений.
Уровень техники
Последние достижения в изучении нейрофизиологических функций метаботропных глутаматных рецепторов показали, что эти рецепторы являются перспективными мишенями для лекарственных средств при терапии острых и хронических неврологических и психических заболеваний и нарушений. Однако при реализации этой идеи основной проблемой является разработка соединений, избирательных к подвиду метаботропных глутаматных рецепторов.
Глутамат является главным стимулирующим нейромедиатором центральной нервной системы (ЦНС) млекопитающих. Глутамат оказывает воздействие на центральные нейроны посредством связывания с рецепторами клеточной поверхности и их активации. Эти рецепторы подразделяются на два главных класса, ионотропные и метаботропные глутаматные рецепторы, на основе структурных характеристик рецепторных белков, с помощью которых рецептор передает сигнал в клетку, и совокупности их фармакологических параметров.
Метаботропные глутаматные рецепторы (mGluR) это опосредованные G-белками рецепторы, которые после связывания с глутаматом активируют различные внутриклеточные системы вторичных мессенджеров (посредников). Активация mGluR в интактных нейронах млекопитающих индуцирует один или более следующих ответов: активацию фосфолипазы С, усиление гидролиза фосфоинозитидов (ФИ), высвобождение внутриклеточного кальция, активацию фосфолипазы D, активацию или ингибирование аденилциклазы, усиление или подавление образования циклоаденозинмонофосфата (цАМФ), активацию гуанилилциклазы, усиление образования циклогуанозинмонофосфата (цГМФ), активацию фосфолипазы A2, усиление высвобождения арахидоновой кислоты, а также усиление или подавление активности потенциали лиганд-управляемых ионных каналов. См. статьи Schoepp и соавт., Trends Pharmacol. Sci., 14:13 (1993); Schoepp, Neurochem. Int., 24:439 (1994), Pin и соавт., Neuropharmacology, 34:1 (1995).
Методом молекулярного клонирования идентифицировано восемь различных подвидов mGluR, получивших названия mGluR1-mGluR8. См., например, в статьях Nakanishi, Neuron, 13:1031 (1994); Pin и соавт., Neuropharmacology, 34:1 (1995); Knopfel и соавт., J. Med. Chem., 38:1417 (1995). Образование ряда других рецепторов происходит путем экспрессии альтернативно сплайсированных форм некоторых подвидов mGluR. См. в статьях Pin и соавт.; PNAS, 89:10331 (1992); Minakami и соавт., BBRC, 199:1136 (1994); Joly и соавт., J. Neurosci., 15:3970 (1995).
Подвиды метаботропного глутаматного рецептора подразделяются на три группы, группу I, группу II и группу III mGluR, на основе гомологии аминокислотной последовательности, систем вторичного мессенджера, используемых рецепторами, и их фармакологических характеристиках. См. в статьях Nakanishi, Neuron, 13:1031 (1994); Pin и соавт., Neuropharmacology, 34:1 (1995); Knopfel и соавт., J. Med. Chem., 38:1417 (1995).
Группа I mGluR включает mGluRI, mGluR5 и их альтернативно сплайсированные варианты. Связывание агонистов с этими рецепторами вызывает активацию фосфолипазы С и последующую мобилизацию внутриклеточного кальция. Для демонстрации этих эффектов выполнены электрофизиологические измерения, например, на овоцитах Xenopus, которые экспрессируют рекомбинантные рецепторы mGluRI. См., например, в статьях Masu и соавт., Nature, 349:760 (1991); Pin и соавт., PNAS, 89:10331 (1992). Аналогичные результаты получены на овоцитах, экспрессирующих рекомбинантные рецепторы mGluR5. См. в статьях Abe и соавт., J. Biol. Chem., 267:13361 (1992); Minakami и соавт., BBRC, 199:1136 (1994); Joly и соавт., J. Neurosci., 15:3970 (1995). В другом эксперименте, активация агонистом рекомбинантных рецепторов mGluR 1, экспрессированных в клетках яичника китайского хомячка (СНО), стимулирует гидролиз ФИ, образование цАМФ и высвобождение арахидоновой кислоты, что было определено измерениями с помощью стандартных биохимических испытаний. См. в статье Aramori и соавт., Neuron, 8:757 (1992).
Для сравнения, активация рецепторов mGluR5, экспрессированных в клетках СНО, стимулирует гидролиз ФИ и последующее изменение потоков внутриклеточного кальция, но при этом не наблюдается стимуляции образования цАМФ или высвобождения арахидоновой кислоты. См. в статье Abe и соавт., J. Biol. Chem., 267:13361 (1992). Однако, активация рецепторов mGluR5, экспрессированных в клетках LLC-PK1, приводит к гидролизу ФИ и образованию повышенной концентрации цАМФ. См. в статье Joly и соавт., J. Neurosci., 15:3970 (1995). Эффективность действия агониста рецептора mGluR группы I изменяется следующим образом: квисквалат > глутамат = иботенат > (28,1′ S,2′S)-2-карбоксициклопропилглицин (L-CCG-I) > (18,3R)-1-аминоциклопентан-1,3-дикарбоновая кислота (АЦПД). Квисквалат действует относительно избирательно на рецепторы группы I по сравнению с mGluR групп II и III, но, кроме того, является сильным активатором ионотропных рецепторов АМФ кислоты. См. в статьях Pin и соавт., Neuropharmacology, 34:1 (1995); Knopfel и соавт., J. Med. Chem., 38:1417 (1995).
Отсутствие агонистов и антагонистов к подвидам mGluR препятствует изучению физиологической роли отдельных mGluR, в связи с этим в настоящее время необходимо исследовать опосредованные этими рецепторами патофизиологические процессы, действующие на ЦНС. Однако исследования с использованием имеющихся неспецифических агонистов и антагонистов дают некоторое общее представление о рецепторах mGluR группы I в сравнении с рецепторами mGluR групп II и III.
Попытки выяснения физиологических функций mGluR группы I свидетельствуют о том, что активация этих рецепторов вызывает возбуждение нейронов. Различного рода исследования показали, что АЦПД может вызывать постсинаптическое возбуждение после воздействия на нейроны в гиппокампе, коре головного мозга, мозжечке и таламусе, а также в других отделах мозга. Факты свидетельствуют о том, что это возбуждение происходит благодаря прямой активации постсинаптических mGluR, но кроме того, предполагают, что имеет место активация предсинаптических mGluR, что приводит к повышенному выбросу нейромедиатора. См. в статьях Baskys, Trends Pharmacol. Sci., 15:92 (1992); Schoepp, Neurochem. Int., 24:439 (1994); Pin и соавт., Neuropharmacology, 34:1 (1995).
В фармакологических экспериментах рецепторы mGluR группы I используются в качестве медиаторов этого механизма возбуждения. Действие АЦПД может быть воспроизведено при низких концентрациях квисквалата в присутствии антагонистов iGluR. См. в статьях Ни и соавт., Brain Res., 568:339 (1991); Green и соавт., Eur. J. Pharmacol., 226:279 (1992). Известно, что два производных фенилглицина, (S)-3-гидроксифенилглицин ((S)-ЗГФГ) и (S)-3,5-дигидроксифенилглицин ((S)-ДГФГ), активируют mGluR 1 и, таким образом, вызывают возбуждение. См. в статье Watkins и соавт., Trends Pharmacol. Sci., 15:33 (1994). Кроме того, возбуждение может быть блокировано (S)-4-карбоксифенилглицином ((S)-4КФГ), (S)-4-карбокси-3-гидроксифенилглициноом ((S)-4КЗГФГ) и (+)-α-метил-4-карбоксифенилглицином ((+)-4МКФГ), то есть соединениями, известными как антагонисты mGluRI. См. в статьях Eaton и соавт., Eur. J. Pharmacol., 244:195 (1993); Watkins и соавт., Trends Pharmacol., Sci. 15:33 (1994).
Метаботропные глутаматные рецепторы принимают участие в ряде нормальных процессов ЦНС млекопитающих. Показано, что активация mGluR необходима для индукции долговременного потенциирования гиппокампа и долговременного торможения мозжечка. См. в статьях Bashirn соавт., Nature, 363:347 (1993); Bortolotto и соавт., Nature, 368:740 (1994); Aiba и соавт., Cell, 79:365 (1994); Aiba и соавт., Cell, 79:377 (1994). Установлена также роль активации mGluR в проявлении болевых ощущений и в аналгезии. См. в статье Meller и соавт., Neuroreport, 4:879 (1993). Кроме того, предполагается, что активация mGluR выполняет модуляторную функцию во многих других нормальных процессах, включая синаптическую передачу сигнала, развитие нейронов, апоптотическую гибель нейронов, синаптическую пластичность, пространственное обучение, обонятельную память, центральную регуляцию сердечной активности, пробуждение от сна, регуляцию двигательного центра и регуляцию вестибулярно-зрительного рефлекса. См.,например, в статьях Nakanishi, Neuron, 13:1031 (1994); Pin и соавт., Neuropharmacology, 34:1 (1995); Knopfel и соавт., J. Med. Chem., 38:1417 (1995).
Предполагается также, что метаботропные глутаматные рецепторы принимают участие во многих патофизиологических процессах и патологических состояниях, затрагивающих ЦНС. Такие состояния включают инсульт, травмы головы, гипоксические и ишемические повреждения, гипогликемию, эпилепсию и нейродегенеративные заболевания, такие как болезнь Альцгеймера. См. в статьях Schoepp и соавт., Trends Pharmacol. Sci., 14:13 (1993); Cunningham и соавт., Life Sci., 54:135 (1994); Hollman и соавт., Ann. Rev. Neurosci., 17:31 (1994); Pin и соавт., Neuropharmacology, 34:1 (1995); Knopfel и соавт., J. Med. Chem., 38:1417 (1995). Полагают, что многие патологические процессы при этих состояниях происходят из-за возбуждения нейронов ЦНС, вызванных избытком глутамата. Поскольку считается, что mGluR группы I усиливает возбуждение нейронов, опосредованное глутаматом, через постсинаптические механизмы и усиленный предсинаптический выброс глутамата, их активация, вероятно, вносит определенный вклад в развитие патологических состояний. Соответственно, избирательные антагонисты mGluR группы I могут быть эффективны в терапии, прежде всего, в качестве нейропротективных агентов, аналгетиков или противосудорожных средств.
Предварительные исследования по оценке терапевтических характеристик известных агонистов и антагонистов mGluR привели к кажущимся противоречивым результатам. Например, было установлено, что нанесение АЦПД на нейроны гиппокампа приводит к эпилептическому припадку и повреждению нейронов (см. в статьях Sacaan и соавт., Neurosci. Lett., 139:77 (1992); Lipparti и соавт., Life Sci., 52:85 (1993)). Однако другие исследования свидетельствуют о том, что АЦПД ингибирует эпилептоформную активность, а также может проявлять нейропротективные свойства. См. в статьях Taschenberger и соавт., Neuroreport, 3:629 (1992); Sheardown, Neuroreport, 3:916 (1992); Koh и соавт., Ргос. Natl. Acad. Sci. USA, 88:9431 (1991); Chiamulera и соавт., Eur. J. Pharmacol., 216:335 (1992); Siliprandi и соавт., Eur. J. Pharmacol., 219:173 (1992); Pizzi и соавт., J. Neurochem., 61:683 (1993).
Вероятно, эти противоречивые результаты связаны с недостаточной избирательностью АЦПД, который вызывает активацию нескольких различных подвидов mGluR. Работы, в которых обнаружено повреждение нейронов, по-видимому, свидетельствуют о том, что происходит активация mGluR группы I, что в свою очередь приводит к усилению нежелательного переноса возбуждающего нервного импульса. Работы, в которых установлено нейропротективное действие, свидетельствуют о том, что происходит активация mGluR группы II и/или III, ингибирование предсинаптического выброса глутамата и снижение переноса возбуждающего нервного импульса.
Такая интерпретация результатов согласуется с наблюдением, что (S)-4КЗГФГ, антагонист mGluR группы I и агонист mGluR группы II, защищает мышей линии DBA/2 от аудиогенных эпилептических припадков, в то время как агонисты DCG-IV и L-CCG-1, селективные в отношении mGluR группы II, защищают нейроны от токсичного действия, индуцированного NMDA и КА. См. в статьях Thomsen и соавт., J. Neurochem., 62:2492(1994); Вгипо и соавт., Eur. J. Pharmacol., 256:109(1994); Pizzi и соавт., J. Neurochem., 61:683(1993).
Из вышесказанного очевидно, что известные в настоящее время агонисты и антагонисты mGluR имеют ограниченное значение ввиду недостаточной эффективности и селективности действия. Кроме того, большинство известных соединений являются аминокислотами или их производными, обладающими ограниченной биодоступностью, что препятствует исследованиям in vivo по оценке физиологической роли mGluR, фармакологии и терапевтических свойств таких соединений. Соединения, которые избирательно ингибируют активацию подвидов метаботропных глутаматных рецепторов группы I, могут найти применение при терапии неврологических нарушений и заболеваний, таких как старческое слабоумие, болезнь Паркинсона, болезнь Альцгеймера, хорея Гентингтона, боли, мигрень, эпилепсия, травма головы, гипоксические или ишемические повреждения, психические нарушения, такие как шизофрения, депрессия и тревога, офтальмологические нарушения, такие как различные ретинопатии, например, диабетическая ретинопатия, глаукома, и неврологические нарушения слуховой природы, такие как шум в ушах, и невропатические болевые состояния, включая невропатические заболевания, такие как диабетическая невропатия, невропатии, вызванные химиотерапией, пост-герпетическая невралгия и невралгия тройничного нерва.
Соответственно, существует необходимость в эффективных агонистах и антагонистах mGluR, обладающих высокой избирательностью в отношении подвидов mGluR, прежде всего, в отношении подвида рецепторов группы I.
Сущность изобретения
Объектом настоящего изобретения являются соединения, активные в отношении метаботропных глутаматных рецепторов, обладающие высокой эффективностью и избирательностью к отдельным подвидам метаботропного глутаматного рецептора, и разработка способов получения таких соединений.
Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение, которое обладает высокой эффективностью и избирательностью в отношении отдельных подвидов метаботропного глутаматного рецептора, и разработка способов получения таких фармацевтических композиций.
Еще одним объектом настоящего изобретения является способ ингибирования активации mGluR группы 1 и ингибирования неврологических заболеваний, вызванных стимулирующей активацией mGluR группы I, прежде всего, mGluR5.
Еще одним объектом изобретения является способ лечения заболеваний, вызванных стимулирующей активацией рецептора mGluR группы I, прежде всего, mGluR5.
Для достижения этих и других объектов и целей настоящее изобретение включает в себя эффективные антагонисты mGluR группы I, прежде всего mGluR5. Эти антагонисты могут быть представлены формулой I
A1-G-Ar2,
где Ar1 означает необязательно замещенный гетероароматический остаток, а Ar2 означает необязательно замещенный бензольный цикл. G означает группу, которая связана с Ar1 и Ar2 не только ковалентными связями, и обеспечивает формирование правильной пространственной ориентации Ar1 и Ar2, но также может сама по себе взаимодействовать с белком, тем самым вызывая связывание с рецептором.
В одном из вариантов воплощения изобретения, G выбирают из группы, включающей в себя -NH-, -S-, -O-, -СО-, -CONH-, -CONHCH-, -СН2CONH-, -CNHNH-, -CNHNHCH2-, -С=NO-СН2-, -CH2NCH2-, -CH2CH2NH-, -NHCH2CO-, -NHCH2CHOH-, -NHCNHNH-, -NHCONH-, циклопентан, циклопентадиен, фуран, тиофуран, пирролидин, пиррол, 2-имидазолин, 3-имидазолин, 4-имидазолин, имидазол, пиразолин, пиразолидин, имидазолидин, оксазол, 2-оксазол, тиазол, изоксазол, изотиазол, 1Н-1,2,4-триазол, 1Н-1,2,3-триазол, 1,2,4-оксатиазол, 1,3,4-оксатиазол, 1,4,2-диоксазол, 1,4,2-оксатиазол, 1,2,4-оксадиазол, 1,2,4-тиадиазол, 1,2,5-оксадиазол, 1,2,5-тиадиазол, 1,3,4-оксадиазол, 1,3,4-тиадиазол, 1Н-тетразол, циклогексан, пиперидин, тетрагидропиридин, 1,4-дигидропиридин, пиридин, бензол, тетрагидропиран, 3,4-дигидро-2Н-пиран, 2Н-пиран, 4Н-пиран, тетрагидротиопиран, 3,4-дигидро-2Н-тиопиран, 2Н-тиопиран, 4Н-тиопиран, морфолин, тиоморфолин, пиперазин, пиридазин, пиримидин, пиразин, 1,2,4-триазин, 1,2,3-триазин, 1,3,5-триазин и 1,2,4,5-тетразин.
В другом варианте воплощения изобретения Ar1 выбирают из группы, включающей в себя фенил, бензил, нафтил, флуоренил, антренил, инденил, фенантренил и бензонафтенил, а Ar2 выбирают из группы, включающей в себя тиазолил, фурил, пиранил, 2Н-пирролил, тиенил, пирролил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил, пиридазинил, бензотиазолил, бензимидазолил, 3Н-индолил, индолил, индазолил, пуринил, хинолизинил, изохинолил, хинолил, фтализинил, нафтиридинил, хиназолинил, циннолинил, изотиазолил, хиноксалинил, индолизинил, изоиндолил, бензотиенил, бензофуранил, изобензофуранил и хроменил.
В еще одном варианте воплощения изобретения, соединения по настоящему изобретению имеют формулу II
где X, Y и Z независимо выбирают из группы, состоящей из N, О, S, С и СО, причем по крайней мере один из X, Y и Z означает гетероатом,
Ar1 и Ar2 независимо выбирают из группы, включающей в себя гетероциклический или конденсированный гетероциклический остаток, содержащий от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S, и ароматический остаток, выбранный из группы, состоящей из фенила, бензила, 1-нафтила, 2-нафтила, флуоренила, антренила, инденила, фенантренила и бензонафтенила,
причем остатки Ar1 и Ar2 необязательно замещены одним или более заместителями, выбранными из группы, состоящей из -F, -Cl, -Br, -I, -OR, -SR, -SOR, -SO2R, -SO2NRR', -OCOR, -OCONRR', -NRCOR', -NRCO2R', -CN, -NO2, -CO2R, -CONRR', -C(O)R, -CH(OR)R', -CH2(OR). -R и -A-(CH2)n-NRR', где R или R' выбирают из группы, включающей в себя Н, CF3, С1-С10алкил, циклоалкил, алкиларил, алкилгетероарил, гетероциклоалкил, арил, и где R и R' могут быть объединены с образованием цикла, а A означает СН2, О, NH, S, SO, SO2, и n равно 1, 2, 3 или 4. Гетероциклический или конденсированный гетероциклический остаток предпочтительно выбирают из группы, состоящей из хинолила, хиназолила, хиноксалила, 2-пиримидила, 4-пиримидила, 5-пиримидила, 2-пиридила, 3-пиридила, 4-пиридила и пиразила.
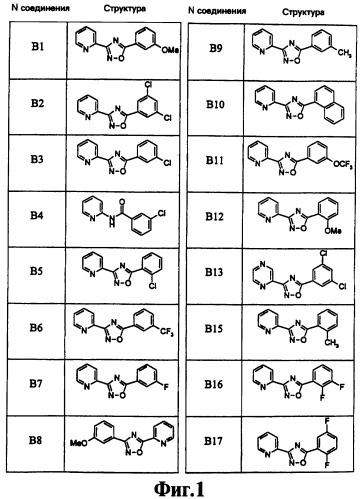
В предпочтительном варианте воплощения изобретения соединение выбирают из группы, включающей в себя
3-(2-пиридил)-5-(3,5-дихлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-хлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-метоксифенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2-хлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-[3-(трифторметил)фенил]-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-метилфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(1-нафтил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-[3-(трифторметокси)фенил]-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2,3-дифторфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2,5-дифторфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3,5-дифторфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3,5-диметоксифенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2,3-дихлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-хлор-5-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-фтор-5-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-хлор-5-фторфенил)-1,2,4-оксадиазол,
3-(5-хлорпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(5-фторпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(5-фторпирид-2-ил)-5-(3-циано-5-фторфенил)-1,2,4-оксадиазол,
3-(3-фторпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(5-фторпирид-2-ил)-5-(3,5-диметоксифенил)-1,2,4-оксадиазол,
3-(5-метоксипирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(2-хинолинил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(3-хлор-5-трифторметилпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(5-хлор-2-метоксифенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2-хлор-5-метилтиофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2-бром-5-метоксифенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2,5,6-трифторфенил)-1,2,4-оксадиазол,
2-(3-хлорфенил)-4-(пиридин-2-ил)-1,3-оксазол и
3-(2-пиридил)-5-(2,5,6-трифторфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-нитрофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-бромфенил)-1,2,4-оксадиазол и
их фармацевтически приемлемые соли.
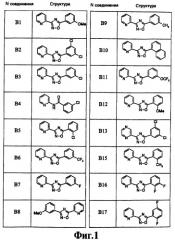
В другом варианте осуществления изобретения соединение выбирают из группы, включающей в себя
2-(3,5-дихлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-метоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2-хлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-трифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-метилфенил)-4-(2-пиридил)-1,3-оксазол,
2-( 1 -нафтил)-4-(2-пиридил)-1,3-оксазол,
2-(3-трифторметоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,3-дифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,5-дифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3,5-дифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-цианофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3,5-диметоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,3-дихлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлор-5-цианофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-фтор-5-цианофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлор-5-фторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-цианофенил)-4-(5-хлорпирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(5-фторпирид-2-ил)-1,3-оксазол,
2-(3-циано-5-фторфенил)-4-(5-фторпирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(3-фторпирид-2-ил)-1,3-оксазол,
2-(3,5-диметоксифенил)-4-(5-фторпирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(5-метоксипирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(2-хинолинил)-1,3-оксазол,
2-(3-цианофенил)-4-(3-хлор-5-трифторметилпирид-2-ил)-1,3-оксазол,
2-(5-хлор-2-метоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2-хлор-5-метилтиофенил)-4-(2-пиридил)-1,3-оксазол,
2-(2-бром-5-метоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,5,6-трифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлорфенил)-4-(пиридин-2-ил)-1,3-оксазол,
2-(3-нитрофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-бромфенил)-4-(2-пиридил)-1,3-оксазол и
их фармацевтически приемлемые соли.
Еще один вариант воплощения изобретения относится к фармацевтической композиции, содержащей вышеописанное соединение формулы I и формулы II в смеси с фармацевтически приемлемым разбавителем или наполнителем.
Еще один вариант воплощения изобретения относится к способу получения вышеописанного соединения. Более подробно, соединения по изобретению в общем виде могут быть получены путем образования фрагмента G между двумя соединениями-предшественниками, содержащими соответствующие остатки Ar1 и Ar2. Если связующая группа содержит 1,2,4-оксадиазол, с помощью известных способов может быть получен гетероцикл, например, по реакции между амидоксимом и хлорангидридом кислоты или по реакции амидоксима с ацилимидазолом. Иллюстрация этого превращения представлена ниже в Примерах 3-6.
Амидоксимы могут быть получены с помощью известных способов по реакции нитрила, замещенного Ar1, с гидроксиламином. Иллюстрация такого превращения приведена ниже в Примере 1.
В большинстве случаев соединения-предшественники, хлорангидриды карбоновой кислоты (карбонилхлориды), содержащие Ar2, доступны или могут быть получены с использованием известных методов органической химии. Например, карбоновые кислоты могут быть превращены в хлорангидриды, например, по реакции с тионилхлоридом или оксалилхлоридом.
Если связующая группа содержит 1,3-оксазол, соединения получают по методике, аналогичной описанной в статье Kelly и соавт., J. Org. Chem., 61, 4623-4633 (1996). 3,5-Дизамещенные-1,3-оксазолы получают при взаимодействии галогенкетона с карбоксамидом при кипячении в толуоле с обратным холодильником в течение 3 сут. Полученную смесь охлаждают до комнатной температуры, растворитель удаляют, а остаток подвергают очистке.
Еще один вариант воплощения изобретения относится к способу ингибирования активации рецептора mGluR группы I, а именно mGluR5, включающему обработку клеток, содержащих упомянутые рецепторы mGluR группы I, эффективным количеством соединения, описанного выше.
Другим объектом изобретения является разработка способа ингибирования повреждения нейронов, вызванных возбуждающей активацией рецептора mGtuR группы I, включающего обработку нейронов эффективным количеством соединения, описанного выше.
В соответствии с еще одним воплощением изобретения представлен способ лечения заболевания или нарушения, ассоциированного с глутамат-индуцированными повреждениями нейронов, или способ лечения заболевания или нарушения, ассоциированного с активацией mGlu группы I или подвергающегося терапевтическому действию вместе с антагонистом mGlu группы I, причем способ включает введение пациенту, страдающему упомянутым заболеванием или нарушением, эффективного количества композиции, описанной выше, при этом упомянутое заболевание или нарушение выбирают из группы, включающей в себя старческое слабоумие, болезнь Паркинсона, болезнь Альцгеймера, хорею Гентингтона, боли, мигрень, эпилепсию, травмы головы, гипоксические или ишемические повреждения, психические нарушения, такие как шизофрения, депрессия, тревога, диабетическая ретинопатия, глаукома, шум в ушах, диабетическая невропатия, невропатии, индуцированные химиотерапией, постгерпетическая невралгия и невралгия тройничного нерва.
Другие объекты, признаки и преимущества настоящего изобретения представляются очевидными из следующего подробного описания изобретения. Однако следует понимать, что данное подробное описание и специфические примеры, несмотря на определение предпочтительных вариантов воплощения изобретения, представлены только для иллюстрации, так как для специалиста в данной области техники при прочтении данного подробного описания представляются очевидными возможные различные изменения и модификации в пределах объема и сущности изобретения.
Перечень фигур чертежей
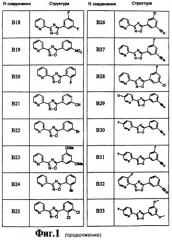
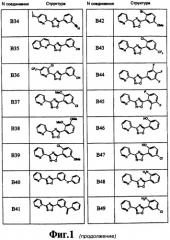
На чертеже в качестве иллюстрации представлены соединения, полученные согласно изобретению.
Сведения, подтверждающие возможность осуществления
изобретения
В настоящем изобретении представлены соединения, являющиеся сильнодействующими и селективными антагонистами mGluR5. Соединения, рассматриваемые в изобретении, могут быть представлены общей формулой
Ar1-G-Ar2 (I),
где Ar1 означает необязательно замещенный гетероциклический остаток и Ar2 означает необязательно замещенный карбоциклический остаток. G означает группу, которая не только ковалентно связана с остатками Ar1 и Ar2 и облегчает формирование правильной пространственной ориентации остатков Ar1 и Ar2, но также может сама по себе взаимодействовать с белком, делая тем самым возможным связывание с рецептором.
Структура остатков Ar1 и Ar2
Остаток Ar1 в основном определен как гетероциклический остаток, а остаток Ar2 в основном определен как карбоциклический остаток. Остатки Ar1 и Ar2 могут означать моноциклические или конденсированные бициклические группы. Ar2 предпочтительно определен как арильный или алкарильный остаток. Ar1 предпочтительно определен как гетероциклический, гетероарильный или гетероарилалкильный остаток. Кольцевые системы, определенные как Ar1, могут содержать вплоть до четырех гетероатомов, которые независимо выбирают из группы, включающей в себя N, S и О. Если Ar1 является гетероарильным кольцом или кольцевой системой, то он предпочтительно содержит один или два гетероатома. По крайней мере один из гетероатомов предпочтительно является азотом (N). Гетероциклический или конденсированный гетероциклический остаток предпочтительно выбирают из группы, включающей в себя хинолил, хиназолил, хиноксалил, 2-пиримидил, 4-пиримидил, 5-пиримидил, 2-пиридил, 3-пиридил, 4-пиридил и пиразил.
Моноциклические группы Ar1 включают в себя, без ограничения перечисленным, тиазолил, фурил, пиранил, 2Н-пирролил, тиенил, пирролил, имидазоил, пиразоил, пиридил, пиразинил, пиримидинил и пиридазинил. Моноциклические группы Ar2 включают в себя, без ограничения перечисленным, фенил и бензил. Конденсированная бициклическая группа Ar2 включает в себя, без ограничения перечисленным, нафтил, флуоренил, антренил, инденил, фенантренил и бензонафтенил. Конденсированные бициклические группы Ar1 включают в себя, без ограничения перечисленным, бензотиазолил, бензимидазолил, 3Н-индолил, индолил, индазолил, пуринил, хинолизинил, изохинолил, хинолил, фтализинил, нафтиридинил, хиназолинил, циннолинил, изотиазолил, хиноксалинил, индолизинил, изоиндолил, бензотиенил, бензофуранил, изобензофуранил и хроменил. Ar1 предпочтительно является 2-пиридильным остатком. Ar2 предпочтительно является замещенным фенильным остатком.
Остатки Ar1 и Ar2 необязательно могут быть независимо замещены по меньшей мере одним остатком, выбранным из группы, включающей в себя галоген, С1-С3 алкил, С1-С3O-алкил, -OН, -OCF3, -COOR, -COR, -SOR, -SO2NRR′, -NRR′, -CN, -CF3, -CO-NRR′, -A-(CH2)n-NRR′, где А означает С, О, N, SO, SO2, a R и R′ независимо выбирают из группы, включающей в себя С1-С3алкил, Н, циклоалкил, гетероциклоалкил, арил, и n равно 1, 2, 3 или 4.
Структура остатка G
Остаток G в основном составлен из 1-14 атомов. G независимо может быть выбран из группы атомов: С, Н, N, О и S.
Таким образом, остаток G может являться нециклическим остатком. К некоторым примерам таких остатков, например, относятся -NH(амин), -S-(тиоэфир), -O(простой эфир), -СО(кетон), -CONH(амид), -CONHCH2-, -СН2CONH-, -CNHNH(амидин), -CNHNHCH2-, -C=NO-CH2(метоксим), -CH2NHCH2-, -СН2СН2NH-, -NHCH2CO-, -NHCH2CHOH-, -NHCNHNH-(гуанидин) и -NHCONH(мочевина).
Конфигурация атомов в остатке G может образовать пятичленное кольцо. К некоторым примерам таких остатков, например, относятся циклопентан, циклопентадиен, фуран, тиофуран, пирролидин, пиррол, 2-имидазолин, 3-имидазолин, 4-имидазолин, имидазол, пиразолин, пиразолидин, имидазолидин, оксазол, 2-оксазол, тиазол, изоксазол, изотиазол, 1Н-1,2,4-триазол, 1Н-1,2,3-триазол, 1,2,4-оксатиазол, 1,3,4-оксатиазол, 1,4,2-диоксазол, 1,4,2-оксатиазол, 1,2,4-оксадиазол, 1,2,4-тиадиазол, 1,2,5-оксадиазол, 1,2,5-тиадиазол, 1,3,4-оксадиазол, 1,3,4-тиадиазол и 1Н-тетразол. Наиболее предпочтительным является 1,2,4-оксадиазол.
Конфигурация атомов в остатке G может также образовать шестичленное кольцо. К некоторым примерам таких остатков, например, относятся циклогексан, пиперидин, тетрагидропиридин, 1,4-дигидропиридин, пиридин, бензол, тетрагидропиран, 3,4-дигидро-2Н-пиран, 2H-пиран, 4Н-пиран, тетрагидротиопиран, 3,4-дигидро-2Н-тиопиран, 2Н-тиопиран, 4Н-тиопиран, морфолин, тиоморфолин, пиперазин, пиридазин, пиримидин, пиразин, 1,2,4-триазин, 1,2,3-триазин, 1,3,5-триазин и 1,2,4,5-тетразин.
Конфигурация атомов в остатке G может также образовать пяти- или шестичленное кольцо, содержащее одну или более карбонильных групп. К некоторым примерам таких остатков, например, относятся 2-азетидинон, 1,2-диазетидин-3-он, циклопентанон, 2-циклопентенон, 2-пирролидинон, 3-пирролин-2-он, сукцинимид, малеимид, 3-пиразолидинон, 2-имидазолидон, 4-имидазолин-2-он, 2Н-имидазол-2-он, 4-имидазолинон, З-пиразолин-5-он, гидантоин, 1Н-имидазол-2,5-дион, 2-оксазолин-4-он, 2-оксазолидинон, 3-оксазолин-5-он, 3(2Н)-изоксазолон, 2,4-оксазолидиндион, 1,2,4-триазолин-3,5-дион, 2,4-дигидро-3Н-1,2,4-триазол-3-он, 2Н-пиран-2-он, 2(1H)-пиридон, 2(1Н)-пиразинон, 4(3Н)-пиримидон, 3,4-дигидропиримидин-4-он,глутаримид, 4,6-(1H,5Н)-пиримидиндион, 1,3,5-триазин-2(1Н)-он и циануровая кислота.
В предпочтительном варианте воплощения изобретения остаток G включает гетероциклическую пятичленную кольцевую систему. G предпочтительно является оксазоловым или 1,2,4-оксадиазоловым кольцом.
Остаток G может иметь одну или две возможные ориентации относительно групп Ar1 и Ar2. Таким образом, предпочтительными соединениями по изобретению, например, являются следующие конфигурации: 4-(Ar1)-2-(Ar2)-оксазол или 3-(Ar1)-5-(Ar2)-1,2,4-оксадиазол.
В другом варианте воплощения изобретения соединения по настоящему изобретению могут быть представлены общей формулой II:
где X, Y и Z независимо выбирают из группы, состоящей из N, О, S, С и СО, причем по крайней мере один из X, Y и Z является гетероатомом;
Ar1 и Ar2 независимо выбраны из группы, состоящей из гетероциклического или конденсированного гетероциклического остатка, содержащего от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, О и S, а ароматический остаток выбран из группы, включающей в себя фенил, бензил, 1-нафтил, 2-нафтил, флуоренил, антренил, инденил, фенантренил и бензонафтенил, причем остатки Ar1 и Ar2 необязательно замещены по меньшей мере одним остатком, выбранным из группы, состоящей из -F, -Cl, -Br, -I, -OR, -SR, -SOR, -SO2R, -SO2NRR′, -OCOR, -OCONRR′, -NRCOR′, -NRCO2R′, -CN, -NO2, -CO2R, -CONRR′, -C(O)R, -CH(OR)R′, -CH2(OR), -R и -A-(CH2)n-NRR′, причем R или R′ выбраны из группы, включающей в себя Н, CF3, C1-С10алкил, циклоалкил, алкиларил, алкилгетероарил, гетероциклоалкил, арил, где R и R′ могут быть объединены с образованием кольца, а A определен как CH2, О, NH, S, SO, SO2 и n равно 1, 2, 3 или 4.
В предпочтительном варианте воплощения изобретения соединение
выбирают из группы, включающей в себя
3-(2-пиридил)-5-(3,5-дихлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-хлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-метоксифенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2-хлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-[3-(трифторметил)фенил]-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-метилфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(1-нафтил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-[3-(трифторметокси)фенил]-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2,3-дифторфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2,5-дифторфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3,5-дифторфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3,5-диметоксифенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2,3-дихлорфенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-хлор-5-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-фтор-5-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-хлор-5-фторфенил)-1,2,4-оксадиазол,
3-(5-хлорпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(5-фторпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(5-фторпирид-2-ил)-5-(3-циано-5-фторфенил)-1,2,4-оксадиазол, 3-(3-фторпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(5-фторпирид-2-ил)-5-(3,5-диметоксифенил)-1,2,4-оксадиазол,
3-(5-метоксипирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(2-хинолинил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(3-хлор-5-трифторметилпирид-2-ил)-5-(3-цианофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(5-хлор-2-метоксифенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2-хлор-5-метилтиофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(2-бром-5-метоксифенил)-1,2,4-оксадиазол, 3-(2-пиридил)-5-(2,5,6-трифторфенил)-1,2,4-оксадиазол,
2-(3-хлорфенил)-4-(пиридин-2-ил)-1,3-оксазол,
3-(2-пиридил)-5-(3-нитрофенил)-1,2,4-оксадиазол,
3-(2-пиридил)-5-(3-бромфенил)-1,2,4-оксадиазол и
их фармацевтически приемлемые соли.
В другом варианте воплощения изобретения соединение выбирают из группы, включающей в себя
2-(3,5-дихлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-метоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2-хлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-трифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-метилфенил)-4-(2-пиридил)-1,3-оксазол,
2-(1-нафтил)-4-(2-пиридил)-1,3-оксазол,
2-(3-трифторметоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,3-дифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,5-дифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3,5-дифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-цианофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3,5-диметоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,3-дихлорфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлор-5-цианофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-фтор-5-цианофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлор-5-фторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-цианофенил)-4-(5-хлорпирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(5-фторпирид-2-ил)-1,3-оксазол,
2-(3-циано-5-фторфенил)-4-(5-фторпирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(3-фторпирид-2-ил)-1,3-оксазол,
2-(3,5-диметоксифенил)-4-(5-фторпирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(5-метоксипирид-2-ил)-1,3-оксазол,
2-(3-цианофенил)-4-(2-хинолинил)-1,3-оксазол,
2-(3-цианофенил)-4-(3-хлор-5-трифторметилпирид-2-ил)-1,3-оксазол,
2-(5-хлор-2-метоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2-хлор-5-метилтиофенил)-4-(2-пиридил)-1,3-оксазол,
2-(2-бром-5-метоксифенил)-4-(2-пиридил)-1,3-оксазол,
2-(2,5,6-трифторфенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-хлорфенил)-4-(пиридин-2-ил)-1,3-оксазол,
2-(3-нитрофенил)-4-(2-пиридил)-1,3-оксазол,
2-(3-бромфенил)-4-(2-пиридил)-1,3-оксазол и
их фармацевтически приемлемые соли.
Получение антагонистов mGluR группы I
Многие исходные материалы для получения соединений по настоящему изобретению можно приобрести на фирмах, таких как Aldrich Chemical Company (Milwaukee, Wl). В то же время, соединения по настоящему изобретению легко получить из имеющихся предшественников с использованием прямых превращений, известных в данной области техники.
Для специалистов в данной области представляется очевидным, что антагонисты mGluR группы 1 могут быть получены с помощью хорошо известной методологии с использованием широко распространенных методов органической химии. Подходящие реакции описаны в стандартных учебниках по органической химии. Например, см. учебник March, Advanced Organic Chemistry (Органическая химия), 2-е изд., McGraw Hill (1977).
Более подробно, соединения по настоящему изобретению могут быть получены путем образования остатка G из двух исходных соединений, содержащих подходящие остатки Ar1 и Ar2. Если связующая группа содержит 1,2,4-оксадиазол, то гетероцикл может быть сформирован с использованием хорошо известного способа, такого как реакция между амид