Варианты полипептида гамма-интерферона
Иллюстрации
Показать всеИзобретение относится к области генной инженерии, конкретно к получению новых вариантов полипептида гамма-интерферона, обладающих активностью гамма-интерферона (IFNG), и может быть использовано в медицине для лечения интерстициальных легочных заболеваний. Новые варианты полипептида включают замены S99T по сравнению с аминокислотной последовательностью huIFNG, могут быть укорочены с С-конца на 1-15 аминокислот и способны повышать использование природного сайта N-гликозилирования в положении 97. Мутантные формы гамма-интерферона, содержащие треонин в положении 99, могут включать от 1 до 10 модификаций, без потери активности полипептида. Полипептид получают путем экспрессии в клетках-хозяевах, трансформированных вектором, включающим нуклеиновую кислоту, которая кодирует мутантный IFNG. Путем ПЭГилирования получают конъюгат мутантного полипептида с ПЭГ, который обладает увеличенным временем полужизни в сыворотке и сниженной иммуногенностью. Полученный полипептид IFNG используют в способах лечения и профилактики интерстициальных легочных заболеваний в составе фармацевтической композиции. Изобретение позволяет получить мутантный гамма-интерферон с повышенным использованием сайта N-гликозилирования в положении 97 по сравнению с природной формой huIFNG. 11 н. и 31 з.п. ф-лы, 3 ил., 4 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение касается новых вариантов полипептида γ-интерферона, обладающих активностью γ-интерферона (IFNG), способов их получения, фармацевтических композиций, включающих варианты полипептида, и их применения при лечении заболеваний, в частности, при лечении интерстициальных легочных заболеваний, таких как идиопатический фиброз легких.
УРОВЕНЬ ТЕХНИКИ
γ-Интерферон (IFNG) - это цитокин, вырабатываемый Т-лимфоцитами и естественными клетками-киллерами, который существует в виде гомодимера из двух нековалентно связанных полипептидных субъединиц. Зрелая форма каждого димера содержит 143 аминокислотных остатка (приведены в SEQ ID No:17), а их предшественник включает 166 аминокислотных остатков (приведены в SEQ ID No:18).
Каждая субъединица содержит два потенциальных сайта N-гликозилирования (Aggarwal et al., Human Cytokines, Blackwell Scientific Publications, 1992) в положении 25 и 97. В зависимости от степени гликозилирования молекулярный вес IFNG в виде димера составляет 34-50 кДа (Farrar et al., Ann. Rev. Immunol. 1993, 11: 571-611).
Первичная последовательность IFNG дикого типа человека (huIFNG) представлена в Gray et al. (Nature 298: 859-863, 1982), Taya et al. (EMBO J. 1: 953-958, 1982), Devos et al. (Nucleic Acids Res. 10: 2487-2501, 1982) и Rinderknecht et al. (J.Biol. Chem. 259: 6790-6797, 1984), а также в ЕР 0077670, ЕР 0089676 и ЕР 0110044. Трехмерная структура hulFNG приведена в Ealick et al. (Science 252: 698-701, 1991).
Сообщалось о различных естественных или мутированных формах полипептидов субъединиц IFNG, включая форму, содержащую N-концевую последовательность из аминокислот Cys-Tyr-Cys в положениях (-3)-(-1) относительно SEQ ID No:17, форму, содержащую N-концевой метионин (в положении - 1 относительно SEQ ID No:17) и различные укороченные с С-конца формы, содержащие 127-134 аминокислотных остатка. Известно, что удаление 1-15 аминокислотных остатков с С-конца не вызывает потери активности молекулы IFNG. К тому же Pan et al. (Eur. J. Biochem. 166: 145-149, 1987) сообщали о гетерогенности С-конца huIFNG.
О мутеинах huIFNG сообщали Slodowski et al. (Eur. J. Biochem. 202: 1133-1140, 1991), Luk et al. (J. Biol. Chem 265: 13314-13319, 1990), Seelig et al. (Biochemistry 27: 1981-1987, 1988), Trousdale et al. (Invest. Ophtalmol. Vis. Sci 26: 1244-1251, 1985), а также в ЕР 146354. О природном варианте huIFNG сообщали Nishi et al. (J. Biochem. 97: 153-159, 1985).
В US 6046034 раскрыты термостабильные рекомбинантные варианты huIFNG (rhuIFNG), в которые включено до 4 пар остатков цистеина для обеспечения образования дисульфидных мостиков и, таким образом, стабилизации варианта hulFNG в гомодимерной форме.
В WO 92/08737 раскрыты варианты IFNG, содержащие добавочный метионин на N-конце полной (остатки 1-143) или укороченной (остатки 1-132) аминокислотной последовательности IFNG дикого типа человека. В ЕР 0219781 раскрыта частичная последовательность huIFNG, содержащая аминокислотные остатки 3-124 (SEQ ID No:17). В US 4832959 раскрыты частичные последовательность hulFNG, содержащие остатки 1-127, 5-146 и 5-127 из аминокислотной последовательности, которая по сравнению с SEQ ID No:17 имеет три дополнительных N-концевых аминокислотных остатка (Cys-Tyr-Cys). В US 5004689 раскрыта последовательность ДНК, кодирующая huIFNG без трех аминокислотных остатков на N-конце (Cys-Tyr-Cys), и ее экспрессия в Е.coli. В ЕР О 446582 раскрыт полученный в Е.coli rhuIFNG, лишенный N-концевого метионина. В US 6120762 раскрыт пептидный фрагмент huIFNG, содержащий остатки 95-134 (относительно SEQ ID No:18).
Wang et al. (Sci. Sin. В 24: 1076-1084,1994) сообщали о высоком уровне экспрессии rhuIFNG.
Curling et al. (Biochem. J. 272: 333-337, 1990) и Hooker et al. (J. of Interferon and Cytokine Research, 1998, 18: 287-295) сообщали о гликозилированных вариантах rhuIFNG.
О модификации rhuIFNG полимерами сообщали Kita et al. (Drug Des. Deliv. 6: 157-167, 1990) и в ЕР 236987 и US 5109120.
В WO 92/22310 раскрыты асиалогликопротеиновые конъюгаты интерферонов, в том числе и huIFNG.
Были описаны и слитые белки IFNG. Например, в ЕР 0237019 раскрыт одноцепочечный полипептид, у которого один участок обладает активностью β-интерферона, а другой участок - активностью IFNG.
В ЕР 0158198 раскрыт одноцепочечный полипептид, у которого один участок обладает активностью IFNG, а другой участок - активностью IL-2. В нескольких работах описаны одноцепочечные димерные белки IFNG, например Landar et al. (J. Mol. Biol. 2000, 299: 169-179).
В WO 99/02710 раскрыты одноцепочечные полипептиды, среди которых один из многих представляет собой IFNG.
В WO 99/03887 раскрыты модифицированные PEG варианты полипептидов, принадлежащих к суперсемейству гормонов роста, в которых несущественный аминокислотный остаток, расположенный в определенном участке полипептида, был заменен остатком цистеина. IFNG упоминается как один из представителей суперсемейства гормонов роста, но о его модификации не приводится никаких подробностей.
IFNG предлагали для лечения интерстициальных легочных заболеваний (также известных как интерстициальный фиброз легких (IPF) (Ziesche et al., N. Engl. J. Med. 341: 1264-1269, 1999; Chest 110: Suppi: 25S, 1996) и в ЕР 0795332, для этих целей IFNG может применяться в сочетании с преднизолоном. Помимо IPF, с помощью IFNG можно лечить грануломатозные заболевания (Bolinger et al., Clinical Pharmacy, 1992, 11: 834-850), некоторые микобактериальные инфекции (N. Engl. J. Med. 330: 1348-1355, 1994), рак почек (J. Urol. 152: 841-845, 1994), остеопетроз (N. Engl. J. Med. 332: 1594-1599, 1995), склеродермию (J. Rheumatol. 23: 654-658, 1996), гепатит В (Hepatogastroenterology 45: 2282-2294, 1998), гепатит С (Int. Hepatol. Communic. 6: 264-273, 1997), септический шок (Nature Medicine 3: 678-681, 1997) и ревматоидный артрит.
В качестве фармацевтического соединения rhuIFNG применяется с определенным успехом, прежде всего, против некоторых вирусных инфекций и опухолей. rhuIFNG обычно применяется в виде парентеральных, предпочтительно подкожных, инъекций. Максимальная концентрация в сыворотке обнаруживается через 7 часов. Период полужизни в плазме составляет 30 минут после внутривенного введения. По этой причине эффективное лечение при помощи rhuIFNG подразумевает частые инъекции. Основные неблагоприятные побочные эффекты заключаются в жаре, ознобе, потливости, головной боли, миалгии и сонливости. Такие эффекты связаны с введением rhuIFNG и наблюдаются в первые часы после инъекции. К редко встречающимся побочным эффектам относятся боль и эритема в месте инъекции, повышение печеночных ферментов, обратимая грануло- и тромбопения и кардиотоксичность.
В WO 01/36001 раскрыты новые конъюгаты IFNG, содержащие неполипептидный компонент, присоединенный к полипептиду IFNG, который был модифицирован путем введения и/или удаления сайтов для присоединения таких неполипептидных компонентов, например, сайтов для PEG и сайтов гликозилирования.
Хорошо известно, что когда N-гликозилированные молекулы, такие как IFNG, продуцируются в гликозилирующем хозяине, не все потенциальные сайты N-гликозилирования полностью утилизируются. Это означает, что достаточно часто получается смесь белков с различной степенью N-гликозилирования in vivo, что в свою очередь приводит к необходимости последующей очистки. К тому же зачастую разделение идентичных белков с различной степенью гликозилирования требует времени и представляется затруднительным. Однако неожиданно оказалось, что замещение одного или нескольких аминокислотных остатков, расположенных вблизи от сайта N-гликозилирования in vivo (независимо от того, присутствует ли сайт N-гликозилирования in vivo естественным образом в IFNG или он был введен, к примеру, как описано в WO 01/36001), дает возможность повысить долю полностью гликозилированных молекул IFNG. В частности, было обнаружено, что замена естественных сайтов N-гликозилирования N-Y-S в положениях 97, 98 и 99 в huIFNG на N-Y-T приводит к резкому увеличению доли полностью гликозилированных молекул IFNG.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Итак, первый аспект изобретения касается варианта полипептида γ-интерферона (IFNG), обладающего активностью IFNG и имеющего аминокислотную последовательность, представленную в SEQ ID No:1 ([S99T]huIFNG), или его фрагмента, обладающего активностью IFNG.
Следующий аспект изобретения касается варианта SEQ ID No:1, включая вариант фрагментов SEQ ID No:1 (таких как SEQ ID No:2-16), при этом данный вариант включает по меньшей мере одну дополнительную модификацию и обладает активностью IFNG.
Другие аспекты настоящего изобретение касаются нуклеотидной последовательности, кодирующей вариант полипептида по изобретению.
Следующие аспекты настоящего изобретения касаются экспрессионного вектора, содержащего нуклеотидные последовательности по изобретению, и гликозилирующих клеток-хозяев, содержащих нуклеотидную последовательность по изобретению или экспрессионный вектор по изобретению.
Настоящее изобретение также касается фармацевтической композиции, содержащей вариант полипептида по изобретению, и варианта полипептида по изобретению или фармацевтической композиции по изобретению для применения в качестве лекарственного средства.
Следующие аспекты изобретения касаются применения варианта полипептида по изобретению или применения фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения интерстициальных легочных заболеваний.
Аналогичным образом, настоящее изобретение также касается способа лечения или профилактики интерстициальных легочных заболеваний, при этом способ заключается во введении млекопитающему, в частности человеку, нуждающемуся в этом, эффективного количества варианта полипептида по изобретению или фармацевтической композиции по изобретению.
Следующий аспект изобретения касается популяции вариантов полипептида IFNG или композиции, содержащей популяцию вариантов полипептида IFNG, при этом популяция содержит по меньшей мере 70% варианта полипептида IFNG по изобретению.
Следующий аспект настоящего изобретения касается способа повышения степени N-гликозилирования in vivo исходного полипептида IFNG, содержащего по меньшей мере один сайт N-гликозилирования in vivo с аминокислотной последовательностью N-X-S, где Х - любой аминокислотный остаток, за исключением пролина, причем способ включает замену остатка серина в указанной аминокислотной последовательности N-X-S остатком треонина для получения варианта IFNG.
Следующий аспект настоящего изобретения касается способа получения варианта полипептида IFNG по изобретению, при этом способ включает:
(a) культивирование гликозилирующей клетки-хозяина, содержащей нуклеотидную последовательность, кодирующую вариант полипептида IFNG по изобретению, в условиях, способствующих экспрессии этого варианта полипептида;
(b) необязательно проведение реакции указанного варианта полипептида с неполипептидным компонентом in vitro в условиях, способствующих осуществлению конъюгации; и
(c) извлечение варианта полипептида.
Другие аспекты настоящего изобретения станут понятными из нижеследующего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 представлены результаты Вестерн блоттинга оптимизированных по гликозилированию вариантов rhuIFNG. Левый блот: дорожка 1 - стандарт, 2 - Actimmune®, 3 - rhuIFNG, 4 - [E38N]rhuIFNG. Средний блот: дорожка 1 - стандарт, 2 - rhuIFNG, 3 - [E38N+S40T]rhuIFNG. Правый блот: дорожка 1 - стандарт, 2 - rhuIFNG, 3 - [S99T]rhuIFNG, 4 - [E38N+S40T+S99T]rhuIFNG.
На фиг.2 представлена кривая активность IFNG в сыворотке-время после подкожного введения крысам. • - Actimmune®, - rhuIFNG, ▴ - [E38N+S40T+S99T]-rhuIFNG. Все соединения вводили в одинаковых дозах (1,15×107 AU/кг).
На фиг.3 представлена кривая активность IFNG в сыворотке-время после подкожного введения крысам. • - [N16C+S99T]rhuIFNG (присоединен mPEG размером в 5 кДа), - [N16C+S99T]rhuIFNG (присоединен mPEG размером в 10 кДа), ▴ - [E38N+S40T+S99T]rhuIFNG. Вариант [E38N+S40T+S99T] вводили в дозе 1,15×107 AU/кг, тогда как оба модифицированных PEG варианта вводили в дозах 4,6×106 AU/кг.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Определения
В контексте настоящей заявки и изобретения применимы следующие определения.
Термин "конъюгат" (или взаимозаменяемо "конъюгированный полипептид" или "конъюгированный вариант") служит для обозначения гетерогенной (в смысле состава или химерной) молекулы, образованной при ковалентном присоединении одного или нескольких вариантов полипептида к одному или нескольким неполипептидным компонентам. Термин ковалентное присоединение означает, что вариант полипептида и неполипептидный компонент ковалентно связаны друг с другом либо непосредственно, либо непрямо через промежуточный компонент или компоненты, такие как мостики, спейсеры или молекулы линкера. Предпочтительно конъюгированный вариант полипептида растворим при релевантной концентрации и условиях, то есть растворим в физиологических средах типа крови. Примеры конъюгированных вариантов полипептида по изобретению включают гликозилированные и/или модифицированные PEG варианты полипептида. Термин "неконъюгированный вариант полипептида" может применяться к полипептидному компоненту конъюгированного варианта полипептида.
Термин "неполипептидный компонент" служит для обозначения молекулы, способной к конъюгированию со связующей группой варианта полипептида IFNG. Предпочтительные примеры таких молекул включают молекулы полимеров, липофильные соединения, сахара и органические модифицирующие агенты. Подразумевается, что неполипептидный компонент связан с полипептидом через связующую группу варианта полипептида. За исключением случаев, когда число неполипептидных компонентов типа молекул полимеров, присоединенных к варианту полипептида IFNG, указано точно, всякое упоминание "неполипептидного компонента", присоединенного к варианту полипептида IFNG или иным образом используемого в настоящем изобретении, следует понимать как одну или несколько "неполипептидных компонентов", присоединенных к варианту полипептида IFNG.
Термин "молекула полимера" означает молекулу, образованную путем ковалентной связи между двумя и более мономерами, причем ни один из мономеров не является остатком аминокислоты. Термин "полимер" может применяться взаимозаменяемо с термином "молекула полимера".
Термин "остаток сахара" служит для обозначения молекулы углевода, присоединенной путем гликозилирования in vivo или in vitro, например N- или О-гликозилирования.
"Сайт N-гликозилирования" имеет последовательность N-X-S/T/C, где Х - любая аминокислота за исключением пролина, N - аспарагин и S/T/C - серин, треонин или цистеин, предпочтительно серии или треонин, наиболее предпочтительно - треонин. "Сайт О-гликозилирования" представляет собой ОН-группу остатка серина или треонина.
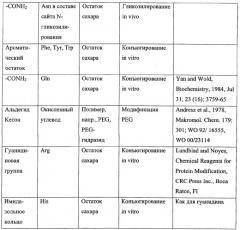
Термин "связующая группа" служит для обозначения группы аминокислотного остатка, способной к конъюгированию с релевантным неполипептидным компонентом, таким как молекула полимера или остаток сахара. Подходящие связующие группы и соответствующие им неполипептидные компоненты приведены ниже в таблице.
В отношении N-гликозилирования in vivo термин "связующая группа" применяется нестандартным образом для обозначения аминокислотных остатков, составляющих сайт N-гликозилирования (имеющий последовательность N-X-S/T/S, где Х - любой аминокислотный остаток, кроме пролина, N - аспарагин и S/T/C - серин, треонин или цистеин, предпочтительно серин или треонин, наиболее предпочтительно - треонин). Несмотря на то что именно остаток аспарагина в сайте N-гликозилирования служит для присоединения остатка сахара при гликозилировании, такое присоединение не происходит, если отсутствуют другие аминокислотные остатки сайта N-гликозилирования. Соответственно, когда неполипептидный компонент представлен остатком сахара, а конъюгация происходит путем N-гликозилирования, термин "аминокислотный остаток, содержащий связующую группу для неполипептидного компонента" в применении к изменениям аминокислотной последовательности полипептида IFNG следует понимать как то, что один, два или все аминокислотные остатки, составляющие сайт N-гликозилирования, подвергаются такому изменению, при котором функциональный сайт N-гликозилирования вводится в аминокислотную последовательность либо удаляется из нее, или же функциональный сайт N-гликозилирования сохраняется в аминокислотной последовательности (например, при замещении остатка серина, уже входящего в состав сайта N-гликозилирования, остатком треонина и наоборот).
В настоящей заявке названия и обозначения аминокислот и атомов (к примеру, CA, CB, CD, CG, SG, NZ, N, O, C и т.д.) применяются согласно определениям Базы Данных по Белкам (Protein DataBank, PDB) (www.pdb.org), которые основаны на номенклатуре IUPAC (IUPAC Nomenclature and Symbolism for Amino Acids and Peptides (residue names, atom names etc.), Eur. J. Biochem., 138, 9-37 (1984) вместе с поправками в Eur. J. Biochem., 152, 1 (1985). СА иногда обозначается как Сα, СВ - как Сβ. Термин "аминокислотный остаток" служит для обозначения аминокислотных остатков, входящих в группу, состоящую из остатков аланина (Ala или А), цистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (Ile или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gln или Q), аргинина (Arg или R), серина (Ser или S), треонина (Thr или Т), валина (Val или V), триптофана (Trp или W) и тирозина (Tyr или Y).
Нумерация аминокислотных остатков в настоящем документе начинается с N-конца [S99T]huIFNG без сигнального пептида (то есть SEQ ID No:1) или, где уместно, с N-конца huIFNG без сигнального пептида (то есть SEQ ID No:17).
Терминология, используемая для обозначения положения/замены аминокислот, иллюстрируется следующим образом: G18 означает положение 18, занятое глицином в аминокислотной последовательности, приведенной в SEQ ID No:17 G18N означает, что остаток Gly в положении 18 был заменен на Asn. Множественные замены обозначаются через "+", например G18N+S20T означает аминокислотную последовательность, содержащую замену остатка Gly в положении 18 на Asn и замену остатка Ser в положении 20 на Thr. Альтернативные замены обозначаются через "/". Например, G18S/T охватывает следующие индивидуальные замены: G18S и G18T. Делеции обозначаются звездочкой. Например, G18* означает, что остаток Gly в положении 18 был удален. Инсерции обозначаются следующим образом: инсерция дополнительного остатка Ser после остатка Gly, находящегося в положении 18, обозначается как G18GS. Комбинированные замены и инсерции обозначаются следующим образом: замена остатка Gly в положении 18 остатком Ser и инсерция остатка Ala после аминокислоты в положении 18 обозначается как G18SА.
Термин "нуклеотидная последовательность" служит для обозначения непрерывной цепочки из двух и более молекул нуклеотидов. Нуклеотидная последовательность может происходить из генома, кДНК, РНК, иметь полусинтетическое или синтетическое происхождение либо представлять собой любую их комбинацию.
Термин "полимеразная цепная реакция" или "ПЦР" в общем относится к методу амплификации требуемой нуклеотидной последовательности in vitro, как описано, к примеру, в US 4683195. В общем случае метод ПЦР заключается в многократном повторении цикла реакций удлинения праймера с использованием олигонуклеотидных праймеров, способных предпочтительно гибридизоваться с матричной нуклеиновой кислотой.
Термины "клетка", "клетка-хозяин", "линия клеток" и "культура клеток" в настоящем изобретении применяются взаимозаменяемо и следует иметь в виду, что все они включают потомство, образующееся в результате роста или культивирования клетки.
Термины "трансформация" и "трансфекция" в настоящем изобретении применяются взаимозаменяемо для обозначения процесса введения ДНК в клетку.
"Функционально связанный" относится к ковалентному соединению двух и более нуклеотидных последовательностей путем ферментативного лигирования или иным способом, в такой конфигурации друг относительно друга, чтобы могло осуществляться нормальное функционирование этих последовательностей. Например, нуклеотидная последовательность, кодирующая последовательность предшественника или лидера секреции, функционально связана с нуклеотидной последовательностью полипептида, если она экспрессируется в виде белка-предшественника, участвующего в секреции этого полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию этой последовательности; сайт связывания с рибосомой функционально связан с кодирующей последовательностью, если он располагается в таком положении, что способствует трансляции. В общем случае "функционально связанный" означает, что соединяемые нуклеотидные последовательности - смежные, а в случае лидера секреции - смежные и находятся в одной рамке считывания. Соединение осуществляется путем лигирования в соответствующих сайтах рестрикции. Если таких сайтов нет, то применяются синтетические олигонуклеотидные адаптеры или линкеры в соответствии со стандартными методами рекомбинантной ДНК.
Термин "модификация" в применении к настоящему изобретению охватывает замены, инсерции и делеции.
Термины "мутация" и "замена" применяются здесь взаимозаменяемо.
Термин "ввести" главным образом означает замещение существующего аминокислотного остатка, но может означать и вставку дополнительного аминокислотного остатка.
Термин "удалить" главным образом означает замещение аминокислотного остатка, подлежащего удалению, другим аминокислотным остатком, но может означать и делецию (без замещения) аминокислотного остатка, подлежащего удалению.
Выражение "аминокислотный остаток, содержащий связующую группу для неполипептидного компонента" служит для обозначения именного того аминокислотного остатка, с которым связывается неполипептидный компонент (в случае введения аминокислотного остатка) или с которым он мог бы связаться (в случае удаления аминокислотного остатка).
Выражение "одно отличие" или "отличается от" в применении к конкретным модификациям служит для обозначения дополнительных отличий, присутствующих помимо уже указанного различия по аминокислотам. Так, в дополнение к описанным изменениям аминокислотных остатков, имеющих целью оптимизацию использования сайтов гликозилирования или удаление и/или введение аминокислотных остатков, содержащих связующую группу для неполипептидного компонента, вариант полипептида IFNG может, если нужно, содержать другие модификации, не связанные с такими изменениями. Они могут включать, к примеру, укорочение С-конца на одну или несколько аминокислот, добавление одного и более дополнительных остатков на N- и/или С-конце, например, добавление остатка Met на N-конце, добавление аминокислотной последовательности Cys-Tyr-Cys на N-конце, а также "консервативные замены аминокислот", то есть замены, осуществляемые в пределах группы аминокислот с близкими характеристиками, например, малых аминокислот, кислых аминокислот, полярных аминокислот, основных аминокислот, гидрофобных аминокислот и ароматических аминокислот. Примеры консервативных замен в настоящем изобретении, в частности, можно выбрать из групп, перечисленных в нижеследующей таблице.
| 1 | Аланин (A) | Глицин (G) | Серии (S) | Треонин (T) |
| 2 | Аспарагиновая к-та (D) | Глутаминовая к-та (Е) | ||
| 3 | Аспарагин (N) | Глутамин (Q) | ||
| 4 | Аргинин (R) | Гистидин (Н) | Лизин (K) | |
| 5 | Изолейцин (I) | Лейцин (L) | Метионин (M) | Валин(V) |
| 6 | Фенилаланин (F) | Тирозин (Y) | Триптофан (W) |
Выражение "по меньшей мере" в применении к неполипептидному компоненту, аминокислотному остатку, замене и т.д. означает один или более.
Термин "AUCsc", или "площадь под кривой при подкожном введении" применяется в его обычном значении, а именно как площадь под кривой активность IFGN в сыворотке/время после подкожного введения варианта полипептида IFGN, в частности при подкожном введении его крысам. После определения экспериментальных точек активности IFGN в зависимости от времени можно без труда рассчитать AUCsc с помощью компьютерной программы типа GraphPad Prism 3.01.
Термин "функциональный период полужизни in vivo" применяется в его обычном значении, как время, по прошествии которого в организме/органе-мишени остается 50% биологической активности полипептида, или как время, по прошествии которого активность полипептида составляет 50% от первоначального значения.
В качестве альтернативы определению функционального периода полужизни in vivo можно определять "время полужизни в сыворотке", то есть время, по прошествии которого в плазме или кровотоке циркулирует 50% полипептида до полного выведения. Определение времени полужизни в сыворотке часто бывает проще, чем определение функционального периода полужизни in vivo, и величина полужизни в сыворотке обычно является хорошим показателем величины функционального периода полужизни in vivo. Термины, альтернативные времени полужизни в сыворотке - это "время полужизни в плазме", "время полужизни в кровотоке", "сывороточный клиренс", "плазменный клиренс" и "период полувыведения". Время полужизни в сыворотке можно без труда определить у крыс, см. раздел Материалы и Методы. Важно иметь в виду, что "время полужизни в сыворотке", когда оно применяется в настоящем изобретении для данного варианта полипептида IFNG, необходимо определять для образца, который был введен внутривенно.
Термин "сыворотка" применяется в его обычном значении, как плазма крови без фибриногена и других факторов свертываемости.
Полипептид обычно выводится под действием одной или более ретикулоэндотелиальных систем (RES), почек, селезенки или печени, либо путем специфического или неспецифического протеолиза. Термин "почечный клиренс" применяется в его обычном значении для обозначения любого типа выведения через почки, например, посредством клубочковой фильтрации, выделения с мочой или элиминации в трубочках. Обычно выведение через почки зависит от физических характеристик полипептида, таких как молекулярный вес, размер (относительно предела исключения для клубочковой фильтрации), симметрия, форма/ упругость, заряд, присоединенные углеводные цепи и наличие клеточных рецепторов для полипептида. Молекулярный вес примерно в 67 кДа обычно считается пределом исключения при почечном клиренсе. Почечный клиренс можно определить любым подходящим методом, например одним из принятых методов in vivo. Например, почечный клиренс можно определить путем введения пациенту меченного (радиоактивной или флуоресцентной меткой) конъюгированного полипептида и измерения активности метки в собранной у пациента моче. Снижение почечного клиренса определяется относительно контрольной молекулы, такой как huIFNG, [S99T]huIFNG или Actimmune®. Функциональность, которая должна сохраняться, обычно выбирается из антивирусной, антипролиферативной, иммуномодуляторной активности или связывания с рецептором IFNG.
Термин "увеличение (повышение)" в применении к функциональному времени полужизни in vivo или в сыворотке означает, что соответствующее время полужизни варианта IFNG статистически достоверно увеличивается по сравнению с таковым для контрольной молекулы, такой как гликозилированный nuIFNG (SEQ ID No:17), гликозилированный [S99T]huIFNG (SEQ ID No:1) или Actimmune® (SEQ ID No:34 - продуцируемый в Е.coli), при внутривенном введении и при измерении в сравнимых условиях. Так, представляют интерес такие варианты полипептида IFNG, которые обладают увеличенным функциональным временем полужизни in vivo или в сыворотке по сравнению с любой из контрольных молекул, указанных выше.
В частности, представляют интерес такие варианты полипептида IFNG, для которых соотношение между временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) данного варианта и временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) huIFNG или [S99T]huIFNG в их гликозилированных формах составляет по меньшей мере 1,25, более предпочтительно по меньшей мере 1,50, например, по меньшей мере 1,75, например, по меньшей мере 2, еще более предпочтительно по меньшей мере 3, типа по меньшей мере 4, например, по меньшей мере 5, при внутривенном введении, в частности при внутривенном введении крысам.
Другими примерами представляющих интерес вариантов IFNG являются такие варианты, для которых соотношение между временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) данного варианта и временем полужизни в сыворотке (или функциональным периодом полужизни in vivo) Actimmune® (SEQ ID No:34 - продуцируемый в Е.coli) составляет по меньшей мере 2, более предпочтительно по меньшей мере 3, типа по меньшей мере 4, например, по меньшей мере 5, еще более предпочтительно по меньшей мере 6, типа по меньшей мере 7, например, по меньшей мере 8, наиболее предпочтительно по меньшей мере 9, например, по меньшей мере 10, при внутривенном введении, в частности при внутривенном введении крысам.
Термин "повышение (увеличение)" в применении к AUCsc означает, что площадь под кривой для варианта IFNG по изобретению, при подкожном введении, статистически достоверно повышается по сравнению с таковой для контрольной молекулы, такой как гликозилированный huIFNG (SEQ ID No:17), гликозилированный [S99T]huIFNG (SEQ ID No:1) или Actimmune® (SEQ ID No:34 - продуцируемый в Е.coli), при определении в сравнимых условиях. Так, предпочтительны такие варианты IFNG, у которых AUCsc повышается по сравнению с любой из контрольных молекул, указанных выше. Конечно, следует вводить одинаковое количество активности варианта IFNG по изобретению и контрольной молекулы. Впоследствии, для проведения прямых сравнений между различными молекулами IFNG значение AUCsc можно нормализировать, то есть их можно выражать в виде AUCsc/введенная доза.
Особенно предпочтительны такие варианты IFNG, для которых соотношение между AUCsc данного варианта и AUCsc гликозилированного huIFNG или гликозилированного [S99T]huIFNG составляет по меньшей мере 1,25, типа по меньшей мере 1,5, например, по меньшей мере 2, более предпочтительно по меньшей мере 3, типа по меньшей мере 4, например, по меньшей мере 5 или 6, еще более предпочтительно по меньшей мере 7, типа по меньшей мере 8, например, по меньшей мере 9 или 10, наиболее предпочтительно по меньшей мере 12, типа по меньшей мере 14, например, по меньшей мере 16, 18 или 20, в частности при (подкожном) введении крысам.
Другими примерами особенно предпочтительных вариантов IFNG являются такие варианты, для которых соотношение между AUCsc данного варианта и AUCsc Actimmune® составляет по меньшей мере 100, более предпочтительно по меньшей мере 150, типа по меньшей мере 200, например, по меньшей мере 250, еще более предпочтительно по меньшей мере 300, типа по меньшей мере 400, например, по меньшей мере 500, наиболее предпочтительно по меньшей мере 750, типа по меньшей мере 1000, например, по меньшей мере 1500 или 2000, в частности при (подкожном) введении крысам.
Термин "Tmax,sc" относится к тому времени на кривой активность IFNG в сыворотке-время, когда наблюдается максимальная активность IFNG в сыворотке. Предпочтительными вариантами IFNG по изобретению являются такие варианты, у которых Тmax,sc повышается по сравнению с Actimmune® и/или по сравнению с гликозилированным huIFNG. В частности, у таких предпочтительных вариантов Tmax,sc (при определении после подкожного введения крысам) составляет по меньшей мере 200 мин, типа по меньшей мере 250 мин, например, по меньшей мере 300 мин, более предпочтительно по меньшей мере 350 мин, например, по меньшей мере 400 мин.
Термин "пониженная иммуногенность" означает, что вариант полипептида IFNG вызывает измеримо меньший иммунный ответ, чем контрольная молекула, к примеру, huIFNG или Actimmune®, при определении в сравнимых условиях. Иммунный ответ может быть клеточным или антительным (развернутое определение иммуногенности см., к примеру, в Roitt: Essential Immunology (8th edition, Blackwell). Обычно снижение антительной реакции является показателем пониженной иммуногенности. Пониженная иммуногенность может быть определена любым подходящим способом, известным в этой области, например, in vivo или in vitro.
В контексте настоящего изобретения термин "повышенное гликозилирование", "повышение степени N-гликозилирования in vivo" или "повышение степени N-гликозилирования" служит для обозначения повышенного содержания присоединенных углеводных молекул, что обычно происходит вследствие более высокого (или лучшего) использования сайта/ов гликозилирования. Хорошо известно (Hooker et al., 1998, J. Interferon and Cytokine Res. 18, 287-295 и Sarenva et al., 1995, Biochem J., 308, 9-14), что при экспрессии huIFNG в клетках СНО только у 50% молекул IFNG используются оба сайта гликозилирования, у 40% - используется один сайт гликозилирования (1N) и около 10% не гликозилированы (0N). Повышение степени N-гликозилирования in vivo можно определить любым подходящим способом, известным в этой области, например электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE). Один из удобных методов определения повышенного гликозилирования описан в Материалах и Методах, в разделе под названием "Определение повышенной степени гликозилирования".
Применяемый в настоящем изобретении термин "популяция вариантов полипептида IFNG" или "композиция, содержащая популяцию вариантов полипептида IFNG" служит для обозначения композиции, содержащей по меньшей мере два полипептида IFNG, в разной степени гликозилированных. Как это станет ясно, настоящее изобретение обеспечивает способы получения популяции полипептидов IFNG, в которой содержится повышенное количество полностью гликозилированных молекул IFNG.
Таким образом, настоящее изобретение также касается гомогенной популяции полипептидов IFNG по изобретению (то есть популяции, в которой большинство полипептидов IFNG полностью гликозилировано) или композиций, содержащих гомогенную популяцию полипептидов IFNG по изобретению. Например, популяция полипептидов IFNG может содержать по меньшей мере 70% полипептида IFNG по изобретению, предпочтительно по меньшей мере 75%, типа по меньшей мере 80%, например, по меньшей мере 85%, более предпочтительно по меньшей мере 90%, типа по меньшей мере 95%, например, по меньшей мере 96%, еще более предпочтительно 97%, типа по меньшей мере 98%, например, по меньшей мере 99%.
Термин "обладающий активностью IFNG" означает то, что вариант полипептида обладает одной или более функциями нативного huIFNG или rhuIFNG, включая его способность связываться с рецептором IFNG и вызывать передачу сигнала при связывании hulFNG со своим рецептором при определении in vitro или in vivo (то есть биоактивность in vitro или in vivo). Рецептор IFNG был описан Aguet et al. (Cell 55: 273-280, 1988) и Calderon et al. (Proc. Natl. Acad. Sci. USA 85: 4837-4841, 1988). Подходящим способом измерения активности IFNG является способ, раскрытый в настоящем изобретении под названием "Первичный анализ". При применении описанного здесь "первичного анализа" удельная активность вариантов полипептида, "обладающих активностью IFNG", составляет по меньшей мере 5% по сравнению с rhuIFNG. Следует иметь в виду, что в зависимости от того, какая проводилась конкретная модификация, например, модифицирован PEG этот вариант или нет, активность может варьировать в широком диапазоне. Так, примеры удельных активностей могут варьировать от таких низких значений, как 5%, до таких высоких, как 150% по сравнению с rhuIFNG. Например, удельная активность может составлять по меньшей мере 10% (например, 10-125%), по меньшей мере 15% (например, 15-125%), по меньшей мере 20% (например, 20-125%), по меньшей мере 25% (например, 25-125%), по меньшей мере 30% (например, 30-125%), по меньшей мере 35% (например, 35-125%), по меньшей мере 40% (например, 40-125%), по меньшей мере 45% (например, 45-125%), по меньшей мере 50% (например, 50-125%), по меньшей мере 55% (например, 55-125%), по меньшей мере 60% (например, 60-125%), по меньшей мере 65% (например, 65-125%), по меньшей мере 70% (например, 70-125%), по меньшей мере 75% (например, 75-125%), по меньшей мере 80% (например, 80-125%), или по меньшей мере 90% (например, 90-110%) по сравнению с удельной активностью rhuIFNG.
"Полипептид IFNG" - это полипептид, обладающий активностью IFNG, то есть термин "полипептид IFNG" относится к любой молекуле IFNG (независимо от того, является ли она huIFNG, укороченной его формой или вариантом), если указанная молекула IFNG обладает активностью IFNG согласно данному определению. Термин "полипептид IFNG" относится и к полипептиду в форме мономера или димера, по ситуации. Например, при обозначении конкретных замен их обычно указывают относительно мономерного полипептида huIFNG. В случае, когда указана молекула IFNG по изобретению, то обычно это означает димер (она при этом содержит два мономера полипептида IFNG, модифицированных, как описано). Димерная форма полипептидов IFNG может быть получена при нормальной ассоциации двух мономеров или находиться в форме одноцепочечного димера полипептида IFNG.
Термин "исходный" служит для обозн