Штамм культивированных клеток растений ajuga reptans l.
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано в медицинской, пищевой и парфюмерной промышленности. Штамм Е IVk суспензионной культуры растительных клеток Ajuga reptans L. N 63 - продуцент экдистероидов. Изобретение позволяет эффективно получить экдистероиды. 2 ил.
Реферат
Изобретение относится к биотехнологии и может быть использовано в медицинской, пищевой и парфюмерной промышленности.
В настоящее время проводятся интенсивные исследования по получению фитоэкдистероидов из лекарственного растительного сырья (Фитоэкдистероиды / Под ред. В.В.Володина. Санкт-Петербург: Наука, 2003, 293 с.; Патент РФ №2153346, МКИ А 61 К 35/78. Способ получения экдистероидов / В.В.Володин, С.О.Володина; Патент РФ №2155599, МКИ А 61 К 35/78. Способ выделения индивидуальных соединений из смеси экдистероидов из надземной части растений Serratula coronata/ В.В.Володин, С.О.Володина).
Для этих соединений показана перспектива использования в составе актопротекторных, сахароснижающих и ранозаживляющих препаратов, тонизирующих пищевых добавок и косметических композиций (Фитоэкдистероиды / Под ред. В.В.Володина. Санкт-Петербург: Наука, 2003, 293 с.; Патент РФ №2119331, МКИ А 61 К 9/06, 35/78. Средство для лечения ожоговых ран "Витадерм" / В.Н.Дармограй, С.М.Потехинский и др.; Patent EP 0436650, МКИ А 61 К N 7/00. Meybeck A., Bonte F., Phases lamellaires lipidiques hydratees on liposomes a base d′ecdysteroides.; Патент РФ №1561263, МКИ А 61 К 35/78. Способ лечения инсулинзависимого сахарного диабета. / М.И.Косовский, В.Н.Сыров и др.)
Альтернативой растительному сырью могут служить культивируемые клетки растений. Известные штаммы культивируемых клеток экдистероидсодержащих растений, описанные в литературе, не продуцируют эти соединения в условиях in vitro либо продуцируют в концентрациях, более низких, чем дикорастущие или интродуцированные виды растений (Tomas J., Camps F., Claveria E., Coll J., Mele E., Messeguer J. Composition and location of phytoecdysteroids in Ajuga reptans in vivo and vitro cultures// Phytochemistry. 1992. V.31. No5. P.1585-1591). Ссылки на депонирование штаммов экдистероидсодержащих растений в доступных коллекциях отсутствуют.
Задачей настоящего изобретения является получение активно растущего штамма суспензионной культуры растительных клеток живучки ползучей (Ajuga reptans L.), характеризующегося высоким содержанием фитоэкдистероидов.
Штамм Ajuga reptans E IVk депонирован в Российскую коллекцию клеток высших растений при Институте физиологии им. К.А.Тимирязева РАН под коллекционным номером 63.
Описание исходного материала. Источником получения штамма суспензионной культуры Ajuga reptans служила длительно культивируемая каллусная культура, которая была получена в 1993 г. в лаборатории биохимии и биотехнологии растений Института биологии Коми НЦ УрО РАН из корня стерильного растения живучки ползучей, выращиваемой в научной коллекции указанного Института. Каллусную культуру выращивали на модифицированной среде Мурасиге-Скуга, с добавлением сахарозы - 30 г/л; 2,4-Д - 1 мг/мл; БАП - 0,2 г/мл; мезо-инозита - 100 мг/л и витаминов по Стаба, мг/л: фолиевой кислоты - 0,5; рибофлавина (В2) - 0,5; биотина - 1,0; Са-пантотената - 1,0; кобаламина (В 12) - 0,0015. рН до автоклавирования - 5,8. Для получения суспензионных культур каллусную культуру переносили в жидкую питательную среду, идентичную по составу среде, на которой культивировались каллусные культуры, с исключением агара. Примерно через две недели суспензионную культуру фракционировали, используя отстаивание в течение 1-2 мин (отбирали среднюю фракцию). Суспензии выращивали в конических колбах объемом 500 мл, с 60-70 мл среды при 25-26°С, относительной влажности воздуха 60%, в темноте, на качалке, 90-100 качаний в минуту. Установлен следующий режим пересева: 12±1,5 мл инокулюма на 100 мл среды. Интервал субкультивирования - 12-14 дней.
Культуральные свойства штамма.
Характер роста: суспензия белого цвета, индекс роста по сырой биомассе - 13,02±0,32, по сухой биомассе - 12,69±0,83. Удельная скорость роста по сырой биомассе - 0,36±0,03 сут-1, по сухой биомассе - 0,32±0,03 сут-1, по числу клеток - 0,31±0,03 сут-1. Число живых клеток - 88-92%.
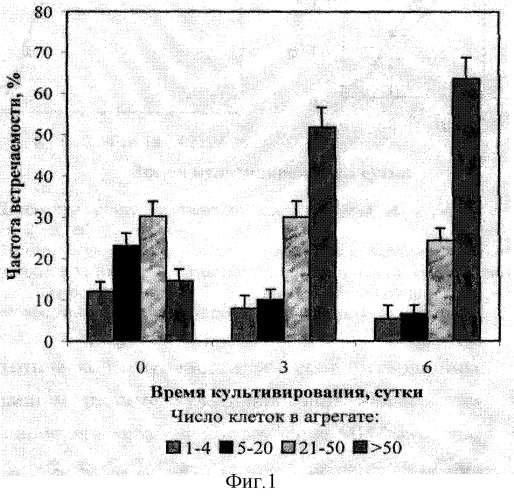
Цитологическая характеристика. В суспензионной культуре живучки ползучей содержание крупных агрегатов (>50 клеток в агрегате) в течение цикла культивирования изменялось от 14,6 до 63,5%, доля мелких агрегатов (1-4 и 5-20 клеток в агрегате), наоборот, уменьшалось. На фиг.1 представлена агрегированность суспензионной культуры Ajuga reptans с циклом культивирования одна неделя
Кариологическая характеристика.
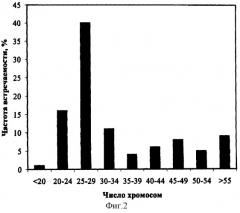
По литературным данным (Болховских З.В., Гриф В.Г., Захарьева О.И., Матвеева Т.С. Хромосомные числа цветковых растений. Л.: Наука, - 1969) число хромосом в клетках меристемы корня интактного растения Ajuga reptans 2n=32. Анализ распределения числа хромосом в клетках суспензионной культуры корня Ajuga reptans выявил большую вариабельность уровня плоидности. На фиг.2 представлено распределение числа хромосом в клетках суспензионной культуры Ajuga reptans.
В популяции клетки с числом хромосом, близким к диплоидному (2n=30-34), составляют всего 11%. В процессе длительного культивирования происходит редукция числа хромосом: модальный класс (40% популяции) представлен анеуплоидными клетками с числом хромосом 25-29. Обнаружены также клетки с более низким числом хромосом 20-24 и <20 хромосом. В популяции суспензионной культуры имеются и анеуплоидные клетки с числом хромосом, значительно превышающим диплоидное: от 35 до 55 и выше. Доля таких клеток составляет приблизительно 30%.
Характеристика биосинтеза экдистероидов в суспензионной культуре клеток.
Анализ биомассы клеток на содержание экдистероидов проводили методом обращенно-фазной ВЭЖХ на аналитической системе ВЭЖХ Varian, Pro Star (США).
Состав элюента: вода - ацетонитрил (100:20), скорость элюирования 1,5 мл/мин; λ=242 нм; колонка Diasorb C16/T (150×4 мм; 7 мкм). Основным компонентом клеточной биомассы, как и в интактных растениях, является 20-гидроксиэкдизон (используется в качестве субстанции известного тонизирующего препарата "Экдистен"). В проанализированных образцах биомассы присутствовали минорные количества полиподина В, 29-норгсенгостерона и аюголактона, также характерные для интактных растений живучки ползучей. Динамика накопления экдистероидов в цикле выращивания носит периодический характер. Максимум синтеза экдистероидов приходился, как правило, на конец экспоненциальной фазы (в среднем 0,5%). В первые дни культивирования наблюдалось снижение уровня биосинтеза 20Е. В течение экспоненциальной фазы роста наблюдались всплески биосинтетической активности.
Пример конкретного выполнения.
Штамм суспензионной культуры растительных клеток живучки ползучей культивируют на среде указанного выше состава при 26°С в темноте. В фазу замедления роста (12-14 сутки) биомассу клеток отделяют от жидкой среды фильтрованием под ваккумом. 500 г сырой биомассы промывают дистиллированной водой и разрушают гомогенизатором при скорости 15 тыс. об/мин в течение 5 минут при комнатной температуре. В гомогенат добавляют двойной объем водного этанола или метанола. Экстракцию проводят в течение 2 часов при перемешивании при температуре 20-40°С. После отделения осадка проводят вторичную экстракцию биомассы водным этанолом или метанолом. Экстракты объединяют и упаривают под вакуумом. Сгущение экстракта проводят не досуха, а оставляют 10% от исходного количества жидкой фазы. Остаток трижды экстрагируют гексаном для удаления побочных веществ липидной природы, а затем дважды смесью этилацетат:метанол для извлечения целевого продукта. Органические извлечения упаривают досуха, наносят на оксид алюминия и проводят колоночную хроматографию смесью хлороформ-метанол возрастающей полярности. Определение целевых фракций, содержащих сумму экдистероидов, проводят с помощью ТСХ и ВЭЖХ-хроматографии. Целевые фракции упаривают и перекристаллизовывают в смеси этилацетат-метанол 9:1. Получают 0,03 г 20-гидроксиэкдизона (чистота продукта - 92%), содержащего в качестве сопутствующих экдистероидов - полиподин В, 29-норгсенгостерон и аюголактон, в минорных концентрациях. По своему составу экдистероидный препарат, выделенный из биомассы культивируемых клеток, идентичен препарату, получаемому из нативных растений серпухи венценосной, что указывает на возможность использования суспензионной культуры клеток в качестве альтернативного источника 20-гидроксиэкдизона - субстанции актопротекторных и тонизирующих экдистероидсодержащих лекарственных препаратов.
Штамм Е IVk суспензионной культуры растительных клеток Ajuga reptans L. N 63 - продуцент экдистероидов (Российская коллекция клеток высших растений при Институте физиологии им. К.А.Тимирязева РАН).