Штамм культивируемых клеток мышиной гибридомы а3, используемый для получения моноклональных антител к антигену ядрышек клеток человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии, биологии и медицине и может быть использовано для изучения структурно-функциональной организации ядрышка и механизмов действия фармакологических препаратов на клетки человека. Штамм мышиных гибридомных клеток, названный A3, получают путем слияния спленоцитов мыши, иммунизированных грубой фракцией ядер клеток человека линии RAMOS, с клетками мышиной миеломы линии P3-X63-Ag8.653. Полученная гибридома секретирует моноклональные антитела (МонАТ) к антигену, названному A3-антиген, локализованному в ядрышках клеток человека вне зависимости от их тканевого или линейного происхождения. При различных способах фиксации клеток A3-антиген выявляется в составе дискретных (как правило, несколько десятков) фокусов, расположенных исключительно в зоне ядрышек. Уникальным свойством A3-антигена является его высокая чувствительность к действию различных ингибиторов белкового синтеза, например эметину, анизомицину, циклогексимиду и пуромицину. При инкубации клеток в присутствии перечисленных веществ A3-антиген мигрирует из ядрышек в многочисленные фокусы, расположенные в нуклеоплазме ядра. Эта миграция A3-антигена предшествует гибели клеток путем апоптоза. МонАТ A3, производимые штаммом A3, рекомендуются для выявления ядрышек и оценки общего уровня синтеза белка в клетках человека методами клеточной биологии. Антитела могут быть использованы для выявления возможной контаминации культур клеток человека клетками другой видовой принадлежности, а также для изучения биологической активности известных и новых ингибиторов белкового синтеза, включая фармакологические препараты, в клетках человека in vitro. 1 з.п. ф-лы, 6 ил.
Реферат
Изобретение относится к биотехнологии, медицине и биологии и касается штамма мышиных гибридных клеток, секретирующих моноклональные антитела (МКА), пригодные для специфического выявления ядрышек клеток человека. Антитело может быть использовано для изучения биологической активности и механизмов действия новых фармакологических препаратов на клетки человека.
Как известно, ядрышко - основной структурный домен клеточного ядра - принимает участие в биогенезе рибосом, включая транскрипцию рибосомных генов, созревание первичных 47-45 S транскриптов pPHK и сборку пре-рибосомных частиц (Olson, 2004). Согласно последним данным масс-спектроскопии в его составе выявляется от 350 (Andersen et al., 2002) до 700 (Andersen et al., 2004) белков, большая часть которых принимает участие в образовании рибосом. Известно, что некоторые из этих белков изменяют характерную локализацию в ответ на действие химических агентов или физических факторов (Andersen et al., 2004). К последним, в частности, относятся: антибиотик актиномицин Д (ингибитор транскрипции; Perry, Kelley, 1970), цисплатин (ДНК-связывающий агент, применяемый в химиотерапии опухолей; Horky et al., 2001), росковитин (ингибитор клеточной киназы cdc2; Wojciechowski et al., 2003), аналог аденозина, 5,6-дихлоро-1-β-рибофуранозилбензимидазол (ДРБ), являющийся ингибитором казеин киназы II (Granick, 1975; Scheer et al., 1984). Чувствительность белков ядрышка к действию перечисленных веществ лежит в основе изучения механизмов их действия на нормальные и опухолевые клетки человека (Horky et al., 2001). Однако в современной литературе практически не описаны подходы для простого выявления реакции клеток на действие веществ, ингибирующих тотальный белковый синтез, несмотря на то что многие антибиотики и некоторые противоопухолевые препараты (например, эметин, Смирнова и др., 2003) являются ингибиторами трансляции. Одна из причин этого пробела - недостаток необходимых реагентов, позволяющих простыми методами выявлять биологическую активность и эффективность воздействия таких веществ на клетки человека in vitro.
В связи с этим, получение антител к ядрышковым антигенам, которые могут служить "индикаторами" уровня синтеза белков, является актуальным для изучения механизмов действия различных лекарственных препаратов, включая антибиотики, на клетки человека. Кроме того, такие антитела могут быть использованы для изучения функциональной организации ядрышка и его участия в регуляции процессов, прямо не связанных с синтезом рибосом. Литературные данные, полученные в последнее время, однозначно указывают на то, что некоторые белки ядрышка являются мишенями апоптотического процесса, а нарушение структурно-функциональной целостности ядрышка индуцирует вступление клеток в апоптоз (Rubbi, Milner, 2003).
В настоящей заявке представлена полученная нами гибридома, которая продуцирует антитела к ядрышковому антигену клеток человека, проявляющему высокую чувствительность к действию таких эффективных ингибиторов белкового синтеза и индукторов апоптоза, как эметин (Смирнова и др., 2003), анизомицин, циклогексимид и пуромицин (Hartmann et al., 1968; Hash, 1972; Zhou, 2004).
В качестве аналогов полученного нами штамма гибридомы, секретирующей МКА к ядрышковым антигенам, могут рассматриваться следующие:
1) восемь гибридом к РНК полимеразам человека, продуцирующие антитела к общим (малым) субъединицам РНК полимераз I, II и III. Ни одна из гибридом не окрашивает ядрышки избирательно (Jones et al., 2000);
2) гибридома F-9 к специфическому ко-фактору РНК полимеразы I человека, белку UBF, (Santa Cruz Biotechnology, США), которая продуцирует антитела, пригодные для иммуноблотирования. Наша практика работы с данными антителами методами иммуноцитохимии показала, что они плохо выявляют антиген в ядрышках на клеточном уровне;
3) к основному фосфопротеину ядрышка В23/нуклеофозмину, который принимает участие в поздних стадиях сборки рибосом и располагается в гранулярном компоненте ядрышка: гибридомы 3С9 (Булычева и др., 2003; Dergunova et al., 2003); 2H12 (Paulin-Levasseur et al., 1995), 20B2 (Zatsepina et al., 1997), PRO:4-216 (Subong et al., 1999), а также гибридома-продуцент антител к В23/нуклеофозмину крысы, полученная в 1983 г. (Ochs et al., 1983) и в настоящее время реализуемая фирмой Sigma, США (клон FC82291, каталожный номер В 0556);
4) к белку ядрышка фибрилларину, который принимает участие в ранних стадиях созревания пре-pPHK и располагается в фокусах транскрипции рДНК: гибридома 72B9 (Takeuchietal.,1995);
5) гибридома N3-9B6 (Todorov et al., 1987) к неидентифицированному антигену ядрышка В-лимфобластоидной линии человека, который по некоторым свойствам соответствует В23/нуклеофозмину;
6) гибридома Ki-67 к белку Ki-67; связанному с ядрышками только в S-периоде клеточного цикла: (Gerdes et al., 1983).
Однако полных аналогов полученного нами штамма гибридомы не обнаружено, в связи с чем выбрать прототип невозможно.
Целью изобретения явилось создание штамма культивируемых гибридомных клеток, полученных в системе мышь-мышь, секретирующих моноклональные антитела к ядрышкам клеток человека. Антиген, являющийся мишенью антител, проявляет высокую чувствительность к действию ингибиторов белкового синтеза.
Для получения штамма применяли метод соматической гибридизации клеток. В качестве иммуногена использовали фракцию ядер, изолированных из клеток В-лимфобластоидной линии человека RAMOS путем лизиса клеток в 0.1% растворе неионного детергента Нонидет Р-40 (NP-40). Клетки находились в состоянии логарифмической фазы роста, который характеризуется высоким уровнем синтеза белка и образования рибосом. Мышей линии Balb/c четырехкратно иммунизировали, а затем их сенсибилизированные спленоциты сливали с культивируемыми клетками мышиной миеломы линии P3-X63-Ag8.653 в соотношении 3:1. В качестве сливающего агента применяли 50% раствор полиэтиленгликоля с молекулярной массой 3000-3700. После завершения процедуры слияния клетки культивировали в 96-луночных плоскодонных платах (0.2·106 клеток на ячейку) в среде с селективными агентами (0.1 мМ гипоксантина, 0.4 мкМ аминоптерина и 0.016 мМ тимидина). Скрининг культуральных жидкостей из лунок, давших рост гибридомным клонам, проводили в реакции непрямой иммунофлуоресценции на фиксированных клетках Ramos.
Гибридомные клетки, секретирующие моноклональные антитела, специфически окрашивающие ядрышки в реакции непрямой иммунофлуоресценции, шестикратно клонировали методом лимитирующих разведений и выводили в массовую культуру. Для повышения концентрации моноклональных антител, названных A3, штамм клеток A3 выращивали в виде асцитной опухоли в брюшной полости мышей (DBA·Balb/c)F1 с предварительным введением пристана и облучением в дозе 400 рад.
Штамм A3 имеет следующие характеристики:
Морфологические признаки. Культура имеет вид суспензии, где клетки собраны в конгломераты, слабо прикрепляющиеся к пластику. Культуральные свойства. Среда для культивирования - DMEM, 20% эмбриональной телячьей сыворотки, 4 мМ L-глутамина, 2% буфера Hepes, 50 мкг/мл гентомицина и 5·10-5 М 2-меркаптоэтанола. Условия культивирования; 37°С, абсолютная влажность и 5% СО2 в атмосфере. Частота пассирования 3-4 суток, кратность рассева 1:5-1:10. Титр антител в культуральной жидкости в реакции непрямой иммунофлуоресценции определяется как 1:10-1:100.
Титр моноклональных антител в асцитной жидкости составляет 1:1000-1:2000.
Характеристика моноклональных антител. Моноклональные антитела A3, секретируемые штаммом A3, относятся к иммуноглобулинам класса G, обладают высокой реактивностью в иммуноцитохимических реакциях при использовании различных фиксаторов (параформальдегид, метанол, ацетон, а также смесь метанола и ледяной уксусной кислоты) и не связывают антиген в лизатах клеток при иммуноблотировании.
Способ криоконсервирования штамма клеток A3. Криозащитная среда: DMEM, содержащая 40% телячьей эмбриональной сыворотки и 10% диметилсульфоксида. Криоампулы с клеточной взвесью помещают на сутки в холодильник на -70°, после чего переносят в жидкий азот. Жизнеспособность после размораживания - 90-95%. После размораживания клетки культивируют в плотности 0.2-0.3·106 кл/мл.
Бактерии, грибы и дрожжи в культуре не обнаружены.
Специфичность МКА A3. Моноклональные антитела A3 окрашивают ядрышки в клетках человека вне зависимости от их тканевого или линейного происхождения. Клетки других тестированных видов млекопитающих, включая свинью (клетки культуры СПЭВ), мышь (3Т3 и L), крысу (С6), китайского хомячка (СНО), сирийского хомячка (ВНК-21), кенгуровой крысы (РТК1), быка (МПТР), кошки (F8), антителом A3 не окрашиваются. Антитела A3 маркируют ядрышки в клетках человека различного происхождения, включая карциному шейки матки (HeLa), клетки рака молочной железы (MCF-7), клетки лимфобластоидных линий человека RAMOS и DAUDI, а также В- и Т-лимфоциты лимфоциты периферической крови здоровых доноров. Это указывает на высокую видовую и низкую тканевую специфичность эпитопа, узнаваемого A3-антигеном.
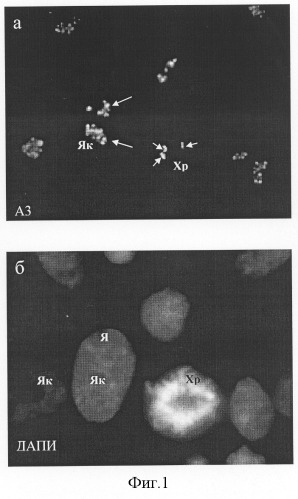
При всех способах фиксации клеток человека A3-антиген выявлялся в составе дискретных (как правило, несколько десятков) фокусов, расположенных только в зонах ядрышек (фиг.1). В митозе А3-антитиген выявлялся в составе малочисленных фокусов, расположенных на хромосомах, вероятно соответствующих местам ядрышковых организаторов (фиг.1). Обработка клеток протеолитическими ферментами - пепсином (0,01-0,001%) и трипсином (0,01-0,001%) - приводила к блокированию иммуномечения ядрышек антителом A3, что указывает на белковую природу A3-антигена.
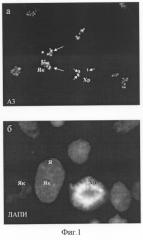
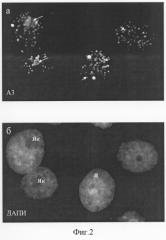
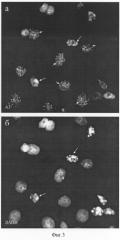
Уникальным свойством A3-антигена является его чувствительность к действию на клетки различных ингибиторов белкового синтеза, таких как эметин, анизомицин, циклогексимид и пуромицин. При инкубации клеток HeLa в присутствии перечисленных веществ в течение 30 мин - 6 час A3-антиген мигрирует из ядрышек в нуклеоплазму, образуя дискретные фокусы (фиг.2). Характерно, что длительное воздействие ингибиторов трансляции приводит к гибели клеток путем апоптоза (фиг.3). Таким образом, по своим свойствам антиген A3 относится к ядрышковым белкам, быстро изменяющим локализацию при ингибировании белкового синтеза. Антитело A3 не проявляет иммунореактивности в лизатах клеток человека методом иммуноблотов.
Созданные моноклональные антитела A3 могут быть рекомендованы в качестве реагента для выявления ядрышек и оценки общего уровня синтеза белка в клетках человека методами непрямой иммуноцитохимии. Антитела могут быть использованы для выявления возможной контаминации культур клеток человека клетками другой видовой принадлежности, а также для изучения биологической активности известных и новых ингибиторов белкового синтеза, включая фармакологические препараты, в клетках человека in vitro.
Литература
Булычева Т.И., Дергунова Н.Н., Артеменко Е.Г., Дудник О.А., Шпакова А.П., Малашенко
О.С., Зацепина О.В. (2000) Анализ пролиферативной активности клеток с помощью
новых моноклональных антител к ядрышковому белку В23/нуклеофозмину.
Цитология 42:944-954.
Смирнова О.Ю., Дудник О.А., Зацепина О.В. (2002) Особенности организации и
функционирования ядрышка в условиях полного пространственного разобщения
его основных структурных компонентов in situ. Цитология 44:5-13.
Andersen J.S., Lyon C.E., Fox A.H., Leung A.K., Lam Y.W., Steen H., Mann M., Lamond A.I.
(2002) Directed proteomic analysis of the human nucleolus. Curr. Biol. 12:1-11.
Andersen J.S., Lam Y.W., Leung A.K., Ong S.E., Lyon C.E., Lamond A.I., Mann M. (2005)
Nucleolar proteome dynamics. Nature 433:77-83.
Dergunova N.N., Bulycheva T.I., Artemenko E.G., Shpakova A.P., Pegova A.N., Gemjian E.G.,
Dudnik О.А., Zatsepina O.V., Malashenko O.S. (2002) A major nucleolar protein B23 as
a marker of proliferation activity of human peripheral lymphocytes. Immunology Letters 83:67-72.
Gerdes J., Schwab U., Lemke H., Stein H. (1983) Production of a mouse monoclonal antibody
reactive with a human nuclear antigen associated with cell proliferation. Int. J.Cancer 31:13-20.
Granick D. (1975) Nucleolar necklaces in chick embryo fibroblast cells. I. Formation of
necklaces by dichlororibobenzimidazole and other adenosine analogues that decrease
RNA synthesis and degrade preribosomes. J.Cell Biol. 65:398-417.
Hartmann G., Behr W., Beissner K.A., Honikel K., Sippel A. (1968) Antibiotics as inhibitors of
nucleic acid and protein synthesis. Angew Chem. Int. Ed Engl. 97:693-701.
Hash J.H. (1972) Antibiotic mechanisms. Annu. Rev. Pharmacol. 12:35-56.
Horky M., Wurzer G., Kotala V., Anton M., Vojtesek В., Vacha J., Wesierska-Gadek
J. (2001) Segregation of nucleolar components coincides with caspase-3 activation in
cisplatin-treated HeLa cells. J. Cell Sci. 114:663-670.
Jones E., Kimura H., Vigneron M., Wang Z., Roeder R.G., Cook P.R. (2000) Isolation and
characterization of monoclonal antibodies directed against subunits of human RNA
polymerases I, II, and III. Exp. Cell Res. 254:163-172.
Ochs R., Lischwe M., O′Leary P., Busch H. (1983) Localization of nucleolar phosphoproteins
B23 and C23 during mitosis. Exp. Cell Res. 146:139-149.
Olson M.O. (2004) Sensing cellular stress: another new function for the nucleolus?
Sci.STKE.224:1-3.
Paulin-Levasseur M., Julien M., Horner M., Chen G. (1995) Characterization of the 2H12
antigen as a nonshuttling human isoelectric variant of the nucleolar protein B23. Exp Cell
Res. 219:514-526.
Perry R.P., Kelley D.E. (1970) Inhibition of RNA synthesis by actmomycin D: characteristic
dose-response of different RNA species. J.Cell Physiol. 76:127-139.
Rubbi C.P., Milner J. (2003) Disruption of the nucleolus mediates stabilization of p53 in
response to DNA damage and other stresses. EMBO J. 22:6068-6077.
Scheer U., Hugle В., Hazan R., Rose K.M. (1984) Drug-induced dispersal of transcribed rRNA
genes and transcriptional products: immunolocalization and silver staining of different
nucleolar components in rat cells treated with 5,6-dichloro-beta-D
ribofuranosylbenzimidazole. J. Cell Biol. 99:672-679.
Subong E.N., Shue M.J., Epstein J.I., Briggman J.V., Chan P.K., Partin A.W. (1999) Monoclonal antibody to prostate cancer nuclear matrix protein (PRO:4-216) recognizes
nucleophosmin/B23. Prostate 39:298-304.
Takeuchi K., Turley S.J., Tan E.M., Pollard K.M. (1995) Analysis of the autoantibody response
to fibrillarin in human disease and murine models of autoimmunity. J. Immunol. 154:961-971.
Todorov I.Т., Philipova R.N., Zhelev N.Z., Hadjiolov A.A. (1987) Monoclonal antibody to a
nucleolar antigen of human B-lymphoblastoid cells. Cell Biol. Int. Rep.11:181-187.
Wojciechowski J., Horky M., Gueorguieva M., Wesierska-Gadek J. (2003) Rapid onset of
nucleolar disintegration preceding cell cycle arrest in roscovitine-induced apoptosis of
human MCF-7 breast cancer cells. Int. J. Cancer. 106:486-495.
Zatsepina O.V., Dudnic O.A., Todorov I.T., Thiry M., Spring H., Trendelenburg M.F. (1997)
Experimental induction of prenucleolar bodies (PNBs) in interphase cells: interphase
PNBs show similar characteristics as those typically observed at telophase of mitosis in
untreated cells. Chromosoma 105:418-430.
Zhou P. (2004) Determining protein half-lives. Methods Mol. Biol. 284:67-77.
Подписи к чертежам
к заявке Булычевой Т.И. и др. «Штамм культивируемых клеток мышиной гибридомы A3, используемый для получения моноклональных антител к антигену ядрышек клеток человека»
Фиг.1. Локализация A3-антигена, узнаваемого штаммом гибридомы A3 в интерфазных и митотических клетках человека HeLa в контроле (а). А3-антиген выявляется в многочисленных дискретных фокусах в интерфазных ядрышках (Як, длинные стрелки) и одиночных фокусах в хромосомах в митозе (Xp, короткие стрелки), б - окрашивание ядер красителем на хроматин ДАПИ, после которой видны границы ядер (Я), ядрышки и хромосомы.
Фиг.2. Изменения в локализации A3-антигена, узнаваемого штаммом гибридомы A3, при кратковременном воздействии ингибитора трансляции циклогексимида (2 ч, 20 мкг/мл) (а). А3-антиген выявляется в интерфазных ядрышках (Як, длинные стрелки) и многочисленных фокусах, расположенных в ядре (Я, короткие стрелки), б - окрашивание ядер красителем на хроматин ДАПИ, после которой видны границы ядер и ядрышек.
Фиг.3. Изменения в локализации A3-антигена, узнаваемого штаммом гибридомы A3, при продолжительном воздействии ингибитора трансляции циклогексимида (6 ч, 20 мкг/мл) (а). А3-антиген выявляется в многочисленных дискретных фокусах расположенных в ядрах (Я, короткие стрелки); в клетках на поздних стадиях апоптоза (длинные стрелки) характерная окраска на А3-антиген отсутствует, б - окрашивание ядер красителем на хроматин ДАПИ, после которой видны границы ядер, а также фрагментация ядер на поздних стадиях апоптоза (длинные стрелки).
1. Штамм культивируемых клеток мышиной гибридомы A3, используемый для получения моноклональных антител к ядрышковому антигену клеток человека, чувствительному к действию ингибиторов белкового синтеза.
2. Штамм по п.1, где полученные моноклональные антитела относятся к иммуноглобулинам класса G1, обладают высокой реактивностью в иммуноцитохимических реакциях и не связывают антиген в лизатах клеток при иммуноблотировании.