Способ дифференциальной диагностики заболеваний печени
Иллюстрации
Показать всеИзобретение относится к области вирусологии и медицины. Сущность способа дифференциальной диагностики заболеваний печени: исследуют суспензии эритроцитов здоровых пациентов и пациентов с различными заболеваниями печени (гепатиты и циррозы различной этиологии), измеряют средние скорости движения каждой клетки суспензии, их минимальные, средние и максимальные радиусы через определенные интервалы времени в период воздействия переменного электрического поля с частотой f от 10 кГц до 5 МГц и средней напряженностью Е0 электрического поля в зазоре между электродами в пределах 104-106 Вольт/м и после его отключения. На основании полученных данных определяют вязкоупругие характеристики эритроцитов, из которых формируют массив данных для диагностики заболеваний печени. Затем проводят аналогичные измерения образцов проб эритроцитов пациента с определением вязкоупругих характеристик эритроцитов с последующим сравнением этих характеристик с соответствующими значениями, определенными для различных видов патологии печени. Определяют показатель близости измеряемых характеристик эритроцитов к каждому из имеющихся видов диагноза, по минимальному значению которого делают вывод о наличии той или иной патологии печени. Использование способа позволяет повысить точность дифференциальной диагностики заболеваний печени. 4 табл., 3 ил.
Реферат
Область техники
Изобретение относится к области вирусологии и медицины. Предлагаемые способы и устройство могут применяться для лабораторного анализа физиологического состояния клеток, например эритроцитов и лейкоцитов с целью ранней диагностики отклонений от нормального состояния (выявления зараженных или раковых) клеток в крови человека и животных, а также для определения стадии заболевания печени (гепатит, цирроз) и его этиологии (вирусная, алкогольная).
Способность клетки к деформации играет важную роль в процессе ее жизнедеятельности. Например, эритроциты должны обладать высокой эластичностью для того, чтобы проникать в капилляры. Плотный контакт между стенками капилляра и мембраной эритроцита облегчает газообмен кислорода и углекислого газа, что способствует полноценному обеспечению организма кислородом.
Изменение деформируемости эритроцитов наблюдается при некоторых заболеваниях, например, диабете или атеросклерозе, заболеваниях печени различной этиологии, что указывает на актуальность изучения и измерения вязкоупругих характеристик биологических частиц.
Предшествующий уровень техники
Дифференциальная диагностика диффузных заболеваний печени алкогольного и неалкогольного генеза строится на комплексе клинико-биохимических и морфологических признаков. По данным литературы известно более 26 "биологических маркеров" потребления алкоголя, некоторые из них используются в дифференциальной диагностике заболеваний печени. К таким маркерам относятся: активность аминтрансфераз (АЛТ, ACT), их соотношение, активность гаммаглутамилтранспептидазы (ГГТП), щелочной фосфатазы (ЩФ), соотношение ГГТП/ЩФ, уровень ферритина, карбогидратдефицитного трансферрина, уровень фосфатидилэтанола, эпинефрина, активность алкогольдегидрогеназы, средний корпускулярный объем эритроцитов, уровень холестерина липопротеидов высокой плотности (ХС ЛПВП) [S.Aradóttir, К.Moller, and С.Alling. Phosphatidylethanol Formation And Degradation In Human And Rat Blood. - Alcohol. 2004, v.39: 8-13]. Следует отметить, что в практике используют наборы этих показателей из-за недостаточной чувствительности или специфичности каждого из них, взятого в отдельности. В диагностике алкогольных поражений печени весьма перспективным является определение карбогидратдефицитного трансферрина, но его использование ограничено высокой стоимостью и труднодоступностью радиоиммунных наборов для его измерения [J.Chen, K.M.Conigrave, P.Macaskill, J.В.Whitfield, and L.Irwig. Combining carbohydrate-deficient transferrin and gamma-glutamyltransferase to increase diagnostic accuracy for problem drinking. - Alcohol. 2003, v.38: 574-582].
Алкогольные энзимопатии в сыворотке крови проявляются как ранние признаки метаболических и структурных перестроек при алкоголизации [С.К.Farren and K.F.Tipton. Trait markers for alcoholism: clinical utility. Alcohol. - 1999, v.34: 649-665] наиболее характерны в период адаптационных и компенсаторных изменений в содержащих эти ферменты органах и системах. В период деструктивных изменений органов в стадии декомпенсации ферменты, представляющие эти органы [N.Fleeman Review. Alcohol home detoxification: a literature review Alcohol. - 1997, v.32: 649-656] в сыворотке крови, не всегда пропорционально отражают степень органопатологии. Необходимо учитывать, что повышение активности ряда ферментов сыворотки крови возможно при патологии печени неалкогольного генеза [S.Sherlock. Alcoholic liver disease. Lancet. - 1995, v.34:227-8]. Так, активность ГГТП может повышаться при патологических процессах в печени, сопровождающихся холестазом, при лекарственной интоксикации, беременности и др. Рядом авторов указывается, что уровень и стойкость повышения ГГТП существенно выше при алкогольных поражениях печени [F.Duckert, J.Johnsen, A.Amundsen, J.Stromme, and J.Morland Co-variation between biological markers and self-reported alcohol consumption. A twoyear study of the relationship between changes in consumption and changes in the biological markers gamma-glutamyi transpeptidase (GGT) and average volume per erythrocyte (MCV) among problem drinkers. - Alcohol. - 1992, v.27: 545-555]. Повышение активности ACT и АЛТ в ряде исследований расценивается как признак поражения печени при злоупотреблении алкоголем [A. Helander, В. Tabakoff. Special article. Biochemical markers of alcohol use and abuse: experiences from the pilot study of the WHO/ISBRA collaborative project on state and trait markers of alcohol. Alcohol, 1997, v.32: 133-144]. При этом с повышенным уровнем АЛТ связывают более глубокие повреждения печени. Некоторые исследователи считают более информативным повышение соотношения АСТ/АЛТ именно при алкогольном поражении печени [Zamin. J., et al. The importance of AST/ALT rate in nonalcoholic steatohepatitis diagnosis. Arq. GastroenteroL, Jan./Mar. 2002, vol.39, no.1, p.22-26]. Однако при проведении дифференциальной диагностики следует учитывать, что источниками ACT являются также скелетная и сердечная мускулатура, повреждение которой может привести к повышению уровня ACT [S. Sherlock. Alcoholic liver disease. Lancet. -1995, v.34:227-8].
Ряд авторов предлагает использовать соотношение активности ГГТП/ЩФ для диагностики алкогольных поражений печени [С.К.Farren and K.F.Tipton. Trait markers for alcoholism: clinical utility. Alcohol. - 1999, v.34: 649-665].
По данным литературы известно, что уровень ХС ЛПВП, повышающийся при систематическом потреблении алкоголя, не увеличивается по мере прогрессирования алкогольных поражений печени, что ограничивает использование этого показателя при дифференциальной диагностике [Т.В.Чернобровкина. Энзимопатии при алкоголизме. Киев, "Здоровья", 1992. - с.312].
В случаях далеко зашедших форм алкогольных поражений печени более показательными являются неферментные методы исследования морфофункциональной сохранности печени: определение белковых, иммуноглобулиновых фракций и липидов сыворотки крови, осадочных проб (тимоловая, сулемовая), показателей, выделительной и метаболизирующей функций (плазменный клиренс красителей, антипириновый индекс).
Несоответствие степени нарушения перечисленных не ферментных показателей и остающейся в норме или снижающейся активности ферментов сыворотки крови подчеркивает степень декомпенсации органа в результате хронического повреждения алкоголем.
Таким образом, недостатками использования перечисленных показателей в целях дифференциальной диагностики заболеваний печени являются их недостаточная чувствительность и специфичность, а также высокая трудоемкость, длительность проведения анализов и получения исходных материалов для ряда маркеров.
Известны способы и устройства для измерения деформируемости эритроцитов с помощью продавливания через тонкие капилляры [WO, 02/09583, А2, 30.07.2001; SU, 1462201, 28.02.89].
Однако эти способы трудоемки, дают большую погрешность в измерениях и требуют большой объем исследуемой крови.
Наиболее близким аналогом (прототипом) измерения вязкоупругих характеристик является способ и устройство для измерения вязкоупругих характеристик, эритроцитов в электрическом поле, создаваемым высокочастотным генератором между последовательно установленными электродами [Н.Engelhardt, E.Sackmann. On the measurement of shear elastic moduli and viscosities of erythrocyte plasma membranes by transient deformation in high frequency electric fields. Biophys. J. - 1988, v.54: 495-508]. Способ включает заполнение суспензией клеток рабочего объемы измерительной камеры с последовательно установленными в ней электродами, наложение неоднородного переменного электрического поля на суспензию, компьютерное распознавание максимального размера эритроцита, притянувшегося к электроду, расчет силы растягивающей клетку по модели проводящего эллипсоида.
Недостатком описанных способа и устройства является низкая точность измерения жесткости и вязкости клетки, обусловленная погрешностью при расчете растягивающей силы по модели проводящего эллипсоида и погрешностью связанной с тем, что клетка имеет непосредственный контакт с поверхностью электрода. Это изменяет физиологическое состояние мембраны клетки. Способ и устройство имеют малую производительность процесса измерения вязкоупругих характеристик клетки.
Наиболее близким аналогом (прототипом) способа диагностики заболеваний печени является способ дифференциальной диагностики диффузных заболеваний печени алкогольной и неалкогольной природы с помощью измерения среднего радиуса и среднего корпускулярного объема эритроцитов (СКОЭ), (MCV) [Т.Wetterling, R.Kanitz, H.Rumpf, U.Hapke, and D.Fischer. Comparison of CAGe and MAST with the alcohol markers CDT, {gamma}-GT, ALAT, ASAT and MCV. Alcohol. - 1998, v.33: 424-430], который вычисляется как отношение гематокритного показателя к числу эритроцитов в 1 мкл крови. Достоинством этого показателя является доступность, достаточно высокая чувствительность от 29 до 95%, длительное сохранение на прежнем уровне в период абстиненции. Причинами увеличения СКОЭ при длительной алкоголизации является токсическое влияние этанола на миелопоэз, нарушение обмена витаминов группы В и фолиевой кислоты, изменение текучести мембран эритроцитов за счет изменения соотношения холестерин/фосфолипиды, изменение состава фосфолипидов; повышение осмотического давления плазмы. Отмечено стойкое изменение этого показателя при алкогольном поражении печени. Измерение СКОЭ осуществляется, как правило, с помощью кондуктометрического геманализатора (счетчика частиц), основанного на измерении электрического сопротивления тонкого капилляра, через который проходит поток эритроцитов.
Наиболее близким техническим решением (прототипом) устройства для дифференциальной диагностики диффузных заболеваний печени является счетчик частиц французской фирмы "Coulter" [FR, 2092378, 1972], содержащий кювету с электропроводящей суспензией частиц и вертикально расположенную на ней измерительную трубку, имеющую в нижней части калиброванное входное отверстие, причем верхний конец измерительной трубки соединен пневмопроводом с источником вакуума (ручным поршневым насосом), в измерительной трубке установлен внутренний электрод, а в кювете внешний электрод. Электроды соединены с источником тока и электронным блоком измерения и обработки данных.
Недостатком указанных способа диагностики заболеваний и устройства для его осуществления является низкая достоверность дифференциальной диагностики заболеваний из-за узкого спектра измеряемых параметров эритроцитов человека (определение только размера эритроцитов и характеристик, непосредственно связанных с размером эритроцитов), а также большие погрешности при измерении размера эритроцитов с высокой степенью агрегации.
Раскрытие изобретения
Техническим результатом предлагаемого изобретения является повышение точности измерения вязкоупругих характеристик клеток биологических объектов и увеличение достоверности и специфичности дифференциальной диагностики заболеваний печени и сокращение времени диагностики путем обеспечения возможности измерения следующих параметров эритроцитов человека без изменения физиологического состояния мембраны клеток эритроцитов: средний радиус клетки, Кα - отношение среднего значения поляризуемости α0.1 и α1 на двух частотах, например, 100 кГц и 1 МГц, проводимость и емкость мембраны эритроцитов, жесткость и вязкость эритроцитов, индекс агрегации эритроцитов, коэффициент деструкции эритроцитов в электрическом поле.
Указанный технический результат достигается тем, что в способе измерения вязкоупругих характеристик клеток биологических объектов, включающем отбор проб клеток биологических объектов, разведение их изотоническим раствором, поддерживающим жизнедеятельность клеток, с заданным коэффициентом k, определение динамической вязкости ηw суспензии эритроцитов в указанном изотоническом растворе и перенос смеси исследуемых эритроцитов с заданной концентрацией клеток в измерительную кювету, согласно изобретению в кювете формируют неоднородное переменное электрическое поле с частотой ƒ от 10 кГц до 5 МГц и средней напряженностью Е0 электрического поля в зазоре между электродами в пределах от 104 до 106 Вольт/м, измеряют средние скорости движения каждой клетки в суспензии и их средний радиус R через определенные интервалы времени в период воздействия электрического поля и после его отключения по истечении времени t путем видеозаписи изображения движения клеток и изменения их размера, полученные данные в цифровом виде вводят и обрабатывают в компьютере, имеющем вычислительную программу накопления и обработки данных, в результате чего определяют следующие средние значения характеристик клеток биологических объектов, в том числе и их упругоэластичные характеристики, по формулам: поляризуемость клеток
(где ηw - динамическая вязкость жидкости, R - средний радиус клетки, средние скорости движения каждой клетки в суспензии, E0 - напряженность внешнего электрического поля, ε0 - диэлектрическая проницаемость вакуума); силу (Fэл), растягивающую клетку, по направлению вектора напряженности электрического поля:
жесткость (с) клетки:
где величина деформации Δх после отключения электрического поля; вязкость (ηс) клетки:
где величина деформации Δx после отключения электрического поля, t - время после выключения электрического поля, A - значение деформации Δх - после выключения электрического поля.
Таким образом, для обеспечения высокой точности измерения вязкоупругих характеристик биологической клетки подобраны оптимальные частота, амплитуда и длительность воздействия электрического поля с условием заданной величины деформации клеток. Как правило, для каждого вида биологических клеток существуют критические частота и напряженность поля, при которых эффективность деформации максимальна, что обеспечивает высокую точность измерения вязкоупругих характеристик клетки.
Указанный технический результат достигается также тем, что в способе дифференциальной диагностики заболеваний печени, включающем отбор проб эритроцитов, разведение их изотоническим раствором, поддерживающим жизнедеятельность клеток эритроцитов, с заданным коэффициентом k, определение динамической вязкости ηw суспензии эритроцитов в указанном изотоническом растворе и перенос смеси исследуемых эритроцитов с заданной концентрацией клеток в измерительную кювету, согласно изобретению в кювете формируют неоднородное переменное электрическое поле с частотой ƒ от 10 кГц до 5 МГц и средней напряженностью E0 электрического поля в зазоре между электродами в пределах от 104 до 106 Вольт/м, измеряют средние скорости движения каждой клетки в суспензии и их минимальный радиус Rмин, средний радиус R и максимальный радиус Rмах через определенные интервалы времени в период воздействия электрического поля и после его отключения по истечении времени t путем видеозаписи изображения движения клеток и изменения их размера, полученные данные в цифровом виде вводят и обрабатывают в компьютере, имеющем вычислительную программу накопления и обработки данных, в результате чего определяют средние значения характеристик xj эритроцитов для данного образца (где j - порядковый номер характеристики от 1 до 8):
x1=R - средний радиус клетки, вычисляемый по формуле:
где - сила вязкого трения со стороны жидкости;
ηw - динамическая вязкость жидкости, R - средний радиус клетки,
- средние скорости движения каждой клетки в суспензии;
x2=Kα=α0.1/α1, - отношение среднего значения поляризуемости αc=0.1 и αc=1 на двух частотах, например, 100 кГц и 1 МГц, которые (αc=0.1 и αс=1) вычисляются из условия равенства силы со стороны электрического поля и силы вязкого трения по формуле:
где ηw - динамическая вязкость жидкости, R - средний радиус клетки, средние скорости движения каждой клетки в суспензии, E0 - напряженность внешнего электрического поля, εo - диэлектрическая проницаемость вакуума;
- проводимость мембраны, где: ƒeg - равновесная частота вычисляется по формуле:
где ƒ0.1 - нижняя частота, на которой измеряется поляризуемость α0.1, ƒ1 - верхняя частота, на которой измеряется поляризуемость α1.
- емкость мембраны клетки,
где σ - электропроводность раствора, в котором проводятся измерения.
- жесткость мембраны клетки,
где Δx - величина деформации клетки после выключения электрического поля;
- вязкость клетки,
где t - время после выключения электрического поля, A - значение деформации Δх в момент выключения электрического поля;
- индекс агрегации эритроцитов,
где Nd - число слипшихся клеток в поле наблюдения микроскопа; N0 - общее число клеток в поле наблюдения микроскопа;
- коэффициент деструкции клеток,
где Nds - число клеток, оставшихся в поле наблюдения микроскопа после деструкции;
N0 - общее число клеток в поле наблюдения микроскопа;
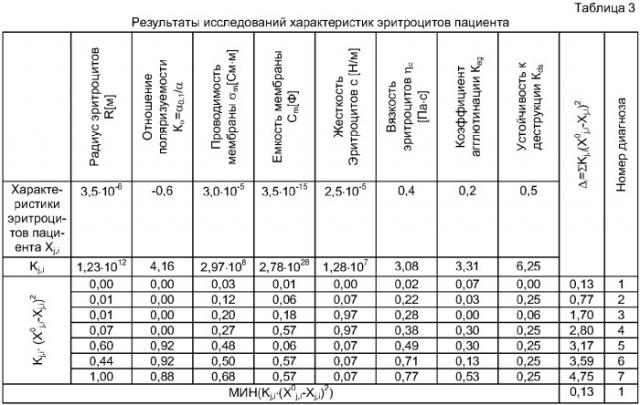
причем выше описанный процесс измерений средних скоростей движения каждой клетки в суспензии, их минимальный Rмин, средний Rcp, максимальный Rмах радиусы и определение характеристик xj, эритроцитов проводят многократно для проб эритроцитов здоровых пациентов (в норме) и пациентов с различными видами патологий, диагноз (состояние здоровья) которых определен заранее другими методами, например иммуноферментным методом, с определением характеристик эритроцитов (где i - порядковый номер диагноза от 1 до 7, в том числе норма и различные виды патологий: i=1 - норма, i=2 вирусный гепатит, i=3 - алкогольный гепатит, i=4 - смешанный гепатит, i=5 - вирусный цирроз, i=6 - алкогольный цирроз, i=7 - смешанный цирроз) и формируют из данных статистически достоверный массив для последующего использования его в дифференциальной диагностике заболеваний печени, а затем проводят аналогичные измерения образцов проб эритроцитов пациентов с различными видами патологий с определением характеристик эритроцитов xj,i в реальном масштабе времени с последующим сравнением этих характеристик с соответствующими значениями , находящимися в базе данных компьютера, и определением показателя Δi близости измеряемых характеристик эритроцитов к каждому из представленных семи видов диагноза:
для i=1-7,
где Kj - нормировочные диагностические коэффициенты, которые вычисляют по формуле:
где - максимальное значение j-го параметра из всех параметров, соответствующих всем i-м диагнозам; - минимальное значение j-го параметра из всех параметров, соответствующих всем i-м диагнозам, причем минимальное значение Δi, измеряемых параметров эритроцитов человека xj,i соответствует i-му диагнозу, который и принимают как окончательно поставленный диагноз.
Указанный технический результат достигается также тем, что в устройстве для измерения вязкоупругих характеристик клеток биообъектов и для дифференциальной диагностики диффузных заболеваний печени, включающем прозрачную измерительную кювету, в которой расположены электроды, соединенные с источником электропитания, а также измерительный блок, согласно изобретению источник электропитания представляет собой генератор переменного электрического напряжения, а измерительный блок содержит микроскоп, оптически связанный с измерительной кюветой, и систему анализа изображения для измерения скорости движения эритроцитов, содержащую видеокамеру, оптически связанную с микроскопом, и компьютер, соединенный с видеокамерой. Причем электроды в измерительной кювете установлены с зазором, достаточным для формирования в нем средней напряженности электрического поля в пределах от 104 до 106 Вольт/м.
В условиях неоднородного переменного электрического поля (НПЭП) тестируется подвижность эритроцитов в суспензии. Проведенные эксперименты показали, что эритроциты обладают значительной подвижностью в условиях переменного неоднородного электрического поля. В слабоэлектропроводящем растворе глюкозы эритроциты в норме поступательно движутся в область с высокой напряженностью электрического поля при высокой частоте (≈1-5 МГц) электрического поля. При более низкой частоте электрического поля (≈10-100 кГц) эритроциты движутся в область с низкой напряженностью электрического поля. Кроме того установлено, что эритроциты с патологией печени, теряют свою способность движения в НПЭП. Принципиальная разница в подвижности эритроцитов в норме и при патологии и в НПЭП положена в основу изобретения.
Соотношение движущихся с разной скоростью эритроцитов в НПЭП связывается со степенью патологии печени.
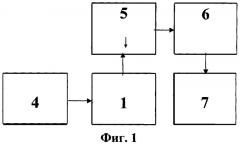
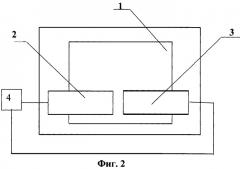
Изобретения иллюстрируются следующими графическими материалами. На фиг.1 приведена блок-схема автоматизированной установки для реализации предлагаемых способа измерения вязкоупругих характеристик клеток биологических объектов и способа дифференциальной диагностики диффузных заболеваний печени. На фиг.2 приведена схема измерительной кюветы. На фиг.3 представлена конструкция действующей автоматизированной установки для реализации предлагаемых способа измерения вязкоупругих характеристик клеток биологических объектов и способа дифференциальной диагностики диффузных заболеваний печени.
Варианты осуществления изобретения
Устройство для измерения вязкоупругих характеристик биологических клеток и для дифференциальной диагностики диффузных заболеваний печени включает разборную оптически прозрачную измерительную кювету 1 (фиг.2), в которой расположены металлические электроды 2 и 3, соединенные с источником электропитания 4, а также измерительный блок. Источник электропитания 4 представляет собой генератор переменного электрического напряжения, а измерительный блок (фиг.1) содержит микроскоп 5, оптически связанный с измерительной кюветой 1, и систему анализа изображения для измерения скорости движения тест-клеток, содержащую видеокамеру 6, оптически связанную с микроскопом 5, и компьютер 7, соединенный с видеокамерой 6. Компьютер 7 содержит специализированную программу обработки изображений. Измерительная кювета 1 размещена на подвижном столе микроскопа 5. Причем электроды 2 и 3 в измерительной кювете 1 установлены с зазором, достаточным для формирования в нем средней напряженности электрического поля в пределах от 104 до 106 Вольт/м. Зазор между электродами 2 и 3 в экспериментальной конструкции кюветы 1 устанавливают в пределах 50-100 мкм, а толщина указанных электродов составляет 0,2-2 мкм. Конструкция экспериментальной действующей установки (фиг.3) дополнительно предусматривает наличие осциллографа 8, подключенного к электродам 2 и 3 измерительной кюветы 1 для контроля электрических параметров, а также соединенный с цифровой видеокамерой 6 монитор 9.
Устройство работает следующим образом. Измерительную кювету 1 устанавливают на подвижный стол микроскопа 5 и фиксируют на нем указанную кювету 1. В измерительную кювету 1 вносят пробу суспензии клеток с известной степенью разведения. На электроды 2 и 3 измерительной кюветы 1 подают напряжение (не более 10 Вольт) от источника 4 (генератора) переменного напряжения, между которыми формируют среднюю напряженность электрического поля в пределах от 104 до 106 Вольт/м. С помощью видеокамеры 6 регистрируют динамику движения отдельных клеток в измерительной кювете 1. С видеокамеры 6 видеосигнал динамики движения клеток подают на компьютер 7 (со специализированной программой обработки изображений), где обрабатываются данные и вычисляются характеристики клеток биологических объектов, в том числе их вязкоупругие характеристики, используемые, например, для дифференциальной диагностики диффузных заболеваний печени.
Преимущество устройства для измерения вязкоупругих характеристик клетки биологических объектов с помощью высокочастотного электрического поля по сравнению с существующими аналогами заключаются в том, что он обеспечивает повышение точности измерения вязкоупругих характеристик клетки одновременно как за счет изменения амплитуды, так и за счет частоты переменного напряжения на электродах в кювете для измерения, и уменьшение времени для одного измерения. По сравнению с прототипом, в котором деформация клеток биологических объектов обеспечивается только изменением амплитуды напряжения импульса на электродах, в предлагаемом устройстве благодаря изменению как амплитуды, так и частоты переменного напряжения на электродах обеспечивается более высокая точность измерения вязкоупругих характеристик клетки.
Способ измерения вязкоупругих характеристик клеток биологических объектов и способ дифференциальной диагностики диффузных заболеваний печени реализуют следующим образом.
1-й этап измерений и вычислений. Он относится как к способу измерения характеристик клеток биологических объектов, в том числе вязкоупругих характеристик, например эритроцитов, так и к способу дифференциальной диагностики диффузных заболеваний печени. Для этого предварительно проводят отбор проб клеток биологических объектов, например, проб крови. Пробы разводят с заданным коэффициентом k и переносят смесь исследуемых проб материала с заданной концентрацией клеток Ск в измерительную кювету 1. В кювете 1 формируют неоднородное переменное электрическое поле с частотой от 10 кГц до 5 МГц и средней напряженностью электрического поля в зазоре между электродами в пределах от 104 до 106 Вольт/м путем подачи напряжения (не более 10 Вольт) на электроды 2 и 3 от источника 4 (генератора) электропитания. Далее измеряют средние скорости движения каждой клетки в суспензии и их минимальный радиус Rмин, средний радиус R и максимальный радиус Rмах через определенные интервалы времени в период воздействия электрического поля и после его отключения по истечении времени t путем видеозаписи изображения движения клеток и изменения их размера, полученные данные в цифровом виде вводят и обрабатывают в компьютере, имеющем вычислительную программу накопления и обработки данных, в результате чего определяют средние значения характеристик xj клеток биологических объектов, в том числе упругоэластичные характеристики эритроцитов, для данного образца (где j - порядковый номер характеристики от 1 до 8).
В условиях неоднородных электрических полей средняя скорость поступательного движения клетки определяется равенством среднего значения силы со стороны неоднородного электрического поля
где αс - поляризуемость клетки, Е0 - напряженностъ внешнего электрического поля, ε0 - диэлектрическая проницаемость вакуума.
Сила вязкого трения со стороны жидкости :
где ηw - динамическая вязкость жидкости, R - средний радиус клетки, который является первым диагностическим параметром xj,i.
Поляризуемость клетки вычисляют из условия равенства силы со стороны электрического поля и силы вязкого трения по формуле
Вычислением отношения среднего значения поляризуемости на двух частотах (100 кГц и 1 МГц) определяется второй из диагностических параметров хj,i x2,i=Kα=α0.1/α1,
Третьим диагностическим параметром является проводимость мембраны, которая определяется по формуле:
Равновесная частота вычисляется по формуле:
где f0.1 - нижняя частота, на которой измеряется поляризуемость α0.1, ƒ1 - верхняя частота, на которой измеряется поляризуемость α1.
Четвертым диагностическим параметром является емкость мембраны, которая вычисляется по формуле:
σ - электропроводность раствора, в котором проводятся измерения.
Сила со стороны электрического поля, растягивающая клетку, вычисляется по формуле:
Жесткость клетки (с) является пятым диагностическим параметром клетки (вязкоупругая характеристика клетки) и вычисляется в зависимости от величины деформации Δх по формуле:
После выключения электрического поля происходит восстановление исходной формы клетки. При этом величина деформации Δх уменьшается по экспоненциальному закону:
где t - время после выключения электрического поля, A - значение деформации Δх в момент выключения электрического поля.
Показатель скорости изменения величины деформации γ зависит от жесткости и вязкости клетки ηс.
Измерением зависимости деформации клетки от времени определяется вязкость клетки, которая является шестым диагностическим параметром клетки (вязкоупругая характеристика клетки):
Измерением отношения числа слипшихся клеток Nd к общему числу клеток N0 в поле наблюдения микроскопа определяется индекс агрегации эритроцитов, который является седьмым диагностическим параметром:
Измерением отношения числа клеток Nds, оставшихся в поле наблюдения микроскопа после деструкции, к общему числу клеток N0 в поле наблюдения микроскопа определяется коэффициент деструкции клеток, который является восьмым диагностическим параметром:
2-й этап измерений и вычислений. Он относится только к способу дифференциальной диагностики диффузных заболеваний печени.
Вышеописанный процесс (1-й этап) измерения средних скоростей движения каждой клетки в суспензии, их минимальный Rмин, средний Rcp, максимальный Rмах радиусы и определения характеристик xj эритроцитов проводят на каждом кадре видеозаписи многократно для проб эритроцитов здоровых пациентов (в норме) и пациентов с различными видами патологий, диагноз (состояние здоровья) которых определен заранее другими методами, например иммуноферментным методом, с определением характеристик эритроцитов (где i - порядковый номер диагноза от 1 до 7, в том числе норма и различные виды патологий: i=1 - норма, i=2 вирусный гепатит, i=3 - алкогольный гепатит, i=4 - смешанный гепатит, i=5 - вирусный цирроз, i=6 - алкогольный цирроз, i=7 - смешанный цирроз). Затем формируют из характеристик статистически достоверный массив данных, которые хранят в памяти компьютера для последующего их использования в дифференциальной диагностике заболеваний печени. Проводят аналогичные измерения образцов проб эритроцитов пациентов с различными видами патологий с определением характеристик эритроцитов хj,i, в реальном масштабе времени с последующим сравнением этих характеристик с соответствующими значениями , находящимися в базе данных компьютера, и определением показателя Δi близости измеряемых характеристик эритроцитов к каждому из представленных семи видов диагноза:
где Kj - нормировочные диагностические коэффициенты, которые вычисляют по формуле:
где - максимальное значение j-го параметра из всех параметров, соответствующих всем i-м диагнозам; - минимальное значение j-го параметра из всех параметров, соответствующих всем i-м диагнозам.
Нормировочные диагностические коэффициенты Кj позволяют провести сравнение в безразмерном виде измеряемых параметров, имеющих различную размерность, а также привести значения этих параметров к величинам близким к единице.
Далее выбирают минимальное значение Δi измеряемых параметров эритроцитов человека xj,i, соответствующее i-тому диагнозу, который и принимают как окончательно поставленный диагноз.
Пример 1. Определение вязкоупругих характеристик эритроцитов
Эксперименты проведены на установке, представленной на фиг.3. Кювета 1 выполнена в виде двух стеклянные пластин, на которых методом фотолитографии сформированы параллельно расположенные электроды 2 и 3. Для увеличения срока службы электродов они покрыты слоем диэлектрика. Расстояние между пластинами 50 мкм. Проба эритроцитов человека разведена в 5%-ном растворе глюкозы в соотношении 1:1000 с получением суспензии клеток эритроцитов до достижения концентрации эритроцитов, например, 1 млн/мл с динамической вязкостью суспензии ηw, равной 1,2·10-3 Па·с. После того как клеточная суспензия придет в состояния покоя, на металлические электроды 2 и 3 измерительной кюветы 1 подают переменное напряжение (не более 10 В). Скорость потока 50 мкм/с. Оптимальная частота электрического поля подобрана 1 МГц, на которой деформация эритроцитов человека наиболее выражена, а амплитуда электрического сигнала равна 10 В. Проведенные эксперименты показали, что для каждого из исследованных типов клеток существует оптимальное значение частоты и амплитуды электрического поля, при которой достигается максимальная степень деформации.
Далее измеряют средние скорости движения каждой клетки в суспензии и их минимальный радиус Rмин, средний радиус R и максимальный радиус Rмах через определенные интервалы времени в период воздействия электрического поля и после его отключения по истечении времени t путем видеозаписи изображения движения клеток и изменения их размера, полученные данные в цифровом виде вводят и обрабатывают в компьютере, имеющем вычислительную программу накопления и обработки данных, в результате чего определяют средние значения характеристик xj клеток биологических объектов, в том числе упругоэластичные характеристики эритроцитов, для данного образца (где j - порядковый номер характеристики от 1 до 8). Компьютерные данные для наглядности представлены в виде таблицы 1.
| Таблица 1Сравнительные данные вязкоупругих характеристик клеток эритроцитов, полученные заявляемым способом и по прототипу | |||||
| № эритроцита | αс [10-15 м3] | с[10-5 H/м] | ηc, [Па·с] | с [10-5 Н/м] | ηс, [10-7 Нс/м] |
| Результаты, вычисленные по формулам 1-7 | Результаты, вычисленные по формулам прототипа | ||||
| 1 | 4,2 | 2 | 0,7 | 4, |