Фрагменты пептидов, фармацевтические композиции и вакцины на их основе и их применение для профилактики и терапии атеросклероза
Иллюстрации
Показать всеИзобретение относится к области медицины и касается иммунотерапии на основе пептидов для лечения атеросклероза. Сущность изобретения включает фрагменты аполипопротеина В, в частности, его определенные пептиды для иммунизации или терапевтического лечения млекопитающих, включая человека, от ишемических сердечно-сосудистых заболеваний. Преимущество изобретения заключается в разработке новых антигенных пептидов аполипротеина В-100, предназначенных для лечения атеросклероза. 7 н. и 14 з.п. ф-лы, 5 табл., 6 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к новым пептидам, в частности к пептидам, предназначенным для применения при лечении атеросклероза, и к разработке на основе пептидов ИФА для определения иммунного ответа против окисленного липопротеина низкой плотности и диагностики наличия или отсутствия атеросклероза.
В частности, изобретение включает в себя
1) Применение любого из пептидов, перечисленных в таблице 1, индивидуально или в сочетании друг с другом, нативного или модифицированного MDA, предпочтительно совместно с подходящим носителем и адъювантом, в качестве иммунотерапии или «противоатеросклерозной «вакцины» для профилактики и лечения ишемического сердечно-сосудистого заболевания.
2) Применение тех же пептидов в ИФА для определения антител, связанных с усиленным или пониженным риском развития ишемических сердечно-сосудистых заболеваний.
Известный уровень техники
Атеросклероз представляет собой хроническое заболевание, которое вызывает утолщение внутреннего слоя (интимы) крупных артерий и артерий среднего размера. Это снижает ток крови и может вызвать ишемию и разрушение ткани в органах, снабжающихся кровью через поврежденный сосуд. Атеросклероз является главной причиной сердечно-сосудистого заболевания, включая инфаркт миокарда, инсульт и заболевание периферических артерий. Он является основной причиной смерти на Западе и, как предсказывается, станет лидирующей причиной смерти во всем мире в пределах двух десятилетий.
Заболевание начинается с накопления липопротеинов, в первую очередь, липопротеина низкой плотности (ЛПНП), во внеклеточном матриксе сосуда. Данные частицы ЛПНП агрегируют и подвергаются модификации в результате окисления. Окисленный ЛПНП является токсичным и вызывает повреждение сосудов. Во многих отношениях атеросклероз представляет собой ответ на повреждение, включающий воспаление и фиброз.
В 1989 г. Palinski и соавторы идентифицировали циркулирующие антитела против окисленных ЛПНП у человека. Это позволяло предположить, что атеросклероз может быть аутоиммунным заболеванием, вызываемым в результате иммунных реакций против окисленных липопротеинов. К настоящему времени несколько лабораторий начало исследовать связи между титрами антител против окисленных ЛПНП и сердечно-сосудистыми заболеваниями. Однако картина, которая возникла в результате данных исследований, далека от ясности. Антитела существовали против большого числа различных эпитопов окисленных ЛПНП, но структура таких эпитопов была неизвестной. Термин «антитела к окисленным ЛПНП», таким образом, относится к неизвестной смеси различных антител, а не к одному специфичному антителу. Независимые от Т-клеток антитела IgM встречались более часто, чем зависимые от Т-клеток антитела IgG.
Антитела против окисленных ЛПНП присутствовали как у пациентов с сердечно-сосудистыми заболеваниями, так и у здоровых лиц в контроле. Хотя в некоторых ранних исследованиях описаны связи между титрами антител к окисленным ЛПНП и сердечно-сосудистым заболеванием, другие исследователи были не в состоянии найти такие связи. Основным слабым моментом таких исследований был тот факт, что в применяемых для определения титров антител тестах ИФА в качестве лиганда использовали окисленные частицы ЛПНП. Состав ЛПНП является различным у разных индивидуумов, степень модификации в результате окисления трудно как контролировать, так и оценивать, и уровни антител против различных эпитопов в окисленных частицах ЛПНП не могут быть определены. В некоторой степени из-за технических проблем трудно оценить роль ответов антител против окисленных ЛПНП с применением доступных до сих пор методологий, но, однако, невозможно создать хорошо определяемые и воспроизводимые компоненты вакцины при применении интактных частиц окисленных ЛПНП.
Другим подходом в изучении предположения, что аутоиммунные реакции против окисленных ЛПНП в сосудистой стенке играют ключевую роль в развитии атеросклероза, является иммунизация животных против их собственных окисленных ЛПНП. Идея, лежащая в основе данного подхода, заключается в том, что если аутоиммунные реакции против окисленных ЛПНП усилятся при применении классических способов иммунизации, это должно привести к усилению воспаления сосудов и прогрессии атеросклероза. Для проверки данной гипотезы кроликов иммунизировали гомологичным окисленным ЛПНП и затем индуцировали атеросклероз путем содержания животных на диете с высоким содержанием холестерина в течение 3 месяцев.
Однако, в отличие от исходной гипотезы, иммунизация окисленным ЛПНП оказывала защитный эффект, снижая атеросклероз приблизительно на 50%. Сходные результаты были также получены при последующем исследовании, в котором диету с высоким содержанием холестерина сочетали с повреждением сосуда с помощью баллона для индукции более агрессивного развития бляшек. Параллельно с исследованиями авторов изобретения несколько других лабораторий представили сходные наблюдения. Суммарно доступные данные ясно указывают на то, что существуют иммунные реакции, которые защищают против развития атеросклероза и которые включают и аутоиммунный ответ против окисленных ЛПНП.
Данные наблюдения также предполагают возможность разработки иммунотерапии или «вакцины» для лечения возникшего в результате атеросклероза сердечно-сосудистого заболевания у человека. Один такой подход заключается в иммунизации индивидуума своим собственным ЛПНП после его окисления в результате экспозиции, например, с медью. Однако данный подход осложняется в связи с тем, что остается неизвестным вопрос о том, какая структура в окисленном ЛПНП отвечает за индукцию защитного иммунитета и может ли окисленный ЛПНП содержать также эпитопы, которые могут вызывать индукцию неблагоприятных иммунных реакций.
Идентификация эпитопов в окисленном ЛПНП важна по нескольким причинам:
Во-первых, один или несколько таких эпитопов, скорее всего, являются ответственными за активацию антиатерогенного иммунного ответа, наблюдаемого у животных, иммунизированных окисленным ЛПНП. Пептиды, содержащие данные эпитопы, могут, следовательно, предоставлять возможность для разработки иммунотерапии или «вакцины от атеросклероза» у человека. Кроме того, они могут быть использованы для терапевтического лечения развившегося у человека атеросклероза.
Во-вторых, пептиды, содержащие идентифицированные эпитопы, могут быть использованы для разработки методов ИФА, с помощью которых можно определять антитела против специфической структуры в окисленных ЛПНП. Такие методы ИФА должны быть более точными и надежными, чем доступные в настоящее время, в которых в качестве антигена используются частицы окисленного ЛПНП. Они должны также позволить анализировать иммунные ответы против различных эпитопов в окисленных ЛПНП, ассоциированных с сердечно-сосудистым заболеванием.
Патент США 5972890 относится к применению пептидов для диагностики атеросклероза. Способ, представленный в указанном патенте США, представляет собой в принципе форму радиофизической диагностики. Последовательность пептида метят радиоактивностью и его вводят в кровоток. Если данная пептидная последовательность будет идентична последовательностям, присутствующим в аполипопротеине В, она будет связываться с тканью, в которой присутствуют рецепторы для аполипопротеина В. В сосудах это, прежде всего, атеросклеротическая бляшка. Концентрирование радиоактивности в стенке сосуда может быть затем определено, например, с помощью гамма-счетчика. Способ, таким образом, представляет собой радиофизический способ диагностики, основанный на том, что радиоактивно меченые пептидные последовательности будут связываться со своими нормальными тканевыми рецепторами, присутствующими в атеросклеротической бляшке, и будут определяться с применением внешнего анализа радиоактивности. Он представляет собой способ прямого анализа для идентификации атеросклеротической бляшки. Он требует того, чтобы больной получал радиоактивные соединения.
Методология настоящего изобретения основывается на совершенно других принципах и способах. В соответствии с пунктом 1 формулы изобретения, изобретение относится к фрагментам аполипопротеина В для иммунизации против сердечно-сосудистого заболевания, а также к способу диагностики иммунных реакций против пептидных последовательностей аполипопротеина В. Такие иммунные реакции, в свою очередь, как показано, увеличиваются у индивидуумов, страдающих развитым атеросклерозом. Настоящий способ основан на прикреплении пептидных последовательностей к дну полимерных лунок. Когда добавляют образец крови, пептиды будут связываться с антителами, которые специфичны для данных последовательностей. Затем определяют количество связанных антител с применением иммунологического способа/метода. В отличие от способа указанного патента США данный способ, таким образом, не является методом прямого определения для идентификации и установления локализации атеросклеротической бляшки, но служит для определения иммунологического ответа, который проявляет высокую степень ковариантности со степенью атеросклероза.
Основной принцип настоящего изобретения является, таким образом, совершенно отличным от такового в указанном патенте. Последний зависит от связывания пептидных последовательностей с нормальными рецепторами липопротеинов, присутствующими в атеросклеротической ткани, в то время как первый основывается на открытии иммунных реакций против пептидных последовательностей и определении антител к данным пептидным последовательностям.
Опубликованные исследования (Palinski et al., 1995, and George et al., 1998) показали, что иммунизация против окисленных ЛПНП снижает развитие атеросклероза. Это должно указывать на то, что иммунные реакции против окисленных ЛПНП в целом обладают защитным эффектом. Представленные здесь результаты, однако, неожиданно показывают, что это происходит не всегда. Например, иммунизация с применением смеси пептидов #10, 45, 154, 199 и 240 дает толчок к усилению развития атеросклероза. Иммунизация с применением других пептидных последовательностей, например, пептидных последовательностей #1 и с 30 по 34, в целом не влияет на развитие атеросклероза. Результаты являются неожиданными потому, что они подводят базу под тот факт, что иммунные реакции против окисленных ЛПНП могут защищать против развития, вносить вклад в развитие атеросклероза и совсем не оказывать какого-либо эффекта, в зависимости от того, на какие структуры окисленных ЛПНП они направлены. Эти данные делают возможным разработку способов иммунизации, которые отдельно активируют защитные иммунные реакции. Далее, они показывают, что иммунизация с применением интактных окисленных ЛПНП может оказывать вредное воздействие, если применяемые частицы содержат высокий уровень структур, которые вызывают подъем атерогенных иммунных реакций.
Патент WO 99/08109 относится к применению панели моноклональных мышиных антител, которые связываются с частицами окисленных ЛПНП, для определения присутствия окисленных ЛПНП в сыворотке и плазме. Это, таким образом, совершенно отлично от настоящего изобретения, в котором раскрыт способ определения антител против окисленных ЛПНП.
Патент США 4970144 относится к способу получения антител с помощью иммунизации с применением пептидных последовательностей, причем антитела могут применяться для определения аполипопротеинов с использованием ИФА. Это, таким образом, нечто также совершенно отличное от настоящего изобретения.
В патенте США 5861276 описывается рекомбинантное антитело к нормальной форме аполипопротеина В. Данное антитело применяют для определения присутствия нормального аполипопротеина В в плазме и сыворотке и для лечения атеросклероза с помощью снижения количества частиц нормальных ЛПНП в системе циркуляции.
Таким образом, в настоящем изобретении описывается применение антител для лечения атеросклероза. Однако в противоположность патенту США 5861276, данные антитела направлены на структуры, присутствующие в частицах окисленных ЛПНП, а не на нормальную частицу ЛПНП. Преимущество состоит в том, что используются окисленные ЛПНП, которые, как предполагается, вызывают стимуляцию развития атеросклероза. Применение антител, направленных на структуры, являющиеся специфичными для окисленных ЛПНП, не описано в указанном патенте США.
Краткое изложение существа изобретения
Окисление липопротеинов, главным образом ЛПНП, в артериальной стенке, как считается, является важным фактором развития атеросклероза. Продукты, вырабатываемые при окислении ЛПНП, являются токсичными для клеток сосудов, вызывают воспаление и инициируют образование бляшек. Эпитопы в окисленных ЛПНП узнаются иммунной системой и вызывают стимуляцию образования антител. Эксперименты на животных показали, что некоторые из данных иммунных ответов обладают защитным эффектом в отношении атеросклероза. Антитела обычно направлены почти исключительно против структур на основе пептидов. Применяя библиотеку полипептидов, покрывающую полную последовательность только белка, представленного в ЛПНП, аполипопротеина В, были идентифицированы эпитопы в окисленных ЛПНП, которые вызывают стимуляцию образования антител у человека. Данные эпитопы пептидов могут быть использованы для разработки методов ИФА для исследования связи между иммунными ответами против окисленных ЛПНП и сердечно-сосудистым заболеванием и для разработки иммунотерапии или «вакцины» против атеросклероза для профилактики и лечения ишемического сердечно-сосудистого заболевания.
Подробное описание изобретения
Осуществлена молекулярная характеристика эпитопов окисленных ЛПНП, которые вызывают рост зависящих от антител иммунных ответов у человека. Применяемый подход имеет преимущества благодаря тому факту, что иммунные реакции почти исключительно направлены против пептидных последовательностей длиной в 5-6 аминокислот. ЛПНП содержит только один белок, аполипопротеин В длиной 4563 аминокислоты. При окислении аполипопротеин В фрагментируется, и альдегидные аддукты соединяются с положительно заряженными аминокислотами, в частности с лизином. Это означает, что пептидные последовательности, обычно не экспонирующиеся из-за трехмерной структуры аполипопротеина В, становятся доступными для иммунных клеток и/или что обычно экспонируемые пептидные последовательности становятся иммуногенными из-за гаптенилирования с альдегидами.
Таким образом, было определено, что следующие пептиды, нативные или производные MDA, обладающие такой эффективностью в плане индукции иммунного ответа, представляют собой
FLDTVYGNCSTHFTVKTRKG
PQCSTHILQWLKRVHANPLL
VISIPRLQAEARSEILAHWS
KLVKEALKESQLPTVMDFRK
LKFVTQAEGAKQTEATMTFK
DGSLRHKFLDSNIKFSHVEK
KGTYGLSCQRDPNTGRLNGE
RLNGESNLRFNSSYLQGTNQ
SLTSTSDLQSGIIKNTASLK
TASLKYENYELTLKSDTNGK
DMTFSKQNALLRSEYQADYE
MKVKIIRTIDQMQNSELQWP
IALDDAKINFNEKLSQLQTY
KTTKQSFDLSVKAQYKKNKH
EEEMLENVSLVCPKDATRFK
GSTSHHLVSRKSISAALEHK
IENIDFNKSGSSTASWIQNV
IREVTQRLNGEIQALELPQK
EVDVLTKYSQPEDSLIPFFE
HTFLIYITELLKKLQSTTVM
LLDIANYLMEQIQDDCTGDE
CTGDEDYTYKIKRVIGNMGQ
GNMGQTMEQLTPELKSSILK
SSILKCVQSTKPSLMIQKAA
IQKAAIQALRKMEPKDKDQE
RLNGESNLRFNSSYLQGTNQ
SLNSHGLELNADILGTDKIN
WIQNVDTKYQIRIQIQEKLQ
TYISDWWTLAAKNLTDFAEQ
EATLQRIYSLWEHSTKNHLQ
ALLVPPETEEAKQVLFLDTV
IEIGLEGKGFEPTLEALFGK
SGASMKLTTNGRFREHNAKF
NLIGDFEVAEKINAFRAKVH
GHSVLTAKGMALFGEGKAEF
FKSSVITLNTNAELFNQSDI
FPDLGQEVALNANTKNQKIR, также как не вызывающий продукцию антител пептид
ATRFKHLRKYTYNYQAQSSS
или активный сайт одного или более из данных пептидов.
Материалы и способы
Для определения того, какие части аполипопротеина В становятся иммуногенными в результате окисления ЛПНП, была создана библиотека полипептидов, состоящая из пептидов длиной 20 аминокислот, покрывающих полную последовательность аполипопротеина В человека. Пептиды получали с перекрыванием из 5 аминокислот для покрытия всех последовательностей в точках разрыва. Пептиды применяли в их нативном состоянии или после включения в фосфолипидные липосомы после окисления путем экспозиции с медью или после модификации малоновым деальдегидом (MDA) для имитации различных модификаций аминокислот, которые могут происходить во время окисления ЛПНП.
Пептиды
302 пептида, соответствующих полной аминокислотной последовательности аполипопротеина В человека, были синтезированы (Euro-Diagnostica AB, Malmö, Швеция и KJ Ross Petersen AS, Horsholm, Дания) и применены в ИФА. Часть каждого синтетического пептида была модифицирована 0,5 М MDA (Sigma-Aldrich Sweden AB, Stockholm, Швеция) в течение 3 час при 37°С и в присутствии липосом 0,5 М MDA в течение 3 час при 37°С или 5 мкМ CuCl2 (Sigma) в течение 18 час при 37°С. Модифицированные MDA пептиды диализовали против ЗФР, содержащего 1 мМ ЭДТА, с несколькими сменами в течение 18 час при 4°С. Модификацию пептидов тестировали в денатурирующих полиакриламидных гелях (Bio-Rad Laboratories, Hercules, CA), подходящих для разделения пептидов. Пептиды нумеровали 1-302, начиная с N-конца белка.
Для получения производных могут быть применены другие альдегиды, такие как гидроксиноненаль и другие.
Липосомы
Смесь яичного фосфатидилхолина (EPC) (Sigma) и фосфатидилсерина (PS) (Sigma) в растворе хлороформа при молярном отношении 9:1 и концентрации 3 мМ фосфолипида (PL) упаривали в стеклянном контейнере под слабой струей аргона. Контейнер затем помещали в вакуум на 3 часа. К высушенной пленке EPC/PS добавляли раствор, содержащий 0,10 мМ пептида (5 мл) в стерильно отфильтрованном 10 мМ HEPES-буфере рН 7,4, 145 мМ NaCl и 0,003% азида натрия, и инкубировали в течение 15 мин при 50°С. Смесь осторожно перемешивали в течение приблизительно 5 мин при комнатной температуре и затем помещали в баню с ледяной водой и сонифицировали с амплитудой 7,5 микрон в течение 3 х 3 мин (Sonyprep 150 MSE Sanyo, Tamro-Medlab, Швеция) с промежутками 1 мин. PL-петидную смесь, нативную или модифицированную 0,5 М MDA в течение 3 час при 37°С или 5 мМ CuCl2 в течение 18 час при 37°С, хранили под аргоном в стеклянных сосудах при 4°С, закрытых алюминиевой фольгой, и использовали в пределах 1 недели. Модифицированную MDA смесь диализовали против ЗФР, содержащего 1 мМ ЭДТА, с несколькими сменами в течение 18 час при 4°С перед хранением. Модификацию смеси тестировали в денатурирующих полиакриламидных гелях (Bio-Rad Laboratories, AB, Sundbyberg, Швеция), подходящих для разделения пептидов.
Образцы плазмы
Образцы плазмы от 10 больных с сердечно-сосудистым заболеванием (AHP) и 50 образцов плазмы, 25 женских и 25 мужских, от нормальных доноров крови (NHP) собирали и объединяли. Два пула аликвотировали и хранили при -80°С.
ИФА
Нативные или модифицированные синтетические пептиды, разведенные в ЗФР, рН 7,4 (20 мкг/мл), в присутствии или в отсутствие липосом, абсорбировали на лунках планшета для микротитрования (Nunc MaxiSorp, Nunc, Roskilde, Дания) в ходе ночной инкубации при 4°С. В качестве контроля в каждый планшет вносили один из пептидов (P6). После промывки ЗФР, содержащим 0,05% Твин-20 (ЗФР-Т), покрытые планшеты блокировали с помощью SuperBlock в TBS (Pierce, Rockford, IL) в течение 5 мин при комнатной температуре с последующей инкубацией объединенной плазмы человека, AHP или NHP, разведенной 1/100 в TBS-0,05% Твин-20 (TBS-T) в течение 2 час при комнатной температуре и затем в течение ночи при 4°С. После промывки определяли задержку аутоантител против пептидов с применением биотинилированных антител кролика против IgG или IgM человека (Dako A/S, Glostrup, Дания), разведенных подходящим образом в TBS-T. После дополнительной инкубации в течение 2 час при комнатной температуре планшеты промывали и связанные биотинилированные антитела определяли с помощью щелочной фосфатазы, конъюгированной со стрептавидином (Sigma), с инкубацией в течение 2 час при комнатной температуре. Цветная реакция развивалась при применении набора субстрата фосфатазы (Pierce), и измеряли поглощение при 405 нм через 1 час инкубации при комнатной температуре. Величины поглощения различных пептидов делили на величину поглощения Р6 и сравнивали.
Последовательности аполипопротеина В, которые узнавались антителами плазмы человека, показаны как Seq. Id 1-37 на прилагаемой фигуре. И AHP, и NHP содержат антитела к большому количеству различных пептидов. Были идентифицированы антитела против как нативных, так и модифицированных пептидов. В целом титры антител к модифицированным MDA пептидам были выше или равны таковым для соответствующего нативного пептида. Сравнение нативного, модифицированного MDA, окисленного медью пептида показало высокую степень корреляции, а также то, что наибольшие титры антител определялись с применением модифицированных MDA пептидов. Применение пептидов, включенных в липосомы, не приводило к повышенному уровню антител. Антитела подкласса IgM были более распространенными, чем антитела подтипа IgG.
Пептиды, против которых были определены наиболее высокие уровни антител, могли быть подразделены на шесть групп с общими характеристиками (Таблица 1):
(A) Высокие уровни антител IgG против модифицированных MDA пептидов (n=3).
(B) Высокие уровни антител IgM, но нет различий между нативными и модифицированными MDA пептидами (n=9).
(С) Высокие уровни антител IgG, но нет различий между нативными и модифицированными MDA пептидами (n=2).
(D) Высокие уровни антител IgG против модифицированных MDA пептидов и, по меньшей мере, в 2 раза больше антител в пуле NHP по сравнению с пулом AHP (n=5).
(E) Высокие уровни антител IgM против модифицированных MDA пептидов и, по меньшей мере, в 2 раза больше антител в пуле NHP по сравнению с пулом AHP (n=11).
(F) Высокие уровни антител IgG, но нет различий между интактными и модифицированными MDA пептидами, но, по меньшей мере, в 2 раза больше антител в пуле AHP по сравнению с пулом NHP (n=7).
(G) Отсутствуют антитела IgG или IgM
| Таблица 1 | |
| А. Высокий IgG, отличие от MDA | |
| P 11.P 25.P 74. | FLDTVYGNCSTHFTVKTRKGPQCSTHILQWLKRVHANPLLVISIPRLQAEARSEILAHWS |
| B. Высокий IgM, отсутствие отличия от MDA | |
| P 40.P 68.P 94.P 99.P 100.P 102.P 103.P 105.P 177. | KLVKEALKESQLPTVMDFRKLKFVTQAEGAKQTEATMTFKDGSLRHKFLDSNIKFSHVEKKGTYGLSCQRDPNTGRLNGERLNGESNLRFNSSYLQGTNQSLTSTSDLQSGIIKNTASLKTASLKYENYELTLKSDTNGKDMTFSKQNALLRSEYQADYEMKVKIIRTIDQMQNSELQWP |
| C. Высокий IgG, отсутствие отличия от MDA | |
| P 143.P 210. | IALDDAKINFNEKLSQLQTYKTTKQSFDLSVKAQYKKNKH |
| D. NHS/AHP, IgG-ak>2, отличие от MDA | |
| P1.P 129.P 148.P 162.P 252. | EEEMLENVSLVCPKDATRFKGSTSHHLVSRKSISAALEHKIENIDFNKSGSSTASWIQNVIREVTQRLNGEIQALELPQKEVDVLTKYSQPEDSLIPFFE |
| E. NHS/AHP, IgM-ak>2, отличие от MDA | |
| P 301.P 30.P 31.P 32.P 33.P 34.P 100.P 107.P 149.P 169.P 236. | HTFLIYITELLKKLQSTTVMLLDIANYLMEQIQDDCTGDECTGDEDYTYKIKRVIGNMGQGNMGQTMEQLTPELKSSILKSSILKCVQSTKPSLMIQKAAIQKAAIQALRKMEPKDKDQERLNGESNLRFNSSYLQGTNQSLNSHGLELNADILGTDKINWIQNVDTKYQIRIQIQEKLQTYISDWWTLAAKNLTDFAEQEATLQRIYSLWEHSTKNHLQ |
| F. NHS/AHP, IgG-ak<0,5, отсутствие отличия от MDA | |
| P 10.P 45.P 111.P 154.P 199.P 222.P 240. | ALLVPPETEEAKQVLFLDTVIEIGLEGKGFEPTLEALFGKSGASMKLTTNGRFREHNAKFNLIGDFEVAEKINAFRAKVHGHSVLTAKGMALFGEGKAEFFKSSVITLNTNAELFNQSDIFPDLGQEVALNANTKNQKIR |
| G. | |
| P 2. | ATRFKHLRKYTYNYQAQSSS |
Все из этих 38 пептидных последовательностей представляют собой мишени для иммунных реакций, которые могут иметь важное значение для развития атеросклероза и ишемических сердечно-сосудистых заболеваний. Данные пептиды могут, следовательно, быть применены для разработки ИФА для определения связей между уровнями антител против определенных последовательностей модифицированных MDA аминокислот в аполипопротеине В и риска развития сердечно-сосудистого заболевания.
Данные пептиды также представляют собой возможные посредники защитного иммунитета, наблюдаемого у экспериментальных животных, иммунизированных окисленным ЛПНП, и могут быть применены для тестирования в последующей разработке иммунотерапии или "вакцины" против атеросклероза.
Так, было идентифицировано 38 различных последовательностей в белке аполипопротеина В человека, которые вызывают значительные иммунные ответы у человека. Данные эпитопы, по-видимому, представляют собой то, что ранее было описано как антитела против окисленного ЛПНП. Поскольку большинство иммунных ответов направлено против пептидных последовательностей, и аполипопротеин В является единственным белком в ЛПНП, примененный в данном проекте подход должен давать возможность идентифицировать специфические эпитопы по существу для всех антител против окисленных частиц ЛПНП. Было описано семейство специфичных в отношении фосфолипидов антител, включающее антитела против кардиолипина, которые взаимодействуют с окисленным ЛПНП, однако специфичность и роль данных антител предстоит полностью охарактеризовать.
Во многих случаях титры антител были выше по отношению к модифицированным MDA полипептидам по сравнению с нативными последовательностями. Когда антитела определяли против модифицированной MDA последовательности, это почти всегда было связано с наличием антител против нативной последовательности. Вероятное объяснение этому заключается в том, что иммунный ответ против модифицированной MDA аминокислотной последовательности в аполипопротеине В (модификация MDA происходит в результате окисления ЛПНП) ведет к нарушению толерантности к нативной последовательности. Для других последовательностей не было различий в титрах антител против модифицированных MDA или нативных последовательностей. Это заставляет предположить, что иммунные реакции направлены против нативных последовательностей. Не должно быть иммунного ответа против аминокислотных последовательностей белка, нормально экспонированного иммунной системе. В нативной частице ЛПНП значительные части белка аполипопротеина В скрыты в фосфолипидном слое ЛПНП и, следовательно, не доступны для иммунной системы. Во время окисления ЛПНП аминокислотная цепь аполипопротеина В фрагментируется, что ведет к изменениям в трехмерной структуре. Это, по-видимому, ведет к экспонированию пептидных последовательностей, в норме недоступных для иммунной системы, и к выработке антител против данных последовательностей, что может объяснить наблюдавшееся наличие антител против нативных последовательностей аполипопротеина В. Альтернативно, истинный иммунный ответ направлен против модифицированных MDA последовательностей, однако перекрестная реакция с нативными последовательностями является настолько высокой, что не удается показать различий в связывании.
Возможность того, что методы ИФА на основе данных пептидов (нативных или модифицированных MDA) могут быть использованы для определения связей между иммунной реакцией против определенных эпитопов в окисленных ЛПНП и наличием и/или риском развития сердечно-сосудистого заболевания изучали в пилотном исследовании. Исследование выполняли на субъектах, участвующих в исследовании противораковых диет Malmö, популяционном исследовании, в котором в промежутке между 1989 и 1993 гг. участвовало свыше 30000 индивидуумов. Уровни антител против 24 из 38 пептидов, перечисленных в таблице 1, определяли в базовых образцах плазмы 26 субъектов, у которых развился острый инфаркт миокарда в течение последующего периода, и у 26 здоровых контрольных субъектов, подобранных по возрасту, полу и употреблению сигарет. Дополнительную группу из 26 субъектов, подобранных по возрасту, полу и употреблению сигарет, но для всех с уровнями холестерина ЛПНП выше 5,0 ммоль/л, также включали для исследования уровней антител в виде группы с высокой степенью риска, в которой не развилось сердечно-сосудистое заболевание.
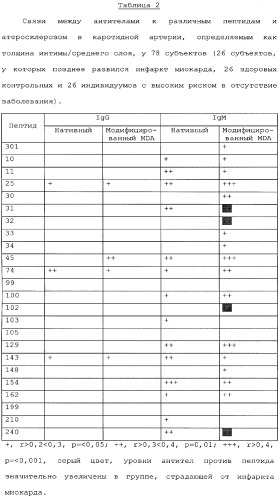
Для 19 из 24 проанализированных пептидов были выявлены существенные корреляции между уровнями антител IgM против пептидов, модифицированных MDA, и тяжестью атеросклероза в каротидной артерии (толщины интимы/среднего слоя) при оценке с помощью ультразвукового исследования общей каротидной артерии, т.е. чем больше уровни антител, тем больше атеросклероз (Таблица 2). Для многих из данных пептидов существовали также значительные корреляции между уровнями антител к нативным пептидам и толщиной интимы/среднего слоя. Только для 4 пептидов показана существенная корреляция между антителами IgG и толщиной интимы/среднего слоя. Данные наблюдения предполагают, что ИФА с использованием данных модифицированных MDA пептидов (по одиночке или в сочетании) может быть применен для идентификации субъектов с усиленным атеросклерозом.
Четыре из протестированных пептидов были не только связаны с наличием усиленного атеросклероза, но были также существенно увеличены в группе субъектов, которые впоследствии страдали от инфаркта миокарда (Таблица 2). Такие наблюдения также показывают, что ИФА на основе пептидов может быть также использован для идентификации субъектов с усиленным риском развития инфаркта миокарда.
Выявлено также существенное увеличение уровней антител IgG для нативного пептида 103, 162 и 199, а также для модифицированного MDA 102, в группе, которая впоследствии страдала от инфаркта миокарда. Однако антитела IgG против данных пептидов не были значимо связаны с наличием атеросклероза в каротидной артерии.
Особенно интересное наблюдение было проведено для антител против пептида 210, модифицированного MDA, для которого наблюдались значительно более высокие уровни антител IgM у здорового контроля и в группе высокого риска (холестерин ЛПНП выше 5,0 ммоль/л), чем в группе, в которой развился инфаркт миокарда. Соответственно, антитела против пептида 210, модифицированного MDA, могут являться маркерами для индивидуумов с пониженным риском развития сердечно-сосудистого заболевания.
В настоящее время показано, что иммунизация нативными и модифицированными MDA апо В-100 пептидными последовательностями ведет к ингибированию атеросклероза у экспериментальных животных (Nordin Fredrikson, Söderberg et al., Chyu et al.). Механизмы, с помощью которых осуществляются данные атерозащитные иммунные ответы, остается полностью выяснить. Однако одна вероятная возможность заключается в том, что атерозащитный эффект опосредуется антителами, выработанными против данных пептидных последовательностей. Данные антитела могут, например, ускорять удаление поврежденных в результате окисления частиц ЛПНП с помощью Fc-рецепторов макрофагов.
Макрофагальные рецепторы-мусорщики узнают только ЛПНП с большим окислительным повреждением [9]. Последние исследования выявили наличие циркулирующих окисленных ЛПНП [10, 11]. Данные частицы характеризуются только минимальным окислительным повреждением и не узнаются рецепторами-мусорщиками. Связывание антител с данными циркулирующими окисленными частицами ЛПНП может способствовать их удалению из циркуляции до их аккумуляции в ткани сосудов [12].
В ряде исследований поддерживается роль антител в защите против атеросклероза. Узнавание В-клетками ингибирует развитие атеросклероза у спленэктомированных нокаутных по апо Е мышей [13], также как образование неоинтимы после повреждения каротидной артерии у мышей RAG-1 (неопубликованные наблюдения в лаборатории авторов изобретения). Более того, показано, что повторяющиеся инъекции иммуноглобулинов снижают атеросклероз у нокаутных по апо Е мышей [6].
Как обсуждалось выше, антитела против пептидных последовательностей, модифицированных MDA, в апо В-100 могут быть выработаны путем активной иммунизации с применением синтетических пептидов. Данная процедура требует 2-3 недель для достижения полного эффекта в плане получаемой продукции антител.
В некоторых ситуациях может быть необходим более быстрый эффект. Одним из примером могут служить нестабильные атеросклеротические бляшки, в которых окисленные ЛПНП, очевидно, вносят вклад в воспаление, клеточную токсичность и риск отрыва бляшек. В данных условиях пассивная иммунизация путем введения очищенных или полученных рекомбинантным способом антител против нативных и модифицированных MDA последовательностей может оказывать более быстрый эффект.
Другой ситуацией, при которой пассивная иммунизация с помощью введения очищенных или полученных рекомбинантным способом антител может быть эффективной, является коронарная болезнь сердца у пожилых индивидуумов. Исследования авторов показали, что с возрастом у человека происходит снижение антител против последовательностей пептида апо В, и оно связано с увеличением уровня окисленных ЛПНП в плазме (Nordin Fredrikson, Hedblad et al.). Это может предполагать наличие старения иммунных клеток, ответственных за продукцию антител против антигенов в окисленных ЛПНП, и вести к дефектному клиренсу поврежденных в результате окисления частиц ЛПНП из циркуляции. Соответственно, данные субъекты должны извлечь больше пользы из пассивной иммунизации с помощью введения очищенных или полученных рекомбинантным способом антител, чем из активной иммунизации пептидными последовательностями апо В-100.
Синтетические нативные пептиды (Euro-Diagnostica AB, Malmö, Швеция), применяемые здесь в последующем, представляют собой пептид 1, 2 и 301 из первоначального скрининга полипептидной библиотеки.
В случае пептида 1 (аминокислотная последовательность: EEEMLENVSLVCPKDATRFK, n=10) и пептида 301 (аминокислотная последовательность: HTFLIYITELLKKLQSTTVM, n=10), как обнаружено, выявляется более высокий ответ антител IgG или IgM на форму, модифицированную MDA, чем на нативный пептид, соответственно, и оба титра выше у здорового субъекта. Данные пептиды были выбраны на основе предположения, что ответ антител на данные пептиды может быть защитным в отношении атеросклероза.
В случае пептида 2 (аминокислотная последовательность: ATRFKHLRKYTYNYQAQSSS, n=10) не выявлено ответа антител при первоначальном скрининге антител, следовательно, он был выбран как контрольный пептид. Мыши, получавшие квасцы, служили контролем (n=9).
Мыши апо Е (-/-) получали первичную подкожную иммунизацию в возрасте 6-7 недель с последующей внутрибрюшинной бустерной инъекцией через 3 недели. Мышей содержали на диете с высоким содержанием холестерина с момента иммунизации и продолжали содержать до забоя в возрасте 25 недель. Ко времени забоя не наблюдалось существенных различий в массе тела у 4 групп мышей. Не было статистически значимых различий в уровне холестерина сыворотки, измеренного имеющимся в продаже набором (Sigma). У всех них средние уровни холестерина в сыворотке составляли выше 715 мг/дл.
Область нисходящей аорты, покрытую атеросклеротической бляшкой, измеряли на препарате en face после окрашивания масляным красным О. По сравнению с контрольной группой мыши, иммунизированные пептидом No. 2 и No. 301, характеризовались существенно сниженным атеросклерозом (фиг.2). Иммунизация пептидом No. 1 не вызывала значимого снижения атеросклероза по сравнению с контролем. В отличие от нисходящей аорты степень атеросклероза в корне аорты и дуге аорты не различалась в 4 экспериментальных группах (фиг.3).
Не выявлено различий между 4 группами в плане размера бляшек синуса аорты или содержания в них липидов (таблица А). Средние размеры бляшек в дугах аорты 4 групп мышей не различались. Однако при оценке размеров бляшек в нисходящей грудной и брюшной аорте en face с помощью окрашивания масляным красным О выявлено, что контрольная группа и группа с пептидом No. 1 имели сходное количество атеросклеротических бляшек в аорте, в то время как группы с пептидом No. 2 и No.9 характеризовались существенно сниженной тяжестью атеросклеротических изменений в аорте (таблица А). Выявление того, что иммунизация пептидами не влияла на размер бляшек в синусе аорты или дуге аорты, но снижала бляшки в нисходящей аорте, предполагает, что иммунизация пептидом должна снижать образование новых бляшек, но не влиять на прогрессирование бляшек.
Дополнительно тестировали, будет ли иммунизация пептидами модулировать фенотип атеросклеротических бляшек. Замороженные срезы бляшек синуса аорты окрашивали иммуногистохимически антителом против моноцитов/макрофагов (MOMA-2, Serotec). В соответствии с данными, полученными при исследовании en face, пептид No. 2 значительно снижал инфильтрацию бляшек макрофагами (фиг.1). Окрашивание трихромом выявило среднее содержание коллагена 40,0±7,7% в бляшках синуса аорты в группе с пептидом 2; в то время как среднее содержание коллагена в контрольной группе с квасцами, группе с пептидом 1 и группе с пептидом 9 составляло 32,3±5,3%, 35,6±8,5% и 29,4±9,6%, соответственно.
В каждой группе определяли ответ антител против пептидов, применяемых для иммунизации. Титр антител после иммунизации возрастал в 6,1±3,1 раз в группе с пептидом 1, в 2,4±1,0 раз в группе с пептидом 2 и в 1,8±0,6 раз в группе с пептидом 9; в то время как в группе с квасцами наблюдалось увеличение титра а