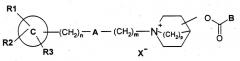Карбаматы хинуклидина, способы их получения и фармацевтическая композиция на их основе
Иллюстрации
Показать всеИзобретение относится к новым производным карбамата формулы (I) или к их фармацевтическим приемлемым солям,
,
в которой R1 представляет собой
, , , ,
, , , или ;
R3 означает атом водорода, галоген или алкил;
R2 означает бензил, фенетил, фуран-2-илметил, фуран-3-илметил, тиофен-2-илметил, тиофен-3-илметил или алкил;
p равно 1 или 2, а замещение в азабициклическом кольце может быть в положении 2, 3 или 4.
Соединение формулы (I) и их соли обладают ингибирующей активностью в отношении мускариновых рецепторов МЗ и могут найти применения в медицине. 6 н. и 19 з.п. ф-лы, 1 табл.
Реферат
Данное изобретение имеет отношение к новым терапевтически эффективным производным карбамата хинуклидина, к некоторым способам их получения и к фармацевтическим композициям, содержащим названные производные.
Новые соединения согласно изобретению являются антимускариновыми агентами с сильным и длительно продолжающимся действием. В частности, названные соединения проявляют высокое сродство в отношении мускариновых рецепторов МЗ. Упомянутый подтип мускаринового рецептора присутствует в железах и гладкой мышце и опосредует возбуждающее действие парасимпатической системы на секрецию желез и сокращение висцеральной гладкой мышцы (Chapter 6, Cholinergic Transmission, in H.P.Rang et al., Pharmacology, Churchill Livingstone, New York, 1995).
Поэтому понятно, что антагонисты МЗ оказываются эффективными при лечении заболеваний, характеризующихся повышенным тонусом парасимпатической системы, избыточной секрецией желез или сокращением гладких мышц (R.M.Eglen and S.S.Hegde, (1997), Drug News Perspect., 10(8):462-469).
Примерами упомянутого типа заболеваний являются респираторные расстройства, такие как хроническое обструктивное заболевание легких (COPD), бронхит, повышенная реактивность бронхов, астма, кашель и ринит; урологические расстройства, такие как недержание мочи, поллакиурия, нейрогенный или нестабильный мочевой пузырь, цистоспазм или хронический цистит; желудочно-кишечные расстройства, такие как синдром раздраженной толстой кишки, спастический колит, дивертикулит и пептические язвы; и сердечно-сосудистые расстройства, такие как вагус-индуцированная синусовая брадикардия (Chapter 7, Muscarinic Receptor Agonists and Antagonists, in Goodman and Gilman's The Pharmacological Basis of Therapeutics, 10th edition, McGraw Hill, Ney York, 2001).
Соединения по изобретению могут быть использованы сами по себе или в сочетании с другими лекарственными средствами, обычно считающимися эффективными для лечения перечисленных выше заболеваний. Например, их можно вводить в сочетании с β2-агонистами, стероидами, противоаллергическими лекарственными средствами, ингибиторами фосфодиэстеразы IV и/или антагонистами лейкотриена D4 (LTD4) для одновременного, раздельного или последовательного применения при лечении респираторного заболевания. Предлагаемые соединения используются для лечения рассмотренных выше респираторных заболеваний в комбинации с β2-агонистами, стероидами, противоаллергическими лекарственными средствами или ингибиторами фосфодиэстеразы IV.
Соединения с близкой структурой описаны в нескольких патентах как спазмолитические и антихолинергические средства.
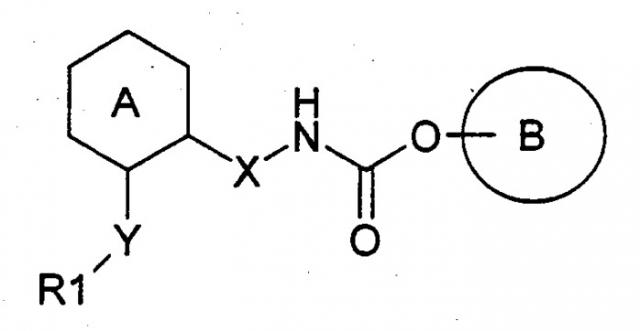
Например, в заявке на патент ЕР 747355 описаны производные карбамата, которые характеризуются следующей общей формулой
в которой каждый символ имеет следующее значение:
кольцо А означает кольцо бензола или пиридина,
кольцо представляет собой азотсодержащее насыщенное гетерокольцо, которое может иметь заместитель при атоме азота и которое может содержать поперечную связь,
R1 означает фенильную группу, которая может иметь заместитель, циклоалкильную или циклоалкенильную группу, содержащую от 3 до 8 атомов углерода или пяти-, или шести-членную азотсодержащую гетероциклическую группу,
Х означает простую связь или группу метилена,
Y означает простую связь, карбонильную группу, метиленовую группу, которая может быть замещена гидроксильной группой или группой, изображаемой формулой -S(O)l-, и l является целым числом 0-2.
Описанные соединения четко отличаются от соединений данного изобретения по их структурным характеристикам, так как они всегда содержат один водород при азоте карбаматной связи.
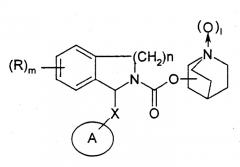
Кроме того, в другой заявке на патент ЕР 801067 описывают соединения, изображаемые формулой
в которой означает группу арила, группу циклоалкила, группу циклоалкенила или группу гетероарила,
Х означает простую связь или группу метилена,
l равно 0 или 1,
n равно целому числу 1 или 2.
Описанные соединения также отличаются от соединений, заявленных в данном изобретении, так как в них азот карбаматной связи включен в циклическую структуру.
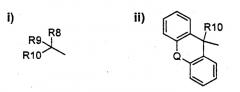
В WO 01/04118 описаны соединения, имеющие следующую общую формулу
в которой В представляет собой группу формулы (i) или (ii):
А, , R1, R2, R3, m, n, p, X-, Q, R8, R9 и R10 описаны в п.1 цитируемой заявки.
В данном изобретении предлагаются новые соединения, которые являются производными карбамата хинуклидина, с сильной активностью антагониста мускариновых рецепторов М3, которые имеют химическую структуру, описанную в формуле (I), или являются их фармацевтически приемлемыми солями, включая соли формулы (II).
Формула (I) представляет карбамат следующей общей структуры:
которая может быть кватернизирована, чтобы получить фармацевтически приемлемую соль карбамата формулы (I), в частности соль общей формулы (II).
в которой R1 представляет собой
где R3 представляет собой атом водорода или галогена, или группу низшего алкила с прямой или разветвленной цепью, или цианогруппу;
R2 означает группу бензила, фенетила, фуран-2-илметила, фуран-3-илметила, тиофен-2-илметила или тиофен-3-илметила, или алкильную группу с прямой или разветвленной цепью, содержащую 3-8 атомов углерода, группу алкенила, содержащую от 3 до 8 атомов углерода, или группу циклоалкила, содержащую 3-6 атомов углерода;
p равно 1 или 2, а замещение в бициклическом кольце может быть во 2, 3 или 4 положении, включая все возможные конфигурации асимметричных атомов углерода;
m соответствует целому числу от 0 до 8;
А представляет собой группу -CH2-, -CH=CR4-, -CR4=CH-, -CO-, -O-, -S-, -S(O)-, SO2, -NR4- или группу -CR4R5-, в которых R4 и R5, каждый независимо, означают атом водорода, группу низшего алкила с прямой или разветвленной цепью, или R4 и R5 вместе образуют алициклическое кольцо;
n означает целое число от 0 до 4;
В представляет собой атом водорода, алкоксигруппу, циклоалкильную группу, -COOR4 или -OOCR4, в которых R4 является таким, как описано выше, или цианогруппу, группу нафталинила, группу 5,6,7,8-тетрагидронафталинила, группу бифенила или группу формулы (i) или (ii)
в которых Z означает О, N или S;
R3 определен, как указано выше; и
R6, R7 и R8, каждый независимо, означают атом водорода или галогена, или группу гидрокси, фенил, -OR4, -SR4, -NR4R5, -NHCOR4, -CONR4R5, -CN, -NO2, -COOR4 или -CF3, или содержащую от 1 до 6 атомов углерода группу алкила с прямой или разветвленной цепью, которая является незамещенной либо замещенной одной или несколькими гидроксильными группами или C1-C6-алкоксигруппами, где R4 и R5, каждый независимо, представляют собой атом водорода, группу низшего алкила с прямой или разветвленной цепью, или R4 и R5 вместе образуют алициклическое кольцо; или R6 и R7 вместе образуют ароматическое, алициклическое или гетероциклическое кольцо; и
Х- означает фармацевтически подходящий анион моно- или поливалентной кислоты.
В соединениях четвертичного аммония данного изобретения, включая соединения, представленные формулой (II), эквивалент аниона (X-) ассоциирован с положительным зарядом атома N. Х- может быть анионом различных минеральных кислот, таким как, например, хлорид, бромид, иодид, сульфат, нитрат, фосфат, или анионом органической кислоты, таким как, например, ацетат, трифторацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. X- предпочтительно является анионом, выбранным из хлорида, бромида, иодида, сульфата, нитрата, ацетата, малеата, оксалата или сукцината. Более предпочтительно, X- означает хлорид, бромид, трифторацетат или метансульфонат.
Приведенные в описании группы низшего алкила и фрагменты, если не указано особо, представляют собой алкильные группы с прямой или разветвленной цепью, содержащие от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода. Предпочтительные группы и фрагменты низшего алкила включают в себя метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил и трет-бутил. Упомянутые в описании алкильные группы, содержащие от 3 до 8 углеродов, такие как группы, представленные в группе R2, включают в себя н-пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, пентил, гексил, гептил и октил.
Упомянутые в описании, возможно замещенные группы низшего алкила включают в себя группы алкила с прямой или разветвленной цепью, содержащие от 1 до 6, предпочтительно от 1 до 4 атомов углерода, как упомянуто выше, которые могут быть незамещенными или замещенными в любом положении одним или несколькими заместителями, например 1, 2 или 3 заместителями. Если имеется два или более заместителей, каждый из заместителей может быть одним и тем же или отличаться. Заместитель(и) обычно представляет собой гидрокси- или алкоксигруппы.
Упоминаемые в описании группы алкенила, имеющие 3-8 атомов углерода, такие как группы, представленные в группе R2, являются группами с прямой или разветвленной цепью, такими как пропенил, бутенил, пентенил, гексенил, гептенил или октенил с прямой или разветвленной цепью. Двойная связь может находиться в любом положении в группе алкенила, например на концевой связи относительно карбаматной группы.
Упоминаемые в описании алкоксигруппы, такие как группы, представленные в группе В, обычно означают группы низшего алкокси, которые являются группами, содержащими от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, с углеводородной цепью, которая является разветвленной или прямой. Предпочтительные алкоксигруппы включают в себя метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, втор-бутокси и трет-бутокси.
Упоминаемые в описании циклоалкильные группы и алициклические группы, если не указано особо, обычно содержат от 3 до 8 атомов углерода, предпочтительно от 3 до 6 атомов углерода. Группы циклоалкила и алициклические кольца из 3-6 атомов углерода включают в себя циклопропил, циклобутил, циклопентил и циклогексил.
Ароматическое кольцо, упоминаемое в связи с R6 и R7, обычно содержит от 5 до 14, предпочтительно 5-10 атомов углерода. Примеры ароматических групп включают в себя циклопентадиенил, фенил и нафталинил.
Упоминаемое в связи с R6 и R7 гетероциклическое кольцо обычно означает 3-10-членное кольцо, такое как 5- или 6-членное кольцо, содержащее один или несколько гетероатомов, выбранных из N, S и O. Обычно присутствует 1, 2, 3 или 4 гетероатома, предпочтительно 1 или 2 гетероатома. Примеры гетероциклических колец включают в себя пиперидил, пирролидил, азетидинил, азиридил, пиперазинил, морфолинил, тиоморфолинил, пирролил, имидазолил, имидазолидинил, пиразолинил, индолинил, изоиндолинил, пиридил, пиразинил, пиримидинил, пиридазинил, индолизинил, изоиндолил, индолил, индазолил, пуринил, хинолизинил, изохинолил, хинолил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, птеридинил, хинуклидинил, триазолил, пиразолил, триазолил, тетразолил и тиенил.
Атом галогена включает в себя атом фтора, хлора, брома или иода, обычно атом фтора, хлора или брома.
Соединения по данному изобретению, представленные формулой (I), и их соли, такие как представленные формулой (II), которые могут иметь один или несколько асимметричных атомов углерода, включают в себя все возможные стереоизомеры. Отдельные изомеры и смеси изомеров попадают в объем интересов данного изобретения.
Предпочтительные карбаматы формулы (I) представляют собой карбаматы, в которых R1 означает группу фенила, тиофен-2-илметила, тиенила или фуран-2-илметила, которая является незащищенной (то есть R3 означает водород). Однако если R1 защищен группой R3, которая не является водородом, заместитель может находиться в положении 2, 3, 4 или 5 или, если R1 означает группу фенила, в положении 6. Когда R1 соответствует фенилу, заместитель предпочтительно находится в положении 4 кольца. Заместитель R3 предпочтительно означает водород, галоген или низший алкил, предпочтительно водород, фтор, хлор, метил или этил, и особо предпочтительно водород, фтор или метил. Примеры замещенных групп R1 включают в себя галоген-фенил, галоген-тиофен-2-илметил, галоген-тиенил, галоген-фуран-2-илметил, (С1-4-алкил)-фенил, (С1-4-алкил)-тиофен-2-илметил, (С1-4-алкил)-тиенил или (С1-4-алкил)-фуран-2-илметил. Конкретные примеры включают в себя 4-фторфенил, 4-метилфенил, 4-хлорфенил, 4-этилфенил, 3-метилфенил, 3-фторфенил, 3-хлорфенил, 3-этилфенил, фтортиофен-2-илметил, фтортиенил и фторфуран-2-илметил. Особо предпочтительные группы R1 включают в себя фенил, 4-фторфенил, 4-метилфенил, тиофен-2-илметил, тиенил и фуран-2-илметил.
Предпочтительные группы R2 включают в себя бензил, тиофен-2-илметил, тиофен-3-илметил, фуран-2-илметил, фенетил, пент-4-енил, пентил, бутил, аллил или циклопентил.
Предпочтительные группы -NR1R2 в формуле (I) включает в себя группы -N-(бензил)(фенил); -N-(бензил)(4-фторфенил); -N-(бензил)(п-толилфенил); -N-(бутил)(фенил); -N-(фенил)(тиофен-2-илметил); -N-(фенетил)(фенил); -N-(пентил)(фенил); -N-(пент-4-енил)(фенил); -N-(фенил)(тиофен-3-илметил); -N-(бутил)(тиофен-2-илметил); -N-бис-тиофен-2-илметил; -N-(фуран-2-илметил)(тиофен-2-илметил); -N-(аллил)(тиофен-2-илметил); -N-(циклопентил)(тиофен-2-илметил); -N-(фуран-2-илметил)(фенил) и N-бис-фуран-2-илметил.
Предпочтительно, p равно 2. Замещение в азабицикло[2.2.2]октане предпочтительно находится в положении 3. Замещенный атом углерода может иметь (R)- или (S)-конфигурацию, предпочтительно (R)-конфигурацию.
Следующие соединения общей формулы (I) предназначены для иллюстрации, а не ограничения рамок данного изобретения.
1-азабицикло[2.2.2]окт-3-(R)иловый эфир бензилфенилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир бензил(4-фторфенил)карбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир бензил-п-толилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир бутилфенилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир фенилтиофен-2-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир фенетилфенилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир пентилфенилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир пент-4-енилфенилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир фенилтиофен-3-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир бутилтиофен-2-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир бис-тиофен-2-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир фуран-2-илметил-2-тиофен-2-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир аллилтиофен-2-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир циклопентилтиофен-2-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир фуран-2-илметилфенилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)иловый эфир бис-фуран-2-илметилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)гепт-4-иловый эфир бензилфенилкарбаминовой кислоты
1-азабицикло[2.2.2]окт-3-(R)окт-4-иловый эфир бензилфенилкарбаминовой кислоты
и их фармацевтически приемлемые соли.
Предпочтительными солями формулы (II) являются соли, соответствующие предпочтительным определениям R1, R2, -NR1R2 и р, как для формулы (I) выше, и имеющие такую же локализацию и конфигурацию заместителя на азониабициклическом кольце.
Кроме того, предпочтительно, чтобы В представлял собой атом водорода или замещенную либо незамещенную группу фенила, пирролила, тиенила или фурила, или группу бифенила, нафталинила, 5,6,7,8-тетрагидронафталинила или группу бензо[1,3]диоксолила, в частности замещенную или незамещенную группу фенила или тиенила, такую как группа 2-тиенила или группа 3-тиенила, особенно группа 2-тиенила.
Группа тиенила, пирролила или фурила может быть незамещенной или замещенной группой R3, которая описана выше. Заместитель может находиться в положении 2, 3, 4 или 5 на кольце.
Группа фенила может быть незамещенной или замещенной одной, двумя или тремя группами (R6-R8), которые могут располагаться в любом положении на кольце. Обычно группа фенила не замещена или замещена одной группой, например, в положении 2, 3 или 4. Предпочтительно, заместители R6, R7 и R8, каждый независимо, представляют собой атом водорода или галогена или группу гидроксила, метила, трет-бутила, -СН2ОН, 3-гидроксипропила, -OMe, -NMe2, -NHCOMe, -CONH2, -CN, -NO2, -COOMe или -CF3, илиR6 и R7 вместе образуют 5- или 6-членное кольцо, такое как кольцо фенила или тиазолила. Более предпочтительно, R6, R7 и R8 означают атом водорода, или галогена, или группу гидроксила, метила, -СН2ОН, -OMe, -NMe, -NHCOMe, -CONH2, -CN, -NO2, -COOMe или -CF3, в особенности атом водорода, гидроксигруппу или атом галогена, где атом галогена предпочтительно является фтором. Примерами замещенных групп фенила, которые могут представлять В, являются толил, включая о-, м- и п-толил, 3-цианофенил, 2-, 3- и 4-гидроксифенил, 2-, 3- и 4-фторфенил и бензотиазолил. Особо предпочтительно В означает группу фенила, 4-фторфенила или 3-гидроксифенила.
Обычно, n=0 или 1; m является целым числом от 1 до 6, в частности 1, 2 или 3; а А означает группу -СН2-, -СН=СН-, -СО-, -NMe-, -O- или -S-, в частности группу -СН2-, -СН=СН- или -O-. Примеры подходящих групп -(СН2)m-A-(CH2)n- включают метилен, этилен, аллилен, н-пропилен, и-пропилен, бутилен, 4-метилпент-3-енилен, гептилен, этиленокси, пропиленокси, бутиленокси, сульфаноилпропилен, метиламинопропилен и 4-оксобутилен, предпочтительно метилен, этилен, аллилен, н-пропилен, изо-пропилен, гептилен, этиленокси или пропиленокси.
Более предпочтительными солями формулы (II) являются соли, в которых группа азониабицикло замещена при атоме азота группой 3-феноксипропила, 2-феноксиэтила, 3-фенилаллила, фенетила, 4-фенилбутила, 3-фенилпропила, 3-[2-гидроксифенокси]пропила, 3-[4-фторфенокси]пропила, 2-бензилоксиэтила, 3-пиррол-1-илпропила, 2-тиен-2-илэтила, 3-тиен-2-илпропила, 3-фениламинопропила, 3-(метилфениламино)пропила, 3-фенилсульфанилпропила, 3-о-толилоксипропила, 3-(2,4,6-триметилфенокси)пропила, 3-(2-трет-бутил-6-метилфенокси)пропила, 3-(бифенил-4-илокси)пропила, 3-(5,6,7,8-тетрагидронафталин-2-илокси)пропила, 3-(нафталин-2-илокси)пропила, 3-(нафталин-1-илокси)пропила, 3-(2-хлорфенокси)пропила, 3-(2,4-дифторфенокси)пропила, 3-(3-трифторметилфенокси)пропила, 3-(3-цианофенокси)пропила, 3-(4-цианофенокси)пропила, 3-(3-метоксифенокси)пропила, 3-(4-метоксифенокси)пропила, 3-(бензо[1,3]диоксол-5-илокси)пропила, 3-(2-карбамоилфенокси)пропила, 3-(3-диметиламинофенокси)пропила, 3-(4-нитрофенокси)пропила, 3-(3-нитрофенокси)пропила, 3-(4-ацетиламинофенокси)пропила, 3-(3-метоксикарбонилфенокси)пропила, 3-[4-(3-гидроксипропил)фенокси]пропила, 3-(2-гидроксиметилфенокси)пропила, 3-(3-гидроксиметилфенокси)пропила, 3-(4-гидроксиметилфенокси)пропила, 3-(2-гидроксифенокси)пропила, 3-(4-гидроксифенокси)пропила, 3-(3-гидроксифенокси)пропила, 4-оксо-4-тиен-2-илбутила, 3-(1-метил-[1H]-имидазол-2-илсульфанил)пропила, 3-(бензотиазол-2-илокси)пропила, 3-бензилоксипропила, 6-(4-фенилбутокси)гексила, 4-феноксибутила или 2-бензилоксиэтила. Особо предпочтительными солями являются соли, в которых группа азониабицикло замещена по атому азота группой 3-феноксипропила, 2-феноксиэтила, 3-фенилаллила, фенетила, 3-фенилпропила, 3-(3-гидроксифенокси)пропила, 3-(4-фторфенокси)пропила, 3-тиофен-2-илпропила, 1-аллила или 1-гептила.
Следующие соли общей формулы (II) предназначены для иллюстрации, а не ограничения рамок данного изобретения.
3-(R)(Бензилфенилкарбамоил-окси)-1-(3-фенилаллил)-1-азониабицикло[2.2.2]октан, бромид
1-Аллил-3-(R)(бензилфенилкарбамоил-окси)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бензилфенилкарбамоил-окси)-1-фенетил-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бензилфенилкарбамоил-окси)-1-(3-тиофен-2-илпропил)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бензилфенилкарбамоил-окси)-1-(3-фенилпропил)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бензилфенилкарбамоил-окси)-1-(2-феноксиэтил)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бутилфенилкарбамоил-окси)-1-(3-фенилаллил)-1-азониабицикло[2.2.2]октан, бромид
1-Аллил-3-(R)(бутилфенилкарбамоил-окси)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бутилфенилкарбамоил-окси)-1-(2-феноксиэтил)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бутилфенилкарбамоил-окси)-1-[3-(3-гидроксифенокси)пропил]-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бутилфенилкарбамоил-окси)-1-[3-(4-фторфенокси)пропил]-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бутилфенилкарбамоил-окси)-1-(3-тиофен-2-илпропил)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бутилфенилкарбамоил-окси)-1-(3-фенилпропил)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Фенилтиофен-2-илметилкарбамоил-окси)-1-(3-тиофен-2-илпропил)-1-азониабицикло[2.2.2]октан, бромид
1-(2-Феноксиэтил)-3-(R)(фенилтиофен-2-илметилкарбамоил-окси)-1-азониабицикло[2.2.2]октан, бромид
1-Аллил-3-(R)(фенилтиофен-2-илметилкарбамоил-окси)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Фенетилфенилкарбамоил-окси)-1-(2-феноксиэтил)-1-азониабицикло[2.2.2]октан, трифторацетат
1-Гептил-3-(R)(пент-4-енилфенилкарбамоил-окси)-1-азониабицикло[2.2.2]октан, трифторацетат
1-Аллил-3-(R)(фенилтиофен-3-илметилкарбамоил-окси)-1-азониабицикло[2.2.2]октан, трифторацетат
3-(R)(Фенилтиофен-3-илметилкарбамоилокси)-1-(3-тиофен-2-илпропил)-1-азониабицикло[2.2.2]октан, бромид
1-(2-Феноксиэтил)-3-(R)(фенилтиофен-3-илметилкарбамоилокси)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бис-тиофен-2-илметилкарбамоилокси)-1-(3-фенилпропил)-1-азониабицикло[2.2.2]октан, бромид
3-(R)(Бис-тиофен-2-илметилкарбамоилокси)-1-(3-тиофен-2-илпропил)-1-азониабицикло[2.2.2]октан, бромид
1-Аллил-3-(R)(аллилтиофен-2-илметилкарбамоилокси)-1-азониабицикло[2.2.2]октан, трифторацетат
3-(R)(Циклопентилтиофен-2-илметилкарбамоилокси)-1-(3-фенилпропил)-1-азониабицикло[2.2.2]октан, трифторацетат
3-(R)(Фуран-2-илметилфенилкарбамоил-окси)-1-(3-фенилпропил)-1-азониабицикло[2.2.2]октан, трифторацетат
1-Аллил-3-(R)(бис-фуран-2-илметилкарбамоил-окси)-1-азониабицикло[2.2.2]октан, трифторацетат
В данном изобретении также предлагаются способы получения соединений формул (I) и (II).
Соединения общей формулы (I) можно получать по способу (а), проиллюстрированному в следующей схеме и подробно описанному в экспериментальном разделе.
В формулах (I), (III) и (IV) R1, R2 и р являются такими, как установлено выше.
Соединения общей формулы (III) могут быть получены из соответствующих вторичных аминов по стандартному способу (b), описанному в литературе.
Амины общей формулы (V), которые не поставляются коммерчески, получены в результате синтеза по стандартным способам. Например, амины, в которых R1 означает тиофен-2-илметил, а R2 является таким, как определено выше, получают гидроалкилированием. Соответствующий альдегид обрабатывают подходящим первичным амином для образования имина, который восстанавливают боргидридом натрия, чтобы получить вторичный амин.
Карбаматы формулы (I) могут быть превращены в фармацевтически приемлемые соли по способам, известным в данной области. Обычно карбамат формулы (I) обрабатывают неорганической или органической кислотой, такой как фумаровая, винная, янтарная или хлористоводородная кислота.
Производные четвертичного аммония общей формулы (II) можно получать реакцией алкилирующего агента общей формулы (VI) с соединениями общей формулы (I). В формулах (I), (II) и (VI), R1, R2, А, В, X, n, m, и p являются такими, как описано выше.
В формуле (VI) W соответствует любой подходящей уходящей группе, такой как группа X, которая описана выше. Предпочтительно, W представляет группу X.
Упомянутая реакция алкилирования может быть проведена по двум различным экспериментальным способам, (с) и (d), которые описываются ниже. В частности, способ (d) представляет собой новый экспериментальный способ, использующий технологию экстракции твердой фазы, что допускает параллельное получение нескольких соединений. Если W представляет собой группу иную, чем X, соль четвертичного аммония формулы (II) получают из продукта способа (с) или (d) посредством проведения реакции обмена по стандартным способам, чтобы заменить анион W- требуемым анионом Х-.
Способы (с) и (d) описываются в экспериментальном разделе. Соединения общей формулы (VI), которые не поставляются коммерчески, получены в результате синтеза по стандартным способам. Например, соединения, в которых n = 0, а А = -О-, -S- или -NR4, где R4 определен, как указано выше, получают в результате реакции соответствующего ароматического производного или его калиевой соли с алкилирующим агентом общей формулы Y-(CH2)m-X, в которой X может быть галогеном, а Y может быть галогеном или сложным сульфонатным эфиром. В других примерах соединения общей формулы (VI), в которой n>=1, синтезировали из соответствующего производного спирта общей формулы (VII) по известным способам.
В-(СН2)n-A-(СН2)m-OH (VII)
Соединениями формулы (IV) могут быть:
4-гидрокси-1-азабицикло[2.2.1]гептан, описанный в WO93/15080
4-гидрокси-1-азабицикло[2.2.2]октан, описанный Grob, C.A. et al. Helv. Chim. Acta (1958), 41, 1184-1190
3(R)-гидрокси-1-азабицикло[2.2.2]октан или 3(S)-гидрокси-1-азабицикло[2.2.2]октан, описанные Ringdahl, R. Acta Pharm. Suec. (1979), 16, 281-283 и коммерчески поставляется фирмой CU Chemie Uetikon GmbH.
Структуры полученных соединений подтверждали методами 1Н-ЯМР и МС. Спектры ЯМР регистрировали, используя прибор Varian 300 МГц, и химические сдвиги выражали как миллионные доли (δ) относительно внутреннего стандарта - тетраметилсилана. Чистоту соединений определяли посредством ВЭЖХ, используя хроматографию с обращенной фазой на приборе Waters, и получали величины выше 95%. Молекулярные ионы получали электрораспылительной ионизационной масс-спектрометрией на приборе Hewlett Packard. Исследования ВЭЖХ-МС проводили на приборе Gilson, снабженном бинарным насосом (поршневой насос Gilson 321); вакуумным дегазатором (Gilson 864); инжектором - коллектором фракций (жидкостной манипулятор Gilson 215); двумя инъекционными модулями, аналитическим и препаративным (Gilson 819); клапаном (Gilson Valvemate 7000); разделяющим устройством 1/1000 (Acurate by LC Packings); подающим насосом (Gilson 307); диодным детектором (Gilson 170) и детектором МС (Thermoquest Finnigan aQa, квадрупольный масс-спектрометр с ионизационными режимами ES (электрораспыление) и ACPI (химическая ионизация при атмосферном давлении)). ВЭЖХ-МС контролировали посредством IBM PC.
Способ (а)
Пример 54 - Получение 1-азабицикло[2.2.2]окт-3-(R)илового эфира бутилфенилкарбаминовой кислоты.
0,65 г (28,50 ммоль) натрия добавляли к 70 мл сухого толуола. Суспензию кипятили с обратным холодильником при энергичном перемешивании. Когда весь натрий расплавлялся, добавляли 3,60 г (28,30 ммоль) (R)-3-гидрокси-1-азабицикло[2.2.2]октана и продолжали перемешивание в течение 2 часов, и в течение этого времени весь натрий прореагировал с образованием алкоголята. Затем медленно добавляли 6,00 г (28,30 ммоль) фенилбутилкарбамилхлорида, растворенного в 30 мл толуола. Смесь кипятили с обратным холодильником в течение одного часа, а затем реакционную смесь перемешивали в течение всей ночи при комнатной температуре. Суспензию фильтровали и фильтрат выпаривали. К остатку добавляли простой эфир и перемешивали в течение 10 минут. Суспензию фильтровали и фильтрат концентрировали в вакууме с получением 7,18 г коричневого масла. Полученный продукт очищали методом колоночной хроматографии (силикагель, хлороформ/этанол/аммиак 140:8:1) с получением 1,78 г (5,89 ммоль) (22%) чистого продукта, структуру подтверждали 1Н-ЯМР. 300 МГц, CDCl3: δ 0,9 (м,3Н), 1,3 (м,4Н), 1,5 (м,4Н), 1,9 (с,1Н), 2,7 (м,5Н), 3,2 (м,1Н), 3,7 (м,2Н), 4,7 (м,1Н), 7,2-7,4 (м,5Н); МС[М+1]+: 303.
Пример 150 - Получение 1-азабицикло[2.2.2]окт-3-(R)илового эфира циклопентилтиофен-2-илметилкарбаминовой кислоты.
0,57 г (24,59 ммоль) натрия добавляли к 70 мл сухого толуола. Суспензию кипятили с обратным холодильником при энергичном перемешивании. Когда весь натрий расплавлялся, добавляли 3,11 г (24,42 ммоль) (R)-3-гидрокси-1-азабицикло[2.2.2]октана и перемешивали в течение 2 часов, и в течение этого времени весь натрий вступал в реакцию с образованием алкоголята. Затем медленно добавляли 4,96 г (20,35 ммоль) циклопентилтиофен-2-илметилкарбамилхлорида, растворенного в 30 мл толуола. Смесь кипятили с обратным холодильником в течение пяти часов, а затем реакционную смесь перемешивали в течение всей ночи при комнатной температуре. Суспензию фильтровали и фильтрат промывали водой. Органический слой экстрагировали 20% HCl, а водный слой подщелачивали 8 н. NaOH и экстрагировали этилацетатом. Органический слой промывали водой, высушивали над безводным Na2SO4 и упаривали. Полученное масло (4,50 г) очищали методом колоночной хроматографии (силикагель, хлороформ/этанол/аммиак 225:8:1) с получением 2,25 г (6,73 ммоль) (33%) чистого продукта, структуру подтверждали 1Н-ЯМР. 300 МГц, (DMSO-d6): δ 1,20-1,40 (м,1Н), 1,45-1,72 (м,11Н), 1,89 (уш.с,1Н), 2,45-2,62 (м,5Н), 3,30-3,10 (м,1Н), 4,22 (уш.с, 1Н), 4,50-4,63 (м,3Н), 6,93-6,99 (м,2Н), 7,38 (м,1Н); МС[М+1]+: 335.
Пример 159 - Получение 1-азабицикло[2.2.1]гепт-4-илового эфира бензилфенилкарбаминовой кислоты.
В двугорлую колбу в атмосфере азота помещали 3 мл ТГФ и 150 мг (1,33 ммоль) 4-гидрокси-1-азабицикло[2.2.1]гептана. Суспензию охлаждали до -60°С и по каплям добавляли 0,7 мл (1,46 ммоль) диизопропиламида лития (LDA). После добавления позволяли температуре повышаться до 0°С и поддерживали в течение двух часов. В течение 30 минут добавляли раствор 295 мг (1,20 ммоль) бензилфенилкарбамилхлорида в 2 мл ТГФ. Реакционную смесь оставляли для медленного нагревания до комнатной температуры и перемешивали в течение 18 часов. Суспензию фильтровали, а фильтрат концентрировали при пониженном давлении. Остаток экстрагировали дихлорметаном и водой. Органический слой экстрагировали 2 н. HCl, а водный слой подщелачивали 8 н. NaOH и экстрагировали дихлорметаном. Органические слои высушивали над безводным Na2SO4 и упаривали. Полученное масло (162 мг) очищали методом ВЭЖХ-МС с получением 4,86 мг (0,015 ммоль) продукта в виде формиата с 1,3% чистоты, структуру подтверждали 1Н-ЯМР. 300 МГц, (DMSO-d6): δ 1,86 (м,4Н), 2,65 (с,2Н), 2,77 (уш.с,2Н), 3,03 (уш.с,2Н), 4,84 (с,2Н), 7,14-7,32 (м, 10Н), 8,19 (с,1Н); МС[М-НСОО]+: 323.
Способ (b)
Карбамоилхлориды общей формулы (III) получали в соответствии со способами, описанными в литературе: M. Saraswati et al., Drug Development Research (1994), 31, 142-146; G.M. Shutske et al., J. Heterocycl. Chem. (1990), 27, 1617; GB 1246606; US 2762796.
Пример 1-1 - Получение бутилфенилкарбамоилхлорида
К раствору 6,72 г (45 ммоль) бутилфениламина в 50 мл хлористого метилена, охлажденного до 10°С, при перемешивании медленно добавляли 6,67 г (22,5 ммоль) трифосгена в 40 мл хлористого метилена. Реакция протекала при комнатной температуре в течение 27 часов. Растворитель выпаривали, а остаток дважды экстрагировали н-гексаном. Органический раствор концентрировали в вакууме до получения 9,11 г (43,03 ммоль) желтого масла (96%). 1Н-ЯМР (CDCl3): δ 0,9 (м,3Н), 1,3 (м,2Н), 1,6 (м,2Н), 3,7 (м,2Н), 7,2-7,4 (м, 5Н).
Пример 1-2 - Получение циклопентилтиофен-2-илметилкарбамилхлорида
К раствору 5,0 г (27,58 ммоль) циклопентилтиофен-2-илметил-амина в 40 мл хлористого метилена при 10°С при перемешивании медленно добавляли 4,09 г (13,79 ммоль) трифосгена в 35 мл хлористого метилена. Реакцию проводили при комнатной температуре в течение 64 часов, при кипячении с обратным холодильником в течение 4 часов и еще в течение 25 часов при комнатной температуре. Растворитель выпаривали, а остаток экстрагировали н-гексаном. Органический раствор концентрировали, чтобы получить 4,96 г (20,34 ммоль) коричневого масла (74%). 1Н-ЯМР (CDCl3): δ 1,4 (м,8Н), 4,2 (уш.с,1Н), 4,5 (м,2Н), 6,8-7,3 (м,3Н).
Способ (с)
Пример 146 - Получение (R)-3-(бис-тиофен-2-илметилкарбамоил-окси)-1-(3-тиофен-2-илпропил)-1-азониабицикло[2.2.2]октана, бромида
Смешивали 0,54 г (1,5 ммоль) 1-азабицикло[2.2.2]окт-3-(R)-илового эфира бис-тиофен-2-илметилкарбаминовой кислоты, 7,5 мл тетрагидрофурана и 0,46 г (2,25 ммоль) 2-(3-бромпропилтиофена). Раствор кипятили с обратным холодильником в течение 4 часов и оставляли, чтобы продолжить перемешивание при комнатной температуре в течение 116 часов. Добавляли эфир и полученную суспензию перемешивали в течение 30 минут. Растворитель экстрагировали и добавляли еще эфир. Описанную процедуру повторяли несколько раз для того, чтобы удалить алкилирующий агент. Наконец, суспензию фильтровали, а остаток высушивали в вакуумной печи. Выход составлял 0,69 г (1,22 ммоль) (81%). 1Н-ЯМР (DMSO-d6): δ 1,78-2,10 (м,6Н), 2,34 (уш.с,1Н), 2,82 (м,2Н), 3,21-3,46 (м,7Н), 3,89 (м,1Н), 4,54 (м,4Н), 5,06 (м,1Н), 6,95-7,01 (м,4Н), 7,07-7,11 (м,2Н), 7,38-7,49 (м,3Н); МС[M-Br]+: 487; температура 143°С.
Способ (d)
Пример 133 - Получение 1-гептил-3-(R)(фенилтиофен-3-илметилкарбамоилокси)-1-азониабицикло[2.2.2]октана, трифторацетата
30 мг (0.08 ммоль) 1-азабицикло[2.2.2]окт-3-(R)илового эфира фенилтиофен-3-илметилкарбаминовой кислоты растворяли в 1 мл ДМСО. К полученному раствору добавляли 75 мг (0,40 ммоль) гептилбромида. После перемешивания в течение ночи при комнатной температуре смесь очищали экстракцией твердой фазы с использованием катионообменного картриджа Mega Bond Elut, предварительно уравновешенного 0,1 М NaH2PO4-буфером при рН=7,5. Реакционную смесь наносили на картридж и промывали сначала 2 мл ДМСО, а затем три раза 5 мл CH3CN, вымывая все исходные материалы. Производное аммония элюировали 5 мл 0,03 М раствора ТФУК в смеси CH3CN:CHCl3 (2:1). Полученный раствор нейтрализовали 300 мг поли(4-винилпиридином), фильтровали и выпаривали досуха.
Выход составлял 12 мг (34%) указанного в заголовке соединения. 1Н-ЯМР (DMSO-d6): δ 0,88 (м,3Н), 1,28 (м,8Н), 1,60-2,19 (м,7Н), 3,00-3,41 (м,7Н), 3,83 (м,1Н), 4,88 (с,2Н), 5,99 (м,1Н), 7,01 (м,1Н), 7,21-7,39 (м,6Н), 7,49-7,52 (м,1Н); МС[M-CF3COO]+: 441.
Также в объем данного изобретения включены фармацевтические композиции, которые содержат в качестве активного ингредиента, по крайней мере, одно производное хинуклидина общей формулы (I) или (II) в комбинации с фармацевтически приемлемым носителем или разбавителем. Предпочтительно, композицию составляют в форме, подходящей для перорального применения. Фармацевтически приемлемый носитель или разбавители, которые смешивают с соединением или соединениями для образования композиции по данному изобретению, сами по себе хорошо известны, и использование определенных наполнителей зависит, в числе прочего, от предполагаемого способа введения композиции.
Композиции по данному изобретению адаптированы для перорального применения. В данном случае, композицию для перорального применения можно приготовить в виде таблеток, покрытых пленкой таблеток, жидкого ингаляционного препарата, порошкообразного ингаляционного препарата и ингаляционной аэрозоли. Любой из этих препаратов содержит одно или несколько соединений по изобретению. Такие препараты могут быть приготовлены способами, хорошо известными в данной области.
Разбавители, которые могут быть использованы в препаратах композиций, включают в себя те жидкие и твердые разбавители, которые совместимы с активным ингредиентом, при необходимости вместе с окрашивающими и вкусовыми агентами. Таблетки или покрытые пленкой таблетки обычно могут содержать между 0,1 мг и 500 мг, предпочтительно от 0,5 до 200 мг активного ингредиента. Ингаляционные композиции могут содержать от 1 мкг до 1000 мкг, предпочтительно от 10 до 800 мкг активного ингредиента. При лечении человека доза соединения общей формулы (I) или (II) зависит от требуемого эффекта и продолжительности лечения; дозы для взрослых обычно составляют от 0,5 мг до 300 мг в день в виде таблеток и от 10 мкг до 800 мкг в день в виде ингаляционной композиции.
Соединения данного изобретения или фармацевтические композиции, содержащие их, могут быть использованы вместе с β2-агонистом, стероидом, антиаллергическим лекарственным средством и/или ингибитором фосфодиэстеразы IV для одновременного, раздельного или последовательного применения при лечении респираторного заболевания.
Фармакологическое действие
Следующие примеры демонстрируют прекрасную фармакологическую активность соединений данного изобретения. Результаты относительно связывания мускаринового рецептора человека и влияния на бронхоспазм у морской свинки были получены, как описано ниже.
Исследования мускаринового рецептора человека