Матрица, обеспечивающая пролонгированное, инвариантное и независимое высвобождение активных соединений
Иллюстрации
Показать всеИзобретение относится к фармацевтической композиции, содержащей по меньшей мере два активных соединения, опиоидный анальгетик и опиоидный антагонист в не набухающей диффузионной матрице, характеристики высвобождения определяются матрицей из этилцеллюлозы и, по меньшей мере, одного жирного спирта. Изобретение также относится к частному случаю такого фармацевтического препарата, содержащего 10-150 мг оксикодона и 1-50 мг налоксона на стандартную дозу. Композицию отличает устойчивость при хранении, соединения высвобождаются из матрицы пролонгированно, инвариантно и, при наличии нескольких соединений, независимо. 2 н. и 15 з.п. ф-лы, 26 ил., 19 табл.
Реферат
Изобретение относится к устойчивому при хранении фармацевтическому препарату, содержащему, по меньшей мере, одно фармацевтически активное соединение в практически не набухающей диффузионной матрице, причем высвобождение соединения из матрицы является пролонгированным, инвариантным и, если присутствует несколько соединений, независимым. Что касается ее основных характеристик высвобождения, в состав матрицы входит, в основном, этилцеллюлоза и, по меньшей мере, один жирный спирт.
Изобретение также относится к способу получения устойчивых при хранении фармацевтических препаратов, содержащих, по меньшей мере, одно фармацевтически активное соединение в практически не набухающей диффузионной матрице, причем высвобождение, по меньшей мере, одного соединения из матрицы является пролонгированным, инвариантным и, если присутствует несколько соединений, также независимым.
Фармацевтические препараты пролонгированного действия играют главную роль в создании усовершенствованных лекарственных средств. Смысл создания всех препаратов пролонгированного действия заключается в обеспечении более продолжительного фармакологического действия после введения лекарственного вещества, нежели фармакологическое действие, наблюдающееся после введения лекарственных форм быстрого действия. Применение фармацевтических препаратов пролонгированного действия, содержащих относительно большие количества фармацевтически активного соединения, в которых высвобождение соединения контролируется и регулируется в течение более продолжительного периода времени (как правило, 2-16 часов), гарантирует, что пациенту следует реже давать лекарственный препарат и что достигается более высокая податливость (степень согласия с режимом) пациентов.
Более продолжительное выделение (высвобождение) и сопутствующее пролонгированное действие активных соединений, гарантированное фармацевтическими препаратами пролонгированного действия, дает, кроме того, множество преимуществ при лечении, которые нельзя достичь с помощью соответствующих препаратов мгновенного действия. Лечение с применением фармацевтических препаратов пролонгированного действия может продолжаться, например, ночью, при этом нет необходимости нарушать сон больного. Это имеет значение, например, при лечении больных эпилепсией, где таким образом можно предотвратить ночные приступы. До некоторой степени у больных, страдающих хроническими болями, не нарушается сон.
С медико-фармакологической точки зрения одним из преимуществ препаратов пролонгированного действия является совершенно равномерная концентрация активного соединения в крови, что дает пролонгированное действие и уменьшение побочных эффектов. Уменьшение побочных эффектов играет решающую роль, например, при использовании опиоидов в лечении боли. Побочные эффекты, вызванные опиоидами, создают, помимо прочего, опасность развития аддикции. Так как аддиктивный потенциал активного соединения определяется не самим соединением, но скорее способом применения и обусловленной им фармако-динамикой (например, скоростью, с которой активное соединение проникает в мозг), пролонгированное выделение опиоидного анальгетика может уменьшить аддиктивный потенциал этих активных соединений (Nolte, Т.: STK-Zeitschrift fur angewandte Scmerztherapie, 2001, Vol.2).
Так как препараты пролонгированного действия позволяют создать равномерную высокую концентрацию активного вещества в крови, повышается биодоступность активного соединения. Биодоступность активного соединения определяется множеством факторов. Такие факторы включают концентрацию активного соединения в соответствующей биологической жидкости (например, в крови), всасываемость активного соединения мембранами (например, при реабсорбции в желудочно- кишечном тракте) и доступность активного соединения в нужном месте ткани.
Для того, чтобы всасываться, например, в кишечнике, активное соединение должно находиться в растворе. Время, требующееся для того, чтобы активное соединение, в данной пропорции присутствующее в стандартной дозе фармацевтического препарата, растворилось в соответствующей физиологической жидкости, называется время растворения, а также время выделения (высвобождения) или скорость выделения. Время растворения активного соединения определяется методом испытания в стандартизованных условиях как доля активного вещества, высвободившегося из стандартной дозы за конкретное время. Физиологическая жидкость, в которой определяют время растворения активного вещества, может быть, например, жидкостью из желудочно-кишечного тракта. В современной технике известны многие методики испытания для измерения времени растворения фармацевтических композиций (и соответственно скоростей выделения активных соединений), и эти методики испытания широко описаны в официальной фармакопее.
Среди различных факторов, влияющих на время растворения фармацевтических композиций, и, следовательно, на скорости выделения активных соединений площадь поверхности фармацевтической композиции, доступной для растворяющей среды (среды с растворителем) для растворения, рН растворяющей среды для растворения, растворимость активного соединения в растворяющей среде для растворения и концентрация насыщения растворенных материалов в растворяющей среде для растворения.
Несмотря на множество факторов, которые влияют на растворение активного соединения в растворяющей среде, а также на всасывание активного соединения, установлена строгая корреляция между in vitro временем растворения, определенным для фармацевтического препарата, и in vivo биодоступностью активного соединения. Эта корреляция так четко установлена, что время растворения (скорость выделения активного соединения) рассматривается как общепринятый критерий биодоступности активного соединения фармацевтического препарата. С учетом этой корреляции становится ясно, что скорость выделения, определяемая для активного соединения фармацевтического препарата, является одной из важных фундаментальных характеристик, которые следует принимать во внимание при оценке препаратов пролонгированного действия.
Из предыдущей техники известны различные методы (подходы), которые позволяют получать препараты пролонгированного действия. Эти методы (подходы), имеющие общее, а именно активное соединение, объединяют с добавками, получая оформленные объекты, такие как таблетки или драже, при этом добавки создают барьер, замедляющий высвобождение или растворение активного соединения. В зависимости от природы барьеров, замедляющих высвобождение, можно разделить методы пролонгированного действия. Существуют, например, осмотические системы, системы, замедление в которых достигается за счет покрытия, или системы, в которых активные соединения наносятся на воски, полиметакрилаты, гелеобразующие вещества или кремниевые кислоты. Кроме того, существуют так называемые "матриксные" формы, формы в виде матриц, которые имеют основополагающее значение при приготовлении препаратов пролонгированного действия. Матрица обозначает оформленный объект, содержащий активное соединение, связанное с добавками, которые являются, насколько это возможно, инертными. В зависимости от типа матрицы можно различать набухающие и ненабухающие матрицы. Кроме того, матрицы различаются в зависимости от того, высвобождается ли активное соединение за счет чистой диффузии или за счет эрозии матрицы (U.Schöffling, Arzneiformenlehre, 1998, 3rd edition, Deutscher Apoteker-Verlag, Stuttgart).
Добавки, применяемые для приготовления фармацевтических препаратов пролонгированного действия, часто вызывают проблемы, связанные со стабильностью фармацевтического препарата после продолжительного хранения. Например, показано, что воски претерпевают изменения, так что следует предпринимать усиленные меры предосторожности даже во время приготовления, чтобы предупредить изменения во время хранения. Если для замедления высвобождения применяют пленочное покрытие, состоящее из полимеров, полученных из водных дисперсий, эти фармацевтические препараты также часто создают проблемы, связанные со стабильностью при хранении.
Известны фармацевтические препараты пролонгированного действия с так называемым контролируемым (регулируемым) высвобождением фармацевтически активного соединения, т.е. высвобождение активного соединения является не только пролонгированным, но, кроме того, скорость высвобождения можно доводить до предетерминированного значения. В зависимости от того, какие полимеры (гидроксиалкилцеллюлозы, полиметакрилаты или, например, алкилцеллюлозы) применяют для получения, например, иммобилизованных на матрице фармацевтических препаратов пролонгированного действия с контролируемым высвобождением, могут отличаться свойства соответствующих фармацевтически активных соединений при высвобождении, причем свойства активного соединения часто бывает трудно предсказать.
Как правило, следует обеспечить, чтобы фармацевтические препараты данной фармацевтической композиции высвобождали соответствующее соединение всегда с воспроизводимыми равными скоростями или профилями высвобождения, даже если композиция содержит различные абсолютные количества активных соединений. Однако, вследствие проблем с устойчивостью (стабильностью), вызываемых компонентами, отвечающими за пролонгированное высвобождение, это не является гарантированным.
Существует большое количество препаратов пролонгированного действия с различным терапевтическим действием, которые часто содержат только одно активное соединение. Медицинский препарат Oxygesic®, который применяют в терапии для лечения боли, содержит, например, оксикодон в качестве единственного анальгетически активного компонента. Препарат Kapanol®, который также применяют для лечения боли, содержит морфинсульфат в качестве анальгетически активного соединения.
Так как длительное применение опиоидных анальгетиков, таких как оксикодон, может сопровождаться появлением (развитием) побочных эффектов, таких как ослабление дыхания и стойкий запор, может возникнуть необходимость в одновременном лечении больных опиоидными антагонистами, которые специфически противодействуют вызванным опиоидами побочным эффектам. Если больных, ищущих избавления от боли, лечить препаратами, содержащими опиоидный анальгетик, то для противодействия вышеуказанным побочным эффектам может быть желательным одновременное лечение препаратами, содержащими антагонисты, такие как налтрексон или налоксон. Если содержащий опиоид препарат является препаратом пролонгированного действия, препарат, содержащий антагонист, также должен обеспечивать пролонгированное высвобождение, так как иначе нельзя эффективно подавить появление побочных эффектов. Однако препараты пролонгированного действия, например налоксона, не выпускаются.
Следовательно, при лечении различных симптомов существует общая стратегия противодействия побочным эффектам, вызванным активным соединением, с помощью одновременного применения другого соединения, которое селективно уменьшает эти побочные эффекты. Если, например, опиоидные анальгетики применяются в лечении боли, помимо опасности уже упоминавшегося развития зависимости и аддикции могут проявиться такие побочные эффекты, как стойкий запор и ослабление дыхания. Поэтому делались различные попытки ликвидировать или, по меньшей мере, значительно уменьшить аддиктивный потенциал и потенциал привыкания опиоидных анальгетиков, так же как их побочные эффекты, с помощью одновременного приема антагонистов, которые противостоят действию опиоидного анальгетика.
В связи со значительными преимуществами, которые имеют такие комбинированные препараты, и вследствие вышеупомянутых общих преимуществ фармацевтических препаратов пролонгированного действия существует настоятельная потребность в таких комбинированных препаратах пролонгированного действия. Комбинированные препараты пролонгированного действия должны идеальным образом объединить в себе положительные, синергистические эффекты различных активных соединений длительного высвобождения и, следовательно, увеличить период эффективного действия.
Один пример такого комбинированного препарата, который высвобождает в течение длительного времени несколько соединений, является Valoron® от Gödecke, который содержит тилидин в качестве анальгетически активного соединения и налоксон в качестве антагониста.
Однако одна проблема, с которой часто встречаются в комбинированных препаратах, состоит в том, что активные соединения различного химического строения и с различными физическими свойствами должны быть объединены в одной матрице. Такая комбинация обычно дает различные профили высвобождения для обоих соединений. Однако с медицинской точки зрения может быть в высшей степени желательным высвобождение обоих соединений с одинаковыми профилями. Кроме того, может быть предпочтительным, чтобы оба соединения высвобождались из одной и той же матрицы, так как в этом случае можно получать, например, таблетки, которые могут расщепляться. Такие таблетки применимы для индивидуального приема, и процесс производства таких препаратов может быть значительно упрощен. Другой аспект заключается в том, что когда присутствует несколько соединений различной структуры, стабильность этих соединений в матрице при продолжительном хранении может отличаться. Кроме того, изменение количества одного соединения в таких комбинированных препаратах может непредсказуемым образом изменить профиль высвобождения других соединений, что приводит в результате к значительным расходам при производстве препаратов, содержащих различные количества активных соединений, так как нельзя делать вывод о поведении одного препарата при высвобождении на основании свойств при высвобождении другого препарата.
Как правило, медицинские препараты следует готовить таким образом, чтобы активные соединения были стабильны в стандартных условиях хранения как можно более длительное время. Медицинские препараты также следует готовить таким образом, чтобы предполагаемые профили высвобождения активных соединений не менялись при длительном хранении.
Следует также обеспечить, чтобы профиль высвобождения одного активного соединения данного препарата пролонгированного действия не менялся в зависимости от количества активного соединения. Это требование относится как к случаю, когда в фармацевтическом препарате присутствует единственное соединение, так и к случаю, когда в нем присутствует несколько соединений.
Кроме того (также в случае комбинации активных соединений), профиль высвобождения каждого единичного соединения в случае необходимости должен выбираться. Измерения, которые проводятся, чтобы достичь этой цели, не должны мешать профилям высвобождения дополнительных активных соединений или даже затруднять их, например, в случае комбинации различных активных соединений, выбранных в случае необходимости. Следовательно, не должно быть взаимозависимости профилей высвобождения.
При различных применениях в терапии существует насущная потребность в комбинированных препаратах. В частности, требуются комбинированные препараты для лечения боли, состоящие из опиоидных анальгетиков и соответствующих антагонистов, причем соответствующие фармацевтические препараты должны высвобождать оба соединения продолжительное время и также иметь вышеупомянутые свойства. Препараты в матрице, которые обеспечивают пролонгированное действие активных соединений, в целом, и опиоидных анальгетиков и их антагонистов, в частности, и которые обладают вышеуказанными свойствами, в предыдущем уровне техники не известны.
Патентная заявка ФРГ DE 4325465 A1 относится к лечению побочных эффектов при терапии боли с помощью препарата, состоящего из опиоидного агониста и антагониста. Характерным признаком этой заявки является то, что антагонист может высвобождаться не пролонгированным образом, тогда как агонист должен обладать пролонгированным действием.
Международная патентная заявка WO 99/32120 также относится к препарату, содержащему опиоидный анальгетик и антагонист. Согласно этой заявке оба эти соединения должны высвобождаться пролонгированным образом. Однако стабильность при хранении и взаимная зависимость профилей высвобождения соединений не является предметом изобретения в этой заявке.
Вышеупомянутый препарат Valoron® представляет собой комбинацию тилидин/налоксон. Согласно данным производителя это препарат, из которого оба активных соединения высвобождаются пролонгированно. Применяемая матрица содержит релевантную часть набухающего в воде материала (гидроксипролилметилцеллюлозы (НРМС)) и, следовательно, должна рассматриваться как набухающая (и, возможно, частично эрозионная) диффузионная матрица. Недостатком этой известной рецептуры является то, что тилидин и налоксон, при идентичном массовом соотношении, но с различными абсолютными значениями дают различные профили высвобождения, если высвобождение измеряется при определенных значения рН. Скорости высвобождения агониста и антагониста не являются независимыми друг от друга, что, вероятно, связано с используемой рецептурой пролонгированного действия. Следовательно, врачу необходимо проводить интенсивные эксперименты по определению титра для каждого индивидуального пациента, если он хочет увеличить дозу, даже если он не меняет массовое соотношение тилидин: наксолон, так как он не может быть уверен, что профили высвобождения обоих компонентов остаются постоянными. Следовательно, интервал терапевтически применимых количеств анальгетика, пригодных для врача, ограничен.
Одной из целей настоящего изобретения является создание рецептур для фармацевтических препаратов, которые гарантируют, что активные соединения высвобождаются из препаратов пролонгированным образом, которые стабильны при длительном хранении и в которых высвобождение одного соединения не изменяется, даже если используются различные количества активного соединения. Другой целью изобретения является создание рецептур фармацевтических препаратов, которые проявляют вышеуказанные свойства и в которых не наблюдается взаимная зависимость профилей высвобождения активных соединений.
Другой целью настоящего изобретения является создание методов получения фармацевтических препаратов, содержащих, по меньшей мере, одно фармацевтически активное соединение и из которого соединения высвобождаются пролонгированным, воспроизводимо инвариантным и, в случае присутствия нескольких соединений, независимым образом. Такие препараты должны оставаться стабильными даже при длительном хранении.
Конкретной целью настоящего изобретения является получение составов для фармацевтических препаратов, которые содержат опиоидный антагонист налоксон, в которых активное соединение устойчиво при длительном хранении и высвобождается из препарата пролонгированным и воспроизводимо инвариантным способом. Препараты, которые отвечают этому требованию, не известны в предыдущем уровне техники.
Дополнительной целью настоящего изобретения является приготовление составов для фармацевтических препаратов для лечения боли, содержащих, по меньшей мере, один опиоидный анальгетик и, по меньшей мере, один антагонист, действие которого противоположно действию опиоидного анальгетика (противодействие), при этом состав устойчив при длительном хранении, и активные соединения высвобождаются из препарата независимо друг от друга пролонгированньм и воспроизводимо инвариантным образом.
В соответствии с изобретением указанные цели достигаются с помощью создания фармацевтической рецептуры, содержащей, по меньшей мере, одно фармацевтически активное соединение в практически не набухающей диффузионной матрице, причем матрицу получают, в зависимости от основных характеристик высвобождения, на основе этилцеллюлозы и, по меньшей мере, одного жирного спирта.
Неожиданно было обнаружено, что только рецептуры, содержащие (практически) не набухающую диффузионную матрицу на основе этилцеллюлозы и, по меньшей мере, одного жирного спирта, обеспечивают пролонгированное, инвариантное и, если присутствует несколько активных веществ, независимое высвобождение активных соединений.
Препарат на матрице по изобретению, который стабилен при хранении в течение длительного времени, неизменно гарантирует, что активные соединения всегда высвобождаются в предетерминированном процентном соотношении и что скорости высвобождения не влияют друг на друга. В комбинированных препаратах, которые содержат, например, опиоидные анальгетики и соответствующие антагонисты, предотвращается неправильное поведение препаратов, которое предполагает, что агонист может селективно извлекаться из рецептуры.
Состав препарата по данному изобретению блокирует селективную экстракцию агониста из препарата без соответствующего количества антагониста, независимо от того, какое абсолютное и относительное количество агониста и антагониста выбрано. Кроме того, такие препараты уменьшают побочные эффекты, обычно наблюдаемые при применении опиоидов. Так как активные соединения высвобождаются из одной и той же матрицы, становится возможным более простой и более эффективный способ получения. Это также применимо для комбинированных препаратов, содержащих другие соединения, нежели опиоидные анальгетики и их антагонисты. Кроме того, рецептура препарата по изобретению гарантирует, что при идентичных относительных количествах активные соединения дают одинаковые профили высвобождения вне зависимости от имеющегося абсолютного количества. Такое независимое поведение при высвобождении позволяет врачу оперировать в широком интервале применяемых абсолютных количеств активных соединений, причем оптимальное соотношение соединений (например, соотношение опиоидный агонист/антагонист) известно. Таким образом, можно просто корректировать дозировку для каждого индивидуального пациента, либо постепенно увеличивая дозу, или, при необходимости, постепенно повышая дозировку. Эта возможность корректировать дозировку для индивидуального пациента чрезвычайно удобна с медицинской точки зрения, так как она позволяет усовершенствовать схему приема.
Рецептуры по изобретению также позволяют получать фармацевтические препараты, которые высвобождают активные соединения различной структуры с одинаковыми профилями.
Так как предетерминированное высвобождение активных соединений из рецептур по изобретению не изменяется вне зависимости от количества и числа соединений и происходит из одной и той же матрицы, то когда установлена комбинация активных соединений, препараты с различными количествами активного соединения можно получать без значительных технических трудностей и можно получать соответствующие препараты для различных терапевтически релевантных областей.
Характерными признаками настоящего изобретения является пролонгированное, инвариантное и, если присутствует несколько активных соединений, независимое высвобождение активных соединений из не набухающей (по меньшей мере, в той степени, в которой она релевантна для высвобождения) диффузионной матрицы, при этом матрица детерминирована в отношении основных характеристик высвобождения этилцеллюлозой и, по меньшей мере, одним жирным спиртом и активными соединениями, устойчивыми при длительном хранении.
Согласно настоящему изобретению "пролонгированное" или "контролируемое пролонгированное высвобождение (выделение, действие)" или замедление означает, что фармацевтически активные вещества высвобождаются из медицинского препарата в течение более длительного времени, нежели в случае известных препаратов немедленного действия. Предпочтительно, чтобы высвобождение происходило в течение двух - двадцати четырех часов, двух - двадцати часов, особенно предпочтительно, в течение двух - шестнадцати часов или двух - двенадцати часов, при этом технические характеристики должны соответствовать законным требованиям.
В контексте настоящего изобретения "пролонгированное действие" не означает, что активные соединения высвобождаются из рецептуры или медицинского препарата в зависимости от рН. Согласно изобретению термин "пролонгированное действие (высвобождение)" относится к высвобождению активных соединений из препарата в течение продолжительного периода времени. Он не подразумевает контролируемое высвобождение в определенном месте; следовательно, он не означает, что активные соединения высвобождаются только в желудке или только в кишечнике. Соответственно, высвобождение активных соединений из рецептур по изобретению, предпочтительно, происходит независимо от рН.
(Конечно, рН - зависимое высвобождение в определенном месте может быть достигнуто, например, с помощью энтеросолюбильного покрытия препарата, хотя в данном случае это, по-видимому, не является благоприятным.)
Согласно изобретению "независимое высвобождение (действие)" означает, что при наличии, по меньшей мере, двух активных соединений изменение абсолютного количества одного соединения не влияет на профили высвобождения других соединений, таким образом, профили других соединений не меняются. Для рецептур по изобретению такой характеристикой независимого высвобождения является независимость от величины рН, при которой определяют высвобождение, или от процесса получения. РН-независимость особенно применима к интервалу кислых значений рН, т.е. к рН<7. Профиль высвобождения (или поведение, характеристика, свойства высвобождения) определяется как изменение высвобождения активного соединения из рецептуры во времени, причем высвобождаемое количество каждого активного соединения выражается в процентах от общего количества активного соединения. Профиль высвобождения определяют известными методами испытания.
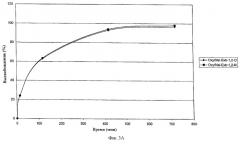
Конкретно это означает, что, например, профиль высвобождения оксикодона, наблюдаемый для комбинации оксикодон/налоксон, содержащий 12 миллиграмм оксикодона и 4 миллиграмма налоксона, не изменяется, если соответствующий препарат той же рецептуры содержит 12 миллиграмм оксикодона, но 6 миллиграмм налоксона.
Характеристика независимого высвобождения, предпочтительно, относится к ситуации, когда сравнивают профили высвобождения препаратов практически (в основном) равного состава. Препараты практически равного состава содержат различные количества активных соединений, но в основном остаются одинаковыми в отношении компонентов композиции, которые практически влияют на характеристики высвобождения.
Если, например, сравнивать два вышеуказанных препарата (первый препарат содержит 12 мг оксикодона и 4 мг налоксона, а второй препарат содержит 12 мг оксикодона и 6 мг налоксона), оба препарата, при условии что они имеют одинаковый общий вес, дадут одинаковый профиль высвобождения для оксикодона и налоксона, если разницу в количестве налоксона заменить компонентом в рецептуре, который, как правило, не влияет на особенности (характеристики) высвобождения.
Специалист в данной области техники хорошо понимает, что если разницу в количестве активного соединения в двух препаратах заменить веществом, которое оказывает существенное влияние на особенности высвобождения из состава, таким как этилцеллюлоза или жирный спирт, могут возникнуть различия в особенностях (характеристиках) высвобождения. Поэтому характеристика независимого высвобождения применяется к составам, которые содержат разные количества активных соединений, но идентичны или, по меньшей мере, в высшей степени сходны в том, что касается компонентов, которые существенно влияют на особенности высвобождения (свойства при высвобождении).
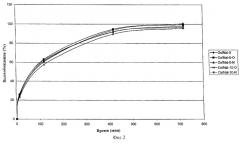
Согласно изобретению "ивариантные особенности высвобождения" или "инвариантный профиль высвобождения" определяется таким образом, что процентное содержание абсолютного количества каждого активного соединения, высвобождающегося в единицу времени, не изменяется значительно и остается практически постоянным (и, следовательно, практически не изменяется), если абсолютные количества изменяются. Довольно (практически) постоянное процентное содержание означает, что процент высвобождающегося в единицу времени вещества отклоняется от среднего значения не более чем на 20%, предпочтительно, не более чем на 15% и, наиболее предпочтительно, не более чем на 10%. Среднее значение рассчитывают из шести измерений профиля высвобождения. Конечно, количество, высвободившееся за единицу времени, должно удовлетворять законным и нормативным требованиям.
Конкретно, это означает, что в случае комбинации оксикодон/налоксон, содержащей 12 мг оксикодона и 4 мг налоксона, в течение первых 4 часов высвобождается 25% оксикодона и 20% налоксона. Если вместо этого комбинация оксикодон/налоксон содержит 24 мг оксикодона и 8 мг налоксона, в течение первых 4 часов также высвобождается 25% оксикодона и 20% налоксона. В обоих случаях девиация будет составлять не более 20% от среднего значения (которое в данном случае составляет 25% оксикодона и 20% налоксона).
Как в общих чертах излагается об особенностях независимого высвобождения, особенность (характеристика) инвариантного высвобождения относится к ситуации, когда сравниваются препараты практически (в основном) одинакового состава. Такие препараты отличаются по количеству активных веществ, но имеют одинаковый или, по меньшей мере, в высшей степени близкий состав компонентов препарата, влияющих на высвобождение. Как правило, разницу в количестве активного соединения заменяют количеством фармацевтически инертного эксципиента, который практически не влияет на особенности (характеристики) высвобождения из препарата. Таким фармацевтическим эксципиентом может быть лактоза, которая является типичным наполнителем в фармацевтических препаратах. Специалист в данной области техники хорошо знает, что инвариантное высвобождение не может относиться к препаратам, в которых разницу в количестве активного соединения заменяют веществами, о которых известно, что они оказывают существенное влияние на особенности высвобождения из состава, такие как этилцеллюлоза или жирный спирт
В разделе "Примеры" показано, что если один препарат содержит 20 мг оксикодона и 1 мг налоксона или 20 мг оксикодона и 10 мг налоксона, при этом разница в количестве налоксона заменена лактозой, то два препарата идентичного веса дают одинаковые профили высвобождения, так что они проявляют пролонгированное, инвариантное и независимое поведение.
Согласно изобретению выражение "устойчив при хранении" или "устойчивость при хранении" означает, что при хранении в стандартных условиях (по меньшей мере, два года при комнатной температуре и обычной влажности) девиация количеств активных соединений в медицинском препарате от начальных количеств не выше значений, приведенных в описании или в руководствах обычной Фармакопеи. Согласно изобретению стабильность при хранении также означает, что препарат, полученный по изобретению, может храниться в стандартных условиях (60% относительная влажность, 25°С) как требуется для признания на рынке.
Согласно изобретению "стабильный при хранении" или "стабильный во времени" также означает, что после хранения в стандартных условиях профили высвобождения активных соединений такие же, как если бы эти препараты использовали сразу же, без всякого хранения. Согласно изобретению приемлемые флуктуации профиля высвобождения характеризуются тем, что количество, высвобождаемое в единицу времени, отличается не более чем на 20%, предпочтительно, не более чем на 15%, и особенно предпочтительно, не более чем на 10% относительно среднего значения. Среднее значение вычисляют из шести измерений профиля высвобождения.
Термин "стабильный при хранении" относится к активному соединению, а также к другим компонентам, входящим в состав формулы по изобретению, и, следовательно, к рецептуре в целом.
Предпочтительно, высвобождение активных соединений из рецептур пролонгированного действия определяют Баскет-методом (Basket) в соответствии с USP при рН 1.2 или рН 6.5 с помощью ВЭЖХ.
Устойчивость (стабильность) при хранении, предпочтительно, определяют Баскет-методом (Basket) в соответствии с USP при рН 1.2 с помощью ВЭЖХ.
Согласно изобретению термин "рецептура, состав" относится к составу фармацевтически активного вещества с добавками (вспомогательными веществами), способствующими оптимальному высвобождению, распределению и созданию активности активного соединения для применения в соответствующих целях.
Согласно изобретению выражения "не набухающая" и "практически не набухающая" диффузионная матрица обозначают препарат в матрице, в котором на набухание матрицы не оказывает влияния (или, по меньшей мере, оказывает влияние не в релевантной степени) высвобождение активных соединений (в особенности в физиологических жидкостях релевантных сайтов-мишеней в организме больного).
Согласно изобретению термин "практически не набухающая" диффузионная матрица также относится к матрице, объем которой увеличивается, примерно, на 300%, предпочтительно, примерно, на 200%, более предпочтительно, примерно, на 100%, примерно, на 75% или, примерно, на 50%, еще более предпочтительно, примерно, на 30% или, примерно, на 20% и наиболее предпочтительно, примерно на 15%, примерно, на 10%, примерно, на 5% или, примерно, на 1% (и в особенности в физиологических жидкостях релевантных сайтов-мишеней в организме больного).
В настоящее время неожиданно обнаружено, что рецептуры медицинских препаратов с практически не набухающими диффузионными матрицами делают возможным пролонгированное, инвариантное и, в тех случаях, когда имеется несколько соединений, независимое высвобождение активных соединений, если диффузионная матрица содержит этилцеллюлозу в качестве вещества, образующего матрицу- каркас, и, кроме того, основные особенности высвобождения определяются этилцеллюлозой и/или, по меньшей мере, одним жирным спиртом. Помимо этого, такие рецептуры характеризуются хорошей стабильностью при хранении. При современном уровне знаний рецептуры главным образом с такими диффузионными матрицами делают возможным высвобождение активных соединений вышеуказанным способом по изобретению. Рецептуры с (практически) набухающей диффузионной матрицей или эрозионной матрицей в настоящее время не рассматриваются как подходящие для этой цели.
Следовательно, набухающие в воде вещества и в особенности набухающие в воде полимеры, как правило, нельзя использовать в качестве каркасообразующих веществ при получении матриц для составов по данному изобретению. В частности, такие обычные матрицеобразующие полимеры, как поливинилпирролидон, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксиметилцеллюлоза, поли(виниловые спирты), альгинаты, гидратированная гидроксиалкилцеллюлоза и простой эфир гидроксипропилметилцеллюлозы, в настоящее время рассматриваются как неподходящие для получения рецептур по данному изобретению.
Каркасообразующие вещества, которые могут образовывать не набухающие диффузионные матрицы, можно использовать для получения препаратов по данному изобретению, если они обеспечивают особенности высвобождения активного вещества в соответствии с данным изобретением, т.е., пролонгированное, инвариантное и, в случае наличия нескольких компонентов, независимое высвобождение, а также стабильность при хранении препарата. Нерастворимые в воде полимеры, которые обычно применяют для получения фармацевтических препаратов пролонгированного действия на матрице, также нельзя непосредственно применять для получения рецептур по данному изобретению. Обычные каркасообразующие вещества, такие как сополимеры акриловой и метакриловой кислот, сополимеры метилметакрилата, сополимеры этоксиэтилметакрилата, сополимеры цианоэтилметакрилата, аминоалкилметакрилата, поли(акриловая кислота), поли(метакриловая кислота), полиметакрилаты, сополимеры ло