Производное 14-гидроксинорморфинона, производное морфинона, производное морфина, способы получения производного 14-гидроксинорморфинона, производное морфинона, нороксиморфона
Иллюстрации
Показать всеИзобретение относится к соединениям, а именно к производному 14-гидроксинорморфинона формулы IV, производному морфинона формулы III, производному морфина формулы II
, , ,
где R1 представляет собой (С1-С7)алкил; и R2 представляет собой бензил или бензил, замещенный одной или несколькими (С1-С6)алкоксигруппами, или бензил, замещенный одним или несколькими галогенами. Также изобретение относится к способу получения производного 14-гидроксинорморфинона формулы IV, включающему взаимодействие соединения формулы III с оксидантом кобальтом (II) в присутствии слабого основания и воздуха или кислорода в качестве сооксиданта; к способу получения производного морфинона формулы III, включающему взаимодействие производного морфина формулы II с окислителем, эффективным для окисления аллильных гидроксигрупп. Главным образом, изобретение относится к способу получения нороксиморфона. Процесс включает окисление производного морфинона формулы III до производного 14-гидроксинорморфинона формулы IV, снятие защиты с положения 3 и восстановление двойной связи в положении 7, 8 производного 14-гидроксинорморфинона формулы IV с получением производного 3,14-гидроксинорморфинона формулы V и гидролиз производного 3,14-гидроксинорморфинона формулы V с получением нороксиморфона формулы VI. Технический результат - получение нороксиморфона с использованием новых промежуточных соединений. 6 н. и 19 з.п. ф-лы.
Реферат
Данное изобретение относится к способу получения производных 14-гидроксинорморфинона, к новому синтетическому направлению получения нороксиморфона, а также к новым промежуточным соединениям указанного направления.
Нороксиморфон является ключевым промежуточным соединением для получения важных лекарственных опиоидов, таких как налтрексон и налоксон. Общим исходным материалом для получения указанных опиоидов является тебаин, из которого они могут быть легко синтезированы. Однако тебаин в естественном виде содержится в небольших количествах только в головках мака и опии. Поскольку поставки тебаина ограничены, а потребность в нем увеличивается, разрабатывались многие альтернативные подходы для получения производных 14-гидроксиморфина. См., к примеру, ЕР 0158476, US 5922876, а также приведенные в данном описании ссылки.
Кроме того, в попытке удовлетворить потребность в тебаине (его получении) Coop et al. (Tetrahedron 55 (1999), 11429-11436; WO 00/66588) недавно описали окислительный способ получения 14-гидроксикодеинона из кодеинона с выходом 51% и применением Со(ОАс)3 в качестве металлического оксиданта в уксусной кислоте при комнатной температуре. Согласно Соор, другие окислительные условия для металлических оксидантов, таких как Со(ОАс)3, при других условиях, FeCl3, Со(ОАс)2 в сочетании с несколькими сооксидантами, RuO4, Mn(OAc)3, Cu(OAc)2 и пр., оказались не очень подходящими.
Неожиданно и несмотря на разработку Соор было обнаружено, что при получении производных 14-гидроксинорморфинона формулы IV из соединений формулы III в качестве эффективных оксидантов могут быть использованы соли кобальта (II) в том случае, когда взаимодействие осуществляют в присутствии слабого основания, а в качестве сооксиданта применяют кислород или воздух. Следовательно, данное изобретение относится к способу получения производных 14-гидроксинорморфинона формулы IV
включающему взаимодействие соединения формулы III
с оксидантом кобальтом (II) в присутствии слабого основания и воздуха или кислорода в качестве кооксиданта;
где R1 представляет собой (1-7С)алкил, необязательно замещенный одним или несколькими атомами хлора (такой как 1,1,1-трихлорэтил), бутенил, винил, бензил, фенил или нафтил;
R2 представляет собой бензил или бензил, замещенный одной или несколькими (1-6С)алкоксигруппами, или бензил, замещенный одним или несколькими галогенами.
Способ окисления в соответствии с настоящим изобретением представляет собой эффективный способ с высоким выходом, существенно улучшенным по сравнению со способом, описанным Coop et al.
Оксидант кобальт (II) в соответствии с настоящим изобретением может быть выбран из ряда солей кобальта (II), таких как CoF2, CoCl2, CoBr2, Co(II)сульфат, Со(II)нитрат, Со(II)ацетат, Со(II)пропионат и т.п., и их смесей. Предпочтительным оксидантом в способе в соответствии с данным изобретением является Со(ОАс)2, и предпочтительным сооксидантом является воздух. Реакционная смесь в соответствии с данным способом окисления представляет собой гетерогенную систему; оксидант растворяется только в небольших количествах в применяемом органическом растворителе. Используемое количество солей кобальта (II) не имеет критического значения, пока система является гетерогенной, и специалисту в данной области известно, как выбирать их достаточное количество. Сооксидант вводят в реакционную смесь, барботируя его через раствор при перемешивании.
Специалисту в данной области техники известно, какой вид оснований подразумевает термин «слабые основания», однако предпочтительными основаниями являются ацетат натрия, ацетат калия, фосфат натрия и фосфат калия. Наиболее предпочтительным является ацетат натрия.
Предпочтительно R1 представляет собой (1-7С)алкил, наиболее предпочтительным является этил. Для R2 наиболее предпочтительным является бензил.
Процесс окисления в соответствии с настоящим изобретением осуществляют в органическом растворителе, хорошо подходящем для растворения соединений такого типа, предпочтительно, (1-4С)спирты или их смеси. Предпочтительным является этанол.
Температура реакции обычно выше комнатной температуры и может быть выбрана в зависимости от температуры кипения применяемого растворителя. Однако температура не может превышать приблизительно 100°С для того, чтобы поддерживать достаточное количество кислорода в растворе.
В терминах (1-7С)алкил, (1-6С)алкокси и (1-4С)спирты алкильная группа представляет собой разветвленную или неразветвленную алкильную группу, имеющую 1-7, 1-6 или 1-4 атомов углерода, соответственно, такую как метил, этил, изопропил, трет-бутил, гептил и т.п.
Соединение формулы III может быть подходящим образом получено способами, хорошо известными в данной области техники. Предпочтительно способ получения соединения формулы III включает взаимодействие производного морфина формулы II
с любым окислителем, эффективным для окисления аллильных гидроксигрупп с образованием кетогрупп, что приводит к получению соединения морфинона формулы III. Предпочтительно окислителем является дихромат натрия. Предпочтительно R1 представляет собой этил, R2 наиболее предпочтительно представляет собой бензил.
Новый способ в соответствии с данным изобретением может быть подходящим образом использован для получения нороксиморфона. Поэтому другой аспект данного изобретения относится к способу получения нороксиморфона, включающему стадию взаимодействия, на которой соединение морфинона формулы III окисляют до производного 14-гидроксинорморфинона формулы IV. В частности, предпочтительным является способ, дополнительно включающий окисление производного морфина формулы II с получением соединения формулы III, как описано выше.
Особенно предпочтительным является способ получения нороксиморфона, включающий следующие стадии:
(а) превращение морфина, имеющего формулу I
путем взаимодействия со сложным эфиром галоформиата формулы Х-С(=О)OR1, где R1 имеет указанные ранее значения, и Х представляет собой галоген (F, Cl, Br или I, предпочтительно, Cl),
с последующим взаимодействием с R2-Х, где Х (предпочтительно, Cl) и R2 имеют указанные ранее значения, с получением производного морфина формулы II;
(b) окисление морфина формулы II с получением производного морфинона формулы III в соответствии с ранее описанным способом;
(с) окисление производного морфинона формулы III с получением производного 14-гидроксинорморфинона формулы IV в соответствии с ранее описанным способом;
(d) снятие защиты с положения 3 и (одновременно) восстановление двойной связи в положении 7,8 производного 14-гидроксинорморфинона формулы IV с получением производного 3,14-гидроксинорморфинона формулы V с применением способов, хорошо известных в данной области техники для взаимодействия такого типа, например, с применением водорода и палладия на углероде в качестве катализатора,
(е) гидролиз производного 3,14-гидроксинорморфинона формулы V с получением нороксиморфона формулы VI с применением способов, хорошо известных в данной области техники для гидролиза такого типа, например, с применением серной кислоты
В соответствии со способом получения нороксиморфона каждое из новых промежуточных соединений формул II, III и IV относится к разным аспектам настоящего изобретения. В частности, промежуточные соединения формул II, III и IV являются предпочтительными в том случае, когда R1 представляет собой этил. Также предпочтительными являются промежуточные соединения формул II, III и IV, в которых R2 представляет собой бензил. Наиболее предпочтительными являются промежуточные соединения формул II, III и IV, в которых R1 представляет собой этил, и R2 представляет собой бензил.
Далее данное изобретение проиллюстрировано следующим примером.
ПРИМЕР 1
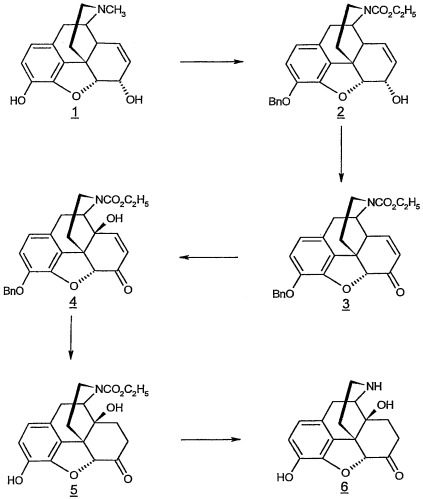
Подчеркнутые цифры относятся к цифрам структур на схеме I (Bn = бензил).
Сложный этиловый эфир (5α,6α)-3-(бензилокси)-7,8-дидегидро-4,5-эпокси-6-гидроксиморфинан-17-карбоновой кислоты (2)
Морфин (1, 8 г) растворяют в 80 мл толуола и раствор сушат азеотропной дистилляцией воды. Добавляют карбонат натрия (15 г) и бикарбонат натрия (6 г) и раствор вновь сушат азеотропной дистилляцией. Медленно и по порциям в течение приблизительно 4 часов при 78°С добавляют этилхлорформиат (30 г). Завершение реакции проверяют при помощи ТСХ. Избыток реагента и солей растворяют, добавляя воду. Слои разделяют, и слой толуола промывают водой. Раствор толуола выпаривают досуха, и остаток растворяют в 70 мл этанола. Группу сложного этилового эфира 3-карбоновой кислоты омыляют 6 г гидроксида калия (растворенного в 18 мл этанола) и 5 г карбоната калия при 55°С. Определяют рН (при 1:1 разбавлении водой), который составляет >11. К полученному основному раствору добавляют 5 г бензилхлорида и взаимодействие осуществляют в течение 4 часов при 75°С. Продукт осаждают, добавляя воду (70 мл), фильтруют, промывают водой и сушат. Выход продукта (2) составляет 10 г. 1Н ЯМР (600 МГц, CDCl3) δ 1,29 (м, 3Н), 1,92 (м, 2Н), 2,52 (с, 1Н), 2,72 (м, 2Н), 2,85 (м, 1Н), 3,01 (м, 1Н), 4,01 (м, 1Н), 4,17 (м, 3Н), 4,87 (д, 1Н), 4,89 (д, 1Н), 5,09 (д, 1Н), 5,18 (д, 1Н), 5,29 (т, 1Н), 5,72 (т, 1Н), 6,53 (д, 1Н), 6,75 (д, 1Н), 7,37 (м, 5Н).
Сложный этиловый эфир (5α)-3-(бензилокси)-7,8-дидегидро-4,5-эпокси-6-оксоморфинан-17-карбоновой кислоты (3)
Получают раствор реактива Джонса, растворяя 7,5 г дихромата натрия·2Н2О в 22 мл воды и 6 мл серной кислоты. Соединение (2) (7,5 г) растворяют в 60 мл трихлорэтилена и добавляют 28 мл воды. рН доводят до 5 с помощью серной кислоты. Смесь кипятят с обратным холодильником и медленно в течение часа добавляют реактив Джонса. Окисление продолжают еще в течение 1,5 часа при кипячении с обратным холодильником. Избыток окислителя разрушают при помощи 6 мл 2-пропанола. Слои разделяют, органический слой промывают 10% раствором бикарбоната натрия и водой и сушат сульфатом натрия. Раствор упаривают досуха и остаток растворяют в этаноле. Выход: ˜9 г продукта (3). 1Н ЯМР (200 МГц, CDCl3) δ 1,28 (м, 3Н), 1,92 (м, 2Н), 2,8 (м, 2Н), 2,9 (м, 1Н), 3,05 (м, 1Н), 4,02 (м, 1Н), 4,19 (м, 2Н), 4,72 (с, 1Н), 5,03 (м, 1Н), 5,18 (с, 2Н), 6,12 (дд, 1Н), 6,57 (д, 1Н), 6,64 (м, 1Н), 6,74 (д, 1Н), 7,34 (м, 5Н).
Сложный этиловый эфир (5α)-3-(бензилокси)-7,8-дидегидро-4,5-эпокси-14-гидрокси-6-оксоморфинан-17-карбоновой кислоты (4)
Раствор продукта (3) в этаноле (9 г в 135 мл) нагревают до 60°С, добавляют 2,6 г ацетата кобальта (II), 0,5 г ацетата натрия и при энергичном перемешивании через раствор барботируют воздух. Полученную реакционную смесь подвергают ТСХ. По завершении взаимодействия раствор обрабатывают древесным углем (0,3 г) и фильтруют. Раствор дистиллируют до нужного объема и полученный концентрированный раствор (6,3 г (4) в 53 мл этанола) переносят на следующую стадию. 1Н ЯМР 4 (360 МГц, СН3ОН-d4) δ 1,28 (м, 3Н), 1,55 (м, 1Н), 2,52 (м, 1Н), 2,74 (м, 1Н), 2,92 (м, 2Н), 4,05 (м, 1Н), 4,15 (м, 2Н), 4,64 (м, 1Н), 4,72 (с, 1Н), 4,85 (м, 1Н), 5,1 (с, 2Н), 6,05 (д, 1Н), 6,6 (д, 1Н), 6,76 (д, 1Н), 6,91 (м, 1Н), 7,3 (м, 5Н).
Сложный этиловый эфир (5α)-4,5-эпокси-3,14-дигидрокси-6-оксоморфинан-17-карбоновой кислоты (5)
К раствору с предыдущей стадии добавляют 6 мл уксусной кислоты. Продукт (4) восстанавливают, применяя водород и палладий на углероде (5%) в качестве катализатора (0,9 г), при 20°С и нормальном давлении. После фильтрации и выпаривания этанола получают 5,4 г сырого продукта (5). Продукт перекристаллизовывают из 2 частей (масс./об.) этилацетата, получая 4,7 г продукта (5).
(5α)-4,5-эпокси-3,14-дигидроксиморфинан-6-он (нороксиморфон) (6)
Продукт (5) (4,7 г) растворяют в 28 мл воды и 5,6 мл серной кислоты и кипятят с обратным холодильником в течение приблизительно 24 часов. Продукт осаждают при рН 9 путем разбавления водой и после фильтрации и сушки получают 4,6 г сырого продукта (6). Продукт подвергают очистке путем растворения его в этаноле, осаждения из указанного растворителя при рН 2, разбавления в воде, обработки древесным углем и осаждения при рН 9. 1Н ЯМР (400 МГц, DMSO-d6) δ 1,17 (м, 1Н), 1,41 (м, 1Н), 1,72 (м, 1Н), 2,07 (м, 1Н), 2,29 (м, 1Н), 2,36 (м, 1Н), 2,62 (м, 1Н), 3,9 (м, 4Н), 4,68 (с, 1Н), 6,52 (д, 1Н), 6,56 (д, 1Н).
СХЕМА 1
1. Способ получения производного 14-гидроксинорморфинона формулы IV
включающий взаимодействие соединения формулы III
с оксидантом кобальтом (II) в присутствии слабого основания и воздуха или кислорода в качестве сооксиданта в органическом растворителе при температуре не выше 100°С;
где R1 представляет собой (С1-С7)алкил; и
R2 представляет собой бензил или бензил, замещенный одной или несколькими (С1-С6)алкоксигруппами, или бензил, замещенный одним или несколькими галогенами.
2. Способ по п.1, в котором оксидант представляет собой Со(ОАс)2.
3. Способ по п.1 или 2, в котором сооксидант представляет собой кислород.
4. Способ по п.1 или 2, в котором сооксидант представляет собой воздух.
5. Способ по п.1 или 2, в котором слабое основание представляет собой ацетат натрия, ацетат калия, фосфат натрия или фосфат калия.
6. Способ по п.5, в котором слабое основание представляет собой ацетат натрия.
7. Способ по п.1 или 2, в котором R1 представляет собой (С1-С7)алкил.
8. Способ по п.7, в котором R1 представляет собой этил.
9. Способ по п.1 или 2, в котором R2 представляет собой бензил.
10. Производное 14-гидроксинорморфинона формулы IV,
где R1 представляет собой (С1-С7)алкил; и
R2 представляет собой бензил или бензил, замещенный одной или несколькими (С1-С6)алкоксигруппами, или бензил, замещенный одним или несколькими галогенами.
11. Производное 14-гидроксинорморфинона по п.10, в котором R1 представляет собой этил.
12. Производное 14-гидроксинорморфинона по п.10 или 11, в котором R2 представляет собой бензил.
13. Производное морфинона формулы III,
где R1 представляет собой (С1-С7)алкил; и
R2 представляет собой бензил или бензил, замещенный одной или несколькими (С1-С6)алкоксигруппами, или бензил, замещенный одним или несколькими галогенами.
14. Производное морфинона по п.13, в котором R1 представляет собой этил.
15. Производное морфинона по п.13 или 14, в котором R2 представляет собой бензил.
16. Способ получения соединения формулы III, включающий взаимодействие производного морфина формулы II
с окислителем, эффективным для окисления аллильных гидроксигрупп с получением кетогрупп, в результате получают соединение формулы III, как указанно в п.1, при этом R1 и R2 имеют значения, указанные в п.1.
17. Способ по п.16, в котором окислитель представляет собой дихромат натрия.
18. Способ по п.16 или 17, в котором R1 представляет собой этил.
19. Способ по п.16 или 17, в котором R2 представляет собой бензил.
20. Производное морфина формулы II
где R1 представляет собой (С1-С7)алкил; и
R2 представляет собой бензил или бензил, замещенный одной или несколькими (С1-С6)алкоксигруппами, или бензил, замещенный одним или несколькими галогенами.
21. Производное морфина по п.20, в котором R1 представляет собой этил.
22. Производное морфина по п.20 или 21, в котором R2 представляет собой бензил.
23. Способ получения нороксиморфона, включающий стадию взаимодействия, на которой производное морфинона формулы III окисляют до производного 14-гидроксинорморфинона формулы IV, как указанно в п.1; снятие защиты с положения 3 и восстановление двойной связи в положении 7, 8 производного 14-гидроксинорморфинона формулы IV с получением производного 3,14-гидроксинорморфинона формулы V
и гидролиз производного 3,14-гидроксинорморфинона формулы V с получением нороксиморфона формулы VI
24. Способ по п.23, дополнительно включающий окисление соединения формулы II, как указанно в п.16, с получением производного морфинона, имеющего формулу III, как определено в п.1.
25. Способ по п.23, в котором превращение морфина в нороксиморфон включает следующие стадии:
(а) превращение морфина, имеющего формулу I
путем взаимодействия со сложным эфиром галоформиата формулы X-C(=О)OR1, где R1 имеет указанные ранее значения, Х представляет собой галоген, с последующим взаимодействием с R2-X, где Х и R2 имеют указанные ранее значения, с получением производного морфина формулы II, как определено в п.16;
(b) окисление морфина формулы II с получением производного морфинона формулы III в соответствии со способом, описанным в п.16;
(c) окисление производного морфинона формулы III с получением производного 14-гидроксинорморфинона формулы IV в соответствии со способом, описанным в п.1;
(d) снятие защиты с положения 3 и восстановление двойной связи в положении 7, 8 производного 14-гидроксинорморфинона формулы IV с получением производного 3,14-гидроксинорморфинона формулы V
(e) гидролиз производного 3,14-гидроксинорморфинона формулы V с получением нороксиморфона формулы VI