Вариант мультисубстратной дезоксирибонуклеозидкиназы, кодирующий его мутированный полинуклеотид, экспрессирующая векторная конструкция и их применение
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано в медицине. Предложены новые мутантные формы мультисубстратной дезоксирибонуклеозидкиназы Drosophila melanogaster (Dm-dNK) с измененными по сравнению с ферментом дикого типа кинетическими свойствами, экспрессия которых в клетке обеспечивает возможность снижения летальной для клетки дозы (LD100) по меньшей мере одного используемого в качестве пролекарства нуклеозидного аналога, выбранного из группы: AZT, ara-A, ara-C, ddC, ddA и 2 CdA. Описаны кодирующие варианты Dm-dNK нуклеотидные последовательности; раскрыты включающие их векторные конструкции, способ получения мутантных форм фермента и применение новых белков и полинуклеотидов в составе фармкомпозиций. Использование настоящего изобретения позволяет повысить эффективность и избирательность действия целого ряда известных цитотоксических и противовирусных препаратов. 6 с. и 1 з.п.ф-лы, 2 ил., 2 табл.
Реферат
Область изобретения
Данное изобретение относится к новым вариантам мультисубстратных дезоксирибонуклеозидкиназ. Более конкретно, в данном изобретении предложены новые варианты дезоксирибонуклеозидкиназ, полученных от насекомых или низших позвоночных, в частности от Drosophila melanogaster, от Bombyx mori или от Xenopus laevis, новые полинуклеотиды, кодирующие варианты мультисубстратных нуклеозидкиназ, векторные конструкции, содержащие полинуклеотид, клетки-хозяева, несущие полинуклеотид или вектор, способы сенсибилизации клеток к пролекарствам, способ ингибирования патогенных агентов у теплокровных животных и фармацевтические композиции, содержащие варианты дезоксирибонуклеозидкиназ по изобретению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
ДНК (дезоксирибонуклеиновая кислота) образуется четырьмя дезоксирибонуклеозидтрифосфатами, получаемыми de novo и путем утилизации отходов метаболизма. Ключевым ферментом de novo пути является рибонуклеотидредуктаза, которая катализирует восстановление 2'-ОН группы нуклеозиддифосфатов, а ключевыми ферментами утилизации отходов метаболизма являются дезоксирибонуклеозидкиназы, которые фосфорилируют дезоксирибонуклеозиды в соответствующие дезоксирибонуклеозид-монофосфаты.
Дезоксирибонуклеозидкиназы из различных организмов различаются своей субстратной специфичностью, регуляцией генной экспрессии и клеточной локализацией. В клетках млекопитающих имеются четыре фермента с перекрывающимися специфичностями, тимидинкиназы 1 (ТК1) и 2 (ТК2), дезоксицитидинкиназа (dCK) и дезоксигуанозинкиназа (dGK), которые фосфорилируют пуриновые и пиримидиновые дезоксирибонуклеозиды. ТК1 и ТК2 являются пиримидинспецифичными и фосфорилируют дезоксиуридин (dUrd) и тимидин (dThd), a TK2 также фосфорилирует дезоксицитидин (dCyd).
dCK фосфорилирует dCyd, дезоксиаденозин (dAdo) и дезоксигуанозин (dGuo), но не dThd. dGK фосфорилирует dGuo и dAdo. TK1 является цитозольной, а ТК2 и dGK локализованы в митохондриях, хотя последние сообщения свидетельствуют также о цитоплазматической локализации ТК2.
В прокариотических клетках набор дезоксирибонуклеозидкиназ установлен не очень хорошо. Представляется, что у Е.coli присутствует только одна дезоксирибонуклеозидкиназа, которая была охарактеризована как ТК со сходством с TK1 млекопитающих. Представляется, что способность воздействовать на dCyd, dAdo и dGuo отсутствует. У Lactobacillus acidophilus, которая является дефицитной по рибонуклеотидредуктазе, четыре дезоксирибонуклеозида фосфорилируются тремя ферментами. Кроме ТК, имеющей сходство с ТК Е.coli, имеются два киназных комплекса, которые фосфорилируют dCyd, dAdo и dGuo. Комплекс I представляет собой dCK/dAK, a комплекс II представляет собой dGK/dAK.
Некоторые вирусы несут ген ТК. Вирусы герпеса имеют ТК, которая тоже может фосфорилировать dCyd, так же как и ТМР и dCMP. Герпетические киназы с относительно широкой субстратной специфичностью имеют много общих признаков с ТК2, dCK и dGK млекопитающих. В поксвирусах (poxviruses) закодирована ТК, очень похожая на TK1 млекопитающих.
До сих пор, однако, ни одна из известных вирусных, бактериальных или эукариотических дезоксирибонуклеозидкиназ не продемонстрировала фосфорилирования всех четырех дезоксирибонуклеозидов.
Недавно была выделена дезоксирибонуклеозидкиназа из Drosophila melanogaster, названная Drosophila melanogaster дезоксирибонуклеозидкиназа, Dm-dNK [Munch-Petersen В, Piskur J, and L: Four Deoxynucleoside kinase Activities from Drosophila melanogaster Are Contained within a Single Monomeric Enzyme, a New Multifunctional Deoxynucleoside Kinase; J. Biol. Chem. 1998 273 (7) 3926-3931]. Затем соответствующий ген клонировали и сверхэкспрессировали [Munch-Petersen В, Knecht W, Lenz С, L and Piskur J: Functional expression of a multi-substrate deoxyribonucleoside kinase from Drosophila melanogaster and its C-terminal deletion mutants; J. Biol. Chem. 2000 275 (9) 6673-6679].
Киназа из Drosophila обладала способностью фосфорилировать все четыре дезоксирибонуклеозида. Это резко контрастирует со всеми известными дезоксирибонуклеозидкиназами, которые обладают различными, хотя и частично перекрывающимися субстратными специфичностями.
Каталитическая скорость дезоксирибонуклеозидного фосфорилирования посредством Dm-dNK была, в зависимости от субстрата, в 4-20000 раз выше, чем известная скорость для любой из дезоксирибонуклеозидкиназ млекопитающих. Метаболизм тимидина был в 70 раз выше, чем катализируемый тимидинкиназой (ТК) вируса 1 простого герпеса (HSV1). Кроме того, Dm-dNK была способна фосфорилировать широкий круг нуклеозидных аналогов, применяемых в химиотерапии рака или для борьбы с вирусными инфекциями.
Уникальные кинетические свойства Dm-dNK делают этот фермент интересным как для биотехнологического, так и для медицинского применения.
Например, ddNTPs, используемые для секвенирования, и dNTPs, используемые для ПЦР реакций (полимеразная цепная реакция), получают путем химического синтеза с токсичными химикатами, дающего ряд побочных продуктов. Эффективный ферментативный синтез монофосфатов из (ди)-дезоксирибонуклеозидов может стать одной из ключевых стадий ферментативного получения нуклеотидов, и Dm-dNK с ее широкой допустимостью субстратов и высокими каталитическими скоростями представляется очевидным кандидатом для решения этой задачи.
Дополнительным примером является применение дезоксирибонуклеозидкиназ в качестве суицидных генов в генной терапии рака или в генетической фармако-модуляционной терапии вирусных инфекций. Основной концепцией здесь является трансдукция раковых или инфицированных вирусом клеток геном, кодирующим HSV1-TK, и последующее воздействие на них нуклеозидным аналогом. Активацию нуклеозидного аналога в цитотоксическое или противовирусное соединение делает возможной трансдуцированная киназа. Эта концепция продемонстрировала усиление эффектов цитотоксических или противовирусных аналогов в сочетании с HSV1-TK, человеческой дезоксицитидинкиназой (dCK) и человеческой дезоксигуанозинкиназой (dGK). Ключевой стадией в активации большинства нуклеозидных аналогов является превращение в монофосфат.
Следовательно, кинетические свойства ферментов, катализирующих эту стадию, важны как для эффективности, так и для селективности этих лекарственных средств, и существует необходимость в выявлении лучших ферментов для дальнейшего развития этой терапевтической концепции. Dm-dNK с ее уникальными кинетическими свойствами была предложена в качестве кандидата для этой цели [Johansson M, Van Rompay A R, Degreves В, Balzarini J and Karlsson A: Cloning and characterization of multisubstrate deoxynucleoside kinase of Drosophilla melanogaster, J. Biol. Chem. 1999 274 (34) 23814-23819; и Munch-Petersen et al.; J. Biol. Chem. 2000 275 (9) 6673-6679].
Недавно в попытке найти лучшие комбинации суицидный ген-пролекарство для генной терапии методами генной инженерии были получены мутанты HSV1-TK с улучшенной специфичностью к нуклеозидным аналогам 3'-азидо-2',3'-дидезокситимидину (Зидовудин, Retrovir®, AZT), ганцикловиру (Cytovene®, GCV) и ацикловиру (Zovirax®, ACV) путем опосредованного праймером случайного мутагенеза или перестановки семейства ДНК [Black M E, Newcomb T G, Wilson H M P and Loeb L A: Creation of drug-specific herpes simplex virus type 1 thymidine kinase mutants for gene therapy; Proc. Natl. Acad. Sci. USA 1996 93 3523529; Christians F С, Scapozza L, Crameri A, Folkers G and Stemmer W P C: Directed evolution of thymidine kinase for AZT phosphorylation using DNA family shuffling; Nat. Biotechnol. 1999 17 259-264; and Kokoris M S, Sabo P, Adman E T and Black M E: Enhancement of tumor ablation by selected HSV-1 thymidine kinase mutant; Gene Therapy 1999 6 1415-1426].
Нуклеозидные аналоги с изменениями в 2'-дезоксирибозной группировке являются важными лекарственными средствами в медицине и предшественниками нуклеотидов, часто применяемых в биотехнологии.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является получение новых вариантов дезоксирибонуклеозидкиназ с увеличенными относительными каталитическими эффективностями в отношении разных субстратов. Эта задача решается тем, что предложены новые варианты мультисубстратных дезоксирибонуклеозидкиназ.
Соответственно, в первом аспекте данного изобретения предложены выделенные мутированные полинуклеотиды, кодирующие мультисубстратные дезоксирибонуклеозидкиназные ферменты, причем мутированный полинуклеотид по сравнению с немутированным полинуклеотидом при трансформации в бактериальную или эукариотическую клетку снижает по меньшей мере в 4 раза летальную дозу (LD100) по меньшей мере одного нуклеозидного аналога.
В другом аспекте изобретения предложены выделенные варианты дезоксирибонуклеозидкиназ, кодируемые полинуклеотидом по данному изобретению.
В третьем аспекте изобретения предложены векторные конструкции, содержащие полинуклеотид по данному изобретению.
В четвертом аспекте изобретения предложены линии упаковывающих клеток, способные продуцировать инфекционный вирион, содержащий вирусный вектор по данному изобретению.
В пятом аспекте изобретения предложены клетки-хозяева, несущие мутированный полинуклеотид по изобретению или вектор по изобретению.
В шестом аспекте изобретения предложены способы сенсибилизации клеток к пролекарствам, которые включают в себя стадии, на которых указанную клетку трансфицируют полинуклеотидной последовательностью по изобретению, кодирующей фермент, который способствует превращению указанного пролекарства в (цитотоксическое) лекарственное средство; и доставляют указанное пролекарство в указанную клетку; где указанная клетка является более чувствительной к указанному (цитотоксическому) лекарственному средству, чем к указанному пролекарству.
В седьмом аспекте изобретения предложены способы ингибирования патогенных агентов у теплокровных животных, при которых указанным животным вводят мутированный полинуклеотид по изобретению или вектор по изобретению.
В восьмом аспекте изобретения предложены фармацевтические композиции, содержащие мутированный полинуклеотид по изобретению или вектор по изобретению.
В девятом аспекте изобретения предложены фармацевтические композиции, содержащие вариант фермента по изобретению и фармацевтически приемлемый носитель или разбавитель.
Другие объекты станут очевидны специалисту в данной области техники из следующего подробного описания и примеров.
ПОДРОБНОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Мутантные Полинуклеотиды
В первом аспекте в данном изобретении предложены выделенные мутированные полинуклеотиды, кодирующие дезоксирибонуклеозидкиназные ферменты насекомых и низших позвоночных.
Мутантные полинуклеотиды по изобретению включают в себя ДНК, кДНК (комплементарная ДНК) и РНК последовательности, а также антисмысловые последовательности и включают в себя природные, синтетические и целенаправленно обработанные полинуклеотиды. Мутантные полинуклеотиды по изобретению также включают в себя последовательности, которые являются вырожденными вследствие генетического кода.
При определении здесь, термин "полинуклеотид" относится к полимерной форме нуклеотидов длиной по меньшей мере 10 оснований, предпочтительно по меньшей мере 15 оснований длиной. Под "выделенным полинуклеотидом" подразумевается полинуклеотид, который не является непосредственно соприкасающимся с обеими кодирующими последовательностями, с которыми он непосредственно соприкасается (одна на 5' конце и одна на 3' конце) в природном геноме организма, из которого он получен. Этот термин, таким образом, включает в себя рекомбинантную ДНК, которая включена в вектор экспрессии, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая существует в виде отдельной молекулы, например кДНК, независимой от других последовательностей.
При определении здесь, мутантный полинуклеотид представляет собой нуклеотидную последовательность, которая отличается одним или более чем одним нуклеотидным положением по сравнению с немутированной (природной, дикого типа или родительской) нуклеотидной последовательностью. Мутированный полинуклеотид по изобретению может, в частности, содержать нуклеотидную последовательность, кодирующую вариант нуклеозидкиназы, имеющий аминокислотную последовательность, которая изменена в одном или более чем одном положении по сравнению с природным, дикого типа или родительским киназным ферментом.
В предпочтительном воплощении мутированные полинуклеотиды содержат нуклеотидную последовательность, кодирующую вариант нуклеозидкиназы, имеющий аминокислотную последовательность, которая изменена в одном или более чем одном положении, расположенном в безмотивных участках и/или только в одном мотивном участке, как определено в табл. 1 ниже.
В другом предпочтительном воплощении мутированный полинуклеотид по изобретению при трансформации в бактериальную или эукариотическую клетку способен снижать по меньшей мере в 4 раза, более предпочтительно по меньшей мере в 8 раз, наиболее предпочтительно по меньшей мере в 10 раз летальную дозу (LD100) по меньшей мере одного нуклеозидного аналога по сравнению с немутированным (дикого типа) полинуклеотидом. В более предпочтительном воплощении нуклеозидный аналог представляет собой ацикловир (9-[2-гидрокси-этокси]-метил-гуанозин), буцикловир (buciclovir), фамцикловир, ганцикловир (9-[2-гидрокси-1-(гидроксиметил)этоксил-метил]-гуанозин), пенцикловир, валцикловир, трифтортимидин, AZT (3'-азидо-3'-дезокситимидин), AIU (5'-иодо-5'-амино-2',5'-дидезоксиуридин), ara-А (аденозин-арабинозид; Vivarabine), ara-C (цитидин-арабинозид), ara-G (9-бета-D-арабинофуранозилгуанин), ara-Т, 1-бета-D-арабинофуранозилтимин, 5-этил-2'-дезоксиуридин, 5-иодо-5'-амино-2,5'-дидезоксиуридин, 1-[2-дезокси-2-фторо-бета-D-арабино-фуранозил]-5-иодоурацил, идоксуридин (5-иодо-2'-дезоксиуридин), флударабин (2-фтороаденин-9-бета-D-арабинофуранозид), генцитабин, 2',3'-дидезоксиинозин (ddl), 2',3'-дидезоксицитидин (ddC), 2',3'-дидезокситимидин (ddT), 2',3'-дидезоксиаденозин (ddA), 2',3'-дидезоксигуанозин (ddG), 2-хлоро-2'-дезоксиаденозин (2CdA), 5-фтородезоксиуридин, BVaraU ((E)-5-(2-бромовинил)-1-бета-D-арабинофуранозилурацил), BVDU (5-бромовинил-дезоксиуридин), FIAU (1-(2-дезокси-2-фторо-бета-D-арабинофуранозил)-5-иодоурацил), 3ТС (2'-дезокси-3'-тиацитидин), dFdC гемцитабин (2',2'-дифтородезоксицитидин), dFdG (2',2'-дифтородезоксигуанозин) или d4T (2',3'-дидегидро-3'-дезокситимидин).
В еще одном предпочтительном воплощении мутированный полинуклеотид по изобретению при трансформации в бактериальную или эукариотическую клетку способен снижать по меньшей мере в 4 раза, предпочтительно по меньшей мере в 8 раз, наиболее предпочтительно по меньшей мере в 10 раз летальную дозу (LD100) по меньшей мере двух разных нуклеозидных аналогов, которые основаны на двух разных сахарных группировках и двух разных группировках оснований.
В предпочтительном воплощении мутированный полинуклеотид по изобретению имеет ДНК последовательность, представленную как SEQ ID NOS:9 или 11.
Варианты ферментов
В другом аспекте в изобретении предложены по существу чистые варианты дезоксирибонуклеозидкиназ.
В контексте данного изобретения, термин "вариант фермента" относится к полипептиду (или белку), имеющему аминокислотную последовательность, которая отличается от последовательности природного, родительского фермента или фермента дикого типа по одному или более чем одному аминокислотному положению, то есть его первичная аминокислотная последовательность изменена. Такие варианты ферментов включают в себя варианты, более подробно описанные ниже, а также консервативные замены, сплайс-варианты, изоформы, гомологи из других видов и полиморфизмы.
Новые варианты ферментов по изобретению можно, в частности, получить из мутированного полинуклеотида по изобретению, используя стандартную методику рекомбинантной ДНК.
В предпочтительном воплощении варианты ферментов по изобретению получены из мультисубстратной киназы. При определении здесь термин "мультисубстратный" относится к дезоксирибонуклеозидкиназному ферменту, способному обладать возможностью фосфорилировать все четыре природных нуклеозида, dC, dA, dG и dT (Thd). Способность фосфорилировать все четыре природных нуклеозида можно определить по соотношению максимальной специфической ферментативной активности (ферментативная активность/количество фермента) для dT и для любого из этих нуклеозидов (максимальная специфическая ферментативная активность для dT/максимальная специфическая ферментативная активность для dC, dG или dA). Это соотношение предпочтительно находится в пределах от 0,01 до 100.
В предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа изменен следующим образом:
1) соотношение "Kcat/Кm(субстрат)/Кcat/Кm(нуклеозидный аналог)" (то есть соотношение между, с одной стороны, "kcat/Km" для по меньшей мере одного природного субстрата и, с другой стороны, "kcat/Km" для по меньшей мере одного нуклеозидного аналога) уменьшено по меньшей мере в 5 раз, более предпочтительно по меньшей мере в 10 раз, наиболее предпочтительно по меньшей мере в 20 раз; и/или
2) ингибирование по типу обратной связи дезоксирибонуклеозидтрифосфатом (dNTP) и, в частности, тимидинтрифосфатом (ТТР) уменьшено по меньшей мере в 1,5 раза, более предпочтительно по меньшей мере в 2 раза, при определении по его значению IC50, используя 2 или 10 мкМ тимидина (dThd) в качестве субстрата.
В предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа снижает по меньшей мере в 4 раза, предпочтительно по меньшей мере в 8 раз, наиболее предпочтительно по меньшей мере в 10 раз летальную дозу (LD100) по меньшей мере двух разных нуклеозидных аналогов, которые основаны на двух разных сахарных группировках и двух разных группировках оснований.
dNK система нумерации
В контексте данного изобретения аминокислотные остатки (а также основания нуклеиновых кислот) указаны с использованием установленных однобуквенных символов.
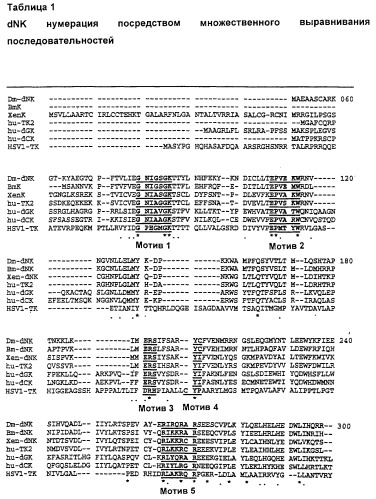
При выравнивании аминокислотных последовательностей известных дезоксирибонуклеозидкиназных ферментов можно использовать определенную систему нумерации аминокислот, при помощи которой возможно однозначно присвоить номер аминокислотного положения любому аминокислотному остатку в любом нуклеозидкиназном ферменте, аминокислотная последовательность которого известна.
Такое выравнивание представлено в табл. 1 ниже. В этой таблице первый N-концевой аминокислотный остаток (то есть метионин; М) Dm-dNK имеет номер 51, а последний С-концевой аминокислотный остаток (то есть аргинин; R) Dm-dNK имеет номер 358.
В контексте данного изобретения эта система нумерации названа dNK системой нумерации.
При описании различных вариантов ферментов, полученных или предполагаемых согласно изобретению, для простоты упоминания использовали следующую номенклатуру:
Исходная аминокислота/Положение/Замещающая аминокислота
Согласно этой номенклатуре замена аланином валина в положении 167 обозначают "V167A".
Делецию метионина в положении 51 обозначают "М51".
Вставку дополнительного аминокислотного остатка, в данном примере аргинина, например, по соседству с положением 62, можно обозначить "T62TR" или "*63R" (предполагается, что в аминокислотной последовательности, используемой для установления системы нумерации, нет никакого положения для этого положения).
Вставку аминокислотного остатка, в данном примере глутамина, в положении, которое существует в установленной системе нумерации, но где никакой аминокислотный остаток в действительности не присутствует, можно обозначить "-116Q".
В таком случае "Dm-dNK/l199M/N216S/M217V/D316N" обозначает конкретный вариант, который может быть получен из Drosophila melanogaster дезоксирибонуклеозидкиназы путем замены метионином изолейцина в положении 199, и замены серином аспарагина в положении 216, и замены валином метионина в положении 217, и замены аспарагином аспарагиновой кислоты в положении 316, причем положения определены в соответствии с табл. 1 ниже.
Другие варианты ферментов, полученные из одного или разных источников, определяют аналогичным образом.
Dm-dNK Drosophila melanogaster дезоксирибонуклеозидкиназа [Munch-Petersen B, Knecht W, Lenz C, L and Piskur J. J. Biol. Chem. 2000 275 (9) 6673-6679; GenBank ACCN AF226281;
Представлена как SEQ ID NO: 1].
Bm-dNK Bombyx mori дезоксирибонуклеозидкиназа [GenBank ACCN AF226281; Представлена как SEQ ID NO:3, получена, как описано в Примере 3].
Xen-dNK Xenopus laevis дезоксирибонуклеозидкиназа [GenBank ACCN
AF250861; Представлена как SEQ ID NO: 5, получена, как описано в Примере 3].
hu-TK2 Человеческая тимидинкиназа 2 [GenBank ACCN 000142; Johansson M & Karlsson A; J. Biol. Chem. 1997 272 (13) 8454-8458].
hu-dGK Человеческая дезоксигуанозинкиназа [GenBank ACCN Q16854; Johansson M & Karlsson A; Proc. Natl. Acad. Sci. U.S.A. 1996 93 (14) 7258-7262]
hu-dCK Человеческая дезоксицитидинкиназа [GenBank ACCN P27707; Chottiner, E. G., et al.,; Proc. Natl. Acad. Sci. U.S.A. 1991 88 (4) 1531-1535]
HSV1-TK тимидинкиназа вируса Herpes simplex [GenBank ACCN CAA23742; McKnight SL; Nucleic Acids Res. 1980 8 (24) 5949-5964]
"Мотив" означает сохраняющийся мотив аминокислот
- указывает на отсутствие (нет) аминокислоты в этом положении.
* указывает положения, где есть единичный, полностью сохраняющийся остаток.
. указывает на то, что одна из следующих "консервативных" групп полностью сохраняется:
-STA, NEQK, NHQK, NDEQ, QHRK, MILV, MILF, HY или FYW.
В другом предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа мутирован:
(1) в безмотивном и/или несохраняющемся участке; и/или
(2) только в одном мотиве и/или сохраняющемся участке; и/или
(3) в любом сохраняющемся положении.
В еще одном предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа мутирован:
(1) в безмотивном участке; и/или
(2) только в одном мотивном участке; и/или
(3) в любом сохраняющемся положении.
При определении здесь мотивный участок обозначает любые из положений, локализованные в пределах любого из пяти мотивных участков, определенных в табл. 1 выше. Безмотивный участок представляет собой любой участок, содержащий аминокислотные остатки, не принадлежащие мотивному участку, как он определен выше.
При определении здесь сохраняющиеся положения представляют собой положения и участки, содержащие аминокислотные остатки, обозначенные звездочкой (*) или точкой (.) в табл. 1. В предпочтительном воплощении сохраняющийся участок выбирают из участков, содержащих аминокислотные остатки, обозначенные только звездочкой (*), то есть содержащие один полностью сохраняющийся остаток. Несохраняющийся участок представляет собой любой участок, содержащий аминокислотные остатки, не принадлежащие сохраняющимся положениям, как они определены выше.
В другом предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа несет мутацию (включая замены, вставки и делеции) в одном или более чем одном из следующих положений: 51, 62, 82, 91, 100, 102, 107, 112, 114, 134, 138, 139, 140, 164, 167, 168, 171, 199, 202, 207, 211, 213, 214, 216, 217, 220, 222, 228, 229, 274, 277, 281, 283, 284, 307, 309, 316, 318, 321, 334, 347 и 352 (dNK нумерация).
В более предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа содержит замену, консервативную по отношению к G80, N81, I82, G83, S84, G85, К86, Т87, Т88, Е107, Р108, V109, Е110, К111, W112, Y140, Q164, Е201, R202, S203, С210, Y211, С212, Р258, R265, I266, R267, Q268, R269, А270, R271, Е274, L279, L282 или L293 (dNK нумерация).
При определении здесь термин "консервативные замены" обозначает замену аминокислотного остатка другим, биологически сходным остатком. Примеры консервативных замен включают в себя
(1) замену неполярными или гидрофобными остатками, такими как аланин, лейцин, изолейцин, валин, пролин, метионин, фенилаланин или триптофан, друг друга, в частности замену аланином, лейцином, изолейцином, валином или пролином друг друга; или
(2) замену одним нейтральным (незаряженным) полярным остатком, таким как серин, треонин, тирозин, аспарагин, глутамин или цистеин, другого остатка, в частности замену аргинином лизина, глутаминовой кислотой аспарагиновой кислоты, или глутамином аспарагина; или
(3) замену положительно заряженным остатком, таким как лизин, аргинин или гистидин, другого такого остатка; или
(4) замену отрицательно заряженным остатком, таким как аспарагиновая кислота или глутаминовая кислота, другого такого остатка.
Термин консервативная замена также включает в себя использование замещающего аминокислотного остатка вместо родительского аминокислотного остатка при условии, что антитела, вырабатываемые к замещенному полипептиду, также являются иммунореактивными в отношении незамещенного полипептида.
В еще более предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа содержит одно или более чем одно из следующих изменений М51Т; Т62А; N91D; N100D; 1102Т; N114D; N134D; N134S; L138S; M139L; M139V; V167A; V167S; V167M; Т168А; M171R; I199М; A207D; V214A; N216S; M217V; N220S; S222W; Y228C; N229S; V277A; Y281H; S307P; K309R; D316N; N318D; N321S; F334L; L347P; и K352N (dNK нумерация).
В еще более предпочтительном воплощении вариант фермента по изобретению по сравнению с ферментом дикого типа содержит следующие изменения:
M51T/T168A/N220S;
T62A/V167A/N321S;
N91D/N134D;
N100D/N134D;
N100D/N134D/N318D/L347P;
N100D/N134D/I199M/N216S/M217WD316N;
I102T/N318D;
N114D/M217V/Y281H;
N134S/L138S/M139L/K352N;
M139V/N318D/L347P;
V167A/M171R/A207D;
V167S/M171R/A207D;
V167A/I199M/N216S/M217WD316N;
V167A/N318D/L347P;
T168A/N318D/L347P;
Т168A/I199M/N216S/M217WD316N;
M171R/A207D;
I199M/V214A/N216S/M217V/D316N;
I199M/N216S/M217V/N229S/S307P/D316N;
I199M/N216S/M217V/D316N;
S222W/F334L;
Y228C/V277A/K309R; или N318D/L347Pi
(dNK нумерация).
В предпочтительном воплощении вариант фермента по изобретению получен из человеческой тимидинкиназы 2 (hu-TK2); или человеческой дезоксигуанозинкиназы (hu-dGK); или человеческой дезоксицитидинкиназы (hu-dCK); или тимидинкиназы вируса Herpes simplex (HSV1-TK).
В другом предпочтительном воплощении вариант фермента по изобретению получен от насекомого или низшего позвоночного, в частности из Drosophila melanogaster дезоксирибонуклеозидкиназы (Dm-dNK), или Bombyx mori дезоксирибонуклеозидкиназы (Bm-dNK), или Xenopus laevis дезоксирибонуклеозидкиназы (Xen-dNK), или Anopheles gambia дезоксирибонуклеозидкиназы.
В более предпочтительном воплощении вариант фермента по изобретению представляет собой
В другом предпочтительном воплощении вариант фермента по изобретению представляет собой
В третьем предпочтительном воплощении вариант фермента по изобретению представляет собой
Гибридные ферменты
В особенно предпочтительном воплощении вариант дезоксирибонуклеозидкиназ по изобретению может представлять собой гибридную дезоксирибонуклеозидкиназу, полученную из двух или более чем двух мультисубстратных дезоксирибонуклеозидкиназ насекомых.
Гибридная дезоксирибонуклеозидкиназа по изобретению должна содержать по меньшей мере 5, предпочтительно по меньшей мере 10, более предпочтительно по меньшей мере 15, еще более предпочтительно по меньшей мере 20, наиболее предпочтительно по меньшей мере 25 последовательных аминокислот, полученных из каждой мультисубстратной дезоксирибонуклеозидкиназы насекомых.
В предпочтительном воплощении гибридный киназный фермент получен из Drosophila melanogaster дезоксирибонуклеозидкиназы и/или Bombyx mori дезоксирибонуклеозидкиназы, и/или Xenopus laevis дезоксирибонуклеозидкиназы, и/или Anopheles gambia дезоксирибонуклеозидкиназы.
В более предпочтительном воплощении гибридный киназный фермент по изобретению получен из Drosophila melanogaster дезоксирибонуклеозидкиназы и Bombyx mori дезоксирибонуклеозидкиназы и содержит аминокислотную последовательность, представленную как SEQ ID NO:10, или аминокислотную последовательность, представленную как SEQ ID NO:12.
Рекомбинантные векторы
В другом аспекте изобретения предложен рекомбинантный вектор, содержащий мутантный полинуклеотид по изобретению.
При определении здесь рекомбинантный вектор представляет собой экспрессирующий переносчик или рекомбинантную экспрессирующую конструкцию, используемую для введения полинуклеотидов в желаемую клетку. Вектор экспрессии может представлять собой вирусный вектор или плазмидный вектор, в который полинуклеотид по изобретению может быть встроен в прямой или обратной ориентации. Этот вектор также может представлять собой искусственный ген.
Подходящие экспрессирующие переносчики включают в себя, но не ограничены ими, эукариотические векторы, прокариотические векторы, например бактериальные линейные или кольцевые плазмиды, вирусные векторы, комплексы ДНК-белок, например комплексы ДНК-моноклональное антитело, и рецепторно-опосредованные векторы. Вектор, в частности, может находиться в липосоме.
Предпочтительные бактериальные векторы включают в себя рQЕ30, pQE70, pQE60, pQE-9 (доступный от Quigen); pbs, pD10, phagescript, psiX174, pbluescript SK, pbsks, pNH8A, pNH16A, pNH18A, pNH46A (доступный от Stratagene); pGEX-2T, PKK223-3, pKK233-3, pDR540 и pRIT5 (доступный от Pharmacia) и pASK75 (доступный от Biometra).
Предпочтительные эукариотические векторы включают в себя pWLNEO, pSV2CAT, pOG44, pXT1, pSG (доступный от Stratagene); pSVK3, pBPV, pMSG, pSVL (доступный от Pharmacia) и pTEJ-8 [FEBS Lett. 1990 267 289-294], и pcDNA-3 (доступный от Invitrogen). Предпочтительные дрожжевые векторы включают в себя pYES2 (доступный от Invitrogen).
Предпочтительные вирусные векторы включают в себя векторы на основе вируса простого герпеса (herpes simplex), аденовирусные векторы, ассоциированные с аденовирусом вирусные векторы, поксвекторы, парвовирусные векторы, бакуловирусные векторы и ретровирусные векторы.
Однако можно использовать любую другую плазмиду или вектор, если они реплицируемы и жизнеспособны в продуцирующем хозяине.
Вектор экспрессии может дополнительно содержать регуляторные последовательности в работоспособной комбинации с полинуклеотидной последовательностью по изобретению. При определении здесь, термин "в работоспособной комбинации" означает, что работающие элементы, то есть ген(ы) и регуляторные последовательности, работоспособным образом соединены так, чтобы осуществлять желаемую экспрессию. Промоторы являются примерами таких регуляторных последовательностей.
В предпочтительном воплощении вектор по изобретению содержит промотор, работоспособным образом соединенный с полинуклеотидом.
Регуляторные элементы можно выбирать из любого желаемого источника, а вектор можно получить, используя стандартные методики, известные в данной области техники, например описанные Sambrook et al. [Sambrook et al.: Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Lab., Cold Spring Harbor, NY 1989].
В предпочтительном воплощении вектор представляет собой вирусный вектор, в частности вектор на основе вируса простого герпеса (herpes simplex), аденовирусный вектор, ассоциированный с аденовирусом вирусный вектор или ретровирусный вектор. Естественно, что выбор вектора и его регуляторных элементов зависит от целей экспрессии и находится на усмотрении специалистов в данной области техники.
В еще одном аспекте изобретения предложены линии упаковывающих клеток, способных продуцировать инфекционный вирион, содержащий вирусный вектор по изобретению.
Клетки-хозяева/продуцирующие клетки
В еще одном аспекте данного изобретения предложена продуцирующая клетка, генетически измененная так, что она содержат полинуклеотидную последовательность по изобретению и/или рекомбинантный вектор экспрессии по изобретению. Клетка по изобретению может быть, в частности, генетически измененной так, чтобы временно или постоянно экспрессировать, сверх-экспрессировать или соэкспрессировать полипептид по изобретению. Способы осуществления временной и постоянной экспрессии известны в данной области техники.
Полинуклеотиды по изобретению можно встраивать в векторы экспрессии, например плазмиду, вирус или другой экспрессирующий переносчик, и работоспособным образом соединять с последовательностями, контролирующими экспрессию, путем лигирования таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с последовательностями, контролирующими экспрессию. Подходящие последовательности, контролирующие экспрессию, включают в себя промоторы, энхансеры, терминаторы транскрипции, инициаторные кодоны, сигналы сплайсинга интронов и терминирующие кодоны, все поддерживаемые в правильной рамке считывания полинуклеотида по изобретению с тем, чтобы обеспечить возможность правильной трансляции мРНК. Последовательности, контролирующие экспрессию, могут также включать в себя дополнительные компоненты, такие как лидерные последовательности и последовательности партнеров по слиянию.
Промотор может представлять собой, в частности, конститутивный и индуцибельный промотор. При клонировании в бактериальных системах можно использовать индуцибельные промоторы, такие как pL бактериофага λ, plac, ptrp, ptac (ptrp-lac гибридный промотор). При клонировании в системах млекопитающих можно использовать промоторы, полученные из генома клеток млекопитающих, например промотор убиквитина, ТК промотор или промотор металлотионеинов, или из вирусов млекопитающих, например ретровирусный длинный концевой повтор, аденовирусный поздний промотор или 7.5К промотор вируса коровьей оспы. Промоторы, полученные при помощи методов рекомбинантной ДНК или синтетических методов, также можно использовать для обеспечения транскрипции полинуклеотида по данному изобретению.
Подходящие векторы экспрессии обычно содержат ориджин экспрессии, промотор, а также специфические гены, которые делают возможной фенотипическую селекцию трансформированных клеток, и включают в себя такие векторы, как вектор экспрессии на основе Т7 для экспрессии в бактериях [Rosenberg et al; Gene 1987 56 125], pTEJ-8, pUbi1Z, pcDNA-3 и pMSXND векторы экспрессии для экспрессии в клетках млекопитающих [Lee and Nathans, J. Biol. Chem. 1988 263 3521], векторы, полученные из бакуловирусов, для экспрессии в клетках насекомых, и ооцитный вектор экспрессии PTLN [Lorenz С, Pusch М & Jentsch Т J: Heteromultimeric CLC chloride channels with novel properties; Proc. Natl. Acad. Sci. USA 1996 93 13362-13366].
В предпочтительном воплощении клетка по изобретению представляет собой эукариотическую клетку, например клетку млекопитающих, например клетку человека, клетку собаки, клетку обезьяны, клетку крысы или клетку мыши, ооцит или дрожжевую клетку. Клетка по изобретению может представлять собой, без ограничения, клетку почки человеческого эмбриона (НЕК), например НЕК 293 клетку, ВНК21 клетку, клетку яичника китайского хомячка (СНО), клетку ооцита Xenopus laevis (XLO). В другом воплощении клетка по изобретению представляет собой грибную клетку, например клетку нитчатого гриба. В другом предпочтительном воплощении клетка представляет собой клетку насекомого, наиболее предпочтительно Sf9 клетку. Дополнительными предпочтительными клетками млекопитающих по изобретению являются клеточные линии РС12, HiB5, RN33b и человеческие невральные клетки-предшественники. Наиболее предпочтительными являются человеческие клетки.
Когда клетка по изобретению представляет собой эукариотическую клетку, введение гетерологичного полинуклеотида по изобретению можно, в частности, осуществить путем инфицирования (используя вирусный вектор), путем трансфекции (используя плазмидный вектор), используя осаждение фосфатом кальция, микроинъекцию, электропорацию, липофекцию или другие физико-химические методы, известные в данной области техники.
В более предпочтительном воплощении выделенную полинуклеотидную последовательность по изобретению и/или рекомбинантный вектор экспрессии по изобретению трансфицируют в клетку-хозяин млекопитающего, невральную клетку-предшественника, астроцит, Т-клетку, гемопоэтическую стволовую клетку, неделящуюся клетку или церебральную эндотелиальную клетку, содержащую по меньшей мере одну молекулу ДНК, способную опосредовать клеточную иммортализацию и/или трансформацию.
Активацию эндогенного гена в клетке-хозяине можно осуществить путем введения регуляторных элементов, в частности, путем введения промотора, способного воздействовать на транскрипцию эндогенного гена, кодирующего вариант фермента по изобретению.
Способ получения полипептидов
В другом аспекте настоящего изобретения предложен способ получения выделенного варианта фермента по изобретению. В способе по изобретению подходящую продуцирующую клетку изменяют генно-инженерным путем посредством введения экзогенных полинуклеотидов, чтобы сделать возможной экспрессию варианта фермента, и эту клетку культивируют в условиях, дающих возможность продуцирования полипептида с последующим извлечением желаемого полипептида.
Полинуклеотид по изобрет