Способ фотометрического определения железа (ii) в растворах чистых солей и искусственных смесей
Иллюстрации
Показать всеИзобретение относится к области аналитической химии, а именно к фотометрическому методу анализа, и может быть использовано для определения содержания железа(II) в растворах чистых солей и искусственных смесей, содержащих железо(II) в очень малой концентрации. Способ включает переведение железа(II) в комплексное соединение с ксиленоловым оранжевым в слабокислой среде. К раствору с pH 1,5-5 добавляют 0,2-0,4 мл поверхностно-активного вещества, 60-70-кратное количество ксиленолового оранжевого и воды до 10 мл объема с последующим нагреванием на водяной бане при температуре 80-98°C в течение 1-3 минут. Технический результат заключается в повышении чувствительности при фотометрическом определении железа(II), избирательности и экономии количества реактивов при осуществлении способа. 9 ил., 1 табл.
Реферат
Изобретение относится к области аналитической химии, а именно к фотометрическому методу анализа, и может быть использовано для определения содержания железа(II) в растворах чистых солей и искусственных смесей, содержащих железо(II) в очень малой концентрации.
Известен способ фотометрического определения железа(II) с помощью ксиленолового оранжевого, заключающийся в добавлении к анализируемому раствору буферного раствора с определенным значением pH (слабокислая среда) и действии органического реактива (Татаев О.А., Багдасаров К.Н. Применение органических реагентов в электрофотометрии. Ч.1. - Махачкала: Изд-во Дагестан. ун-та, 1971. - С.43).
Недостатком способа является невысокая чувствительность и избирательность определения.
Технический результат заключается в повышении чувствительности при фотометрическом определении железа(II), избирательности и экономии количества реактивов при осуществлении способа.
Технический результат достигается тем, что в способе фотометрического определения железа(II) в растворах чистых солей и искусственных смесей, включающем переведение его в комплексное соединение с ксиленоловым оранжевым в слабокислой среде, к раствору с pH 1,5-4 добавляют 0,2-0,4 мл поверхностно-активного вещества, 60-70-кратное количество ксиленолового оранжевого и воды до 10 мл объема с последующим нагреванием на водяной бане при температуре 80-98° в течение 1-3 минут.
Интервал pH существования окрашенного комплексного соединения 1-5. Максимальная интенсивность окраски достигается при pH 2-3. Вне этих интервалов комплекс распадается. Максимальная интенсивность окраски комплексного соединения достигается при 60-70-кратном избытке реагента ксиленолового оранжевого. При меньшей или большей кратности реагента интенсивность окраски падает и комплекс не обнаруживается, не существует. Максимальная интенсивность окраски комплексного соединения, а следовательно, и высокая чувствительность реакции наступает при добавлении 0,2-0,4 мл раствора ПАВ. При меньшем или большем количестве ПАВ от оптимально найденного чувствительность уменьшается. Максимальное развитие окраски достигается при нагревании полученной смеси 1-3 мин на водяной бане при температуре 80-98°С. Снижение температуры водяной бани (<80°C, больше 98°C она не бывает) требует более продолжительного нагревания 30 мин и более, иногда выпадает осадок, что в данном случае недопустимо. Если нагревать при выбранном интервале температуры меньше 1 мин максимальное развитие окраски не достигается, более 3 мин - нерациональная трата времени, так как этим чувствительность реакции не повысить, т.е. интенсивность окраски еще более интенсивней не станет.
Поверхностно-активное вещество: к 7 г желатина добавляли 0,9 мл [ЕТНОХ CHEMICALS, LLC PO BOX 5094 GREENVILLE, SC 29606; SURFACTANT: ЕТНОХ СО-30; PHYSICAL FROM @25°C: LIQUID; HLB: 11,8; WATER SOLUBILITY: SOLUBLE; COMMENTS: РОЕ (30) CASTOR OIL - WATER SOLUBLE EMULSIFIER FOR NATURAL FATS & OILS. DISPERSANT FOR INORGANICS & STABILIZER FOR LATEX EMULISONS] в 122 мл воды (обозначили ПАВ-5).
Пример 1
В пробирки помещают по V мл 10-5 М раствора железа(II), по 3 мл буферного раствора с pH 3, по 0,3 мл раствора ПАВ-5, по 3 мл 10-3 М раствора ксиленолового оранжевого, доводят объемы растворов до 10 мл водой, нагревают на кипящей водяной бане 2 мин. Фотометрируют на КФК, λ 540 нм, l=0,5 см относительно раствора холостого опыта.
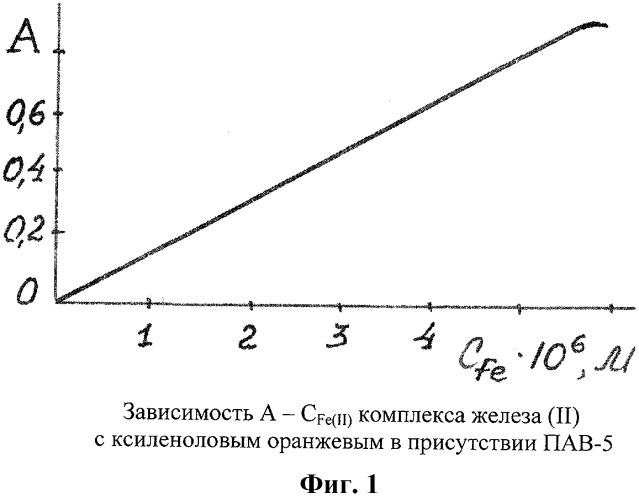
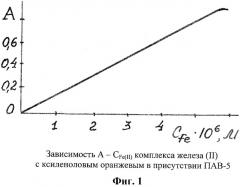
На фиг.1 представлен график определения железа (II) с ксиленоловым оранжевым в присутствии ПАВ-5. Линейность графика соблюдается в интервале концентраций Fe(II) 0,04-0,30 мкг/мл.
Расчет уравнения градуировочного графика
| СFe исход, М | 10-5 | |||||
| VFe, мл | 1,0 | 2,0 | 3,0 | 4,0 | 5,0 | |
| СFe в пробир, М | 1·10-6 | 2·10-6 | 3·10-6 | 4·10-6 | 5·10-6 | |
| СFe, мкг/мл | 5,6·10- | 11,2·10- | 16,8·10- | 22,4·10-2 | 28,0·10-2 | х |
| 0,12 | 0,30 | 0,45 | 0,65 | 0,78 | у |
Σх=(5,6+11,2+16,8+22,4+28,0)·10-2=84·10-2;
Σу=(0,12+0,30+0,45+0,65+0,78)=2,3;
Σх2=31,36+125,44+282,24+501,76+784,0=1724,8·10-4=0,1725;
Σху=(5,6·0,12+11,2·0,30+16,8·0,45+22,4·0,65+28,0·0,78)·10-2=47,99·10-2=0,4799
(Σx)2=(84·10-2)2=0,7056;
у=-0,0409+2,98 x;
Пример 2
Определение железа (II) в растворах искусственных смесей.
В пробирку помещают по 1,5 мл 10-5 М раствора железа (II), различные объемы растворов ионов металлов, по 3 мл буферного раствора с pH 3; по 0,3 мл раствора ПАВ-5, по 3 мл 10-3 М ксиленолового оранжевого, доводят объемы растворов до 10 мл водой, нагревают на кипящей водяной бане 2 мин. Фотометрируют при λ 540 нм, l=0,5 см, относительно раствора холостого опыта. Результаты анализа приведены в табл.1.
| Таблица 1 | |||
| № п/п | Состав смеси, мкг/мл | Введено Fe(II), мкг/мл | Найдено Fe(II), мкг/мл |
| 1 | Fe(III) - 0,5; Cu(II) - 0,8 | 0,084 | 0,084±0,001 |
| 2 | Al(III) - 0,1; Pb(II) - 0,3 | 0,084 | 0,084±0,000 |
| 3 | Cu(II) - 0,8; Pb(II) - 0,8 | 0,084 | 0,084±0,000 |
| 4 | Fe(III) - 0,8; Pb(II) - 0,1 | 0,084 | 0,084±0,001 |
| 5 | Al(III) - 0,3; Cu(II) - 0,5 | 0,084 | 0,084±0,000 |
Изучение комплексообразования железа(III) и железа(II) с ксиленоловым оранжевым в присутствии ПАВ-5.
Аппаратура: спектрофотометр СФ-26, фотоэлектроколориметр КФК-2, pH-метр рН-340, аналитические весы ВЛА-200 г - М. Реагенты: ксиленоловый оранжевый, 10-2 М раствор; раствор железа(II) готовили из навески металлического железа (стандартный образец), растворяя в H2SO4, 0,1034 М раствор; 10-2 М растворы железа(III), алюминия(III), меди(II), свинца(II) готовили из соответствующих солей ч.д.а., растворы меньшей концентрации получали разбавлением исходных; буферные растворы: 0,1000 М раствор HCl готовили из фиксанала, из 2 М растворов СН3СООН и СН3COONa смешиванием получали буферные растворы с pH 2-6, устанавливая точное значение pH на pH-метре со стеклянным индикаторным и хлорсеребряным электродом сравнения (прибор откалиброван по стандартным буферным растворам, прилагаемым к прибору).
При получении окрашенных комплексных соединений добавляли по 3 мл буферных растворов, чтобы ионная сила раствора имела значение μ≥0,5:
Известно, что этим обеспечивается хорошая воспроизводимость опытов (индифферентный электролит в высокой концентрации, например KCl, необходим только при pH 1, создаваемом 0,1 М раствором HCl).
Железо(III) + ксиленоловый оранжевый. В пробирку поместили 0,1 мл 10-3 М раствора железа(III), 3 мл буферного раствора с pH 3; 0,5 мл раствора ПАВ-5 и 0,5 мл 10-2 М раствора ксиленолового оранжевого, довели водой до 10 мл, нагрели 2 мин на кипящей водяной бане. Параллельно готовили раствор холостого опыта. Фотометрировали на СФ-26, l=1 см относительно воды.
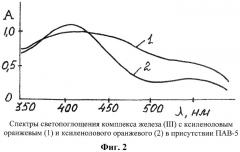
Спектры светопоглощения комплекса железа(III) с ксиленоловым оранжевым (1) и ксиленолового оранжевого (2) показаны на фиг.2
Изучение условий комплексообразования железа(II) с ксиленоловым оранжевым в присутствии ПАВ-5
Ситуация изменилась, когда стали применять ПАВ-5 при получении окрашенного комплексного соединения железа(II) с ксиленоловым оранжевым.
1) Изучение интервала pH существования комплекса
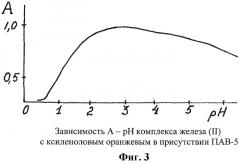
В пробирки помещали по 0,2 мл 10-3 М раствора железа(II), по 3 мл буферных растворов с переменным значением pH 1-6, по 0,5 мл раствора ПАВ-5, по 0,5 мл 10-3 М раствора ксиленолового оранжевого, доводили до 10 мл водой, нагревали 2 мин на кипящей водяной бане. По охлаждении фотометрировали на КФК при λ 590 нм, l=1 см, относительно растворов сравнения холостых опытов. На фиг.3 показана зависимость А - pH комплекса Fe(II) с ксиленоловым оранжевым.
Оптимальный интервал pH существования комплекса 1-6, рНмакс=3.
2) Получение спектра поглощения комплекса железа(II) с ксиленоловым оранжевым
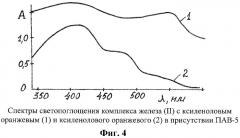
Раствор комплексного соединения п.1) с pH 3 и его холостой раствор фотометрировали на СФ-26 в интервале длин волн 340-600 нм, l=1 см, относительно воды, фиг.4.
На фиг.4 показаны спектры светопоглощения комплекса железа(II) с ксиленоловым оранжевым (1) и ксиленолового оранжевого (2).
Оптимальная длина волны для комплексного соединения 540 или 590 нм.
3) Изучение зависимости оптической плотности от объема раствора железа(II)
В пробирки помещали по V мл 10-5 М раствора железа(II), по 3 мл буферного раствора с pH 2, по 0,2 мл раствора ПАВ-5, по 2,5 мл 10-3 М раствора ксиленолового оранжевого, довели объемы растворов до 10 мл водой, нагревали на кипящей водяной бане 2 мин. По охлаждении фотометрировали на КФК, l=1 см, λ 540 нм, относительно раствора сравнения холостого опыта, фиг.5.
На фиг.5 показан градуировочный график определения железа(II) с ксиленоловым оранжевым в присутствии ПАВ-5, СМ исход=10-5 М.
Подчинение растворов комплексных соединений закону Бера наблюдается в интервале концентраций железа(II) (1,0-2,0)×10-6 М.
На порядок увеличили концентрацию железа(II). В пробирки помещали по
V мл 10-4 M раствора железа(II), по 3 мл буферного раствора с pH 2, по 0,2 мл раствора ПАВ-5, по 0,5 мл 10-2 М раствора ксиленолового оранжевого. Остальное проделали так же, как и в предыдущем случае. На фиг.6 представлен градуировочный график определения железа(II) с ксиленоловым оранжевым в присутствии ПАВ-5, СМ исход=10-4 М.
Линейность градуировочного графика наблюдается в интервале концентрации железа(II) (2,0-8,0)×10-6 М.
4) Изучение зависимости оптической плотности от объема раствора ксиленолового оранжевого
В пробирки помещали по 0,5 мл 10-4 М раствора железа(II), по 3 мл буферного раствора с pH 2, по 0,2 мл раствора ПАВ-5, по V мл 10-3 М раствора ксиленолового оранжевого, довели водой до 10 мл, нагревали на кипящей водяной бане 2 мин. Фотометрировали на КФК при λ 590 нм, l=1 см, относительно растворов сравнения холостых опытов. На фиг.7 показана зависимость оптической плотности от объема раствора ксиленолового оранжевого А-VR для комплекса железа(II) с ксиленоловым оранжевым в присутствии ПАВ-5. Максимальным для получения окрашенного комплекса является 3 мл 10-3 М раствора ксиленолового оранжевого.
Максимальная интенсивность окраски комплексного соединения железа (II) с ксиленоловым оранжевым достигается при добавлении 67-кратного количества реагента:
5) Определение оптимального количества ПАВ-5
В пробирки помещали по 0,5 мл 10-4 М раствора железа(II), по 3 мл буферного раствора с pH 2, по V мл раствора ПАВ-5, по 2,5 мл 10-3 М раствора ксиленолового оранжевого, доводили до 10 мл водой, нагревали 2 мин на кипящей водяной бане. Фотометрировали относительно растворов холостых опытов, λ=590 нм, l=1 см. На фиг.8 показана зависимость А-VПАВ-5.
Максимальное развитие окраски комплекса наблюдается при добавлении 0,3 мл раствора ПАВ-5.
б) Изучение соотношения компонентов M:R в комплексном соединении железа(II) с ксиленоловым оранжевым
Готовили эквимолярные 10-3 М растворы железа(II) и ксиленолового оранжевого. В пробирки помещали по V мл раствора железа(II), по 3 мл буферного раствора с pH 2, по 0,2 мл раствора ПАВ-5, по V мл раствора ксиленолового оранжевого, доводили до 10 мл водой, нагревали на кипящей водяной бане 2 мин. Фотометрировали на КФК, λ 590 нм, l=1 см, относительно растворов сравнения холостых опытов. На фиг.9 показана изомолярная серия комплекса Fe(II) с ксиленоловым оранжевым. Из рисунка видно, что соотношение компонентов в комплексном соединении M:R=1:1.
Преимущества разработанного метода определения железа(II) с ксиленоловым оранжевым в присутствии ПАВ-5:
1) Резко возрастает чувствительность определения по сравнению с известными методами:
Fe(II) + о-фенантролин, ε=2,24×104; 3,3×105/2,24×104=15 раз;
Fe(II) + батофенантролин, ε=1,1×104; 3,3×105/1,1×104=30 раз.
2) Самым высокочувствительным реагентом в фотометрии считается
ди-(β-нафтил)-тиокарбазон (R) на Hg2+, Zn2+, Cd2+ (εMR=(1,4-1,7)×105) [1) Индикаторы. Т.1 // Редактор Э.Бишоп. - М.: Изд-во «Мир», 1976. - 496 с. - С.402. 2) Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа. Изд-е 3-е - Л.: Изд-во «Химия» Ленинградское отделение, 1972. - 408 с. - С.304, 338]. На железо(II) подобный реагент в литературе нами не обнаружен. Молярный коэффициент светопоглощения комплекса железа(II) с ксиленоловым оранжевым в присутствии ПАВ-5 выше по сравнению с максимально известным в настоящее время из литературы примерно в 2 раза. Чувствительность определения 0,04-0,3 мкг/мл железа(II).
3) Реакции образования комплексных соединений идут в водной среде, отсутствует необходимость в органических растворителях, отрицательно влияющих на организм человека.
4) Комплексы железа(II) в присутствии ПАВ-5 устойчивы не менее 1,5 часа, в то время, как, например, соединение железа(II) с дитизоном неустойчиво.
5) Известна малая воспроизводимость при получении некоторых окрашенных комплексных соединений железа(II) с органическими реагентами. В нашем случае воспроизводимость хорошая.
6) Способ довольно избирательный. Определению железа(II) не мешают железо(III), алюминий(III), невысокое светопоглощение для комплексов с хромом(III), медью(II), свинцом(II).
Разработанный способ открывает следующие перспективы развития фотометрического способа в аналитической химии:
1. варьируя органическими реагентами на железо(II) в присутствии ПАВ-5 возможно еще больше повысить чувствительность и избирательность реакции;
2. меняя анализируемый ион в растворе и проделывая реакции его с органическими реагентами в присутствии ПАВ-5, вероятно возможно отыскать такие же высокочувствительные реагенты, как и на железо(II);
3. наконец, разбавляя или увеличивая концентрацию компонентов ПАВ-5, заменяя их другими компонентами ПАВ, можно получить новые системы ПАВ, используя которые в фотометрическом определении ионов металлов с органическими реагентами, вероятно, можно ожидать очень перспективные результаты: получение высокочувствительных и высокоизбирательных реагентов.
Способ фотометрического определения железа(II) в растворах чистых солей и искусственных смесей, включающий переведение его в комплексное соединение с ксиленоловым оранжевым в слабокислой среде, отличающийся тем, что к раствору с pH 1,5-4 добавляют 0,2-0,4 мл поверхностно-активного вещества, 60-70 - кратное количество ксиленолового оранжевого и воды до 10 мл объема с последующим нагреванием на водяной бане при температуре 80-98° в течение 1-3 мин.