Композиции, включающие гормон роста
Иллюстрации
Показать всеИзобретение относится к области медицины и касается жидких композиций гормона роста, которые сохраняют стабильность при хранении в течение более 6 месяцев при температуре в диапазоне 2-8°С в результате простого приготовления композиции, содержащей гормоны роста в фосфатном буфере, физиологическом значении рН. При гарантии того, что значение рН составляет 6,15-6,5, кристаллизация гормона роста в процессе хранения при температурах холодильника или выше ингибируется, или снижается. Для придания изотоничности композиции в нее включают манит. Консерванты включают для снижения бактериального загрязнения, что позволяет получать большое количество стандартных доз, которые можно хранить при 2-8°С. Преимущество изобретения заключается в снижении кристаллизации. 4 н. и 13 з.п. ф-лы, 4 табл., 3 ил.
Реферат
Настоящее изобретение относится к жидким композициям, включающим гормон роста (ГР), которые можно применять для введения человеку или животному. Более конкретно, изобретение относится к жидким композициям, включающим человеческий гормон роста (чГР), которые являются фармацевтически более приемлемыми и предпочтительными и при их получении с помощью различных стадий процесса приготовления не происходит заметной потери активности или заметной потери стабильности.
Нативный чГР представляет собой протеин с одноцепочечной полипептидной цепью, состоящей из 191 аминокислоты. Протеин включает внутренние поперечные связи, образованные дисульфидными мостиками, и в мономерной форме имеет молекулярную массу 22 кДа. Аминокислотная последовательность ГР животных обладает выраженной гомологией с аминокислотной последовательностью человека и вследствие этого ГР животных и человека обладают очень сходными характеристиками.
Основной биологической активностью ГР является способность усиливать рост различных органов и тканей организма. Чувствительные к ГР органы или ткани включают печень, кишечник, почки, мышцы, соединительную ткань и скелет.
Гипофизный инфантилизм представляет собой состояние, которое легко поддается лечению при введении ГР пациенту, страдающему указанным состоянием. До того как научились получать большие количества чГР с помощью методов рекомбинации, можно было получать лишь небольшие количества чГР путем экстракции в лабораторных условиях гипофизов умерших людей. Эта практика была связана с рисками заражения инфицирующими агентами, такими как, например, возбудитель болезни Крейцфельдта-Якоба (КЯБ), и эти агенты могли попадать в организм пациента, которому вводили ГР. Выделение гена чГР и создание трансформированных клеток-хозяев, экспрессирующих чГР в культуре клеток, открыли не только более надежный, безопасный и более дешевый метод лечения гипофизного инфантилизма, но также позволили использовать чГР для лечения других болезней и состояний.
В течение многих лет важная проблема, связанная с водными композициями применяемых в фармацевтике протеинов, включающих не только чГР, состояла в их нестабильности при продолжительном хранении. Известно, что чГР в водном растворе подвергается различным изменениям, связанным с расщеплением. Происходят химические изменения, такие как деаминирование, и это может быть связано со значением рН раствора при хранении. Может происходить окисление остатков метионина. Также может происходить расщепление пептидного каркаса в результате гидролитических реакций. Также возможны физические изменения, которые включают агрегацию, приводящую, например, к образованию нерастворимых частиц.
Предлагаемый ранее путь решения указанных выше проблем, связанных с нестабильностью, заключался в использовании сушки вымораживанием, однако этот путь требует восстановления полученного лиофилизированного продукта непосредственно или незадолго до введения. При обычной практике самолечения пациента в домашних условиях это, как правило, означает, что пациент должен восстановить лиофилизированный препарат в водном растворе. Это неудобно для пациента и сопряжено с риском неправильного восстановления в результате недостаточной осторожности, отсутствия внимания к деталям и инструкциям или просто ошибки.
В патенте США 4968299 (на имя фирмы Kabi Pharmacia) описано устройство, применяемое пациентом для восстановления лиофилизированного препарата, которое позволяет снижать возможность ошибок при восстановлении. Но даже в этом случае сама по себе необходимость осуществлять восстановление является неудобной для пациента, а восстановленный чГР сохраняет стабильность только в течение 3 недель при хранении при 2-8°С. Таким образом, в настоящее время при необходимости введения в течение нескольких месяцев пациенту все еще требуется особое внимание к деталям и инструкциям и, следовательно, все еще сохраняется серьезный риск несоблюдения пациентом режима и схемы лечения.
В любом случае недостатком сушки вымораживанием является высокая стоимость и продолжительное время, необходимое для осуществления стадии приготовления.
Таким образом, попытки упростить самолечение пациентов были сосредоточены на путях, позволяющих получить достаточно стабильные водные композиции чГР в готовой к применению форме.
Нестабильность протеинов в водном растворе является общим явлением, которое не связано конкретно с чГР.
В ЕР-А-0131864 (на имя фирмы Hoechst Aktiengesellschaft) описан метод предупреждения агрегации в водном растворе протеинов, молекулярная масса которых превышает 8,5 кДа, с помощью применения поверхностно-активных веществ.
В ЕР-А-0211601 (на имя фирмы International Minerals and Chemical Corporation), хотя его основной задачей являлась разработка композиций с пролонгированным высвобождением, описан метод стабилизации ГР в растворе, таком как жидкость, путем введения в него неионогенных поверхностно-активных веществ, в частности определенных блок-сополимеров полиоксиэтилена-полиоксипропилена, например, блок-сополимера PLURONIC (товарный знак фирмы BASF) или GENAPOL (товарный знак фирмы Hoechst).
В WO 94/03198 (на имя фирмы Genentech) описан другой путь развития ранее описанных методов с помощью применения неионогенного поверхностно-активного вещества в качестве стабилизатора чГР в жидких композициях. Установлено, что применение в композиции неионогенного поверхностно-активного вещества в диапазоне концентраций 0,1-5% (мас./об.) приводит к тому, в композиции, которые подвергаются воздействию сдвиговых и поверхностных напряжений, не происходит денатурация протеина ГР. В частности, содержащие поверхностно-активное вещество композиции, вероятно, можно применять для введения определенных доз в легкие и для безигольных инжекторов.
Однако поверхностно-активные вещества являются токсичными субстанциями и их применение по возможности должно быть прекращено или по меньшей мере сведено до минимума. Это особенно важно, если композиции предназначены для ежесуточного или очень частого введения, особенно детям и для лечения хронических заболеваний.
Предложены разнообразные другие пути стабилизации водных композиций чГР. В WO 89/09614 (на имя фирмы Genentech) описана композиции чГР, включающая глицин, маннит и буфер; при этом используется молярное соотношение чГР:глицин от 1:50 до 1:200.
В ЕР-А-0303746 (на имя фирмы International Minerals and Chemical Corporation), описано, что водный ГР можно стабилизировать путем введения в композицию полиола, например, нередуцирующих сахаров, сахарных спиртов, сахарных кислот, лактозы, пентаэритриола, водорастворимых декстранов и Фиколла; аминокислот, например, глицина, аргинина и бетаина; полимера аминокислот, несущих заряженную боковую цепь при физиологическом значении рН; и, наконец, производного холина, например холинхлорида, дигидрогенцитрата холина или дихолинмуката. Для многих указанных выше полимерных материалов существует риск при введении пациентам. Согласно законам, регулирующим применение фармацевтических веществ, с целью снижения риска для пациентов следует избегать применения некоторых, не имеющих решающего значения добавок, в частности синтетических добавок (например, пентаэрнтриола). Не очевидно, что многие предлагаемые в описании стабилизаторы можно применять в клинических условиях и, следовательно, на их основе не может быть приготовлена фармацевтически приемлемая композиция.
В WO 92/1 7200 (на имя фирмы Genentech) описана стабилизация чГР не только в жидкости, но также и в лиофилизированных препаратах. Описано получение стабильных димеров цинк:чГР. Димеры цинк:чГР получают из двух ионов цинка и двух молекул чГР.
В WO 93/12811 (на имя фирмы Novo Nordisk) заявлена жидкая композиция чГР, в которой в качестве стабилизатора и забуферивающего вещества применяют аспарагин.
В WO 93/19776 (на имя фирмы Kabi Pharmacia) указано, что совершенно неожиданно было обнаружено, что, когда на основе водного содержащего чГР продукта приготавливают композицию с нитратным буфером, то она становится более стабильной по сравнению с композиций, приготовленной с использованием фосфатного буфера.
Объектом настоящего изобретения является достаточно стабильная композиция чГР, пригодная для быстрого применения пациентами без необходимости в каких-либо процедурах приготовления или восстановления. Другим объектом изобретения является композиция, которая может храниться в домашних условиях в бытовом холодильнике по меньшей мере в течение нескольких месяцев. Еще одним объектом изобретения является жидкая композиция большого объема, которую можно разливать и расфасовывать в картриджи, предназначенные для применения пациентами, без неприемлемой потери активности ГР или неприемлемого снижения стабильности, в частности без неприемлемой агрегации. И еще одним объектом изобретения является достаточно стабильная жидкая композиция, в которой не применяются или применяются в минимальных количествах фармацевтически неприемлемые или нежелательные компоненты, другими словами, еще более приемлемая с точки зрения фармацевтики композиция.
И еще одним объектом изобретения являются жидкие композиции, для которых отсутствует проблема, связанная с образованием кристаллов при хранении в холодильнике в течение длительных периодов времени, например, до 6 или 18 месяцев, или при хранении в течение определенных периодов времени вне холодильника, например, в течение нескольких дней, недель или месяцев.
При создании изобретения неожиданно было установлено, что для решения поставленных задач абсолютно нет необходимости применять дополнительные стабилизирующие агенты в растворе сверх и помимо только чГР и фосфатного буфера, что совершенно отличается от существующей в данной области практики. Кроме того, в настоящем изобретении пересмотрены известные в данной области данные о том, что поверхностно-активные вещества важны для стабилизации водных растворов ГР, и также о том, что забуференные фосфатом растворы не обеспечивают удовлетворительную стабильность по сравнению с нитратным буфером.
Таким образом, одним из объектов настоящего изобретения является жидкая композиция гормона роста, в основном состоящая из гормона роста в забуференном фосфатом растворе.
Вторым объектом изобретения является жидкая композиция гормона роста, в основном состоящая из гормона роста в забуференном фосфатом растворе и консерванта.
Третьим объектом изобретения является жидкая композиция гормона роста, в основном состоящая из гормона роста в изотоничном забуференном фосфатом растворе и консерванта.
Четвертым объектом изобретения является жидкая композиция гормона роста, в основном состоящая из гормона роста в изотоничном забуференном фосфатом растворе.
Целесообразно не применять консервант в вышеуказанных композициях, которые хранятся в ампулах, что является удобной формой применения однократных небольших доз. В многократных дозах предпочтительно применять консервант.
До настоящего времени необъяснимым и действительно совершенно неожиданным преимуществом всех вышеуказанных композиций является то, что они сохраняют стабильность при хранении в холодильнике при температуре 2-8°С. Для оценки стабильности композиций во времени можно применять различные анализа. Репрезентативные примеры методов анализа приведены в примере 3 данного описания, а также в WO 94/03198, которая включена в данное описание в качестве ссылки, однако эти методы никоим образом не ограничивают или не исчерпывают анализы, которые можно применять для оценки стабильности.
Установлено, что при заполнении контейнеров дозами композиций гормона роста, которые не содержат какое-либо неионогенное поверхностно-активное вещество при использовании имеющейся в продаже фасовочной машины образуются неприемлемые уровни агрегации гормона роста. Однако когда нормальные и сдвиговые напряжения в жидкости минимизируют в процессе фасовки (независимо от того, применяют имеющуюся в продаже фасовочную машину или нет), то уровни поверхностно-активных веществ могут быть сведены до минимума или поверхностно-активные вещества могут отсутствовать. Фактический баланс, который необходимо достичь между физическими напряжениями при фасовке и концентрацией поверхностно-активного вещества, специалист в данной области может определить обычным эмпирическим путем.
В зависимости от уровней физических напряжений или сдвиговых напряжений в процессе фасовки и в зависимости от потребности в неионогенном поверхностно-активном веществе для того, чтобы избежать агрегации, концентрации неиногенного поверхностно-активного вещества могут составлять не более примерно 0,2% (мас./об.), как правило, менее 0,05% (мас./об.), предпочтительно менее 0,04% (мас./об.), более предпочтительно менее 0,01% (мас./об.) и еще более предпочтительно менее 0,001% (мас./об.).
Неиногенные поверхностно-активные вещества могут включать полисорбат, такой как полисорбат 20 или 80 и т.д., и полоксамеры, такие как полоксамер 184 или 188, полиолы типа Pluronic® и другие блок-сополимеры этилена/полипропилена.
При создании изобретения неожиданно было установлено, что в композициях ГР может применяться фосфатный буфер, который неожиданно хорошо стабилизирует приготовленные на его основе композиции как в процессе их обработки, например, при заполнение контейнеров, так и в процессе хранения.
При создании изобретения неожиданно установлено, что применение лишь очень низкой концентрации неионогенного поверхностно-активного вещества или полный отказ от его применения не оказывают отрицательного воздействия на стабильность композиции ГР при хранении в контейнерах при характерных для холодильников температуре (например, 2-8°С). Возможно хранение по меньшей мере в течение 3 месяцев или более вплоть до по меньшей мере 6 или 12 месяцев без чрезмерного воздействия на эффективность или фармацевтическую применимость композиций ГР.
Пятым объектом изобретения является жидкая композиция гормона роста, включающая гормон роста в забуференном фосфатом растворе, необязательно дополнительно включающая консервант.
В вышеуказанных объектах изобретения забуференный фосфатом раствор предпочтительно является изотоничным. Когда забуференный раствор является изотоничным, изотоничность обеспечивается нейтральной солью, например NaCl; или моносахаридом, например лактозой; дисахаридом, например, сахарозой, или сахарным спиртом, например, маннитом.
При создании изобретения также были обнаружены определенные соединения, которые можно использовать вместо нейтральной соли для придания изотоничности композициям ГР.
Таким образом, шестым объектом изобретения является жидкая композиция гормона роста, включающая гормон роста в изотоничном забуференном растворе, необязательно забуференном фосфатом растворе, соединение, придающее изотоничность, выбранное из группы, включающей один или несколько моносахаридов, например лактозу; дисахаридов, например сахарозу; сахарных спиртов, например маннит.
Что касается значения рН, то в предпочтительных композициях оно находится диапазоне от 5,0 до 7,0, более предпочтительно от 5,6 до 6,5.
При создании изобретения неожиданно было установлено, что для всех описанных композиций проблемы, связанные с кристаллизации композиций, могут быть исключены или сведены до минимума при обеспечении значений рН на уровне примерно 6,2 или выше.
Предпочтительно для того, чтобы исключить или свести до минимума кристаллизацию, предпочтительно значение рН композиций должно составлять от 6,15 до 7,4, более предпочтительно от 6,2 до 6,5.
Таким образом, изобретение относится к описанным жидким композициям, в которых отсутствует обнаруживаемая кристаллизация при хранении. Срок хранения может составлять по меньшей мере 1 месяц, предпочтительно 6 недель, более предпочтительно примерно от 1 до 4 месяцев, наиболее предпочтительно 3 месяца. Температура хранения может составлять примерно 2°С или выше, предпочтительно примерно 4°С или выше, более предпочтительно температура должна находиться в диапазоне от примерно 2 до ниже 40°С, еще более предпочтительно температура должна находиться в диапазоне от примерно 2 до 25°С, наиболее предпочтительно составлять 15°С.
Кристаллизация характерна для гормона роста. Предпочтительно наличие какой-либо кристаллизации в жидкой композиции определяют непосредственно визуально, более предпочтительно с помощью светового микроскопа при 5-кратном увеличении, еще более предпочтительно с помощью светового микроскопа при 10-кратном увеличении. Перед обследованием с помощью светового микроскопа композиции могут быть профильтрованы с определением на фильтрах наличия или отсутствия кристаллов. При обследовании с помощью светового микроскопа фильтр может иметь размер пор примерно 5 мкм.
Особенно предпочтительный метод оценки кристаллизации основан на применении композиции, которую хранят в течение 3 месяцев при 15°С, и наличие или отсутствие кристаллов в которой определяют визуально.
В качестве консервантов предпочтительно применяют одно или несколько соединений, выбранных из группы, включающей фенол, бензиловый спирт, мета-крезол, метилпарабен, пропилпарабен и бензалконийхлорид, хотя могут применяться любые другие консерванты или соединения, обладающие антибактериальной активностью, в соответствующей концентрации, так, чтобы композиция оставалась фармацевтически приемлемой.
Согласно предпочтительному варианту осуществления забуференный фосфатом раствор получают, используя соответствующие количества соответствующим образом гидратированных форм NaH2PO4 и Na2HPO4, которые необходимы для достижения требуемой концентрации и значения рН буфера, с помощью легко осуществляемого и хорошо известного специалистам в данной области метода.
В предпочтительном варианте осуществления гормон роста представляет собой человеческий гормон роста.
В особенно предпочтительных композициях агрегация гормона роста составляет менее 0,01%, предпочтительно менее 0,1%, более предпочтительно менее 1% и еще более предпочтительно менее 10%. Агрегацию можно оценивать с помощью стандартного метода вытеснительной ЖХВР, который более подробно описан ниже, но также можно применять любой приемлемый метод оценки агрегации.
Изобретение также относится к устройствам, которые предназначены для введения жидкости пациенту (предпочтительно человеку) путем инъекции и включают по меньшей одну стандартную дозу любой из описанных выше жидких композиций гормона роста. Примером такого устройства является ручной инжектор.
Изобретение также относится к наборам, включающим устройство для инъекций и отдельный контейнер, содержащий любую из описанных выше жидких композиций гормона роста. Контейнер предпочтительно адаптирован к применяемому устройству для инъекций таким образом, что при применении жидкая композиция в контейнере перетекает во входное отверстие устройства для инъекций.
Согласно особенно предпочтительным вариантам устройство для инъекций представляет собой ручной инжектор, а контейнер представляет собой картридж.
Кроме того, изобретение относится к картриджу, содержащему любую из описанных выше жидких композиций, предназначенному для применения с ручным инжектором.
При создании изобретения также неожиданно было установлено, что если включающие ГР контейнеры заполняют и запечатывают так, что в них отсутствует воздушное пространство или нет доступа воздуха, то это не только более надежно гарантирует стерильность содержимого контейнеров, но этот фактор также способствует минимизации или отсутствию агрегации ГР.
Таким образом, еще одним объектом изобретения являются запечатанные контейнеры, содержащие жидкие композиции ГР, для которых характерно, что в заполненных контейнерах практически отсутствует воздушное пространство.
Когда объектами для введения являются люди, то предпочтительный гормон роста представляет собой человеческий гормон роста. Особенно предпочтительный человеческий гормон роста получают с помощью методов рекомбинации, которые, например, описаны в ЕР-А-0217822 (фирма SCIOS NOVA). Варианты человеческого гормона роста, которые можно применять согласно изобретению индивидуально или в сочетании с любым другим и нативным гормоном, включают состоящие из 191 аминокислоты виды, известные как соматропин, и состоящие из 192 аминокислот виды с N-концевым метионином (met), известные как соматрем. Также существует вариант, известный как чГР-В (hGH-V), встречающийся в естественных условиях и плаценте во время беременности, для которого известен ген и получен рекомбинантный протеин.
Количество чГР в жидкой композиции по изобретению зависит от объема композиции и количества доз чГР, которое должно находиться в этом объеме. Предпочтительный объем дозы составляет 0,4 мл, однако также могут использоваться объемы от 0,01 до 1,0 мл. Другие предпочтительные объемы доз находятся в диапазоне от 0,1 до 0,6 мл.
В предпочтительной стандартной дозе для суточного введения количество вводимого чГР составляет 1,3 мг, хотя точное количество чГР в дозе может варьироваться в зависимости от конкретного индивидуума. Можно применять дозы, количество чГР в которых находится в диапазоне от 0,033 до 3,33 мг, предпочтительно от 0,33 до 2,0 мг. При снижении частоты введения можно повышать количества чГР в дозе.
Объемы и/или величины доз могут изменяться от индивидуума к индивидууму в зависимости от конкретной рекомендации лечащего врача.
Как правило, композиции по изобретению могут включать чГР в диапазоне от 0,5 до 20 мг/мл, предпочтительно от 1 до 15 мг/мл, более предпочтительно от 2 до 10 мг/мл, еще более предпочтительно от 3 до 5 мг/мл.
Изобретение также относится к наборам, которые включают устройство для инъекций и отдельный контейнер, содержащий описанную выше жидкую композицию гормона роста. Если устройство для введения представляет собой простой шприц для подкожных инъекций, то набор может включать шприц, иглу и пузырек или ампулу, которые содержат композицию чГР, предназначенную для применения с помощью шприца. Согласно более предпочтительным вариантам устройство для инъекций отличается от простого шприца для подкожных инъекций и поэтому отдельный контейнер адаптирован к применяемому устройству для инъекций таким образом, что при применении жидкая композиция в контейнере перетекает во входное отверстие устройства для инъекций.
Примеры устройств для введения включают (но не ограничиваясь ими) шприцы для подкожных инъекций и ручные инжекторы.
Особенно предпочтительными устройствами для инъекций являются ручные инжекторы, в этом случае контейнер представляет собой картридж, предпочтительно одноразовый картридж.
Еще одним объектом изобретения является картридж, содержащий описанную выше жидкую композицию гормона роста, предназначенный для применения с ручным инжектором. Картридж может содержать одну дозу или несколько доз гормона роста.
Предпочтительные варианты осуществления изобретения описаны с помощью приведенных ниже примеров со ссылкой на чертежи, в которых:
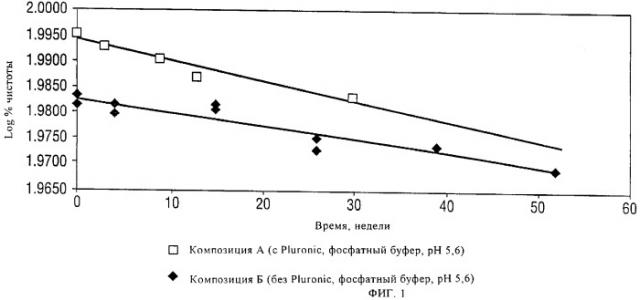
На фиг.1 графически представлены сравнительные данные по оценке стабильности при 2-8°С композиций чГР, которые дополнительно содержат фосфатный буфер, рН 5,6, хлорид натрия и бензиловый спирт. Приведено сравнение данных для этих композиций с добавлением поверхностно-активного вещества Pluronic и без него. На графике представлена зависимость log% чистоты от времени (в неделях).
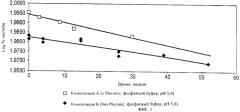
На фиг.2 графически представлены сравнительные данные по оценке стабильности при 2-8°С композиций чГР, которые дополнительно содержат хлорид натрия и бензиловый спирт, рН 6,0. Приведено сравнение данных для этих композиций, содержащих нитратный или фосфатный буфер. На графике представлена зависимость log% чистоты от времени (в неделях).
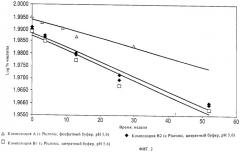
На фиг.3 графически представлены сравнительные данные по оценке стабильности при 2-8°С композиций чГР. Приведено сравнение данных для композиций чГР, содержащих изотоничный цитратный буфер и поверхностно-активное вещество Pluronic, и композиций чГР, которые содержат изотоничный фосфатный буфер и не содержат поверхностно-активное вещество.
Пример 1. Получение и очистка большого количества рекомбинантного чГР
Рекомбинантный человеческий чГР получали в клеточных культурах СНО-клеток, трансформированных геном чГР с целью экспрессии протеина чГР в условиях культивирования. Детали, касающиеся создания и выращивания клеток, описаны в ЕР-А-0217822 (фирма SCIOS NOVA), которая включена в настоящее описание в качестве ссылки. Модификация условий культивирования для выращивания культур в промышленных или коммерческих масштабах хорошо известна специалистам в данной области.
Полученный в клеточной культуре чГР необходимо экстрагировать и очищать в форме, пригодный для фармацевтического применения. Это осуществляли с помощью процессов, описанных в AU 619177 (на имя University of New Wales & Garvan Institute of Medical Research), включенном в настоящее описание в качестве ссылки.
Пример 2. Приготовление стабильной жидкой композиции
Большое количество композиции получали смешением различных компонентов. Порядок смешения компонентов не имеет решающего значения. Точное состояние или форма различных компонентов непосредственно перед смешением также не имеют решающего значения. Согласно предпочтительным вариантам приготовления композиции компоненты перед смешением должны иметь наиболее удобное для смешения состояние, также выбирают наиболее удобный порядок и метод смешения.
Ниже даны наиболее предпочтительные примеры композиций:
Композиция I
| чГР | 3,33 мг/ мл (10 ме/мл) |
| NaH2PO4 | 1,05мг/мл и |
| Na2HPO4 | 0,17 мг/мл (т.е. 10 мМ фосфатный буфер) |
| NaCl | 5,85 мг/мл (т.е. 0,59% мас./об.) |
| бензиловый спирт | 9,00 мг/мл (т.е. 0,9% мас./об.) |
| вода для инъекций | q.s. |
| рН 6,0 |
Композиция II
| чГР | 3,33 мг/мл (10 ме/мл) |
| NaH2PO4 | 1,05 мг/мл и |
| Na2HPO4 | 0,17 мг/мл (т.е. 10 мМ фосфатный буфер) |
| вода для инъекций | q.s. |
| рН 6,0 |
Композиция III
| чГР | 3,33 мг/мл (10 ме/мл) |
| NaH2PO4 | 1,05 мг/мл и |
| Na2HPO4 | 0,17 мг/мл (т.е. 10 мМ фосфатный буфер) |
| NaCl | 5,85 мг/мл (т.е. 0,59% мас./об.) |
| вода для инъекций | q.s. |
| рН 6,0 |
Композиция IV
| чГР | 3,33 мг/мл (10 ме/мл) |
| NaH2PO4 | 1,05мг/мл и |
| Na2HPO4 | 0,17 мг/мл (т.е. 10 мМ фосфатный буфер) |
| бензиловый спирт | 9,00 мг/мл (т.е. 0,9% мас./об.) |
| вода для инъекций | q.s. |
| рН6,0 |
Композиция V
| чГР | 3,33 мг/мл (10 ме/мл) |
| NaH2PO4 | 1,05 мг/мл и |
| Na2HPO4 | 0,17 мг/мл (т.е. 10 мМ фосфатный буфер) |
| маннит | 35 мг/мл (3,5% мас./об.) |
| Pluronic F-68 | 2 мг/мл (0,2% мас./об.) |
| бензиловый спирт | 9,00 мг/мл (т.е. 0,9% мас./об.) |
| вода для инъекций | q.s. |
| рН 6,0 |
Композиция VI
| чГР | 3,33 мг/мл (10 ме/мл) |
| NaH2PO4 | 0,85 мг/мл и |
| Na2HPO4 | 0,31 мг/мл (т.е. 10 мМ фосфатный буфер) |
| маннит | 35 мг/мл (3,5% мас./об.) |
| Pluronic F-68 | 2 мг/мл (0,2% мас./об.) |
| бензиловый спирт | 9,00 мг/мл (т.е. 0,9% мас./об.) |
| вода для инъекций | q.s. |
| рН 6,0 |
Приведенные выше в качестве примеров композиции получали следующим образом:
1. Готовили раствор эксципиента двойной крепости путем растворения всех требуемых эксципиентов в воде для инъекций и доведения значения рН до требуемого уровня с помощью молярных растворов соляной кислоты или гидроксида натрия.
2. Требуемый большой объем раствора гормона помещали в сосуд и при осторожном перемешивании добавляли раствор эксципиентов.
3. При необходимости регулировали значение рН и раствор доводили до конечного объема. Для заполнения картриджей, применяемых с ручными инжекторами, раствор фильтровали через стерилизующий фильтр и заполняли им картриджи для инжекторов, запечатанные на одном конце с помощью подвижного поршня, а другом конце - с помощью алюминиевой крышки, содержащей резиновую прокладку.
Другие тестируемые композиции готовили в целом аналогичным образом и более подробное описание этих композиций приведено в качестве примера ниже.
Пример 3. Определение стабильности водной композиции чГР
Образцы продукта хранили в контролируемых условиях при 2-8°С и анализировали в различные моменты времени. Стабильность продукта определяли с помощью двух ЖХВР-методов, которые оба приведены в монографии European Pharmacopoeia в разделе SOMATROPIN FOR INJECTION, которая включена в настоящее описание в качестве ссылки. Сначала применяли метод ЖХВР 4 с обращенной фазой для определения родственных протеинов, т.е. продуктов разложения, образованных в результате деаминирования и окисления. Второй метод представлял собой вытеснительную ЖХВР для определения димера и родственных субстанций более высокой молекулярной массы.
Метод ОФ-ЖХВР применяли для определения деаминирования и окисления целого ряда различных композиций, которые вплоть до 65 недели хранили при 2-8°С. Данные приведены ниже в таблицах 1-3 и в виде графиков на фиг.1-3.
В таблице 4 приведены результаты опытов по определению стабильности композиции V, которую хранили при 2-8°С.
Указанный ниже метод вытеснительной ЖХВР (данные не приведены) использовали для оценки агрегации. Ни в одном случае в процессе исследования были выявлены поддающиеся количественной оценке димеры и родственные субстанции более высокой молекулярной массы. Во всех композициях обнаружено менее 1% агрегации (фактически в пределах допустимых уровней определения в этом тесте), т.е. агрегация не была обнаружена.
Результаты ясно свидетельствуют о том, что фосфатный буфер превосходит цитратный буфер с точки зрения стабилизации композиций, а также о том, что отсутствие поверхностно-активного вещества Pluronic приводит к более высокой стабильности.
Таблица 1
Изучение стабильности (2-8°С)
Композиция А (с Pluronic, фосфатный буфер, рН 5,6)
| чГР | 3,33 мг/мл |
| Pluronic | 0,8 мг/мл |
| фосфатный буфер | 10 мМ |
| хлорид натрия | 5,9 мг/мл |
| бензиловый спирт | 9 мг/мл |
| Время (недели) | Чистота чГР, % | log % чистоты чГР |
| 0 | 98,90 | 1,9952 |
| 3 | 98,35 | 1,9928 |
| 9 | 97,84 | 1,9905 |
| 13 | 97,05 | 1,9870 |
| 30 | 96,26 | 1,9834 |
| К день-1 × 104 | -1,253 |
Композиция Б (без Pluronic, фосфатный буфер, рН 5,6)
| чГР | 3,33 мг/мл |
| фосфатный буфер | 10 мМ |
| хлорид натрия | 5,9 мг/мл |
| бензиловый спирт | 9 мг/мл |
| Время (недели) | Чистота чГР, % | log % чистоты чГР |
| 0 | 96,28 | 1,9835 |
| 0 | 95,88 | 1,9817 |
| 4 | 95,45 | 1,9798 |
| 4 | 95,80 | 1,9814 |
| 15 | 95,67 | 1,9808 |
| 15 | 95,89 | 1,9818 |
| 26 | 94,46 | 1,9752 |
| 26 | 93,94 | 1,9729 |
| 39 | 94,15 | 1,9738 |
| 52 | 93,21 | 1,9695 |
| k день-1 × 104 | -0,8272 |
Таблица 2
Изучение стабильности (2-8°С)
| чГР | 3,33 мг/мл |
| Pluronic | 0,8 мг/мл |
| цитратный буфер | 10 мМ |
| хлорид натрия | 5,9 мг/мл |
| бензиловый спирт | 9 мг/мл |
Композиции В1 и В2 (рН 5,6 цитратный буфер + Pluronic)
| Время (недели) | Чистота чГР, % | log % чистоты чГР |
| 0 | 97,89 | 1,9907 |
| 0 | 97,93 | 1,9909 |
| 4 | 97,12 | 1,9873 |
| 4 | 96,80 | 1,9859 |
| 13 | 95,44 | 1,9770 |
| 13 | 94,85 | 1,9818 |
| 26 | 93,19 | 1,9694 |
| 26 | 93,60 | 1,9713 |
| 52 | 91,32 | 1,9606 |
| 52 | 91,06 | 1,9593 |
| 0 | 97,48 | 1,9889 |
| 0 | 97,71 | 1,9899 |
| 4 | 96,93 | 1,9865 |
| 4 | 96,92 | 1,9864 |
| 13 | 94,89 | 1,9772 |
| 13 | 95,38 | 1,9795 |
| 26 | 92,59 | 1,9666 |
| 26 | 92,65 | 1,9668 |
| 52 | 90,69 | 1,9576 |
| 52 | 91,11 | 1,9596 |
| k день-1 × 104 | -1,954 |
Таблица 3
Изучение стабильности (2-8°С)
Композиция Г
| чГР | 3,33 мг/мл |
| фосфатный буфер | 10 мМ, рН 6,0 |
| хлорид натрия | 5,9 мг/мл |
| бензиловый спирт | 9 мг/мл |
| Время (недели) | Чистота чГР, % | log % чистоты чГР |
| 0 | 98,47 | 1,9933 |
| 4 | 97,82 | 1,9904 |
| 9 | 97,44 | 1,9887 |
| k день-1 × 104 | -1,65 |
Изучение стабильности (2-8°С)
Композиции Д1, Д2 и Д3 (цитратный буфер, рН 6,0, с Pluronic)
| чГР | 3,33 мг/мл |
| Pluronic | 0,8 мг/мл |
| цитратный буфер | 10 мМ |
| хлорид натрия | 5,9 мг/мл |
| бензиловый спирт | 9 мг/мл |
| Время (недели) | Чистота чГР, % | log % чистоты чГР |
| 0 | 97,75 | 1,99017 |
| 0 | 97,56 | 1,9893 |
| 5 | 96,06 | 1,9825 |
| 5 | 96,95 | 1,9865 |
| 9 | 96,29 | 1,9836 |
| 9 | 96,12 | 1,9828 |
| 0 | 97,96 | 1,9910 |
| 0 | 97,93 | 1,9909 |
| 5 | 97,06 | 1,9872 |
| 9 | 96,52 | 1,9846 |
| 9 | 96,51 | 1,9846 |
| 0 | 98,54 | 1,9936 |
| 0 | 98,47 | 1,9933 |
| 5 | 97,68 | 1,9898 |
| 5 | 97,43 | 1,9887 |
| 9 | 96,67 | 1,9853 |
| 9 | 96,77 | 1,9857 |
| k день-1 × 104 | -2,55 |
| Таблица 4 | ||
| Изучение стабильности; композиция V, (2-8°С) | ||
| Время (недели) | Чистота чГР, % | log % чистоты чГР |
| 0 | 97,21 | 1,988 |
| 0 | 97,23 | 1,988 |
| 4,5 | 96,50 | 1,9798 |
| 4,5 | 96,65 | 1,985 |
| 9 | 95,18 | 1,985 |
| 9 | 95,19 | 1,979 |
| 13 | 95,23 | 1,979 |
| 13 | 95,32 | 1,979 |
| 26 | 94,64 | 1,976 |
| 26 | 94.41 | 1,975 |
| k день-1 × 104 | -2,489 |
Пример 4. Устранение кристаллизации путем регулирования рН жидких композиций
Создавали серии вариантов композиции VI с различными значениями рН (возрастание на 0,1 единицы) путем регулирования соответствующих количеств компонентов фосфатного буфера. Аликвотами по 1,5 мл композиций заполняли соответствующие капсулы, применяемые с ручными инжекторами. Капсулы хранили при 15°С в течение 3 месяцев. Присутствие или отсутствие кристаллов в капсулах определяли визуально в течение периода хранения.
Кристаллизация была обнаружена в композициях, значение рН которых было ниже 6,2, т.е. при рН 6,1. Кристаллизация не была обнаружена в композициях, значение рН которых составляло 6,2 и выше.
Для сравнения, в композиции V (рН 6,0) при хранении при 15°С или 25°С в течение до 6 недель происходила кристаллизация. В композиции V (рН 6,0) при хранении при 2-8°С в течение 2-3 месяцев также была обнаружена кристаллизация.
1. Мультидозная стабильная при хранении жидкая композиция гормона роста, в основном включающая гормон роста в изотоническом забуференном фосфатном растворе, консервант и неионогенное поверхностно-активное вещество, где изотоничность забуференному фосфатом раствору придают с помощью нейтральной соли, моносахарида, дисахарида или сахарного спирта, а рН композиции находится в диапазоне от 6,15 до 6,5, и, в которой при хранении не происходит заметной кристаллизации.
2. Композиция по п.1, которую можно хранить в течение по меньшей мере 1 месяца, предпочтительно 6 недель, более предпочтительно в течение периода времени от примерно 1 до 4 месяца, наиболее предпочтительно 3 месяцев.
3. Композиция по п.1, которую можно хранить при температуре примерно 2°С или выше, предпочтительно примерно 4°С или выше, более предпочтительно при температуре в диапазоне примерно от 2 до менее 40°С, еще более предпочтительно при температуре в диапазоне примерно от 2 до 25°С, наиболее предпочтительно при 15°С.
4. Композиция по п.1, которой кристаллизацию можно обнаружить визуально, предпочтительно с помощью с