Способ получения замещенных n-адамантил-п-нитрозоариламинов
Иллюстрации
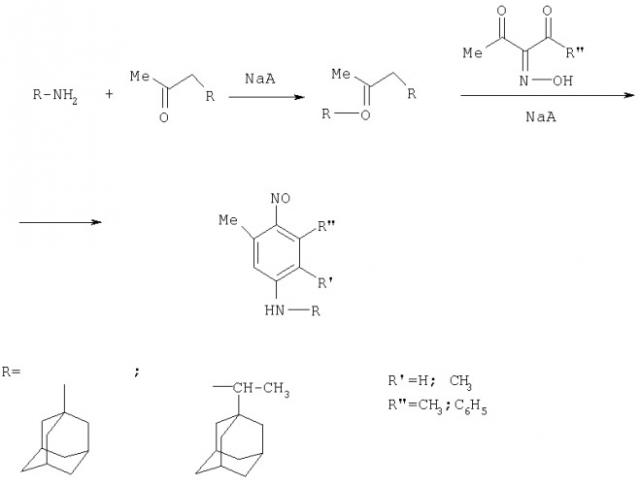
Показать всеИзобретение относится к области органической химии, а именно к способу получения N-адамантил-п-нитрозоариламинов формулы
где R1=Me, Ph; R2=H, Ме; R3=
которые могут найти применение как биологически активные вещества. Техническим результатом предлагаемого способа получения является получение ранее не описанных замещенных N-адамантил-п-нитрозоариламинов.
Реферат
Изобретение относится к области органической химии, а именно к способам получения N-адамантил-п-нитрозоариламинов формулы
где R1=Me, Ph; R2=H, Ме; R3=
которые могут найти применение в качестве биологически активных веществ.
В настоящее время известно несколько способов получения N-адамантил-п-нитрозоариламинов. В них арилъное кольцо вводится в соединение без изменения углеродного скелета.
Известен способ получения на основе бензальдегида. В этом способе из 1-аминоадамантана и бензальдегида получают аминоадамантил-N-бензилиден PhCH=N-Ad, гидрированием которого получают PhCH2-NH-Ad [пат. Австрал. Кл. 09.6, 87.1; 34.2, 09. 10. (С 07 с, A 61k, A 23k), №276243. Paulshock Marvm, Watts Yohn Conway. Aminoadamantanes with therapeutic activities and their prepation. заявл. 7.05.63., опубл. 29.06.67.]
Известен синтез N-2-адамантилдиаминов в две стадии. Первая стадия: восстановительное аминирование 2-адамантанона нитроанилинами. Вторая стадия: восстановление нитрогруппы в N-(2-адамантил) нитроанилинах [Волобоев С.Н., Бутенко Л.Н., Новаков И. А.//Химия и технология элементоорганических мономеров и полимерных материалов: Сборник научных трудов / Волгогр. гос. техн. ун-т. - Волгоград, 1999. - с.3-10].
Известна реакция Лейкарта (взаимодействие альдегидов или кетонов с формиатом аммония, формамидом или их замещенными производными). Взаимодействием адамантан-2-она с бензамидом или с анилином в муравьиной кислоте получают N-2-адамантиланилин [Лаврова Л.Н., Климова Н.В. и др. ЖОрХ, вып.4, 1974, с.761-765].
Недостатками известных способов является то, что все описанные выше способы получения N-адамантилариламинов позволяют получить только простейшие представители соединений рассматриваемого класса. Связано это с тем, что все существующие способы получения основаны на использовании в качестве исходных продуктов ароматических соединений.
Наиболее близким способом того же назначения к заявленному изобретению является способ получения N-арил-N-(1-адамантилметил)аминов [Волобоев С.Н., Бутенко Л.Н., Новаков И.А. // Химия и технология элементоорганических мономеров и полимерных материалов: Сборник научных трудов / Волгогр. гос. техн. ун-т. - Волгоград, 1999. - с.3-10.]. В этом способе N-арил-N-(1-адамантилметил)амины получены восстановительным N-алкилированием ароматических аминов 1-адамантилальдегидом по реакции Валлаха. Реакция проводится без растворителя в присутствии 4-кратного мольного избытка абсолютной муравьиной кислоты.
Недостатками этого способа являются применение абсолютной муравьиной кислоты и возможность получения только простейших представителей соединений рассматриваемого класса.
Изобретение решает задачу создания способа получения замещенных N-адамантил-п-нитрозоариламинов с более широким рядом заместителей.
Техническим эффектом предлагаемого способа получения является получение ранее не описанных замещенных N-адамантил-п-нитрозоариламинов.
Указанный технический результат при осуществлении изобретения достигается тем, что способ получения N-адамантил-п-нитрозоариламинов формулы
где R1=Me, Ph; R2=H, Ме; R3=
из аминов, осуществляют в одну стадию циклоконденсацией изонит-розо-β-дикетонов с кетонами и N-адамантиламинами H2NR, где а) R=Ad, б) R=CH(CH3)-Ad в присутствии органического растворителя при комнатной температуре.
Способ получения N-адамантил-п-нитрозоариламинов осуществляют следующим образом.
Изонитрозо-β-дикетоны смешивают с кетонами и N-адамантиламинами в органическом растворителе в присутствии цеолитов при комнатной температуре. Образующиеся N-адамантил-п-нитрозоариламины очищают от исходных веществ, экстрагируют и выделяют после упаривания экстрагента.
Этим способом получены не описанные ранее вещества:
3,5-диметил-N-адамантил-п-нитрозоанилин.
Кристаллы зеленого цвета растворимы в ацетоне, этаноле, хлороформе, Т.пл. 170°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (32000), 690 (75). Найдено, %: С 75,73; Н 9,29; N 9,55. С18H24N2. Вычислено, %: С 75,99; Н 8,44; N 9,85.
2,3,5-триметил-N-адамантил-п-нитрозоанилин.
Кристаллы зеленого цвета растворимы в ацетоне, этаноле, хлороформе, Т.пл. 135°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (26000), 700 (59). Найдено, %: С 76,23; Н 9,11; N 9,96. С19H26N2. Вычислено, %: С 76,45; Н 8,72; N 9,39.
3-метил-5-фенил-N-адамантил-п-нитрозоанилин.
Кристаллы зеленого цвета, растворимы в ацетоне, этаноле, хлороформе, Т.пл. 125°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (21500), 700 (60). Найдено, %: С 78,83; Н 6,95; N 7,71. С23Н25N2. Вычислено, %: С 79,71; Н 7,51; N 8,09.
3,5-диметил-N-(1-адамантил)этил-п-нитрозоанилин.
Кристаллы зеленого цвета, растворимы в ацетоне, этаноле, хлороформе, Т.пл. 145°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (29000), 690 (67). Найдено, %: С 76,90; Н 8,53; N 8,91. С20Н26N2. Вычислено, %: С 76,84; Н 8,96; N 8,96.
3-метил-5-фенил-N-(1-адамантил)этил-п-нитрозоанилин.
Кристаллы зеленого цвета, растворимы в ацетоне, этаноле, хлороформе, Т.пл. 120°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (23000), 690 (74). Найдено, %: С 79,09; Н 8,77; N 8,06. С25Н30N2. Вычислено, %: С 80,16; Н 8,02; N 7,48.
Пример 1. Получение 3,5-диметил-N-адамантил-п-нитрозоанилина.
Смесь 0.01 моль изонитрозоацетилацетона, 0.07 моль ацетона, 0.009 моль 1-аминоадамантана и 2-2.5 г цеолита в 20 мл циклогексанола выдерживают 168 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 60%. Т.пл. 170°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (32000), 690 (75). Найдено, %: С 75,73; Н 9,29; N 9,55. C18H24N2. Вычислено, %: С 75,99; Н 8,44; N 9,85.
Пример 2. Получение 2,3,5-триметил-N-адамантил-п-нитрозоанилина.
Смесь 0.01 моль изонитрозоацетилацетона, 0.07 моль метилэтилкетона, 0.009 моль 1-аминоадамантана и 2-2.5 г цеолита в 20 мл этиленгликоля выдерживают 168 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 30%. Т.пл. 135°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (26000), 700 (59). Найдено, %: С 76,23; Н 9,11; N 9,96. C19H26N2.Вычислено, %: С 76,45; Н 8,72; N 9,39.
Пример 3. Получение 3-метил-5-фенил-N-адамантил-п-нитрозоанилина.
Смесь 0.01 моль изонитрозобензоилацетона, 0,07 моль ацетона, 0.009 моль 1-аминоадамантана и 2-2,5 г цеолита в 30 мл пиридина выдерживают 240 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 20%. Т.пл. 125°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (21500), 700 (60). Найдено, %: С 78,83; Н 6,95; N 7,71. С23Н25N2. Вычислено, %: С 79,71; Н 7,51; N 8,09.
Пример 4. Получение 3,5-диметил-N-(1-адамантил)этил-п-нитрозоанилина.
Смесь 0,01 моль изонитрозоацетилацетона, 0.07 моль ацетона, 0.009 моль N-(1-адамантил)этиламина и 2-2.5 г цеолита в 20 мл циклогексанола выдерживают 240 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора HCl, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 20%. Т.пл. 145°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (29000), 690 (67). Найдено, %: С 76,90; Н 8,53; N 8,91. C20H28N2. Вычислено, %: С 76,84; Н 8,96; N 8,96.
Пример 5. Получение 3-метил-5-фенил-N-(1-адамантил)этил-п-нитрозоанилина.
Смесь 0-01 моль изонитрозобензоилацетона, 0,07 моль ацетона, 0.009 моль N-(1-адамантил)этиламина и 2-2.5 г цеолита в 20 мл этиленгликоля выдерживают 240 часов при 20°С, затем выливают в 250 мл воды со льдом и экстрагируют диэтиловым эфиром (2×15 мл). Экстракт дважды промывают 15 мл 5% раствора НС1, затем дважды 15 мл 5% раствора NaOH, а затем 50 мл воды. Эфир упаривают, выделившийся маслянистый остаток промывают петролейным эфиром до образования зеленых кристаллов. Выход 15%. Т.пл. 120°С. Электронный спектр, λмакс, нм(ε), этанол: 410 (23 000), 690 (74). Найдено, %: С 79,09; Н 8,77; N 8,06. С25H30N2. Вычислено, %: С 80,16; Н 8,02; N 7,48.
Полученные авторами, не описанные ранее замещенные N-адамантил-п-нитрозоариламины могут найти применение в качестве биологически активных веществ в препаратах медицинского назначения.
Способ получения замещенных N-адамантил-п-нитрозоариламинов общей формулы
где R1=Me, Ph; R2=H, Ме; R3=
из аминов, отличающийся тем, что изонитрозо-β-дикетоны подвергают циклоконденсации с кетонами и N-адамантиламинами H2NR3, где a) R3=Ad, б) R3=CH(Me)-Ad в присутствии органического растворителя.