Способ получения вещества, выбранного из ряда: бор, фосфор, кремний и редкие тугоплавкие металлы (варианты)
Иллюстрации
Показать всеСпособ позволяет получать вещества высокой степени чистоты из дешевого загрязненного примесями сырья, например такого как природные рудные концентраты. Техническим результатом является исключение образования и сброса в окружающую среду технологических отходов. Сущность заявляемой группы изобретений заключается в использовании в качестве галогена-окислителя для оксид- (или сульфид-) содержащего исходного сырья элементного фтора, что позволяет уже на стадии вскрытия получать извлекаемые из него фториды в высокочистом виде (более 99,99 мас.%) и использовать их в качестве исходных соединений для дальнейшего восстановления чистых веществ, и в осуществлении круговорота окислителя - элементного фтора. Круговорот осуществляют за счет выполнения операции восстановления вещества с одновременным получением элементного фтора, направляемого на операцию фторирования исходного сырья. За счет круговорота окислителя - фтора технология становится безреагентной, практически полностью исключается тепловое и химическое загрязнение окружающей среды. 2 н. и 15 з.п. ф-лы, 2 ил.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к химическим технологиям и может быть использовано в химической промышленности и в металлургии для получения высокочистых веществ из указанного ряда.
Уровень техники
К тугоплавким редким металлам относятся переходные элементы IV-VII групп периодической системы, у которых происходит достройка электронного d-уровня: титан Ti, цирконий Zr, ванадий V, ниобий Nb, тантал Та, молибден Мо, вольфрам W и рений Re. Объединение в один ряд перечисленных металлов, а также неметаллов кремния, бора и фосфора обусловлено схожестью их физическо-химических свойств.
Известно получение фосфора электротермическим восстановлением из фосфоритов и апатитов коксом при t=1400-1600°C в присутствии кремнезема SiO2 (см. Химический энциклопедический словарь, М.: Советская энциклопедия, 1983 г., стр.628-629). К недостаткам способа можно отнести его многопередельность и сложность осуществления высокотемпературных операций.
Известен способ получения вольфрама из его концентрата с содержанием 55-65% оксида вольфрама (WO3) восстановлением водородом при t=800-900°С (см. Химический энциклопедический словарь. - М.: Советская энциклопедия, 1983 г.). Недостатком способа является сложность получения WO3 из природных минералов шеелита CaWO4 и вольфрамита (Fe, Mn) WO4.
Известен способ получения полупроводникового кремния восстановлением из трихлорсилана (SiHCl3) водородом (см. Э.С.Фалькевич. Технология полупроводникового кремния. - М.: Металлургия, 1992 г., стр.214-215). Однако процесс достаточно сложный, проходящий с получением вредных газообразных отходов, утилизация которых представляет большую проблему.
Известно получение аморфного бора из борного ангидрида В2O3 металлотермическим восстановлением магнием, а также получение кристаллического бора восстановлением галогенидов BCl3 или BF3 водородом (см. Химическая энциклопедия, т.1, М.: Советская энциклопедия, 1988 г., стр.300).
Известен способ получения чистого циркония (А.Н.Зеликман. Металлургия тугоплавких редких металлов. М.: Металлургия, 1986 г., стр.414-416) из тетрафторида кальциетермическим восстановлением: ZrF4+2Ca=Zr+2CaF2.
Известны способы получения ниобия и титана из их высших хлоридов NbCl5, TiCl4 металлотермическим восстановлением магнием Mg или натрием Na (см. А.Н.Зеликман. Металлургия редких металлов. М.: Металлургия, 1980 г.):
2NbCl5+5Mg=2Nb+5MgCl2 или TiCl4+2Mg=Ti+2MgCl2
Однако эти способы отличаются сложностью проведения операций, требуют использования дорогостоящих высокочистых восстановителей - магния, натрия или кальция, что предопределяет осуществление дополнительных операций по их восстановлению и очистке для повторного использования. Все это ведет к усложнению и удорожанию производства.
Современная промышленность предъявляет высокие требования к чистоте используемых веществ. Вместе с тем для получения веществ высокой степени чистоты любым из вышеуказанных способов необходимо обеспечить высокую степень чистоты исходных соединений - оксидов, хлоридов, фторидов. Однако высокочистые соединения являются дорогостоящим сырьем, т.к. в основном вещества указанного ряда распространены в природе в виде минералов, имеющих сложный комплексный состав. Например, титан распространен в таких минералах, как ильменит FeTiO3, титанит CaTiO(SiO4), тантал и ниобий - в лопаритах (Ne,Ce,Ca)2(Ti,Nb,Ta)2O6, танталите, бор - в датолитах (CaBSiO4(OH)), буре (Na2B4O7), ванадий - в титаномагнетитовых и осадочных железных рудах, цирконий - в цирконе (ZrSiO4), фосфор - в апатите (Са5[PO4]3(F,Cl)) и фосфорите (Са5[PO4]3(ОН,СО3)), молибден содержится в виде оксидных соединений в молибдите Fe2(MoO4)3 или повелитте CaMoO4, и в виде сульфидных соединений - в молибдените MoS2, рений не образует собственных минералов и содержится в качестве примеси, изоморфно замещая молибден в молибдените или медь в медных концентратах.
Получение чистых соединений оксидов или хлоридов требует осуществления ряда сложных технологических процессов по обогащению, очистке от примесей и комплексной переработке природного рудного сырья. Так, известен способ получения высокочистого молибдена (см. А.Н.Зеликман, Молибден, М., 1970), согласно которому сначала молибденитовые концентраты (с содержанием 48-50% Мо) подвергают окислительному обжигу, образовавшийся огарок МоО3 с примесями растворяют в аммиачной воде, из полученного раствора (NH4)2 MoO4 выделяют очищенный от примесей (NH4)6 Мо7O24·4Н2O, который термически разлагают до чистого МоО3, который затем восстанавливают водородом при t=900-1000°С до молибдена. Для получения рения высокой чистоты, осуществляемого водородным восстановлением из его оксида или фторида, также необходимо осуществить ряд операций по получению Re2O7 или ReF6 из промежуточных соединений, сопутствующих получению МоО3.
В некоторых случаях использование дорогостоящего исходного сырья может привести к нерентабельности получения из него чистого вещества. Гораздо более дешевым исходным сырьем для получения тугоплавких металлов, а также бора, фосфора и кремния, являются непосредственно рудные концентраты - оксидные и сульфидные.
Из вышеприведенного следует, что все вещества указанного ряда могут быть получены восстановлением из высших соединений галогенов, поэтому в качестве прототипа для обоих вариантов способа выбран хлоридный способ переработки рудных концентратов (см. А.Н.Зеликман. Металлургия редких металлов. М.: Металлургия, 1980 г., стр.236-243). Способ имеет наибольшее промышленное применение и включает обработку оксидов газообразным элементным хлором в присутствии восстановителя (углерода) при температуре выше 900°С, разделение посредством конденсации продуктов хлорирования для последующего восстановления из них металлов. Восстановление осуществляют либо водородом, либо металлотермическим способом с применением в качестве восстановителя магния, кальция или натрия либо электролитическим способом.
В случае переработки сульфидов хлоридным методом предварительно осуществляют окисление сульфидов кислородом с целью получения оксидов вещества.
Основной недостаток хлоридного способа - сравнительно невысокая степень очистки от примесей, что обусловлено близкими значениями температур возгонки (или конденсации) основных компонентов выходящей из хлоратора парогазовой смеси и, как следствие, невозможность четкого и эффективного разделения всех компонентов концентрата, а значит, невозможность получения высокочистых хлоридов, являющихся исходными соединениями для последующего восстановления из них чистых веществ. Переработка данным методом многопередельна и связана с большими потоками сырья и вспомогательных материалов и, как следствие, - образование при хлорировании значительных объемов твердых, жидких и газообразных отходов, включающих токсичные и агрессивные газы: элементный хлор, хлороводород, оксиды углерода, фосген, обезвреживание которых представляет собой сложную и дорогостоящую инженерную проблему. Кроме того, хлор имеет большую агрессивность по отношению к оборудованию, вследствие чего последнее требует практически полной замены при эксплуатации менее года. Еще одним недостатком указанного метода является необходимость применения дорогих восстановителей - магния, кальция или натрия, т.к. не все редкие тугоплавкие металлы можно восстановить из хлоридов, используя дешевый метод восстановления посредством электричества. Например, до сих пор не удалось получить электролизом металлический титан из TiCl4, имеющего низкую растворимость и высокое парциальное давление в расплаве эвтектики.
Раскрытие изобретения
Заявляемым изобретением решается задача получения высокочистых веществ сравнительно недорогим и экологически чистым способом за счет использования недорогого имеющего невысокую степень чистоты сырья и создания в технологическом процессе круговорота используемого окислителя.
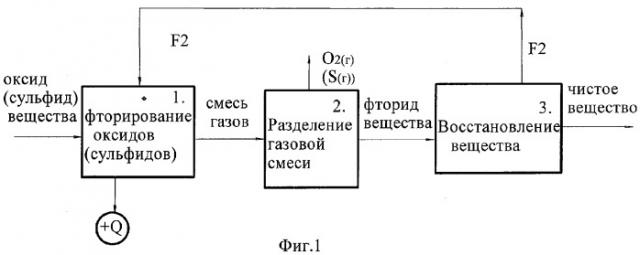
Поставленная задача решена за счет того, что в способе получения вещества, выбранного из ряда: бор, фосфор, кремний и редкие тугоплавкие металлы, включающем взаимодействие оксида вещества с галогеном-окислителем с образованием газообразного галогенида, выделение галогенида из смеси сопутствующих газов и последующее восстановление из него чистого вещества, согласно заявляемому изобретению в качестве галогена-окислителя используют элементный фтор, фторируют оксид вещества элементным фтором с образованием газообразного фторида, а восстановление вещества из выделенного фторида осуществляют с одновременным получением элементного фтора, возвращаемого на операцию фторирования оксида.
Поставленная задача решена также за счет того, что в способе получения редких тугоплавких металлов молибдена и/или рения из сульфидов (сульфидных соединений), включающем получение газообразного галогенида металла, выделение указанного галогенида из смеси сопутствующих газов и последующее восстановление из него чистого металла, согласно заявляемому изобретению, галогенид получают взаимодействием сульфида металла с галогеном-окислителем, в качестве которого используют элементный фтор, выделяют полученный в результате фторирования сульфида фторид металла, из которого осуществляют восстановление металла с одновременным получением элементного фтора, возвращаемого на операцию фторирования сульфида.
В отличие от прототипа в качестве окислителя в любом варианте способа используют элементный фтор, являющийся самым сильным из простых веществ окислителем, что позволяет получить устойчивый высший фторид вещества из указанного ряда взаимодействием непосредственно оксида (для первого варианта) или сульфида вещества (для второго варианта) с элементным фтором. При этом все вещества предлагаемого ряда образуют с элементным фтором летучие фториды, что позволяет использовать для любого вещества ряда предлагаемый способ. Значительные различия физических свойств, в том числе температур кипения (возгонки), фторидов химических элементов указанного ряда от попутно выделяющихся газов, в том числе основных сопутствующих примесей, позволяет четко выделить фторид получаемого вещества из состава газовой смеси.
Этот факт позволяет использовать в качестве исходного дешевое недостаточно чистое сырье и уже на стадии вскрытия получать извлекаемые из него фториды в высокочистом виде (более 99,99 мас.%) и использовать их в качестве исходных соединений для дальнейшего восстановления из них чистых веществ.
При этом получение высших фторидов осуществляется за одну операцию в отличие от хлоридного способа переработки сульфидов и без применения каких-либо активизирующих добавок.
Другим отличительным признаком способа (для обоих вариантов) является осуществление восстановления вещества из выделенного фторида с одновременным получением элементного фтора. Выделенный элементный фтор собирают и используют повторно на операции фторирования оксидов (или сульфидов для второго варианта). За счет круговорота окислителя - фтора технология становится практически безреагентной, т.е. исключается специальное введение в процесс реагентов (окислителей) для осуществления реакций, практически полностью исключается тепловое и химическое загрязнение окружающей среды, более того, происходит обогащение атмосферы за счет выделяющегося при сжигании оксидов кислорода.
Таким образом, за счет использования элементного фтора в качестве фторирующего агента и его воспроизводства и рециркуляции в обоих вариантах способа обеспечивается получение одного и того же технического результата, а именно: высокой степени чистоты конечного продукта и его невысокой стоимости за счет использования недорогого загрязненного примесями сырья и уменьшения количества переделов (операций) процесса.
Из уровня техники известно использование фтора в качестве окислителя для оксида циркония (см. А.Н.Зеликман. Металлургия тугоплавких редких металлов. М.: Металлургия, 1986 г, стр.414-415). В результате окисления получают тетрафторид циркония, из которого восстанавливают кальцием чистый цирконий с попутным выделением дифторида кальция. Таким образом, фтор остается связанным кальцием. В то же время требуется постоянное поступление в технологический процесс элементного фтора извне для окисления оксида циркония. Однако фтор является дорогостоящим окислителем, получение которого специально для введения в процесс - отдельным производством с доставкой к месту использования является большой технической проблемой.
В заявляемом решении (в обоих вариантах) в отличие от вышеуказанного способа в цикле производства высокочистых веществ не только расходуют фтор для окисления оксидов (или сульфидов), но и осуществляют получение элементного фтора при восстановлении вещества из высшего фторида, т.е. осуществляется рециркуляция элементного фтора, что решает вышеназванные проблемы.
Второй вариант способа предназначен для получения молибдена и рения, относящихся к ряду редких тугоплавких металлов, получение которых предложено в первом варианте способа. Остальные указанные в первом варианте способа вещества в основном содержатся в оксидной форме. Молибден и рений образуют оксиды и потому могут быть получены по первому варианту способа, однако наибольшее промышленно важное распространение в природе имеют сульфидные соединения упомянутых металлов.
Предложенная во втором варианте способа альтернатива раздельного или совместного получения металлов (молибдена и/или рения) не противоречит и не изменяет сущности способа и основана на том, что рений не образует собственных минералов и распространен в природе в виде примеси, сопутствующей молибдену в его сульфидсодержащих минералах. Совместное получение металлов (получение в одном производстве) возможно, например, в случае использования в качестве исходного сульфидсодержащего сырья - молибденита, при фторировании которого образуются газообразный фторид молибдена, а также газообразный фторид рения как сопутствующей примеси. Из выделенных фторидов осуществляют получение чистых металлов.
Таким образом, оба варианта способа получения веществ относятся к одному виду объектов изобретения, содержат однотипные операции и направлены на получение одного и того же технического результата. Из чего можно сделать вывод о соответствии изобретения требованию «единства изобретения».
Применение заявляемого способа позволяет получать высокочистые вещества: бор, фосфор, кремний и любой редкий тугоплавкий металл за значительно меньшее число стадий и при значительном снижении отходов производства и вредных выбросов.
Фтор характеризуется низким коррозионным воздействием на аппаратуру и коммуникации, что позволяет при правильной организации проведения фторидных технологических процессов эксплуатировать оборудование без капитальных ремонтов в течение 10 и более лет. Реакция фторирования является экзотермической, проводимой с принудительным отбором тепла. Возможность дополнительного получения тепловой энергии повышает экономическую эффективность предлагаемого способа.
Предпочтительным является использование в качестве исходного сырья оксидных или сульфидных рудных концентратов. Например, для получения титана - рутила, содержащего 95 мас.% TiO2, для получения ниобия, тантала и титана - лопарита, для получения кремния - кварцита, содержащего 97 мас.% SiO2, и др. (Остальная мас. доля - это примеси в виде оксидов железа, алюминия, магния, и проч.)
Фторирование оксидов и сульфидов редких тугоплавких металлов и кремния осуществляют в пламенных реакторах шахтного типа распылением порошка оксида или сульфида получаемого вещества в струе элементного фтора.
Фторирование борного ангидрида осуществляют барботированием элементного фтора через расплав оксида.
Разделение газовой смеси может быть осуществлено любым известным способом, однако предпочтительным является применение системы раздельной конденсации, при которой фторид охлаждается ниже своей температуры кипения, конденсируется и выводится из состава смеси.
Обычно газовую смесь перед выделением фторида дополнительно пропускают через фильтр тонкой очистки, позволяющий отделить уносимую газовой фазой пыль, содержащую частицы твердых фторидов и непрореагировавших оксидов (сульфидов).
Для восстановления любого вещества указанного ряда при фторидном способе производства можно применить электролитический способ восстановления из низкоплавкой эвтектики фторидных солей (LiF-KF-NaF) при температуре 550-600°С.
Примеси, образующие с фтором твердые нелетучие фториды, включая кальций, алюминий, железо и другие, удаляют на стадии фторирования в виде образующегося при сжигании огарка.
Осуществление изобретения
Технологический процесс с использованием элементного фтора может быть осуществлен на оборудовании предприятий ядерного топливного цикла. Оборудование, выполненное из углеродистой и нержавеющей сталей, имеет в безводных фторсодержащих средах высокую коррозионную стойкость, что позволяет его эксплуатировать без капремонта не менее 10 лет. Кроме того, на предприятиях при работе с элементным фтором и фторидными соединениями отработано строгое обеспечение санитарных норм.
На фиг.1 - представлена обобщенная структурная схема технологического процесса получения высокочистых веществ предлагаемым способом.
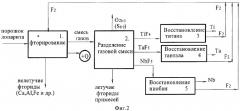
На фиг.2 - пример осуществления способа получения титана, тантала и ниобия из лопаритовых концентратов, структурная схема технологического процесса.
Пример 1. Получение высокочистого порошка бора из ангидрида бора В2O3. Порошок ангидрида бора загружают в герметичный реактор и плавят при t=450-475°C. Под слой расплавленного В2O3 подают через барботер элементный фтор и осуществляют процесс фторирования по реакции:
Образовавшуюся газовую смесь подают в трубчатый конденсатор, охлаждаемый жидким азотом, и при t=-93-100°С сжижают трифторид бора, который собирают в охлаждаемый герметичный баллон. Несконденсированный газообразный кислород сбрасывают через аппарат санитарной очистки в атмосферу. Сжиженный трифторид бора испаряют из баллона при комнатной температуре и подают в герметичный электролизер под слой расплава фторидной эвтектики (LiF-KF-NaF) при 550-600°С, насыщение расплава ведут до 12-15 мас.% по BF3, при этом происходят реакции:
На электроды электролизера подают напряжение постоянного тока U=5-6 вольт, I=100-120 ампер, или более в зависимости от производительности электролизера. На металлическом катоде происходит процесс восстановления катионов бора с получением порошка бора, а на графитовом аноде получают элементный фтор.
Образовавшийся порошок бора в смеси с расплавом электролита снимают с катода и отмывают от электролита растворами соляной кислоты и деионизованной водой. Высокочистый порошок бора (≥99,99 мас.%) упаковывают в герметичную тару и реализуют в качестве товарной продукции. Элементный фтор собирают над расплавом электролита и из-под крышки герметичного электролизера подают в начало процесса для осуществления реакции (1).
Пример 2. Получение высокочистого порошка фосфора.
В отличие от других оксидов фторирование оксида фосфора осуществляют в газообразном состоянии. Для чего исходное сырье в виде порошка оксида фосфора Р4O10 сначала плавят при t=24-26°С, затем испаряют при 175-200°С. Получаемые пары Р4O10 смешивают в горелке с элементным фтором и осуществляют реакцию фторирования;
Все дальнейшие процессы выделения из газовой смеси фторида и электролиз PF5 с получением высокочистого порошка фосфора осуществляют аналогично примеру 1.
Пример 3. Получение высокочистых редких металлов ниобия, тантала и титана из лопаритовых концентратов (структурная схема процесса приведена на фиг.2).
Рудный концентрат, поступающий в переработку, содержит 8.5-9% (Nb2O5 и Та2O5), 34-36% TiO2, 6-8% CaO, 7-8% Na2O, а также оксиды Се, К, Al, Fe и др.
Фторирование оксидов осуществляют в пламенном реакторе шахтного типа при избытке элементного фтора. В форсунку специальной фтородувкой подают элементный фтор, являющийся самым сильным из простых веществ окислителем, туда же подают предварительно измельченный в порошок рудный концентрат. Реакции взаимодействия с фтором протекают на поверхности соприкосновения твердой и газовой фаз, чем выше удельная поверхность соприкосновения фтора и твердой фазы, тем выше скорость реакции, поэтому осуществляют распыление порошка концентрата в струе фтора. Газовзвесь вспыхивает без какого-либо подогрева и сгорает в факеле. При этом происходят реакции, основными из которых являются следующие:
Реакции фторирования оксидов являются экзотермическими и осуществляются с принудительным отбором тепла, которое может быть использовано на конкретные нужды потребителя.
В результате фторирования лопаритового концентрата образуется газовая фаза, содержащая TiF4, NbF5, TaF5 и кислород, и нелетучий остаток примесей, включающий фторидные соединения алюминия, кальция и железа (CaF2, AlF3, FeF3). Твердый огарок примесей выделяют и перерабатывают электролитическим способом или используют в качестве фторидных флюсов в цветной или черной металлургии.
Газовую смесь пропускают через пылеулавливающие фильтры и разделяют на индивидуальные компоненты, используя различия температур кипения составляющих газов. Охлаждаясь до своей температуры кипения, фторид конденсируется и выводится из состава смеси на фильтре тонкой очистки.
Первоначально из состава смеси выводится фторид титана TiF4, охлажденный до t=287°C, затем фторид тантала TaF5 при t=237,5°С и фторид ниобия NbF5 при t=232,5°С. Разделение может быть осуществлено другим способом, например, на каскаде газовых центрифуг или методом ректификации.
Выделенный кислород используют для обогащения воздуха. Выделенные и очищенные от примесей фториды титана, ниобия и тантала, каждый по отдельности подвергают электролитическому разложению.
Выделенный тетрафторид титана, очищенный от кислорода и других летучих фторидов, испаряют и направляют на операцию электролитического восстановления.
Газообразный TiF4 вводят под слой расплава электролита. Операцию осуществляют в герметичном электролизере. Выделенный на катоде порошок титана удаляют, отмывают от фторидных солей электролита и сушат, получая в результате высокочистый порошок металлического титана с содержанием не менее 99,99 мас.%. Выделяющийся на аноде элементный фтор собирают под крышкой электролизера и направляют на операцию фторирования исходного сырья.
Фториды тантала и ниобия подвергают электролитическому восстановлению аналогичным образом.
Пример 4. Получение молибдена и рения из сульфидов.
Предварительно измельченный в порошок рудный концентрат, например молибденит, включающий сульфиды молибдена и рения, фторируют элементным фтором в химическом реакторе факельного типа аналогично процессу, описанному в примере 3, при этом происходят реакции окисления:
Содержащиеся в молибдените примеси находятся в оксидной форме. При взаимодействии с фтором часть оксидов, таких как кремний, фосфор и т.п, образуют газообразные фториды, другая часть оксидов, таких как медь, железо, алюминий, цинк, кальций, магний и т.п., образуют твердые фториды. Твердый огарок примесей отделяется на операции фторирования, газовая фаза подвергается разделению. Выделение фторидов молибдена и рения из смеси газов и дальнейшее восстановление из них чистых веществ посредством электролиза осуществляют аналогично вышеприведенным реакциям (13) и (14) с получением в конечном итоге высокочистого порошка молибдена (99,99 мас.%) и рения (99,99 мас.%).
Фториды примесей также могут быть подвергнуты восстановлению, а могут быть использованы как достаточно чистые соединения самостоятельно.
В результате применения заявляемого способа для получения указанных металлов из их сульфидов одновременно получают еще один товарный продукт - чистую серу.
Использование в качестве основного реагента рециркулирующего элементного фтора приводит к практически полному исключению образования и сброса в окружающую среду технологических отходов. Высокое тепловыделение и скорость фторирования, полное использование фторирующего реагента, высокая коррозионная стойкость оборудования, отсутствие газообразных и жидких выбросов обуславливают высокую производительность технологических процессов и труда и, как следствие, высокую рентабельность производства.
1. Способ получения вещества, выбранного из ряда: бор, фосфор, кремний и редкие тугоплавкие металлы, включающий взаимодействие оксида вещества с галогеном-окислителем с образованием газообразного галогенида, выделение галогенида из газовой смеси и последующее восстановление из него чистого вещества, отличающийся тем, что в качестве галогена-окислителя используют при взаимодействии с оксидом вещества элементный фтор с образованием газообразного фторида, а восстановление вещества из выделенного фторида осуществляют с одновременным получением элементного фтора, возвращаемого на стадию фторирования оксида.
2. Способ по п.1, отличающийся тем, что в качестве исходного сырья используют оксидные рудные концентраты.
3. Способ по п.1 или 2, отличающийся тем, что фторирование оксидов кремния или оксидов редких тугоплавких металлов осуществляют в пламенных реакторах шахтного типа распылением порошка оксида в струе элементного фтора.
4. Способ по п.1 или 2, отличающийся тем, что фторирование оксида бора осуществляют барботированием элементного фтора через расплав оксида.
5. Способ по п.1 или 2, отличающийся тем, что восстановление вещества из выделенного фторида осуществляют электролитическим способом в низкоплавкой эвтектике фторидных солей LiF-KF-NaF.
6. Способ по п.1 или 2, отличающийся тем, что выделение фторида вещества из газовой смеси осуществляют методом конденсации.
7. Способ по п.1, отличающийся тем, что газовую смесь перед выделением фторида дополнительно пропускают через фильтр тонкой очистки.
8. Способ по п.2, отличающийся тем, что используют рутиловый концентрат для получения титана.
9. Способ по п.2, отличающийся тем, что используют попарит для получения титана, тантала и ниобия.
10. Способ по п.3, отличающийся тем, что примеси, образующие с фтором твердые нелетучие фториды, включая кальций, алюминий, железо, удаляют на стадии фторирования в виде образующегося при сжигании огарка.
11. Способ получения редких тугоплавких металлов: молибдена и/или рения из их сульфидов, включающий получение газообразного галогенида металла, выделение указанного галогенида из газовой смеси и последующее восстановление из него чистого металла, отличающийся тем, что галогенид получают взаимодействием сульфида металла с галогеном-окислителем, в качестве которого используют элементный фтор, выделяют полученный в результате фторирования сульфида фторид металла, из которого осуществляют восстановление металла с одновременным получением элементного фтора, возвращаемого на операцию фторирования сульфида.
12. Способ по п.11, отличающийся тем, что в качестве исходного сырья для получения молибдена и рения используют сульфидные рудные концентраты, в том числе молибденит.
13. Способ по п.11 или 12, отличающийся тем, что фторирование осуществляют в пламенных реакторах шахтного типа распылением порошка сульфида в струе элементного фтора.
14. Способ по п.11 или 12, отличающийся тем, что выделение фторида металла из газовой смеси осуществляют методом конденсации.
15. Способ по п.11 или 12, отличающийся тем, что восстановление металла из фторида осуществляют электролитическим способом в низкоплавкой эвтектике фторидных солей LiF-KF-NaF.
16. Способ по п.11, отличающийся тем, что газовую смесь перед выделением фторида дополнительно пропускают через фильтр тонкой очистки.
17. Способ по п.13, отличающийся тем, что примеси, образующие с фтором твердые нелетучие фториды, включая кальций, алюминий, железо, медь, магний, цинк, удаляют на стадии фторирования в виде образующегося огарка.