Способ проведения пцр
Иллюстрации
Показать всеИзобретение относится к области биохимии и может быть использовано в молекулярно-генетических методах детекции нуклеиновых кислот. В соответствии с предложенным способом проводят ПЦР в присутствии праймеров, которые состоят из 3'-участка, комплементарного последовательности-мишени, и 5'-участка, не комплементарного последовательности-мишени, при температуре, соответствующей потенциальной температуре гибридизации праймеров по всей длине. Применение изобретения обеспечивает эффективную и высокоспецифичную амплификацию нуклеиновой кислоты. 4 ил.
Реферат
Изобретение относится к области биохимии, в частности к молекулярно-генетическим методам детекции биологических объектов.
Существуют различные способы проведения ПЦР, которые используются для повышения ее специфичности.
В способе, предложенном F.Weighardt et. al. [2], используются олигонуклеотиды с конструкцией из 3'-участка, комплементарного амплифицируемой последовательности (15-20 нуклеотидов), и 5'-участка, некомплементарного последовательности-мишени (10-15 нуклеотидов) [2]. На первом этапе ПЦР (5 циклов) отжиг ведут при оптимальных температурах гибридизации 3'-комплементарного участка праймеров; на втором этапе (35 циклов) температуру отжига повышают до 72°С, которая соответствует потенциальному оптимуму гибридизации по всей 5'-3' длине праймеров, амплифицируя, таким образом, только те молекулы нуклеиновой кислоты, которые образовались на первом этапе. Указанный способ позволяет повысить специфичность полимеразной цепной реакции. [2].
Цель изобретения - разработка эффективной методики высокоспецифичной ПЦР для индикации и идентификации биологических объектов.
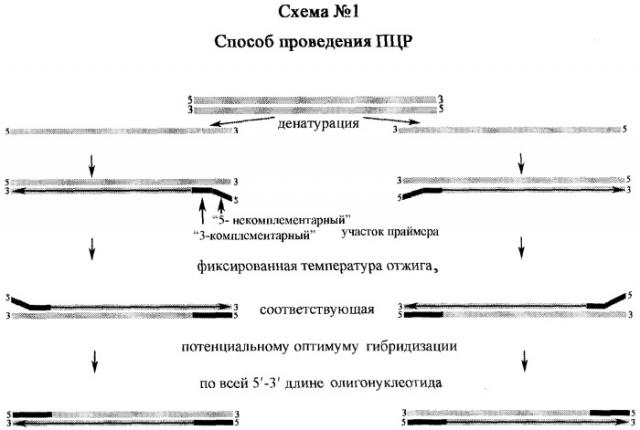
Способ проведения ПЦР, схожий со способом, предложенным F.Weighardt et al. [2], включающий подготовку пробы нуклеиновой кислоты, внесение указанной пробы в реакционную смесь для ПЦР, содержащей в качестве праймеров олигонуклеотиды, которые состоят из 3'-участка, комплементарного последовательности-мишени, и 5'-участка, не комплементарного последовательности-мишени, проведение ПЦР и детекцию амплифицированного фрагмента ДНК методом гель-электрофореза, отличающийся тем, что в качестве праймеров используют олигонуклеотиды с потенциальной температурой гибридизации по всей длине, превышающей температуру отжига их 3'-комплементарного участка на 5-10°С, а при проведении ПЦР отжиг ведут при температуре, соответствующей указанной потенциальной температуре гибридизации (схема 1).
Стратегия выбранного подхода заключается в том, что, используя фиксированную температуру потенциального оптимума отжига праймеров по всей 5'-3' длине, связывание 3'-комплементарного участка олигонуклеотида с нуклеиновой кислотой исследуемого биологического объекта затруднительно ввиду несоответствия температур гибридизации на 5-10°С, однако неспецифичное праймирование находится в значительно более угнетенном состоянии, чем достигается более эффективная наработка только специфичных ампликонов, которые в дальнейшем являются мишенями для праймеров в системе 100% комплементарности.
Условия проведения реакции
Способ проведения ПЦР на примере выявления гена каппа-казеина крупного рогатого скота.
Классическую ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей 60 мМ Трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэтанол; 0,1 мМ тритон Х-100; 0,2 мМ дНТФ, 0.5 ед. Taq ДНК полимеразы, 0.5 мкМ праймера JK5: 5'-ATCATTTATGGCCATTCCACCAAAG-3' (расчетная Тm=60,8°С), 0,5 мкМ праймера JK3: 5'-GCCCATTTCGCCTTCTCTGTAACAGA-3' (расчетная Тm=66,7°С), сконструированных J.F.Medrano and E.Aguilar-Cordova [1] для амплификации фрагмента гена каппа-казеина длиной 350 пар нуклеотидов, 1 мкл пробы ДНК, выделенную из лейкоцитов крови крупного рогатого скота в режиме: ×1:94°С - 4 мин; ×40:94°С - 30 сек, 60°С - 30 сек, 72°С - 30 сек; ×1:72°С - 10 мин (фиг.1, трек 4), а также оптимизированном нами режиме: ×1:94°С - 4 мин; ×40:94°С - 10 сек, 63°С - 10 сек, 72°С - 10 сек; ×1:72°C - 5 мин (фиг.2).
Предлагаемый способ ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей 60 мМ Трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэтанол; 0,1 мМ тритон Х-100; 0,2 мМ дНТФ, 0.5 ед. Taq ДНК полимеразы, 0.5 мкМ праймера JK5-hs с 5'-некомплементарным участком (n) длиной 5 нуклеотидов и 3'-комплементарным участком (N) длиной 25 нуклеотидов: 5'-gggggATCATTTATGGCCATTCCACCAAAG-3' (расчетная nN Tm=70°С; N Тm=60,8°С), 0,5 мкМ праймера JK3-hs с 5'-некомплементарным участком (n) длиной 4 нуклеотида и 3'-комплементарным участком (N) длиной 26 нуклеотидов: 5'-ccccGCCCATTTCGCCTTCTCTGTAACAGA-3' (расчетная nN Tm=73,5°С; N Tm=66,7°С) (амплификация специфичного ПЦР продукта размером 359 bp), 1 мкл пробы ДНК, выделенную из лейкоцитов крови крупного рогатого скота в следующих режимах:
×1:94°С - 4 мин; ×40:94°С - 30 сек, 72°С - 30 сек; ×1:72°С - 10 мин (фиг.1, трек 1),
×1:94°С - 4 мин; ×40:94°С - 10 сек, 68°С - 20 сек; ×1:72°С - 5 мин (фиг.3),
×1:94°С - 4 мин; ×40:94°С - 10 сек, 72°С - 20 сек; ×1:72°С - 5 мин (фиг.4).
Также проводили ПЦР с использованием 0.5 мкМ праймера N-JK5 с 5'-некомплементарным участком (n) длиной 12 нуклеотидов и 3'-комплементарным участком (N) длиной 20 нуклеотидов: 5'-gggcagaggtgaTTATGGCCATTCCACCAAAG-3' (расчетная nN Tm=72,8; N Tm=57,4), 0,5 мкМ праймера N-JK3 с 5'-некомплементарным участком (n) длиной 12 нуклеотидов и 3'-комплементарным участком (N) длиной 20 нуклеотидов: 5'-gggcagaggtgaTTCGCCTTCTCTGTAACAGA-3' (расчетная nN Tm=72,4; N Tm=57,2) (амплификация специфичного ПЦР продукта размером 363 bp) в режиме предлагаемого способа: ×1:94°С - 4 мин; ×40:94°С - 30 сек, 68°С - 30 сек; ×1:72°С - 10 мин (фиг.1, трек 2), а также в режиме ближайшего аналога: ×1:94°С - 4 мин; ×5:94°С - 30 сек, 58°С - 30 сек, 72°С - 30 сек. ×35:94°С - 30 сек, 72°С - 30 сек. ×1:72°С - 10 мин (фиг.1, трек 3).
ПЦР-продукты амплификации фрагментов ДНК, инициированные праймерами JK5+JK3 (фиг.2, трек 1-8) и праймерами JK5-hs+JK3-hs (фиг.3-4, трек 2, 5, 8) обрабатывались 5 U HinfI, а также 10 U HindIII при 37°С в течение ночи (фиг.3-4, трек 3, 6, 9).
Визуализацию амплифицированной ДНК проводили методом гель-электрофореза. Для этого продукты амплификации смешивали с буфером для нанесения проб (0,25% бромфенолового синего, 40% (вес-объем) сахарозы в Н2О) в соотношении 6:1. Полученную смесь вносили в лунки 2,5% агарозного геля, приготовленного на ТАЕ буфере (0,04 М трис-ацетат, 0,002 М ЭДТА, рН 8,0) с содержанием бромистого этидия 0,5 мкг/мл и подвергали горизонтальному электрофорезу в ТАЕ буфере при напряжении 15 В/см в течение 1 часа с последующим просматриванием в УФ-трансиллюминаторе (290-330 нм).
Результаты исследований
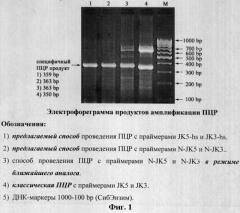
При проведении классической ПЦР с праймерами JK5+JK3 нами получен наряду со специфичным ПЦР продуктом размером 350 bp также неспецифичный фрагмент амплификации размером приблизительно 600-700 bp (фиг.1, трек 4).
При проведении ПЦР с праймерами N-JK5+N-JK3 в режиме ближайшего аналога нами получены наряду со специфичным ПЦР продуктом размером 363 bp также слабые неспецифичные фрагменты амплификации размером приблизительно 600-700 bp (фиг.1, трек 3).
При проведении ПЦР с праймерами N-JK5+N-JK3 и праймерами JK5-hs+JK3-hs в режиме предлагаемого способа нами получены только специфичные ПЦР продукты размером 363 bp (фиг.1, трек 2) и 359 bp (фиг.1, трек 1) соответственно.
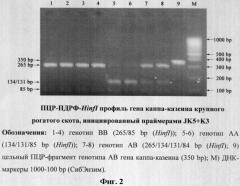
Следует отметить, что праймеры JK5+JK3 эффективно инициируют амплификацию фрагмента гена каппа-казеина крупного рогатого скота длиной 350 bp при оптимизированном нами режиме амплификации (×1:94°С - 4 мин; ×40:94°С - 10 сек, 63°С - 10 сек, 72°С - 10 сек; ×1:72°С - 5 мин), а ПДФР-HinfI профиль идентифицирует его генотипы (AA=134/131/85, BB=265/85 и AB=265/134/131/84) (фиг.2). Исключение амплификации неспецифичных продуктов достигается за счет уменьшения времени синтеза до 10 сек, а также повышения температуры отжига до 62-63°С.
На основании положительного результата по исключению неспецифичной амплификации при использовании предлагаемого способа проведения ПЦР с праймерами JK5-hs+JK3-hs (фиг.1, трек 1) нами были предприняты дальнейшие действия по оптимизации режима двухстадийной ПЦР с температурным совмещением стадий отжига и синтеза при 68/72°С (фиг.3-4).
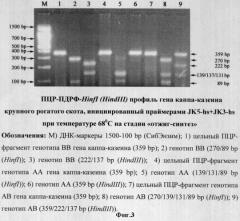
Праймеры JK5-hs+JK3-hs эффективно инициируют амплификацию фрагмента гена каппа-казеина крупного рогатого скота длиной 359 bp, a ПДФР-HinfI профиль (АА=139/131/89, ВВ=270/89 и АВ=270/139/131/89) и ПДФР-HindIII профиль (АА=359, ВВ=222/137 и АВ=359/222/137) идентифицируют его генотипы (фиг.3-4).
Обсуждение
Температура отжига праймеров может быть вычислена теоретически или эмпирически. Теоретические расчеты не всегда являются гарантией температурного оптимума гибридизации, поэтому оптимальная температура отжига олигонуклеотидов нередко высчитывается эмпирически на основании практических исследований.
Исходя из представленной нами техники ПЦР, можно сделать ВЫВОД, что используются праймеры с конструкцией из 3'-комплементарного участка и 5'-некомплементарного участка, чья потенциальная температура гибридизации по всей 5'-3' длине олигонуклеотида превышает температуру отжига его 3'-комплементарного участка на 5-10°С (Tadif). Так, при оптимизации протоколов ПЦР с праймерами JK5+JK3 и JK5-hs+JK3-hs, нами установлено, что оптимальная температура отжига (opt Та) праймеров JK5 и JK3 в оптимизированном нами режиме соответствует 62-63°С, при расчетной Тm, равной 60,8°С и 66,7°С соответственно. Однако неспецифичный фон амплификации удалось преодолеть также за счет сокращения времени стадий отжига и синтеза до 10 сек (фиг.2).
Оптимальная же температура отжига по всей 5'-3' длине праймеров (opt nN Та) JK5-hs (расчетная nN Tm=70°С; N Tm=60,8°С) и JK3-hs (расчетная nN Tm=73,5°С; N Tm=66,7°С) в оптимизированном нами режиме амплификации находилась в пределах 68-72°С, что показано представленными материалами экспериментов, где апробирована двухстадийная ПЦР с совмещением стадий отжига и синтеза (фиг.3-4). Ввиду того, что 3'-комплементарный участок праймера JK5-hs идентичен последовательности олигонуклеотида JK5, а 3'-комплементарный участок праймера JK3-hs идентичен последовательности олигонуклеотида JK3, логично приравнять opt N Та JK5-hs+JK3-hs=opt Та JK5+JK3.
Обоснование вывода:
[opt nN Та - opt N Та = Tadif]
[68°С (72°С) - 63°С = 5°С (9°С)]
[68°С(72°С) - 62°C = 6°C (10°С)]
У ближайшего аналога заявленный диапазон длины 3'-комплементарного участка праймеров составляет 15-20 нуклеотидов, а 5'-некомплементарного участка - 10-15 нуклеотидов [2]. Поэтому для соответствия диапазонам длин ближайшего аналога по 3'-комплементарным и 5'-некомплементарным участкам олигонуклеотидов нами были сконструированы олигонуклеотидные праймеры N-JK5: 5'-gggcagaggtgaTTATGGCCATTCCACCAAAG-3' и N-JK3: 5'-gggcagaggtgaTTCGCCTTCTCTGT AACAGA-3', где длина 5'-некомплементарного участка (n) составляет 12 нуклеотидов, а длина 3'-комплементарного участка (N) составляет 20 нуклеотидов.
Исходя из представленной техники предлагаемого способа проведения ПЦР длина 5'-участка, некомплементарного последовательности-мишени, может колебаться в диапазоне 4-5 (для праймеров JK5-hs и JK3-hs) - 12 (для праймеров N-JK5 и N-JK3) нуклеотидов, а длина 3'-участка, комплементарного амплифицируемой последовательности может быть 20 (для праймеров N-JK5 и N-JK3) - 25-26 (для праймеров JK5 и JK3) нуклеотидов.
Следует отметить, что оптимальная температура отжига 3'-комплементарного участка (opt N Та) праймеров N-JK5 и N-JK3 составляет 58°С при расчетной N Тm, равной 57,4°С и 57,2°С соответственно; а оптимальная температура отжига по всей 5'-3' длине праймеров (opt nN Та) составляет 68°С при расчетной температуре nN Тm, равной 72,8°С и 72,4°С соответственно. Поэтому при проведении ПЦР с данными праймерами по предложенному нами способу использовали двухстадийную ПЦР с совмещением стадий отжига и синтеза при 68°С, что, как было выше сказано, является оптимальной температурой гибридизации по всей 5'-3' длине праймеров, которая превышает оптимальную температуру отжига их 3'-комплементарных участков на 10°С (Tadif):
Обоснование вывода
[opt nN Та - opt N Та = Tadif]
[68°C - 58°C = 10°C]
Заключение
По результатам практических исследований, направленных на теоретическое обоснование эффективности предлагаемого способа проведения ПЦР, нами получен обеспечиваемый заявленным способом технический результат, выраженный в демонстрации более эффективной наработки только специфичных ампликонов с исключением амплификации неспецифичных продуктов (фиг.1, трек 1-2) Однако, по нашему мнению, причина, которая не позволяет ближайшему аналогу достичь указанного технического результата (фиг.1, трек 3), а именно более эффективной наработки специфичных ампликонов с исключением амплификации неспецифичных продуктов (т.е. повышение специфичности ПЦР) заключается в том, что у ближайшего аналога [2] в момент гибридизации при оптимальной температуре отжига праймеров 3'-комплементарного участка имеется вероятность неспецифичного связывания олигонуклеотидов, нежели при использовании нашего способа. Дальнейшее же повышение температуры, соответствующее потенциальному оптимуму гибридизации по всей 5'-3' длине олигонуклеотидов [2], может свести на нет подобные манипуляции, так как прецедент неспецифичного связывания праймеров уже был во время отжига праймеров с температурным оптимумом для 3'-комплементарного участка, а все что синтезировалось, включая и неспецифичные фрагменты ДНК, может эффективно амплифицироваться при достижении рабочего оптимума отжига по всей 5'-3' длине используемых праймеров.
Способ проведения ПЦР, включающий подготовку пробы нуклеиновой кислоты, внесение указанной пробы в реакционную смесь для ПЦР, содержащей в качестве праймеров олигонуклеотиды, которые состоят из 3'-участка, комплементарного последовательности-мишени, и 5'-участка, не комплементарного последовательности-мишени, проведение ПЦР и детекцию амплифицированного фрагмента ДИК методом гель-электрофореза, отличающийся тем, что в качестве праймеров используют олигонуклеотиды с потенциальной температурой гибридизации по всей длине, превышающей температуру отжига их 3'-комплементарного участка на 5-10°С, а при проведении ПЦР отжиг ведут при температуре, соответствующей указанной потенциальной температуре гибридизации.