Способ моделирования спаечного процесса в брюшной полости экспериментальных животных
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к хирургии, в частности к способам моделирования спаечного процесса в брюшной полости экспериментальных животных, и может быть использовано для разработки способов диагностики, лечения и профилактики спаечной болезни брюшной полости. Для этого перед получением антигена животным наносят механическую травму на серозную оболочку толстой и тонкой кишки, берут спаечную ткань через 65-70 дней, а выделение водорастворимых антигенов из спаечной ткани производят путем ее дезинтеграции и водно-солевой экстракции с последующим получением гипериммунной антиспаечной сыворотки крови путем введения животным пятикратно через каждые 3-4 дня увеличивающейся концентрации антигена от 0,1 до 0,3 мг/мл на фоне иммуномодуляторов и введением через каждые 3 дня пятикратно внутривенно сыворотки животным с последующей через 14-15 дней лапаротомией и введением в брюшную полость фиксированного на алюмосиликате водорастворимого антигена из спаечной ткани. Способ обеспечивает получение адекватной воспроизводимой модели для точного диагностирования, успешного лечения и профилактики спаечной болезни брюшной полости. 1 з.п.ф-лы., 6 ил, 1 табл.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно к хирургии, в частности к способам моделирования спаечного процесса в брюшной полости экспериментальных животных, и может быть использовано для разработки способов диагностики, лечения и профилактики спаечной болезни брюшной полости.
Уровень техники
Известен способ моделирования спаечной болезни в эксперименте, включающий выполнение у крыс в стерильных условиях под эфирным наркозом лапаротомии и травмировании брюшины скарификацией. Лапаротомная рана ушивалась наглухо. Через 14 суток животное выводили из опыта путем передозировки эфирного наркоза. Оценивали выраженность спаечного процесса методом семантического дифференциала. Спайки в брюшной полости развивались у 39% животных (Липатов В.А., Григорян В.В. Оценка выраженности спаечного процесса методом семантического дифференциала. // Мат. 2-й Российской научн.-практич. конф. "Актуальные вопросы экологии, экспериментальной и клинической медицины". - Орел, - 2001, с.85-86).
Недостаток данного способа моделирования заключается в том, что он не обеспечивает стабильного получения спаечного процесса (лишь у 39% животных развиваются спайки).
Известна модель развития спаечного процесса в брюшной полости, заключающаяся в том, что на брыжейку кишки крысы накладывалось латексное кольцо диаметром 0,5 см на 30 минут. Животное выводилось из эксперимента через 12 часов, 1, 3, 7, 14 суток. По вскрытии брюшной полости оценивалась выраженность спаечного процесса визуально (Липатов В.А., Григорян В.В. Оценка выраженности спаечного процесса методом семантического дифференциала. // Мат. 2-й Российской научн.-практич. конф. "Актуальные вопросы экологии, экспериментальной и клинической медицины". - Орел, - 2001, с.85-86).
Недостатки данного способа:
- спаечный процесс в брюшной полости развивается только у 35-40% экспериментальных животных;
- невозможно обосновать индивидуальную предрасположенность к патологическому спайкообразованию.
Наиболее близким по технической сущности, достигаемому положительному эффекту и принятым авторами за прототип является способ моделирования спаечного процесса в брюшной полости экспериментальных животных, заключающийся в препарировании брюшины у умерщвленных здоровых кроликов в асептических условиях, отделении от нее жировой клетчатки и сосудов, гомогенизации брюшины путем ее высушивания и растирания с последующим получением экстракта. Этим экстрактом производят сенсибилизацию собак, от которых получают цитотоксическую сыворотку, названную перитонеоцитотоксической (ПЦТ). Кроликам внутривенно через каждые 3 дня пятикратно вводят ПЦТ в дозе 0,5 мл/кг веса. Через 15 дней после окончания введения ПЦТ животных оперируют в асептических условиях. Под местной анестезией производят лапаротомию, эвентерацию кишечника в течение 5 минут, в брюшную полость вводят разрешающую дозу препарата - 2 мл ПЦТ. После этого операционную рану закрывают наглухо шелковыми швами до введения разрешающей дозы ПЦТ. Из 26 оперированных животных в сроки от 31 до 72 суток спайки в брюшной полости обнаружены у 12 (46,1%) (Женчевский Р.А. Спаечная болезнь. М.: Медицина, 1989 - 191 с.).
Недостатки известного способа:
- материалом для получения антигена является нормальная брюшина здорового животного, элементов которой в сформированной спаечной ткани нет;
- способ получения антигена заключается в гомогенизации высушенной брюшины путем ее растирания, что недостаточно для выделения специфического антигенного комплекса;
- способ обеспечивает получение спаечного процесса менее чем у 50% животных.
Раскрытие изобретения
Задачей предлагаемого изобретения является разработка надежного и эффективного способа моделирования спаечного процесса в брюшной полости экспериментальных животных с целью диагностики, лечения и профилактики спаечной болезни брюшной полости.
Технический результат, который может быть получен с помощью предлагаемого изобретения, сводится к надежному, эффективному и точному диагностированию спаечного процесса, успешному лечению и профилактике спаечной болезни брюшной полости.
Технический результат достигается с помощью способа моделирования спаечного процесса в брюшной полости экспериментальных животных, включающий получение антигена, сыворотки к нему с последующей иммунизацией животных, при этом перед получением антигена животным наносят механическую травму на серозную оболочку толстой и тонкой кишки, берут спаечную ткань через 65-70 дней, а выделение водорастворимых антигенов из спаечной ткани производят путем ее дезинтеграции и водно-солевой экстракции с последующим получением гипериммунной антиспаечной сыворотки крови путем введения животным в течение 5-ти дней через каждые 3-4 дня увеличивающейся концентрации антигена от 0,1 до 0,3 мг/мл на фоне иммуномодуляторов и введением сыворотки крови животным с последующим через 14-15 дней лапаротомией и введением в брюшную полость фиксированного на алюмосиликате водорастворимого антигена из спаечной ткани и образованием через 16-30 дней внутрибрюшинных спаек.
В способе в качестве иммуномодуляторов используют тималин и циклофосфан.
Сущность предлагаемого способа моделирования спаечного процесса в брюшной полости экспериментальных животных заключается в следующем.
Для извлечения спаечного антигена получают спайки из брюшной полости экспериментальных животных, в качестве которых используют морских свинок и кроликов. Для этого под наркозом 3-4 животным выполняют лапаротомию с соблюдением правил асептики, десерозируют тонкую и толстую кишки марочным способом по 10-20 участков размерами 0,5-1,0 см. Операционную рану передней брюшной стенки ушивают 2-рядным шелковым швом. Через 65-70 дней после операции животных умерщвляют, вскрывают брюшную полость и иссекают образовавшиеся спайки, затем выделяют водорастворимые антигены из спаечной ткани путем ее дезинтеграции и водно-солевой экстракции с иммобилизацией водорастворимых антигенов из спаечной ткани на алюмосиликате, получают гипериммунную антиспаечную сыворотку крови путем введения животным в течение 5-ти дней через каждые 3-4 дня увеличивающейся концентрации антигена от 0,1 до 0,3 мг/мл на фоне иммуномодуляторов, введения сыворотки крови животным с последующими через 14-15 дней лапаротомией и аппликацией фиксированного на алюмосиликате водорастворимого антигена из спаечной ткани и образованием через 16-30 дней внутри брюшинных спаек, при этом в качестве иммуномодуляторов используют тималин и циклофосфан, причем концентрация тималина равна 5 мг/мл ежедневно в течение 5-ти дней, а циклофосфан с концентрацией 100 мг/мл дополнительно вводят начиная с третьего дня, причем антиген, тималин и циклофосфан морским свинкам вводят внутримышечно, а кроликам антиген вводят внутривенно, а тималин и циклофосфан - внутримышечно.
Краткое описание чертежей последовательного проведения способа моделирования спаечного процесса в брюшной полости экспериментальных животных
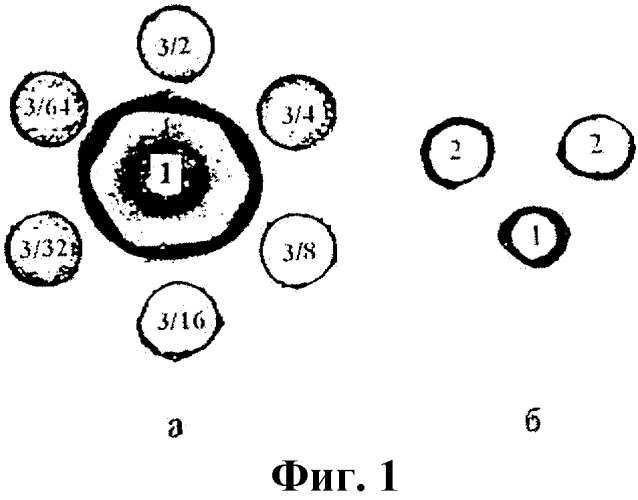
На фиг.1 показана реакция иммунодиффузии в агаровом геле.
Обозначения: а - опыт, б - контроль.
1 - спаечный антиген;
2 - нормальная сыворотка лабораторных животных;
3 - гипериммунная антиспаечная сыворотка;
3/2-3/64 - в знаменателе показатель разведения гипериммунной сыворотки (1:2-1:64).
На фиг.2 показаны сращения между петлями кишки и брюшиной.
На фиг.3 показана окраска гематоксилином и эозином. Ув. 16×7×1,1.
На фиг.4 показана характерная кишечно-париетальная с признаками растяжения и отрыва спаек.
На фиг.5 показаны пленочные (1) и тяжистые (2) спайки, участки фиброза (рубцовых изменений) передней брюшной стенки (3) и область припаянности большого сальника (4).
На фиг.6 показан микропрепарат. Хорошо организованный рубец передней брюшной стенки (1) и нитевидные спайки между листками брюшины (2). Окраска гемотоксилин-эозин. Ув. 1×40.
Осуществление изобретения
Примеры конкретного выполнения способа моделирования спаечного процесса в брюшной полости экспериментальных животных.
Пример. Для опытов используют морских свинок весом 250-300 г (кроликов - 2,5-3 кг). Получение спаечного антигена и иммунной сыворотки крови производится следующим образом.
Предварительно для извлечения спаечного антигена необходимо получить спайки из брюшной полости животных. Для этого под наркозом 3-4 животным выполняют лапаротомию с соблюдением правил асептики, десерозируют тонкую и толстую кишки марочным способом по 10-20 участков размером 0,5×1,0 см. Операционную рану передней брюшной стенки ушивают 2-рядным шелковым швом. Через 65-70 дней после операции животных умерщвляют, вскрывают брюшную полость и иссекают образовавшиеся спайки. Спайки ополаскивают в 0,9% растворе хлорида натрия, тщательно растирают с кварцевым песком с добавлением 3%-ного хлорида натрия и далее извлекают спаечный антиген последовательными манипуляциями, представленными на фиг. 1.
Для получения иммунной сыворотки против спаечного аутоантигена животным вводят парэнтерально увеличивающиеся дозы антигена на фоне иммуномодуляторов (таблица).
| Таблица.Схема иммунизации животных для получения иммунной сыворотки против спаечного аутоантигена | ||||||||
| №№ инъекций | Интервалы между инъекциями, сутки | Концентрация антигена, мг/мл | Способ введения антигена | тималин | циклофосфан | |||
| Концентрация, мг/мл | Способ введения | Концентрация, мг/мл | Способ введения | |||||
| свинка | кролик | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1 | - | 0,1 | в/м | в/в | 5 | в/м | - | - |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 2 | 3-4 | 0,15 | в/м | в/в | 5 | в/м | - | - |
| 3 | 3-4 | 0,20 | в/м | в/в | 5 | в/м | 100 | в/м |
| 4 | 3-4 | 0,25 | в/м | в/в | 5 | в/м | - | - |
| 5 | 3-4 | 0,30 | в/м | в/в | 5 | в/м | - | - |
Способ гипериммунизации заключается в следующем: морским свинкам (внутримышечно), кроликам (внутривенно) вводят спаечный аутоантиген, одновременно внутримышечно (в/м) в качестве иммуномодулятора инъецируют тималин, в третью инъекцию дополнительно вводят в/м циклофосфан. Использование в качестве иммуномодулятора тималина способствует значительному повышению титров сывороточных антител за счет увеличения числа антителообразующих клеток в результате стимуляции функции макрофагов и хелперных Т-клеток. Циклофосфан, являясь классическим иммуносупрессором, также активирует макрофаги, стимулируя фагоцитарную, цитоксическую и супрессивную (в отношении, главным образом, Т-лимфоцитов) функции. Такая избирательность в действии иммуностимулятора, с одной стороны, и определенная селективность в действии иммуносупрессора - с другой, служат оптимальной комбинацией препаратов обеих групп и режимов их использования для активации одних механизмов иммунитета и выключения других. При таком способе продолжительность цикла иммунизации составляет 27-30 дней.
Через 7-10 дней после последней инъекции антигена у животных пробно берут кровь, отделяют сыворотку, оценивают антителообразование в реакции иммунодиффузии в агаровом геле (РИД) по О.Оухтерлони. Для этого готовят 1% агар "Дифко" на 0,9% растворе хлорида натрия (с добавлением азида натрия 1:10000), остужают его до 50-60°С и наливают 15-20 мл агара в чашки Петри, установленные строго горизонтально. После того как агар остынет, пробником (диаметром 3-5 мм) или специальным шаблоном в агаре вырезают лунки на расстоянии 3-5 мм друг от друга, удаляют из лунок агаровые "пробки". Антисыворотку раститровывают в физиологическом растворе с шагом 1:2-1:64. В центральную лунку вносят до ее краев аутоантиген, а в периферические - разведения антисыворотки. Закрывают чашку крышкой и помещают в термостат при температуре (37+1)°С на 25 часа. После этого учитывают предварительный результат и, оставив чашки при комнатной температуре еще на 24 часа, - окончательный.
Антигены и антитела, диффундируя из лунок, встречаются и образуют столько линий преципитации, сколько соответствующих пар антиген-антитело имеется в исследуемой системе. За титр специфических антител принимается то последнее разведение антисыворотки, где визуально определяется линия преципитации.
Титр иммунной сыворотки в РИД, пригодной для использования в экспериментах, должен быть не ниже 1:16 (фиг.1).
Для моделирования иммунного поражения брюшины экспериментальным животным через каждые 3 дня пятикратно внутривенно вводят гипериммунную антиспаечную сыворотку (АСС) в дозе 0,5 мл/кг массы (вводить медленно, обратить внимание на возможность анафилактического шока).
Через 15 дней после последней инъекции АСС животным выполняют лапаротомию и проводят аппликацию фиксированного спаечного антигена. С этой целью антиген иммобилизуют на поверхности сорбента - аэросила А-380 - по следующей методике: 100 мг аэросила А-380 суспендируют в 5 мл ФСБ, добавляют 0,1 мл вторичного алкилсульфата натрия ("Прогресс"), вносят 10 мл спаечного антигена (с концентрацией белка 4,5+0,5 мг/мл) и 4 часа перемешивают при комнатной температуре. После этого суспензию помещают в холодильную камеру при температуре (5+1)°С на 18-20 часов и дважды отмывают 0,9% раствором натрия хлора центрифугированием при 4000 г 20+5 минут.
Патологические изменения возникают в брюшной полости у животных после такой операции через 15-30 дней (фиг.3, 4, 5, 6).
Через 20 дней после операции у морской свинки на секции можно обнаружить серозный экссудат до 7 мл, фибринозный налет и островки организующегося фибрина на петлях кишечника, распространенные сращения в брюшной полости (фиг.3).
Гистологически обнаруживается, что в большинстве случаев висцеральная брюшина значительно утолщена с разрастанием фибринозных волокон (1) и юной грануляционной ткани (2) (фиг.4).
Предлагаемое изобретение по сравнению с прототипом и другими известными техническими решениями имеет следующие преимущества: использование спаечного антигена и антисыворотки к нему для имитации иммунного поражения брюшины позволяет получать выраженный спаечный процесс у 75-80% экспериментальных животных, что на 40-50% выше по сравнению с известными способами.
1. Способ моделирования спаечного процесса в брюшной полости экспериментальных животных, включающий получение антигена, сыворотки к нему с последующей иммунизацией животных, отличающийся тем, что перед получением антигена животным наносят механическую травму на серозную оболочку толстой и тонкой кишки, берут спаечную ткань через 65-70 дней, а выделение водорастворимых антигенов из спаечной ткани производят путем ее дезинтеграции и водно-солевой экстракции с последующим получением гипериммунной антиспаечной сыворотки крови путем введения животным пятикратно через каждые 3-4 дня увеличивающейся концентрации антигена от 0,1 до 0,3 мг/мл на фоне иммуномодуляторов и введением через каждые 3 дня пятикратно внутривенно сыворотки животным с последующей через 14-15 дней лапаротомией и введением в брюшную полость фиксированного на алюмосиликате водорастворимого антигена из спаечной ткани.
2. Способ по п.1, отличающийся тем, что в качестве иммуномодуляторов используют тималин и циклофосфан.