Пептид, нормализующий метаболизм в костной и хрящевой тканях, фармацевтическая композиция на его основе и способ ее применения
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам для профилактики и лечения заболеваний опорно-двигательного аппарата, в частности дегенеративно-дистрофических заболеваний суставов и позвоночника, и может быть использовано как средство, нормализующее метаболизм в костной и хрящевой тканях. Предлагается фармацевтическая композиция, нормализующая метаболизм в костной и хрящевой тканях, содержащая в качестве активного начала эффективное количество пептида аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] и фармацевтически приемлемый носитель. Предлагается пептид аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1], обладающий биологической активностью, проявляющейся в нормализации метаболизма в костной и хрящевой тканях. Предлагается способ профилактики и лечения заболеваний опорно-двигательного аппарата путем нормализации метаболизма в костной и хрящевой тканях, заключающийся во введении пациенту фармацевтической композиции, содержащей в качестве активного начала пептид аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] в дозе 0,01-100 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта. 3 н. и 3 з.п. ф-лы, 2 табл., 1 ил.
Реферат
Изобретение относится к лекарственным средствам для профилактики и лечения заболеваний опорно-двигательного аппарата, в частности дегенеративно-дистрофических заболеваний суставов и позвоночника, и может быть использовано как средство, нормализующее метаболизм в костной и хрящевой тканях.
Известно, что дегенеративно-дистрофические заболевания опорно-двигательного аппарата, а также остеопороз костной ткани являются наиболее часто встречаемой патологией.
Для лечения этих заболеваний применяется широкий спектр препаратов в зависимости от клинических проявлений заболеваний, возраста больного и способа применения.
Так, для лечения остеопороза применяются различные препараты кальция, витамины группы D и гормональные препараты (для женщин).
Медикаментозная терапия дегенеративно-дистрофических заболеваний суставов и позвоночника включает применение различных лекарственных средств симптоматического и патогенетического действия: анальгетики и противовоспалительные средства (анальгин, новокаиновые блокады, реопирин, индометацин, бруфен); антигистаминные средства (димедрол, пипольфен); препараты, улучшающие периферическое кровообращение (пахикарпин, платифиллин); биостимуляторы (румалон, алоэ, стекловидное тело, АТФ); ферментные препараты (лидаза, ронидаза); анаболические стероиды (нерабол, ретаболил).
Кроме того, известны препараты, влияющие на обмен веществ в хрящевой ткани: глюкозамин, хондроитин сульфат натрия (Большая Российская энциклопедия лекарственных средств, Ремедиум, М.: 2002, т.1, c.230-232).
При этом большинство из перечисленных групп препаратов несовместимы с другими лекарственными средствами, вызывают негативные побочные эффекты, что сужает спектр показаний и ограничивает их применение.
Учитывая распространенность заболеваний опорно-двигательного аппарата в разных возрастных группах, а также их социальную значимость, разработка новых лекарственных средств, влияющих на метаболизм в костной, хрящевой и соединительной тканях, актуальна в настоящее время.
Из уровня техники известен пептид аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH (Регистрационный номер RN-85806-95-7; http://stnweb.fiz-karlsruhe.de).
При экспериментальном изучении пептида аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH была выявлена его ранее неизвестная биологическая активность, проявляющаяся в нормализации метаболизма в костной и хрящевой тканях.
Настоящим изобретением поставлена и решена задача получения средства пептидной природы, обладающего биологической активностью, проявляющейся в нормализации метаболизма в костной и хрящевой тканях и фармацевтической композиции, содержащей этот пептид в качестве активного начала, а также способа ее применения.
Технический результат изобретения заключается в проявлении пептидом аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH биологической активности, проявляющейся в нормализации метаболизма в костной и хрящевой тканях, а также содержащей в качестве активного начала этот пептид фармацевтической композиции, использование которой способствует увеличению количества и усилению функции кальцитонин-продуцирующих клеток щитовидной железы, улучшает трофику клеток костной и хрящевой тканей и, таким образом, нормализует метаболизм в костной и хрящевой тканях.
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера, полученные в процессе проведения исследований по методикам, принятым в данной области.
Для решения поставленной задачи и достижения указанного технического результата предложена группа изобретений, объединенных общим изобретательским замыслом.
Настоящее изобретение относится к пептиду аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1], обладающему биологической активностью, проявляющейся в нормализации метаболизма в костной и хрящевой тканях.
Другой аспект настоящего изобретения касается фармацевтической композиции, нормализующей метаболизм в костной и хрящевой тканях, содержащей в качестве активного начала эффективное количество пептида аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] и фармацевтически приемлемый носитель.
При этом фармацевтическая композиция находится в форме, подходящей для парентерального введения.
Предлагается также применение пептида аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] для приготовления лекарственного средства, нормализующего метаболизм в костной и хрящевой тканях
Следующий аспект настоящего изобретения касается способа профилактики и лечения заболеваний опорно-двигательного аппарата путем нормализации метаболизма в костной и хрящевой тканях, заключающегося во введении пациенту фармацевтической композиции, содержащей в качестве активного начала пептид аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] в дозе 0,01-100 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта.
При этом введение осуществляют внутримышечно.
Пептид аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH получают классическим методом пептидного синтеза в растворе.
Изучение биологической активности проводили в эксперименте на эпифизэктомированных крысах, на эксплантатах хрящевой ткани и у больных с дегенеративно-дистрофическими заболеваниями суставов.
Понятие «фармацевтическая композиция» подразумевает различные лекарственные формы, содержащие пептид H-Ala-Glu-Asp-OH, которые могут найти лечебное применение в медицине в качестве средства, нормализующего метаболизм в костной и хрящевой тканях.
Для получения фармацевтических композиций, отвечающих изобретению, эффективное количество пептида H-Ala-Glu-Asp-OH, как активное начало, смешивают с фармацевтически приемлемым носителем согласно принятым в фармацевтике способам компаундирования.
Понятие "эффективное количество" подразумевает использование такого количества активного начала, которое в соответствии с его количественными показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной лекарственной форме.
Носитель может иметь различные формы, которые зависят от лекарственной формы препарата, желаемой для введения в организм.
Для парентерального введения носитель обычно включает физиологический раствор или стерильную воду, хотя могут быть включены другие ингредиенты, способствующие стабильности, или для сохранения стерильности.
Сущность изобретения поясняется табл.1 и 2 чертежом.
В табл.1 представлено влияние пептида H-Ala-Glu-Asp-OH на морфологические и биохимические показатели периферической крови морских свинок при изучении токсичности.
В табл.2 представлено влияние пептида H-Ala-Glu-Asp-OH на количественные характеристики исследуемых параметров в щитовидной железе по данным компьютерного анализа микроскопических изображений.
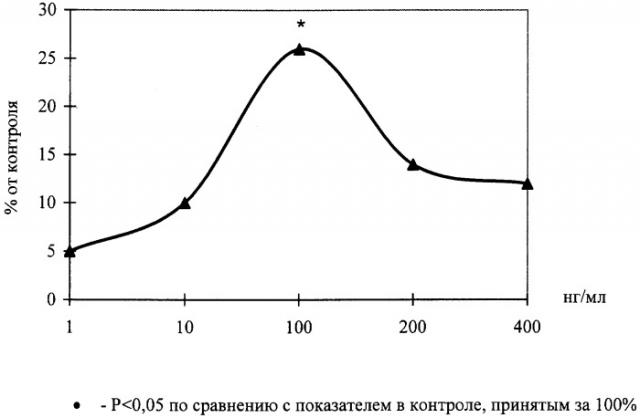
На чертеже показано влияние пептида H-Ala-Glu-Asp-OH на развитие эксплантатов хрящевой ткани.
Изобретение иллюстрируется примером синтеза пептида аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH (пример 1), примерами испытания токсичности и биологической активности пептида (примеры 2, 3, 4), а также примером результатов клинического применения пептида, подтверждающим его фармакологические свойства и возможность достижения профилактического и/или лечебного эффекта (пример 5).
Пример 1. Синтез пептида H-Ala-Glu-Asp-OH
1. Название соединения: аланил-глутамил-аспарагиновая кислота.
2. Структурная формула: Н-Ala-Glu-Asp-ОН
3. Брутто-формула без противоиона: С12Н19N3О8.
4. Молекулярный вес без противоиона: 333,29.
5. Противоион: ацетат.
6. Внешний вид: белый аморфный порошок без запаха.
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме
BOC - трет.бутилоксикарбонильная группа,
Z - бензилоксикарбонильная группа,
OSu - N-оксисукцинимидный эфир,
DCC - N,N'-дициклогексилкарбодиимид,
OBzl - бензиловый эфир,
TFA - трифторуксусная кислота.
Характеристики готового препарата:
- содержание основного вещества: 98,75% (по ВЭЖХ, 220 нм),
- ТСХ - индивидуален, Rf=0,75 (ацетонитрил-вода 1:3),
- содержание влаги: 6%,
- pH 0,01% раствора: 4,17,
- Удельное оптическое вращение: [α]D 22: -20° (с=1, Н2O), "Polamat A", Carl Zeiss Jena.
Пример синтеза:
1) BOC-Glu(OBzl)-OSu, N-оксисукцинимидный эфир N-трет.бутилоксикарбонил-(γ-бензил)глутаминовой кислоты (I).
N-трет.бутилоксикарбонил-(γ-бензил)глутаминовую кислоту BOC-Glu(OBzl)-OH (33,7 г, 0,1 моль) растворяли в 50 мл N,N'-диметилформамида, охлаждали до температуры -10°С, добавляли при перемешивании охлажденные (4-6°С) растворы N,N'-дициклогексилкарбодиимида (23,0 г, 0,11 моль) в 30 мл N,N'-диметилформамида и N-гидроксисукцинимида (13,0 г, 0,11 моль) в 20 мл N,N'-диметилформамида. Реакционную смесь перемешивали в течение 12 ч при охлаждении льдом и далее в течение 1 суток при комнатной температуре. Выпавшую N,N'-дициклогексилмочевину отфильтровывали и полученный раствор активированного эфира использовали без выделения на следующей стадии.
2) BOC-Glu(OBzl)-Asp(OBzl)-OH, N-трет.бутилоксикарбонил-(γ-бензил)глутамил-(β-бензил)аспартат (II).
(β-Бензил)аспарагиновую кислоту H-Asp(OBzl)-OH (28,0 г, 0,12 моль) и 36 мл (0,12 моль) триэтиламина суспендировали в 50 мл N,N'-диметилформамида и перемешивали в течение 1 ч. Затем добавляли порциями раствор активированного эфира ВОС-Glu(OBzl)-OSu (I), полученный на предыдущей стадии. Реакционную смесь перемешивали при комнатной температуре в течение 2 суток. Затем подкисляли 0,5 н. серной кислотой до pH 2-3 и экстрагировали этилацетатом 4×50 мл. Вытяжки объединяли и последовательно промывали 0,5 н. Н2SO4 3×50 мл, водой 2×50 мл, 5% раствором NaHCO3 2×50 мл, водой 2×50 мл, насыщенным раствором NaCl 2×50 мл. Органический слой сушили над Na2SO4, упаривали растворитель в вакууме, остаток кристаллизовали под гексаном. Получено 50 г продукта (92%). Rf=0,34 (бензол-ацетон 2:1).
3) TFA H-Glu(OBzl)-Asp(OBzl)-OH (III), трифторацетат (γ-бензил)-глутамил-(β-бензил)аспартата.
N-трет.бутилоксикарбонил-(γ-бензил)глутамил-(β-бензил)аспартат (I) 5,68 г (≈0,01 моль) растворяли в 20 мл смеси дихлорметан-трифторуксусная кислота (3:1). Через 2 ч растворитель упаривали в вакууме при температуре 40°С, упаривание повторяли с новой порцией дихлорметана (2×10 мл), остаток сушили в вакууме над NaOH. Получили масло 5,80 г (≈100%).
Rf=0,63 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
4) Z-Ala-Glu(OBzl)-Asp(OBzl)-OH (IV), N-бензилоксикарбонил-аланил-(γ-бензил)глутамил-(β-бензил)аспартат.
Трифторацетат (γ-бензил) глутамил-(β-бензил)аспартата (II) 5,65 г (0,01 моль) растворяли в 10 мл диметилформамида, добавляли триэтиламин 2,80 мл (0,02 моль) и N-оксисукцинимидный эфир N-карбобензоксиаланина 4,14 г (0,013 моль). Смесь перемешивали в течение 24 ч при комнатной температуре.
Продукт высаживали 0,5 н. раствором серной кислоты (150 мл), экстрагировали в этилацетат (3×30 мл), промывали 0,5 н. раствором серной кислоты (2×20 мл), водой, 5% раствором бикарбоната натрия (1×20 мл), водой, 0,5 н. раствором серной кислоты (2×20 мл), водой и сушили над безводным сульфатом натрия. Этилацетат фильтровали, упаривали в вакууме при температуре 40°С, остаток закристаллизовывали в системе этилацетат/гексан. Продукт отфильтровывали и сушили в вакууме над Р2O5. Выход 4,10 г (66%). Тпл.=154°С.
Rf=0,48 (бензол-ацетон, 1:1), Rf=0,72 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
5) H-Ala-Glu-Asp-OH, аланил-глутамил-аспартат.
Защищенный трипептид (IV) 1,1 г растворяли в смеси метиловый спирт-вода (4:1) и гидрировали над катализатором Pd/C (5%) в течение 4 ч. Катализатор отфильтровывали, растворитель упаривали в вакууме, остаток сушили в вакууме над КОН и Р2O5. Кристаллизация из системы вода-метанол.
Окончательно остаток растворяли в 20 мл деионизованной воды и лиофилизовывали.
Получено 105 мг чистого препарата в виде аморфного белого порошка без запаха.
6) Анализ готового препарата.
- Содержание основного вещества определяли методом ВЭЖХ на колонке Phenomenex С 18 LUNA 4,6×150 mm. A: 0,1% TFA, В: MeCN; grad. B 0-100% in 10 min. Скорость потока 1 мл/ мин. Детекция при 220 нм, сканирование 190-600 нм, проба 20 μl. Содержание основного вещества 98,75%.
- ТСХ: индивидуален, Rf=0,75 (ацетонитрил-вода 1:3, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление хлор/бензидин).
- Содержание влаги: 6% (гравиметрически по потере массы при сушке 20 мг при 100°С).
- pH 0,01% раствора: 4,17 (потенциометрически).
- Удельное оптическое вращение: [α]D 22: -20° (с=1, H2O), "Polamat A", Carl Zeiss Jena.
Пример 2. Изучение токсичности пептида H-Ala-Glu-Asp-OH
Общетоксическое действие пептида H-Ala-Glu-Asp-OH исследовали в соответствии с требованиями «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ» (2000): острой токсичности при однократном введении препарата, а также подострой и хронической токсичности при длительном введении пептида.
Исследование по изучению острой токсичности проведено на 66 белых беспородных мышах-самцах массой 19-22 г. Животные были рандомизированно разделены на 6 равных групп. Препарат вводили животным однократно внутримышечно в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг в 0,25 мл стерильного 0,9% раствора NaCl. Животным контрольной группы в том же объеме вводили 0,9% раствор NaCl.
Исследования по изучению подострой токсичности проведено на 64 белых беспородных крысах-самцах массой 180-220 г. Ежедневно однократно животным подопытных групп вводили препарат внутримышечно в течение 90 дней в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл стерильного 0,9% раствора NaCl. Животным контрольной группы вводили в том же объеме стерильный 0,9% раствор NaCl. До введения препарата на 30, 60 и 90 сутки после начала введения препарата у животных исследовали морфологический состав и свойства периферической крови. При завершении эксперимента исследовали биохимические и коагулологические показатели крови.
Исследования по изучению хронической токсичности проводили в течение 6 месяцев, исходя из длительности рекомендуемого клинического назначения препарата на 90 морских свинках-самцах массой 270-300 г. Животные подопытных групп получали ежедневно однократно внутримышечно пептид в течение 6 мес. в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл стерильного 0,9% раствора NaCl. В контрольной группе животным вводили по аналогичной схеме стерильный 0,9% раствор NaCl в том же объеме.
У животных в периферической крови общепринятыми методами определяли: количество эритроцитов, гемоглобина, ретикулоцитов, тромбоцитов, лейкоцитов, лейкоцитарную формулу, скорость оседания эритроцитов (СОЭ), резистентность эритроцитов. Наряду с этим определяли содержание в сыворотке крови общего белка по методу Лоури, калия и натрия методом плазменной спектрофотометрии. После завершения эксперимента проводили патоморфологическое исследование головного и спинного мозга, спинномозговых ганглиев, щитовидной железы, паращитовидных желез, надпочечников, семенников, гипофиза, сердца, легких, аорты, печени, почки, мочевого пузыря, поджелудочной железы, желудка, тонкой кишки, толстой кишки, тимуса, селезенки, лимфатических узлов, костного мозга.
При изучении острой токсичности установлено, что однократное введение исследуемого пептида животным в дозе, превышающей терапевтическую, рекомендованную для клинического применения более чем в 5000 раз, не вызывает токсических реакций, что свидетельствует о большой терапевтической широте препарата.
Изучение подострой и хронической токсичности пептида свидетельствует об отсутствии побочных эффектов при длительном применении препарата в дозах, превышающих терапевтическую в 100-1000 раз. При исследовании влияния пептида на морфологический состав и биохимические показатели периферической крови морских свинок достоверного изменения показателей через 3 и 6 месяцев после введения пептида не выявлено (табл.1).
При оценке общего состояния животных, морфологических и биохимических показателей периферической крови, морфологического состояния внутренних органов, состояния сердечно-сосудистой и дыхательной систем, функции печени и почек патологические изменения в организме не обнаружены.
Отсутствие общетоксического действия позволяет рекомендовать фармацевтическую композицию, содержащую пептид H-Ala-Glu-Asp-OH в качестве активного начала, для проведения клинических испытаний.
Пример 3. Влияние пептида H-Ala-Glu-Asp-OH на структурно-функциональную организацию кальцитонин-продуцирующих клеток щитовидной железы эпифизэктомированных крыс.
Работа выполнена на 23 крысах-самцах линии Вистар с массой тела 130-140 г. У животных был удален эпифиз. Операция эпифизэктомии проводилась под эфирным наркозом по разработанной методике.
Животным подопытной группы через три недели после операции (на 21 сутки) в течение последующих 10 дней подкожно вводили пептид H-Ala-Glu-Asp-OH в дозе 0,5 мкг на крысу в 0,5 мл стерильного физиологического 0,9% раствора NaCl. Эпифизэктомированным крысам контрольной группы и здоровым животным по аналогичной схеме вводили стерильный физиологический раствор в том же объеме.
Умерщвление животных и выделение щитовидной железы проводили утром с 10 до 12 ч при естественном освещении под нембуталовым наркозом (50 мг/кг). Часть эпифизэктомированных крыс подопытной и контрольной групп забивали через 3 суток после окончания инъекций (на 33 сутки после операции и начала опыта), а часть животных - через 12 суток (на 42 сутки после эпифизэктомии).
Кусочки щитовидной железы фиксировали в течение 24 ч кислой жидкостью Буэна для свето-микроскопических исследований и по Карновскому для электронной микроскопии. Для анализа кальцитонин-иммунопозитивных клеток (С-клеток) в щитовидной железе использовали показатель объемной доли (ρCa), количественной (NCa/1 мм2) и оптической плотности (OpDCa).
Установлено, что у животных контрольной группы через 1 месяц после эпифизэктомии щитовидная железа в основном сохраняет структурные особенности. Вместе с тем количество коллоида в фолликулах уменьшается, а митотическая активность в фолликулярном эпителии усиливается. Количество С-клеток по сравнению с интактными животными возрастает на 24% и составляет 3012±172 на 1 мм2. Количественная плотность С-клеток через 1,5 месяца после эпифизэктомии возрастает более чем на 50% по отношению к интактным животным, достигая 3668±158 клеток на 1 мм2 (табл.2). Через 1 месяц после эпифизэктомии содержание С-клеток в щитовидной железе животных подопытной группы, получавших пептид H-Ala-Glu-Asp-ОН, также имеет особенности, которые сводятся к достоверному сокращению их числа по отношению к контролю на 35%. Содержание С-клеток в щитовидной железе через 1,5 месяца после эпифизэктомии (12 дней после окончания введения пептида H-Ala-Glu-Asp-OH) полностью нормализуется и практически не отличается от контроля, составляя 2346±162 на 1 мм2. Количественная плотность С-клеток на данном этапе значительно отличается от результатов, полученных в контрольной группе, где этот показатель составлял 3668±158 на 1 мм2, т.е. более чем на 50% превышает контрольные значения (табл.2).
Результаты исследований функциональной морфологии щитовидной железы эпифизэктомированных крыс подопытной группы в условиях действия пептида Н-Ala-Glu-Asp-OH демонстрируют его стимулирующее влияние на тканевой и клеточный метаболизм. Введение пептида H-Ala-Glu-Asp-OH оказывает компенсаторный эффект на структурно-функциональную организацию клеток щитовидной железы эпифизэктомированных животных. Его действие проявляется через 3 суток после окончания введения пептида полным нивелированием эффекта эпифизэктомии и сохраняется через 12 суток, т.е. до окончания эксперимента.
Увеличение количества и усиление функции С-клеток щитовидной железы под действием пептида H-Ala-Glu-Asp-OH свидетельствует о важной компенсаторной роли пептида в регуляции обмена кальция и повышении его резорбции костной тканью, что имеет большое значение в профилактике и лечении остеопороза различной этиологии.
Пример 4. Влияние пептида H-Ala-Glu-Asp-OH на развитие эксплантатов хрящевой ткани
Эксперименты проведены на 28 фрагментах хрящевой ткани проксимальной головки бедренной кости крыс линии Вистар с массой тела 160-200 г. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты хрящевой ткани помещали в эту среду и культивировали в чашках Петри в термостате при температуре 36,7°С в течение 2 суток. В экспериментальную среду добавляли пептид H-Ala-Glu-Asp-OH до конечных концентраций 1, 10, 100, 200 и 400 нг/мл. Критерием биологической активности служил индекс площади (ИП) - соотношение площади всего эксплантата вместе с зоной роста к исходящей площади фрагмента хрящевой ткани. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%.
На чертеже показано влияние пептида H-Ala-Glu-Asp-OH на развитие эксплантатов хрящевой ткани.
Установлено, что через 1 сутки культивирования происходило распластывание эксплантатов на коллагеновой подложке и начиналось выселение пролиферирующих и мигрирующих клеток по периферии эксплантата. На 3-и сутки культивирования при концентрации пептида H-Ala-Glu-Asp-OH 100 нг/мл наблюдалось достоверное повышение ИП эксплантатов на 26% по сравнению с контрольными значениями ИП. При исследовании эксплантатов хрящевой ткани на более длительных сроках культивирования (7 дней) было выявлено аналогичное стимулирующее действие пептида H-Ala-Glu-Asp-OH в той же концентрации.
Таким образом, в отношении хрящевой ткани пептид H-Ala-Glu-Asp-OH оказывал тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов.
Пример 5. Эффективность применения пептида H-Ala-Glu-Asp-OH у больных с остеоартрозом коленных суставов
Исследование проведено на 29 больных в возрасте 52-72 лет с остеоартрозом коленных суставов. Больные предъявляли жалобы на боли и ограничение сгибания и разгибания в суставах при ходьбе. У лиц старшей возрастной группы характерными признаками были деформация суставов, атрофия бедренных мышц и ослабление связочного аппарата суставов. Продолжительность течения заболевания составляла от 5 до 20 лет, отмечалась прогрессирующая динамика развития патологического процесса. Все больные ранее длительное время получали анальгетики и противовоспалительные средства, применение которых вызывало кратковременный терапевтический эффект, требующий увеличения дозы препаратов на курс лечения и продолжительного их приема.
Больные были рандомизированно разделены на 2 группы.
Больных основной группы разделили на 3 подгруппы по возрасту и степени выраженности деформации суставов. Больным основной группы в возрасте старше 65 лет с наиболее выраженной деформацией суставов и ограничением движений вводили фармацевтическую композицию, содержащую пептид H-Ala-Glu-Asp-OH, ежедневно однократно внутримышечно в дозе 5,0 мг в 1 мл стерильного физиологического 0,9% раствора NaCl в течение 20 дней. Больным основной группы в возрасте 60-65 лет с деформацией суставов средней степени вводили фармацевтическую композицию, содержащую пептид H-Ala-Glu-Asp-OH, ежедневно однократно внутримышечно в дозе 10,0 мкг в 1 мл стерильного физиологического 0,9% раствора NaCl в течение 20 дней. Больным основной группы в возрасте от 52 до 60 лет с начальной стадией развития заболевания, выражавшейся в болезненности суставов и некотором ограничении движений в суставах в период обострения заболевания, вводили фармацевтическую композицию, содержащую пептид H-Ala-Glu-Asp-OH, ежедневно однократно внутримышечно в дозе 1,0 мкг в 1 мл стерильного физиологического 0,9% раствора NaCl в течение 20 дней.
Контрольная группа включала 12 пациентов, получавших инъекции стерильного физиологического раствора по аналогичной схеме.
Эффективность применения фармацевтической композиции, содержащей пептид H-Ala-Glu-Asp-OH, у больных оценивали по динамике клинических показателей и данных рентгенологического исследования.
Необходимо отметить, что рентгенологические симптомы дегенеративно-дистрофических заболеваний суставов являются не только объективными диагностическими критериями стадии развития патологического процесса, но и имеют большую прогностическую значимость при проводимой лекарственной терапии.
Установлено, что применение пептида H-Ala-Glu-Asp-OH у больных с остеоартрозом коленных суставов всех подгрупп способствовало снижению болевого синдрома и увеличению подвижности суставов в 54,5-62,7% случаев в зависимости от тяжести заболевания. При этом наиболее полно болевая симптоматика исчезала на рентгенологически определяемых начальных стадиях заболевания: сужение суставной щели между надколенником и бедром, латеральные остеофиты надколенника и мыщелка бедра. Существенной динамики рентгенологических симптомов в этот период не наблюдалось.
У больных в развернутой стадии артроза также наблюдалась аналогичная динамика субъективных показателей, но менее выраженная, поскольку на этой стадии заболевания требуется длительное комплексное лечение. Так как эта стадия заболевания была диагностирована у лиц более старшей возрастной группы, то положительная динамика субъективных показателей характеризовалась как очень благоприятная.
Результаты проведенного исследования свидетельствуют о том, что лечебная эффективность фармацевтической композиции, содержащей пептид H-Ala-Glu-Asp-OH, основана на нормализации метаболизма и замедлении инволюционных изменений в костной и хрящевой тканях коленных суставов за счет улучшения трофики их клеток.
Таким образом, фармацевтическую композицию, содержащую в качестве активного начала эффективное количество пептида H-Ala-Glu-Asp-OH, целесообразно применять с лечебной или профилактической целью, в том числе в сочетании с любыми средствами симптоматической и патогенетической терапии, используемыми для лечения дегенеративно-дистрофических заболеваний суставов и позвоночника, используя различные дозировки фармацевтической композиции от 5 мг до 1 мкг в 1 мл стерильного физиологического 0,9% раствора NaCl в зависимости от возраста пациента и степени выраженности патологического процесса в суставах и позвоночнике.
| Таблица 1Пептид, нормализующий метаболизм в костной и хрящевой тканях, фармацевтическая композиция на его основе и способ ее применения | ||||
| Показатель | Введение пептида H-Ala-Glu-Asp-OH (1 мкг/кг) | |||
| 3 месяца | 6 месяцев | |||
| Контроль (n=24) | Пептид (n=24) | Контроль (n=24) | Пептид (n=24) | |
| Эритроциты, ×1012/л | 5,3±0,6 | 5,4±0,1 | 5,4±0,3 | 5,3±0,5 |
| Гемоглобин, г/л | 14,2±1,4 | 14,6±1,1 | 14,5±1,3 | 13,7±0,8 |
| Ретикулоциты, % | 1,3±0,07 | 1,2±0,04 | 1,1±0,05 | 1,1±0,02 |
| Тромбоциты, ×109/л | 143,7±7,9 | 144,8±6,1 | 144,5±8,6 | 145,3±7,2 |
| Лейкоциты, ×109/л | 9,4±0,5 | 9,7±0,6 | 9,6±0,5 | 10,5±0,2 |
| Нейтрофилы палочкоядерные, % | 0,31±0,04 | 0,28±0,05 | 0,33±0,04 | 0,30±0,03 |
| Нейтрофилы сегментоядерные, % | 45,8±2,1 | 45,1±1,9 | 46,2±3,5 | 44,6±2,8 |
| Эозинофилы, % | 0,69±0,05 | 0,74±0,03 | 0,72±0,04 | 0,68±0,04 |
| Базофилы, % | 0,61±0,04 | 0,64±0,06 | 0,72±0,03 | 0,65±0,02 |
| Моноциты, % | 2,5±0,02 | 2,6±0,05 | 2,6±0,06 | 2,5±0,07 |
| Лимфоциты, % | 48,9±2,5 | 51,2±2,1 | 51,3±2,7 | 49,7±2,1 |
| СОЭ, мм/ч | 1,69±0,05 | 1,73±0,05 | 2,01±0,05 | 1,85±0,05 |
| Резистентность эритроцитов, % NaCl | ||||
| - максимальная | 0,41±0,02 | 0,40±0,06 | 0,42±0,04 | 0,40±0,02 |
| - минимальная | 0,32±0,05 | 0,30±0,01 | 0,34±0,04 | 0,30±0,03 |
| Общий белок в сыворотке крови, г/л | 72,9±3,1 | 71,9±2,7 | 73,1±3,4 | 7131±2,6 |
| Натрий в сыворотке крови, ммоль/л | 153,9±5,7 | 155,2±4,9 | 155,5±6,2 | 153,9±5,9 |
| Калий в сыворотке крови, ммоль/л | 5,1±2,3 | 5,4±2,5 | 5,2±2,1 | 5,3±2,0 |
| Таблица 2Пептид, нормализующий метаболизм в костной и хрящевой тканях, фармацевтическая композиция на его основе и способ ее применения | |||
| Группа животных | ρСа, % | NCa/1 mm2 | OpDCa, у.е. |
| Интактные животные | 14,5±1,9 | 2424±169 | 0,241±0,005 |
| Контроль (эпифизэктомированные животные + физ. раствор) 3 сутки после окончания введения | 17,8±1,6* | 3012±172* | 0,263±0,003 |
| Контроль (эпифизэктомированные животные + физ. раствор) 12 сутки после окончания введения | 22,0±2,3* | 3668±158* | 0,258±0,012 |
| Эпифизэктомированные животные + пептид H-Ala-Glu-Asp-OH 3 сутки после окончания введения | 9,5±1,5** | 1575±163** | 0,344±0,008** |
| Эпифизэктомированные животные + пептид H-Ala-Glu-Asp-OH 12 сутки после окончания введения | 14,1±1,8** | 2346±162** | 0,32810,011** |
| * - Р<0,05 по сравнению с показателем у интактных животных;** - Р<0,05 по сравнению с показателем у животных контрольной группы. |
1. Пептид аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1], обладающий биологической активностью, проявляющейся в нормализации метаболизма в костной и хрящевой тканях.
2. Пептид по п.1 для приготовления лекарственного средства, нормализующего метаболизм в костной и хрящевой тканях.
3. Фармацевтическая композиция, нормализующая метаболизм в костной и хрящевой тканях, характеризующаяся тем, что в качестве активного начала содержит эффективное количество пептида аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] и фармацевтически приемлемый носитель.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что она находится в форме, подходящей для парентерального введения.
5. Способ профилактики и лечения заболеваний опорно-двигательного аппарата путем нормализации метаболизма в костной и хрящевой тканях, заключающийся во введении пациенту фармацевтической композиции, содержащей в качестве активного начала пептид аланил-глутамил-аспарагиновая кислота общей формулы H-Ala-Glu-Asp-OH последовательности 1 [SEQ ID NO:1] в дозе 0,01-100 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта.
6. Способ по п.5, отличающийся тем, что введение осуществляют внутримышечно.