Имплантат-носитель для хирургического лечения заболеваний внутренних органов
Иллюстрации
Показать всеИзобретение относится к медицинской технике, а именно к созданию имплантатов, и может быть использовано для лечения различных заболеваний внутренних органов. Имплантат-носитель для хирургического лечения внутренних органов содержит заполненный клеточной суспензией элемент из пористого проницаемого титана, отличающийся тем, что он имеет пористость 20-70%, коэффициент проницаемости 10-14-10-8 м2 и размеры пор 20-400 мкм. Изобретением достигается увеличение срока службы имплантата-носителя, улучшение смачиваемости материала носителя клеточными суспензиями и увеличение биосовместимости материала носителя. 2 ил.
Реферат
Изобретение относится к медицинской технике, а именно к созданию имплантатов. Имплантат-носитель для хирургического лечения заболеваний внутренних органов представляет собой пористый проницаемый титановый элемент с заданной пористостью, проницаемостью и размерами пор. Поровое пространство титанового элемента заполняется клеточными культурами.
Описание изобретения.
В настоящее время интенсивно развивается новое направление в медицине, связанное с частичным или полным замещением функций заболевшего органа имплантатом - аналогом этого органа, который является носителем-инкубатором фетальных или стволовых клеток. Показано, что использование такого носителя-инкубатора повышает эффективность трансплантации фетальных клеток по сравнению с их простым введением в виде суспензии.
Известен носитель клеточных структур искусственных внутренних органов [1] в виде металлического контейнера с перфорированными стенками. Основной недостаток этого носителя - очень маленький размер перфораций (0,3 мкм), которые быстро зарастают, в результате срок службы имплантата-носителя очень мал.
Известен «Носитель клеточных культур искусственных внутренних органов» [2], содержащий сплошной объем из пористого проницаемого сплава на основе никелида титана, отличающийся тем, что указанный сплав выбран с температурным интервалом фазовых превращений, включающим область рабочих температур 0-60°С.
Недостатки этого носителя состоят в следующем:
1. Преимущественный размер пор (0,3-0,5 мкм), принятый в [2] для характеристики порового пространства, очень мал и не в состоянии нормально пропускать клеточную суспензию.
2. Поровое пространство носителя при таком размере пор быстро зарастает, и срок службы носителя мал.
3. Высокое содержание никеля в сплаве никелида титана, выбранного в качестве материала носителя. В состав никелида титана входит около 50% ат. никеля. Известно, что никель является токсичным элементом, и около 15% людей обладают чувствительностью к нему. Этот металл в виде ионов Ni2+ оказывает сильное хемотоксичное действие на клетки организма и является биокатализатором, ускоряющим процесс деструкции протеинов плазмы крови. При имплантации никеля в организм достоверно установлены бластомагенная активность иона Ni2+ и широкая зона воспалительных процессов, связанных с растворением никеля в тканевых жидкостях. И хотя сплавы на основе никелида титана не подвергаются заметной коррозии, так как при пассивации в биологических жидкостях на их поверхности образуется содержащий небольшое количество никеля слой TiO2, не характеризуются канцерогенной и аллергенной активностью, проблему их биохимической совместимости с тканями организма и клеточными культурами нельзя считать полностью решенной.
4. Специальные эксперименты с носителями клеточных культур из никелида титана показали, что внутренняя поверхность пор является гидрофобной, плохо смачивается клеточными суспензиями, и для улучшения смачиваемости необходимо добавление поверхностно-активных веществ, что существенно усложняет технологию пропитки носителя клеточной суспензией.
Основными недостатками аналога являются низкий срок службы, обусловленный малыми размерами пор, большое содержание никеля в материале носителя - никелиде титана - и плохая смачиваемость последнего клеточными суспензиями.
Известен «Имплантат для хирургического лечения заболеваний внутренних органов» [3], содержащий иммуноизолированное вместилище и помещенную в него клеточную суспензию, отличающийся тем, что указанное вместилище выполнено в виде сплошного объема из пористого проницаемого никелида титана.
Имплантат отличается тем, что пористость никелида титана выбрана с преимущественным размером пор 0,3-0,5 мкм.
Имплантат отличается тем, что форма вместилища выбрана уплощенной.
Имплантат отличается тем, что форма вместилища выбрана сферической.
Недостатки этого носителя, принятого по наибольшему сходству за прототип предлагаемого изобретения, состоят в следующем:
1. Очень малый преимущественный размер пор (0,3 - 0,5 мкм), который плохо пропускает клеточную суспензию, размер клеток в которой обычно составляет 3-10 мкм.
2. При таком размере пор поровое пространство носителя быстро зарастает и срок службы носителя мал.
3. Высокое содержание никеля в сплаве никелида титана, выбранного в качестве материала носителя. В состав никелида титана входит около 50% ат. никеля. Известно, что никель обладает аллергенной активностью и около 15% людей обладают чувствительностью к нему. Этот металл в виде ионов Ni2+ оказывает сильное хемотоксичное действие на клетки организма и является биокатализатором, ускоряющим процесс деструкции протеинов плазмы крови. При имплантации никеля в организм достоверно установлены бластомагенная активность иона Ni2+ и широкая зона воспалительных процессов, связанных с растворением никеля в тканевых жидкостях. И хотя сплавы на основе никелида титана не подвергаются заметной коррозии, так как при пассивации в биологических жидкостях на их поверхности образуется содержащий небольшое количество никеля слой TiO2, не характеризуются канцерогенной активностью, проблему их биохимической совместимости с тканями организма и клеточными культурами нельзя считать полностью решенной.
4. Специальные эксперименты с носителями клеточных культур из никелида титана показали, что внутренняя поверхность пор является гидрофобной, плохо смачивается клеточными суспензиями, и для улучшения смачиваемости необходимо добавление поверхностно-активных веществ, что существенно усложняет технологию пропитки носителя клеточной суспензией.
Основными недостатками аналога, принятого за прототип, являются малый срок службы, большое содержание никеля в материале носителя - никелиде титана - и плохая смачиваемость последнего клеточными суспензиями.
Технический результат предложения - увеличение срока службы носителя, улучшение смачиваемости материала носителя клеточными суспензиями и увеличение биосовместимости материала носителя.
Указанный технический результат достигается тем, что имплантат-носитель клеточных культур искусственных внутренних органов содержит заполненный клеточной суспензией элемент из пористого проницаемого титана, отличающийся тем, что он имеет пористость 20÷70%, коэффициент проницаемости (10-14÷10-8) м2 и размеры пор 20-400 мкм.
Титан, в том числе и пористый, широко используется в медицине и тщательно изучен по сравнению с никелидом титана. Показано, что при взаимодействии титана с культурами клеток сенсорного спинномозгового узла новорожденных крыс функционирование клеток не нарушается, отсутствует влияние ионов титана на клеточные мембраны. Не обнаружено токсического действия титана при его взаимодействии с культурой клеток костного мозга. Отсутствует токсическое действие титана по отношению к функции распространения лейкоцитов. Сорбция лейкоцитов на титане обнаружена, но между клетками и поверхностью титана всегда есть слой аморфного вещества. Частицы титана размером 5 мкм не оказывают воздействия на культуры фибробластов человека и макрофагов мыши. Воспалительный потенциал титана при действии на культуральную среду низок, ионы титана в культуральной среде не обнаружены. Титан, покрытый оксидом TiO2 или нитридом TiN, обладает антимикробным действием относительно стафилококка, стрептококка, кишечной и синегнойной палочки и протея. Таким образом, титан обладает очень высокой биосовместимостью с культуральными средами.
При наличии смачивания заполнение проницаемого носителя клеточными культурами включает пропитку порового пространства клеточной суспензией при комнатной температуре.
Степень заполнения клеточной суспензией порового пространства носителя определяется пористостью носителя, размерами пор и проницаемостью, которая в свою очередь зависит от размеров пор и величины пористости.
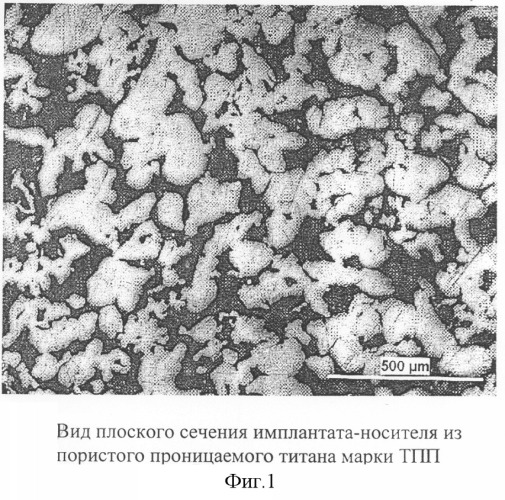
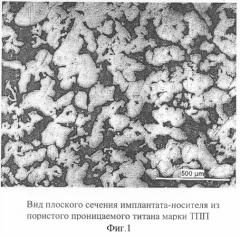
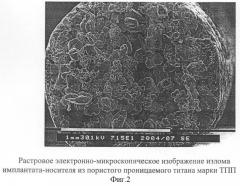
Для изготовления имплантатов-носителей использовали порошок марки ТПП со следующим содержанием основных примесей, мас.%: Fe<0,330; O<0,080; N<0,033. После сушки в вакуумном сушильном шкафу при 300°С в течение 2 часов порошок засыпали в формы и спекали в вакууме 133×10-5 Па при температуре 1200°С. Вид порового пространства и химический состав спеченного титана изучали методами растровой электронной микроскопии и микрорентгеноспектрального анализа (Philips SEM515 с приставкой EDAX Ekon IV). Пористость и проницаемость определяли экспериментально по ГОСТ 25281-82 «Пористость проницаемых материалов и изделий», по ГОСТ 18898-73 «Методы определения плотности и пористости» и по ГОСТ 25283-93 «Изделия порошковые. Метод определения проницаемости газов и жидкостей»
Указанная выше в тексте нижняя граница интервала значений пористости носителя определяется тем, что при значениях общей пористости 20% и менее и размере пор <50 мкм значительная часть пор является закрытой. При этом минимальная открытая пористость, необходимая для пропитки носителя, составляет 12%, а большинство пор - тупиковые. Проницаемость такого порового пространства равна примерно 10-14 м2.
Верхняя граница интервала значений пористости носителя определяется тем, что при 70% все поры являются открытыми, а поровое пространство - полностью проницаемым. При размерах пор порядка 250-400 мкм коэффициент проницаемости равен 10-9÷10-8 м2. При дальнейшем увеличении пористости и размеров пор снижаются капиллярный эффект, определяющий пропитку порового пространства, и прочностные свойства пористого носителя. В результате возникает опасность поломки носителя во время его установки в организм.
Поскольку клетки различного вида имеют разные размеры и морфологию, указанные интервалы характеристик порового пространства носителя допускают пропитку разнообразными культуральными средами.
Принцип действия предлагаемого имплантат-носителя и прототипа одинаков. Изготовленную по специальной технологии клеточную суспензию, необходимую заболевшему органу, помещали в имплантат из пористого проницаемого титана (пропитывали последний клеточной суспензией) и имплантировали в тело больного. После периода адаптации клетки начинали действовать, замещая частично или полностью функцию заболевшего органа и создавая возможность его лечения. Достижимость технического результата обусловлена высокой биохимической совместимостью пористого титана, вследствие этого выполненные из него устройства не капсулируются, его диффузионная способность сохраняется длительное время, а эффективность работы устройства возрастает со временем, так как поровое пространство титана прорастает сосудами и пассивная диффузия метаболитов дополняется активным синтезом и экскрекцией веществ, присущих «родным» органам в естественных условиях.
Вид порового пространства имплантата-носителя представлен на фиг.1 и 2.
В качестве конкретного примера, подтверждающего достижимость технического результата, приведен пример испытания предлагаемого изобретения при лечении осложнений сахарного диабета у подопытных животных.
Пример 1. Лечение осложнений сахарного диабета
Испытание имплантата-носителя клеточных культур искусственных внутренних органов из пористого проницаемого титана проводили в 2004-2005 гг.на крысах серии 2321/BL6. Использовали имплантаты-носители в виде куба 4×4×4 мм, заполненные островковой частью поджелудочной железы поросят.
Клеточную культуру эндокринной части поджелудочной железы готовили в соответствии с известной методикой: в стерильных условиях производили забор поджелудочной железы у поросят, после внутрибрюшинного введения оксибутирата натрия (20%, 2 мл) общий желчный проток пережимали у места впадения в 12-перстную кишку, перерезали аорту и нижнюю полую вену. В общий желчный проток вводили холодный (4°С) раствор Хэнкса (20 мл), содержащий каллагеназу ("SERVA", 20 мг, активность 150 ед./мг) и HEPES (10 mM, рН 7,2). Пропитанную этим раствором поджелудочную железу удаляли и помещали в водяную баню (37°С). Через 40 минут переваривание останавливали, добавляли 15 мл холодного раствора Хэнкса. Далее ткань энергично встряхивали и фильтровали через сито с отверстиями диаметром 0,6-0,8 мм, затем отмывали трижды раствором Хэнкса при центрифугировании (100 g, 10 с). Взвесь ткани центрифугировали в 4-ступенчатом градиенте плотности Фиккола: 1,078; 1.070; 1.060; 1,045. Островки собирали с границы между двумя средними слоями, отмывали от Фиккола с центрифугированием (100 g, 10 с) раствором Хэнкса два раза и физиологическим раствором 1 раз.
Далее островки последовательно помещали в 0,02% раствор ЭДТА на 5 мин при комнатной температуре и в 0,25% раствор трипсина при 4°С на 15 минут, после чего аккуратно пипетировали до превращения островков в однородную взвесь. Затем клетки отмывали раствором РПМИ среды с добавлением 10% телячьей сыворотки. После подсчета клеток в камере Горяева и определения жизнеспособности с помощью трепанового синего (должно быть не менее 90% живых клеток) клетки культивировали в термостате при температуре 37°С после пропитывания имплантата.
Пропитка устройства из пористого проницаемого титана с общей пористостью 20% и размерами пор 20-50 мкм при коэффициенте проницаемости 10-14 м2 протекает с трудом в течение примерно 40 часов, при этом масса клеточной суспензии, поглощенной устройством, мала (поглощение клеточной суспензии В определяли по формуле: В=(Рк-Рс)/Рс, где Pк - масса образца, пропитанного клеточной суспензией, а Рc - масса сухого образца).
Пропитка устройства из пористого проницаемого титана с общей пористостью 70% и размерами пор 100-400 мкм при коэффициенте проницаемости 10-9÷10-8 м2 протекает в течение 20-30 часов, после чего объем пор заполнен на 85-90%. При выбранных характеристиках пористого проницаемого титанового устройства для некоторых образцов наблюдается частичное вытекание клеточной суспензии, обусловленное, по-видимому, наличием некоторого количества крупных пор (500 мкм и более). Наилучшие результаты получены при размерах пор 100-300 мкм, общей пористости 50-60% и коэффициенте проницаемости 10-12÷10-11 м2. Имплантат-носитель из пористого проницаемого титана, имеющий такие характеристики, пропитывается клеточной суспенцией в течение 20-30 часов. Последняя не вытекает из имплантата. Степень заполнения пор с указанными размерами близка к максимальной, некоторые поры остаются частично незаполненными, возможно из-за воздуха, запертого в порах.
Для сравнения пропитывали прототип - имплантат из пористого проницаемого никелида титана (Патент РФ №2143867). Пропитка осуществлялась в течение 48-72 часов с применением поверхностно-активных веществ и занимала в 2-3 раза больше времени, чем пропитка имплантата из пористого проницаемого титана. Это свидетельствует о недостаточной смачиваемости никелида титана клеточной суспензией.
Во время культивирования происходит прикрепление клеток к имплантату-носителю с последующей нормализацией эндогенного дыхания и функциональной активности. Функциональную активность островковых клеток поджелудочной железы оценивали in vitro по способности вырабатывать С-пептид в среду. В среднем при норме (204-938) пмоль/мл с одного имплантата-носителя из пористого никелида титана вырабатывается (50-90) пмоль/мл С-пептида, а с одного имплантата-носителя из пористого проницаемого титана - (80-150) пмоль/мл, что является существенным преимуществом последнего и свидетельствует о его более высокой биохимической совместимости.
Эксперименты проводили на крысах серии 2321/BL6. Всего прооперировано 30 крыс, разбитых на 3 группы: 1 - интактная группа крыс (контроль) получила инсулин по общепринятой методике; 2 - группа крыс, которым трансплантировали имплантат-носитель из пористого никелида титана с преимущественным размером пор 0,3-0,5 мкм и 3-группа крыс, которым трансплантировали имплантат-носитель из пористого проницаемого титана с общей пористостью 60%, преимущественным размером пор 100-300 мкм и коэффициентом проницаемости 10-11÷10-12 м2 .
Предварительно у всех крыс вызывали аллоксановый диабет путем введения в/м раствора аллоксана в дозе 15 мг/кг веса. В течение месяца после введения аллоксана у крыс развивалась стойкая гликемия в среднем от 12-18 ммоль/л через 48 часов. Контроль уровня гликемии производили аппаратом "One Touch". В последующем под общим эфирным обезболиванием производили лапаротомию у крыс серии 2321/BL6 и осуществляли свободную трансплантацию в брюшную полость имплантата-носителя с островками Лангенгарса, полученными по описанной выше методике. Послеоперационный период у крыс протекал гладко, нагноений раны не наблюдали. Компенсация диабета у крыс происходила в течение 1 нед после операции, уровень гликемии составлял в среднем 4-6 ммоль/л и держался на таком уровне до момента выведения крыс из опыта. Гистоморфологические исследования имплантатов, взятых у крыс с аллоксановым диабетом, проводили в сроки 1 нед, 2 нед, 1 мес, 3 мес, полгода, когда в зависимости от срока начиная с 1-го мес обнаружили наличие тонкой пленки соединительной ткани, покрывающей имплантат и содержащей кровеносные сосуды и нервы, врастающие в проницаемую структуру имплантата-носителя, где находятся островки Лангенгарса свиньи.
Результаты через год: В первой группе остались в живых 3 крысы, во второй группе - 5 крыс, а в третьей группе - 8 крыс. Причиной смерти во всех случаях было развитие нефропатии и диабетической антиопатии.
Оценка результатов использования пористых имплантатов из никелида титана (прототип) и титана свидетельствует о существенном преимуществе последнего по сравнению с известными аналогами и выбранным прототипом.
ИСТОЧНИКИ ИНФОРМАЦИИ.
1. Immunosuppression, Macroencapsulation and Ultraviolet Birradiation as Immunoprotection in Porcine Pazereatic Islet Xenotransplantation. Pharmacology and Toxicology. 1995, June.
2. Патент на изобретение РФ №2191607. 7 A61L 27/06, A61L 27/56 (Гюнтер В.Э., Дамбаев В.Н., Ходоренко В.Н., Загребин Л.В., Хлусов И.А., Ясенчук Ю.Ф.) Заявл. 2000.06.23; Опубл. 2002.10.27.
3. Патент на изобретение РФ №2143867. 7 A61F 2/02 (Дамбаев В.Н., Гюнтер В.Э., Загребин Л.В., Ходоренко В.Н. и др.) Заявл. 1997.11.12; Опубл. 2000.01.10.
Имплантат-носитель клеточных культур искусственных внутренних органов, содержащий заполненный клеточной суспензией элемент из пористого проницаемого титана, отличающийся тем, что он имеет пористость 20÷70%, коэффициент проницаемости 10-14÷10-8 м2 и размеры пор 20÷400 мкм.