Комбинации для лечения воспалительных заболеваний
Иллюстрации
Показать всеНастоящее изобретение относится к медицине и касается способа лечения пациента, имеющего воспалительное заболевание или риск его развития, путем введения пациенту (i) трициклического антидепрессанта, например амоксапина, и (ii) кортикостероида, например преднизолона. Лекарственные средства (i) и (ii) вводят одновременно или с интервалом в пределах 14 дней в количествах, достаточных для ингибирования воспаления или уменьшения риска его развития. Изобретение также касается фармацевтической композиции и фармацевтической упаковки, включающей лекарственные средства (i) и (ii), а также способа идентификации комбинаций соединений для лечения воспаления путем определения снижения уровней провоспалительного цитокина при контактировании иммунных клеток с комбинацией соединения-кандидата с (i) или (ii). Изобретение обеспечивает расширение арсенала противовоспалительных средств и их комбинаций, а также идентификации таких комбинаций, уменьшение токсичности противовоспалительного лечения. 5 н. и 31 з.п. ф-лы, 3 табл.
Реферат
Предпосылки к созданию изобретения
Настоящее изобретение относится к лечению воспалительных заболеваний.
Воспаление наблюдается, когда ткани повреждаются вирусами, бактериями, травмой, химическими веществами, теплом, холодом или любыми другими вредными раздражителями. Химические вещества, включая брадикинин, гистамин, серотонин и другие, высвобождаются, привлекая тканевые макрофаги и лейкоциты к участку повреждения для поглощения и разрушения чужеродных веществ. Во время данного процесса высвобождаются химические медиаторы, такие как TNFα, вызывая воспаления. Воспалительными заболеваниями являются такие заболевания, при которых воспаление поддерживается или является хроническим. Примером воспалительного заболевания является остеоартрит.
Иммуновоспалительные заболевания (например, ревматоидный артрит, псориаз, язвенный колит, болезнь Крона, индуцированная внезапным мозговым ударом смерть клеток головного мозга, анкилозирующий спондилит, фибромиалгия, и аутоиммунные заболевания, такие как астма, рассеянный склероз, диабет I типа, системная красная волчанка, склеродермия, системный склероз и синдром Шенгрена) представляют собой воспалительные заболевания, которые характеризуются разрегулировкой иммунной системы и неправильной мобилизацией защитных механизмов организма против его собственной здоровой ткани.
Во всем мире один процент людей страдает ревматоидным артритом, безжалостным, прогрессирующим заболеванием, вызывающим тяжелые отеки, боль и, в конечном итоге, деформацию и разрушение суставов. Согласно Arthritis Foundation ревматоидным артритом в настоящее время страдает более двух миллионов американцев, причем женщины болеют в три раза чаще. Ревматоидный артрит характеризуется воспалением выстилки суставов и/или других внутренних органов, а также наличием повышенного количества лимфоцитов и высоких уровней провоспалительных цитокинов.
Лечение ревматоидного артрита обычно включает введение (i) нестероидных противовоспалительных препаратов (НПВП) (NSAID, например, детопрофена, диклофенака, дифлунизала, этодолака, фенопрофена, флурбипрофена, ибупрофена, индометацина, кетопрофена, меклофенамеата, мефенамовой кислоты, мелоксикама, набумеона, напроксен-натрия, оксапрозина, пироксикама, сулиндака, толметина, целекоксиба, рофекоксиба, аспирина, холина салицилата, салсальта и салицилата натрия и магния); (ii) стероидов (например, кортизона, дексаметазона, гидрокортизона, метилпреднизолона, преднизолона, преднизона, триамцинолона); (iii) DMARD, т.е. модифицирующих заболевание противоревматических лекарственных средств (например, циклоспорина, азатиоприна, метотрексата, лефлуномида, циклофосфамида, гидроксихлорохина, сульфасалазина, D-пеницилламина, миноциклина и препаратов золота), или (iv) рекомбинантных белков (например, ENBREL® (этанерцепта, растворимого рецептора TNF) и REMICADE® (инфликсимаба), химерного моноклонального анти-TNF антитела).
Существует потребность в разработке новых схем лечения ревматоидного артрита и других воспалительных заболеваний.
Краткое описание существа изобретения
Авторы установили, что комбинация амоксапина (2-хлор-11(1-пиперазинил)дибенз[b,f][1,4]оксапина) и преднизолона (известного также как 1-дегидрокортизол; 1-дегидрогидрокортизон; 1,4-прегнадиен-11бета,17альфа,21-триол-3,20-дион и 11бета,17альфа,21-тригидрокси-1,4-прегнадиен-3,20-дион) вызывает значительное подавление уровней TNFα, индуцированных в крови мононуклеарными клетками периферической крови (РВМС).
Амоксапин представляет собой трициклический антидепрессант (ТСА). На основании способности амоксапина действовать вместе с преднизолоном в отношении ингибирования уровней TNFα специалисту будет понятно, что другие ТСА также можно использовать в настоящем изобретении. Также можно использовать структурные аналоги амоксапина, которые не являются трициклическими антидепрессантами. Примеры структурных аналогов включают, например, клотиапин, перлапин, флуперлапин и дибенз(b,f)(1,4)оксазепин, 2-хлор-11-(4-метил-1-пиперазинил)моногидрохлорид.
Преднизолон представляет собой кортикостероид. На основании общих структурных признаков и ясного механизма действия среди веществ семейства кортикостероидов, специалисту будет понятно, что другие кортикостероиды также можно использовать в комбинации с амоксапином или другими ТСА для лечения воспалительных заболеваний.
Соответственно, настоящее изобретение относится к способу лечения пациента, страдающего воспалительным заболеванием, посредством введения пациенту (i) ТСА (например, амоксапина) и (ii) кортикостероида (например, преднизолона) одновременно или с интервалом в пределах 14 дней в количествах, достаточных для подавления уровней TNFα, достаточного для получения терапевтического благоприятного действия на пациента. В одном варианте осуществления настоящего изобретения два соединения представляют собой амоксапин и преднизолон.
Настоящее изобретение относится также к способу лечения пациента, страдающего воспалительным заболеванием, посредством введения пациенту (i) клотиапина, перлапина, флуперлапина или дибенз(b,f)(1,4)оксазепина, 2-хлор-11-(4-метил-1-пиперазинил)моногидрохлорида и (ii) кортикостероида (например, преднизолона) одновременно или с интервалом в пределах 14 дней в количествах, достаточных для подавления уровней TNFα, достаточного для получения терапевтического благоприятного действия на пациента.
Предпочтительно два соединения по настоящему изобретению вводят с интервалом в пределах десяти дней, более предпочтительно с интервалом в пределах пяти дней и наиболее предпочтительно с интервалом в пределах двадцати четырех часов или одновременно. Заболевание, которое лечат, согласно настоящему изобретению может представлять собой, например, ревматоидный артрит, псориаз, язвенный колит, болезнь Крона, индуцированную внезапным мозговым ударом смерть клеток головного мозга, анкилозирующий спондилит и фибромиалгию, астму, рассеянный склероз, диабет I типа, системную красную волчанку, склеродермию, системный склероз или синдром Шенгрена.
В описанном выше способе лечения оба соединения предпочтительно содержатся вместе в фармацевтической композиции, которая также включает фармацевтически приемлемый носитель.
Настоящее изобретение относится также к фармацевтической композиции, которая включает (i) ТСА (например, амоксапин) и (ii) кортикостероид (например, преднизолон) вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем.
Настоящее изобретение относится также к способу идентификации соединений, пригодных для лечения пациента, страдающего воспалительным заболеванием. Способ включает стадии: контактирования иммунных клеток in vitro с (i) ТСА или кортикостероидом и (ii) соединением-кандидатом и определения, модулируется ли иммунный ответ относительно (а) иммунных клеток, контактировавших с ТСА или кортикостероидом, но не контактировавших с соединением-кандидатом, и (b) иммунных клеток, контактировавших с соединением-кандидатом, но не с ТСА или кортикостероидом. Соединение-кандидат, которое после объединения с ТСА или кортикостероидом модулирует иммунный ответ в большей степени, чем контроли, представляет собой соединение, которое является потенциально пригодным для лечения пациента, страдающего воспалительным заболеванием.
Соединения, пригодные для настоящего изобретения, включают соединения, описанные в настоящем документе, в любых своих фармацевтически приемлемых формах, включая их изомеры, такие как диастереоизомеры и энантиомеры, соли, сольваты и полиморфы, а также рацемические смеси соединений, описанных в настоящем документе.
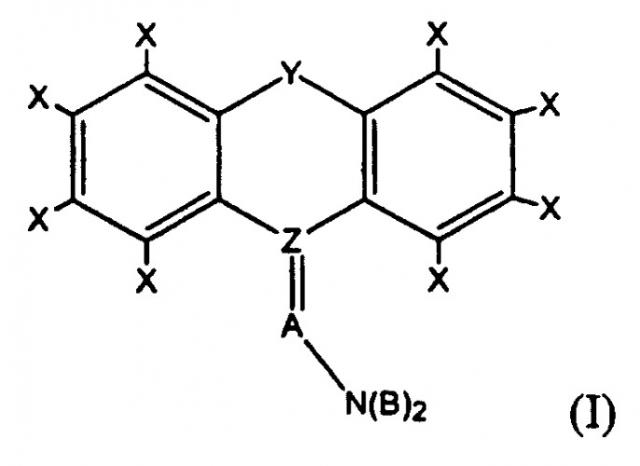
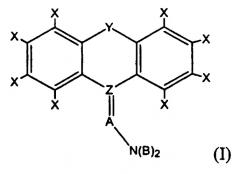
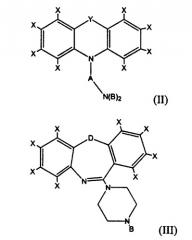
Под «трициклическим антидепрессантом» или «ТСА» подразумевается соединение, имеющее одну из формул (I), (II) или (III):
где каждый Х представляет собой, независимо, H, Cl, F, Br, I, CH3, CF3, OH, OCH3, CH2CH3 или OCH2CH3; Y представляет собой CH2, O, NH, S(O)0-2, (CH2)3, (CH)2, CH2O, CH2NH, CHN или CH2S; Z представляет собой C или S; A представляет собой разветвленную или неразветвленную, насыщенную или мононенасыщенную углеводородную цепь, имеющую от 3 до 6 атомов углерода включительно; каждый В представляет собой, независимо, H, Cl, F, Br, I, CX3, CH2CH3, OCX3 или OCX2CX3; и D представляет собой CH2, O, NH, S(O)0-2.
В предпочтительных вариантах осуществления настоящего изобретения каждый Х представляет собой, независимо, H, Cl или F; Y представляет собой (CH2)2; Z представляет собой C; A представляет собой (CH2)3; каждый В представляет собой, независимо, H, Cl или F.
Примеры трициклических антидепрессантов включают, например, амоксапин, 8-гидроксиамоксапин, 7-гидроксиамоксапин, локсапин, локсапина сукцинат, локсапина гидрохлорид, 8-гидроксилоксапин, амитриптилин, клопрамин, доксепин, имипрамин, тримипрамин, дезипрамин, нортриптилин и протриптилин.
Под «кортикостероидом» подразумевается любой природный или синтетический стероидный гормон, который может быть получен из холестерина и характеризуется гидрированной циклопентанпергидрофенантреновой кольцевой системой. Природные кортикостероиды обычно вырабатывает кора надпочечников. Синтетические кортикостероиды могут быть галогенированными. Функциональные группы, требующиеся для активности, включают двойную связь в положении Δ4, кетон С3 и кетон С20. Кортикостероиды могут обладать активностью глюкокортикоидов и/или минералокортикоидов.
Примеры кортикостероидов включают, например, дексаметазон, бетаметазон, триамцинолон, триамцинолона ацетонид, триамцинолона диацетат, триамцинолона гексацетонид, беклометазона дипропионат, моногидрат беклометазона дипропионата, флуметазона пивалат, дифлоразона диацетат, флуоцинолона ацетонид, фторметолон, фторметолона ацетат, клобетазола пропионат, дезоксиметазон, флуоксиместерон, флупреднизолон, гидрокортизон, гидрокортизона ацетат, гидрокортизона бутират, гидрокортизон-натрия фосфат, гидрокортизон-натрия сукцинат, гидрокортизона ципионат, гидрокортизона пробутат, гидрокортизона валерат, кортизона ацетат, параметазона ацетат, метилпреднизолон, метилпреднизолона ацетат, метилпреднизолон-натрия сукцинат, преднизолон, преднизолона ацетат, преднизолон-натрия фосфат, преднизолона тебутат, клокортолона пивалат, флуцинолон, дексаметазона 21-ацетат, бетаметазона 17-валерат, изофлупредон, 9-фторкортизон, 6-гидроксидексаметазон, дихлоризон, меклоризон, флупредиден, доксибетазол, галопредон, галометазон, клобетазон, дифлукортолон, изофлупредона ацетат, фторгидроксиандростендион, беклометазон, флуметазон, дифлоразон, флуоцинолон, клобетазол, кортизон, параметазон, клокортолон, преднизолона 21-гемисукцината свободная кислота, преднизолона метасульфобензоат, преднизолона тербутат и триамцинолона ацетонида 21-пальмитат.
Под «малой дозой кортикостероида» подразумевается доза, которая меньше дозы, которую обычно назначают пациенту для лечения воспаления. Примерами малых доз кортикостероидов являются следующие: кортизол 12 мг в день; кортизон 15 мг в день; преднизон 3 мг в день; метилпреднизолон 2,5 мг в день; триамцинолон 2,5 мг в день; бетаметазон 250 мкг в день; дексаметазон 450 мкг в день; гидрокортизон 9 мг в день.
Под «дозировкой, эквивалентной дозировке амоксапина» подразумевается дозировка ТСА, которая в комбинации с данной дозировкой преднизолона оказывает такое же противовоспалительное действие на пациента, как дозировка амоксапина в комбинации с той же дозировкой преднизолона.
Под «дозировкой, эквивалентной дозировке преднизолона» подразумевается дозировка кортикостероида, которая в комбинации с данной дозировкой амоксапина оказывает такое же противовоспалительное действие на пациента, как дозировка преднизолона в комбинации с той же дозировкой амоксапина.
Другие признаки и преимущества настоящего изобретения будут понятны из следующего подробного описания, а также из формулы изобретения.
Подробное описание
Было установлено, что комбинация амоксапина и преднизолона обладает значительной подавляющей TNFα активностью против РВМС. Концентрации, которые демонстрировали эффективную подавляющую TNFα активность, не были неприемлемо токсичными для нормальных клеток. Таким образом, данная комбинация лекарственных средств является пригодной для лечения воспалительного заболевания.
Амоксапин
Амоксапин представляет собой трициклический антидепрессант (ТСА) дибензоксапинового типа. Он является структурно родственным более старым ТСА, а также обладает сходством с фенотиазинами.
Точное действие ТСА понятно не полностью, но полагают, что одним из их важных эффектов является усиление действия норэпинефрина и серотонина посредством блокады обратного захвата различных нейротрансмиттеров мембраной нейронов. Амоксапин также обладает некоторым сходством с антипсихотическими лекарственными средствами в том, что он блокирует дофаминовые рецепторы и может вызывать дискинезию. Амоксапин также блокирует обратный захват норэпинефрина, подобно действию дезипрамина и мапротилина.
На основании способности амоксапина действовать вместе с преднизолоном в отношении ингибирования уровней TNFα специалисту будет понятно, что другие ТСА, а также структурные и функциональные аналоги амоксапина, также можно использовать в комбинации с преднизолоном (или другим кортикостероидом, см. ниже). Аналоги амоксапина включают, например, 8-гидроксиамоксапин, 7-гидроксиамоксапин, локсапин, локсапина сукцинат, локсапина гидрохлорид, 8-гидроксилоксапин, клотиапин, перлапин, флуперлапин и дибенз(b,f)(1,4)оксазепин, 2-хлор-11-(4-метил-1-пиперазинил)моногидрохлорид.
Преднизолон
Преднизолон, синтетический кортикостероид надпочечников, обладает противовоспалительными свойствами и используется для лечения обширного ряда воспалительных состояний. Желательным является снижение количества вводимого преднизолона, поскольку длительное применение стероидов может вызывать значительные побочные эффекты.
Преднизолон является членом кортикостероидного семейства стероидов. На основании общих структурных признаков и ясного механизма действия веществ семейства кортикостероидов специалисту будет понятно, что другие кортикостероиды также можно использовать в комбинации с амоксапином или аналогом амоксапина для лечения воспалительных заболеваний. Кортикостероиды включают, например, дексаметазон, бетаметазон, триамцинолон, триамцинолона ацетонид, триамцинолона диацетат, триамцинолона гексацетонид, беклометазона дипропионат, моногидрат беклометазона дипропионата, флуметазона пивалат, дифлоразона диацетат, флуоцинолона ацетонид, фторметолон, фторметолона ацетат, клобетазола пропионат, дезоксиметазон, флуоксиместерон, флупреднизолон, гидрокортизон, гидрокортизона ацетат, гидрокортизона бутират, гидрокортизон-натрия фосфат, гидрокортизон-натрия сукцинат, гидрокортизона ципионат, гидрокортизона пробутат, гидрокортизона валерат, кортизона ацетат, параметазона ацетат, метилпреднизолон, метилпреднизолона ацетат, метилпреднизолон-натрия сукцинат, преднизолон, преднизолона ацетат, преднизолон-натрия фосфат, преднизолона тебутат, клокортолона пивалат, флуцинолон, дексаметазона 21-ацетат, бетаметазона 17-валерат, изофлупредон, 9-фторкортизон, 6-гидроксидексаметазон, дихлоризон, меклоризон, флупредиден, доксибетазол, галопредон, галометазон, клобетазон, дифлукортолон, изофлупредона ацетат, фторгидроксиандростендион, беклометазон, флуметазон, дифлоразон, флуоцинолон, клобетазол, кортизон, параметазон, клокортолон, преднизолона 21-гемисукцината свободная кислота, преднизолона метасульфобензоат, преднизолона тербутат и триамцинолона ацетонида 21-пальмитат.
Терапия
Комбинированную терапию по настоящему изобретению можно осуществлять в отдельности или в сочетании с другой терапией и проводить ее на дому, в кабинете врача, в клинике, в поликлиническом отделении больницы или в больнице. Лечение обычно начинают в больнице, чтобы врач мог непосредственно наблюдать эффекты терапии и вносить в нее изменения, которые требуются. Продолжительность комбинированной терапии зависит от типа воспалительного заболевания, по поводу которого осуществляется лечение, возраста и состояния пациента, стадии и типа заболевания пациента и от того, как пациент реагирует на лечение. Кроме того, лицо, имеющее высокий риск развития воспалительного заболевания (например, лицо, которое имеет генетическую предрасположенность или ранее имело воспалительное заболевание), может получать профилактическое лечение для ингибирования или задержки воспалительного ответа.
Дозировку, частоту и способ введения каждого компонента комбинации можно контролировать независимо. Например, одно соединение можно вводить перорально три раза в день, в то время как второе соединение можно вводить внутримышечно один раз в день. Комбинированную терапию можно проводить прерывистыми курсами, которые включают периоды отдыха. Соединения также можно изготавливать в виде единого препарата, так что одно введение будет доставлять оба соединения.
Изготовление фармацевтических композиций
Подходящие способы введения включают пероральный, ректальный, внутривенный, внутримышечный, подкожный, ингаляционный, местный или чрескожный, вагинальный и глазной пути.
Комбинацию по настоящему изобретению можно также изготавливать в виде компонентов одной фармацевтической упаковки. Два лекарственных средства можно изготавливать вместе или раздельно и в индивидуальных дозированных количествах.
Соединения по настоящему изобретению также являются пригодными, если их помещают в композицию в форме солей. Например, амитриптилин, другой трициклический антидепрессант, использовали в готовой форме в виде соли гидрохлорида, указывая, что амоксапин можно использовать сходным образом. Соли преднизолона включают, например, натриевую соль преднизолона 21-гемисукцината и двунатриевую соль преднизолона 21-фосфата.
Введение каждого соединения комбинации можно осуществлять любыми подходящими средствами, которые обеспечивают концентрацию соединения, которая в комбинации с другим соединением является противовоспалительной. Каждое соединение смешивают с подходящим веществом-носителем, и оно обычно присутствует в количестве 1-95 мас.% от общей массы композиции. Композицию можно изготавливать в виде лекарственной формы, подходящей для перорального, парентерального (например, внутривенного, внутримышечного, подкожного), ректального, чрескожного, назального, вагинального, ингаляционного или глазного пути. Так, композиции могут быть в форме, например, таблеток, капсул, пилюль, порошков, гранулятов, суспензий, эмульсий, растворов, гелей, включая гидрогели, паст, мазей, кремов, пластырей, микстур, устройств для доставки, суппозиториев, клизм, препаратов для инъекций, имплантатов, спреев или аэрозолей. Фармацевтические композиции можно составлять согласно обычной фармацевтической практике (см., например, Remington: The Science and Practice of Pharmacy, (19-е изд.), изд. A.R. Gennaro, 1995, Mack Publishing Company, Easton, PA, и Encyclopedia of Pharmaceutical Technology, изд. J. Swarbrick и J.C. Boylan, 1988-1999, Marcel Dekker, New York).
Фармацевтические композиции по настоящему изобретению можно изготавливать для высвобождения активного соединения практически немедленно после введения или в любой определенный заранее период времени после введения, используя препараты с контролируемым высвобождением.
Введение соединений в препаратах с контролируемым высвобождением является полезным, если соединение, в отдельности или в комбинации, имеет (i) узкий терапевтический индекс (например, разница между концентрацией в плазме, вызывающей вредные побочные эффекты или токсические реакции, и концентрацией в плазме, вызывающей терапевтический эффект, является маленькой; обычно терапевтический индекс, TI, определяют как отношение медианы летальной дозы (LD50) к медиане эффективной дозы (ED50)); (ii) узкие пределы всасывания в желудочно-кишечном тракте или (iii) короткий полупериод биологического существования, так что требуется частое введение лекарственного средства в течение дня, чтобы поддерживать уровень в плазме на терапевтическом уровне.
Для получения контролируемого высвобождения, при котором скорость высвобождения превосходит скорость метаболизма терапевтического соединения, можно следовать многим стратегиям. Например, контролируемое высвобождение можно получить с помощью адекватного подбора параметров и ингредиентов препарата, включая, например, соответствующие композиции и покрытия для контролируемого высвобождения. Примеры включают композиции таблеток или капсул, содержащие одну или множество единиц, масляные растворы, суспензии, эмульсии, микрокапсулы, микросферы, наночастицы, пластыри и липосомы.
Твердые лекарственные формы для перорального введения
Препаративные формы для перорального введения включают таблетки, содержащие активный ингредиент (ингредиенты) в смеси с нетоксичными фармацевтически приемлемыми наполнителями. Указанные наполнители могут представлять собой, например, инертные разбавители или наполнители (например, сахарозу или сорбит), смазывающие агенты, агенты, обеспечивающие скольжение, и антиадгезивы (например, стеарат магния, стеарат цинка, стеариновая кислота, диоксиды кремния, гидрогенизированные растительные масла или тальк).
Два соединения можно смешивать в таблетке или другом носителе или можно разделить. В одном примере первое соединение содержится внутри таблетки, а второе соединение - снаружи, таким образом, чтобы значительная часть второго соединения высвобождалась до высвобождения первого соединения.
Препаративные формы для перорального введения могут также быть изготовлены в форме жевательных таблеток или твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, или мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой.
Дозировки
Дозировка каждого соединения заявленных комбинаций зависит от нескольких факторов, включая способ введения, заболевание, по поводу которого осуществляют лечение, тяжесть заболевания, от того, лечат заболевание или проводят его профилактику, а также от возраста, массы тела и состояния здоровья пациента, которого лечат. Кроме того, на используемую дозировку может повлиять фармакогеномная информация (влияние генотипа на фармакокинетику, фармакодинамику или профиль эффективности лекарственного средства).
Непрерывное ежедневное введение комбинаций по настоящему изобретению может не потребоваться. Схема лечения может требовать циклов, в течение которых лекарственное средство не вводят, или лечение может осуществляться по потребности во время периодов острого воспаления.
Как описано выше, соединение, о котором идет речь, можно вводить перорально в форме таблеток, капсул, эликсиров или сиропов или ректально в форме суппозиториев. Парентеральное введение соединения удобно осуществлять, например, в форме солевых растворов или с соединением, включенным в липосомы. В случаях, когда само соединение обладает недостаточной растворимостью, можно использовать солюбилизатор, такой как этанол.
Ниже с целью иллюстрации описаны дозировки амоксапина и преднизолона. Специалист сможет легко установить подходящие дозировки других ТСА и кортикостероидов. Например, ТСА можно давать в дозе, эквивалентной дозе амоксапина, представленной ниже, а кортикостероид можно давать в дозе, эквивалентной дозе преднизолона, представленной ниже. В одном варианте осуществления настоящего изобретения кортикостероид представляет собой малую дозу кортикостероида.
Пероральное введение
Для амоксапина, адаптированного для перорального введения для системного применения, общая суточная доза составляет обычно приблизительно 1-600 мг (0,01 - 8,5 мг/кг), предпочтительно приблизительно 25-400 мг (0,35 - 5,7 мг/кг) и более предпочтительно приблизительно 100-300 мг (1,4 - 4,2 мг/кг). Введение можно осуществлять от одного до трех раз в день в течение периода времени от одного дня до одного года и даже в течение всей жизни пациента. Постоянное, длительное введение будет показано во многих случаях. Могут потребоваться суточные дозы до 600 мг.
Для преднизолона, адаптированного для перорального введения для системного применения, суточная доза составляет обычно приблизительно 0,05-200 мг (0,7-2800 мкг/кг), предпочтительно приблизительно 0,1-60 мг (1-850 мкг/кг) и более предпочтительно приблизительно 0,1-5 мг (4-70 мкг/кг). Благодаря усиливающему эффекту, проявляемому амоксапином в отношении противовоспалительной активности преднизолона, малые дозы преднизолона (например, 0,2, 0,4, 0,6, 0,8, 1, 2 или 3 мг в день) при комбинации с ТСА могут быть эффективными для лечения воспаления. Желательным является введение от одного до четырех раз в день. Как и амоксапин, преднизолон можно вводить в течение периода времени от одного дня до одного года и даже в течение всей жизни пациента. Могут потребоваться дозы до 200 мг в день.
Ректальное введение
Для композиций, адаптированных для ректального введения для предотвращения заболевания, обычно предпочтительно несколько большее количество соединения. Так, общая суточная доза амоксапина составляет обычно приблизительно 1-600 мг (0,01-8,5 мг/кг). Ректальное введение амоксапина обычно осуществляют от одного до трех раз в день. Общая суточная доза преднизолона составляет обычно приблизительно 0,1-100 мг (1-1420 мкг/кг). Ректальное введение преднизолона обычно осуществляют от одного до четырех раз в день.
Внутривенное введение
Для внутривенного введения амоксапина общая суточная доза составляет приблизительно 1-400 мг (0,014-5,7 мг/кг), предпочтительно приблизительно 10-200 мг (0,14-2,8 мг/кг) и более предпочтительно приблизительно 25-100 мг (0,35-1,4 мг/кг). Внутривенное введение амоксапина можно осуществлять от одного до четырех раз в день, но можно и в виде непрерывной инфузии.
Для внутривенного введения преднизолона общая суточная доза составляет приблизительно 0,05-200 мг (0,0007-2,8 мг/кг), предпочтительно приблизительно 0,1-60 мг (0,001-0,85 мг/кг) и более предпочтительно приблизительно 0,1-5 мг (4-70 мкг/кг). Наиболее предпочтительными являются малые дозы преднизолона, описанные выше. Внутривенное введение преднизолона можно осуществлять от одного до четырех раз в день, но, как для амоксапина, можно и в виде непрерывной инфузии.
Дополнительные пути введения
Для внутримышечного, подкожного, ингаляционного, местного вагинального или глазного введения амоксапина общая суточная доза составляет приблизительно 1-400 мг (0,014-5,7 мг/кг), предпочтительно приблизительно 10-200 мг (0,14-2,8 мг/кг) и более предпочтительно приблизительно 25-100 мг (0,35-1,4 мг/кг), а общая суточная доза преднизолона составляет приблизительно 0,1-100 мг (0,0014-1,42 мг/кг). Введение данными путями амоксапина и преднизолона осуществляют, независимо, от одного до четырех раз в день.
Следующие примеры предназначены для целей иллюстрации настоящего изобретения. Они не подразумевают никакого ограничения настоящего изобретения.
Пример 1: Изготовление матрицы серийного разведения смешанной комбинации двух соединений
Изготавливали маточные растворы амоксапина (16 мг/мл) (Sigma-Aldrich, St. Louis, MO; номер в каталоге А129) и преднизолона (1,6 мг/мл) (Sigma-Aldrich, номер в каталоге Р6004) в диметилсульфоксиде (ДМСО). Матричные планшеты амоксапина изготавливали добавлением 25 мкл концентрированного маточного раствора в колонки 3, 9 и 15 (ряды с С по N) 384-луночного планшета для хранения из полипропилена, который предварительно заполняли 75 мкл безводного ДМСО. Используя манипулятор для жидкостей TomTec Quadra Plus, производили двукратные серийные разведения 25 мкл маточного раствора амоксапина четыре раза в соседние колонки (колонки 4-7, 10-13, 16-19). В шестую колонку (8, 14 и 20) никакого соединения не добавляли, и она служила контролем носителя. Матричные планшеты преднизолона изготавливали добавлением 25 мкл концентрированного маточного раствора преднизолона в соответствующие колонки (ряд С, колонки 3-8; ряд С, колонки 9-14; ряд С, колонки 15-20; ряд I, колонки 3-8; ряд I, колонки 9-14; ряд I, колонки 15-20) соответствующего матричного преднизолонового 384-луночного планшета для хранения. Указанные матричные планшеты предварительно заполняли 75 мкл безводного ДМСО. Используя манипулятор для жидкостей TomTec Quadra Plus, производили двукратные серийные разведения 25 мкл маточного раствора амоксапина четыре раза в соседние ряды (ряды D-G и J-M). В шестой ряд (Н и N) никакого соединения не добавляли, и он служил контролем носителя. Матричные планшеты герметично запечатывали и хранили до использования при -20°С.
Конечный планшет комбинации амоксапин/преднизолон изготавливали путем переноса 1 мкл из каждого амоксапинового и преднизолонового матричного планшета в планшет разведений, содержащий 100 мкл среды (RPMI; Gibco BRL, #11875-085), 10% фетальной телячьей сыворотки (Gibco BRL, #25140-097), 2% пенициллина/стрептомицина (Gibco BRL, # 15140-122)), с использованием манипулятора для жидкостей TomTec Quadra Plus. Планшет разведений затем перемешивали и переносили 10 мкл аликвоты в конечный планшет для анализа, который предварительно заполняли в количестве 40 мкл на лунку средой RPMI, содержащей соответствующий стимулятор для активации секреции TNFα (см. ниже).
Пример 2: Анализ подавляющей TNFα активности амоксапина и преднизолона
Матрицу разведений соединения анализировали с помощью методики ELISA для TNFα. Кратко, 100 мкл суспензии разведенных мононуклеарных клеток периферической крови (РМВС), содержащихся в каждой лунке 384-луночного полистиролового планшета (NalgeNunc) стимулировали для секреции TNFα путем воздействия форбола 12-миристатом 13-ацетатом с конечной концентрацией 10 нг/мл (Sigma) и иономицином с конечной концентрацией 75 нг/мкл (Sigma). Во время стимуляции добавляли различные концентрации каждого тест-соединения. Через 16-18 часов инкубации при 37°С в термостате в атмосфере влажности планшет центрифугировали и надосадочную жидкость переносили в 384-луночный планшет из белого непрозрачного полистирола (NalgeNunc, Maxisorb), с покрытием из анти-TNFα антитела (PharMingen, # 18631D). Через два часа инкубации планшет промывали (Tecan Power Washer 384) физиологическим раствором с фосфатным буфером (PBS), содержащим 0,1% Tween 20 (монолаурат полиоксиэтиленсорбитана) и инкубировали дополнительно один час с другим анти-TNFα антителом, меченным биотином (PharMingen, 18642D) и пероксидазой хрена (HRP), связанной со стрептавидином (PharMingen, # 13047Е). После промывания планшета 0,1% Tween 20/PBS в каждую лунку добавляли субстрат HRP (который содержит люминол, пероксид водорода и усилитель, такой как параиодфенол) и измеряли интенсивность света с помощью люминометра LJL Analyst. Контрольные лунки содержали конечную концентрацию 1 мкг/мл циклоспорина А (Sigma).
Пример 3: Подавление секреции TNFα кровью, обработанной форбола 12-миристатом 13-ацетатом и иономицином, комбинацией амоксапина и преднизолона
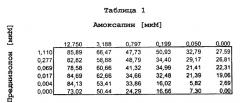
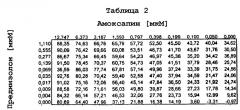
Совместно амоксапин и преднизолон были способны подавлять секрецию TNFα в крови, индуцированную форбола 12-миристатом 13-ацетатом и иономицином. Как показано в таблицах 1 и 3, амоксапин способен усиливать ответ на дозу преднизолона почти в два раза. В концентрации 1,11 мкМ преднизолон в отдельности способен ингибировать секрецию TNFα на 28%. Добавление 0,1 мкМ амоксапина повышает ингибирование TNFα 1,11 мкМ преднизолоном до 51%. Данное большое повышение активности 82% обеспечивается относительно малым повышением только 18% всего лекарственного средства.
Усиление активности преднизолона амоксапином наблюдалось также при вторичном наблюдении. Ингибирование TNFα преднизолоном в концентрации 9 нМ увеличивалось в 2,9 раза до 40% в присутствии 400 нМ амоксапина. Ингибирующая в отношении TNFα активность преднизолона и амоксапина в отдельности в указанных концентрациях составила всего 14% и 16% соответственно. Более того, уровень ингибирования TNFα, достигнутый 9 нМ преднизолоном в комбинации с 398 нМ амоксапином (40%) не меньше, чем у 1110 нМ преднизолона в отдельности (35%). Это увеличение ингибирования TNFα составляет сдвиг мощности для комбинации в 100 раз по сравнению с преднизолоном в отдельности.
Способность амоксапина и преднизолона ингибировать секрецию TNFα кровью, стимулированной LPS, показана в таблице 3.
Другие варианты осуществления настоящего изобретения
Все публикации и патенты, упомянутые в приведенном выше описании, включены в настоящий документ в качестве ссылок. Различные модификации и вариации описанного способа и системы настоящего изобретения будут очевидны для специалиста, без отступления от объема и идеи настоящего изобретения. Несмотря на то, что настоящее изобретение описано в связи с конкретными предпочтительными вариантами его осуществления, следует понимать, что настоящее изобретение в том виде, в котором оно заявлено, не должно чрезмерно ограничиваться указанными конкретными вариантами осуществления. Действительно, подразумевается, что различные модификации описанных способов осуществления настоящего изобретения, которые очевидны для специалиста в области молекулярной биологии или родственных областей, входят в объем настоящего изобретения.
1. Способ лечения пациента, имеющего воспалительное заболевание, или пациента, имеющего риск развития воспалительного заболевания, включающий введение указанному пациенту (i) трициклического антидепрессанта и (ii) кортикостероида, при котором лекарственные средства (i) и (ii) вводят одновременно или с интервалом в пределах 14 дней в количествах, достаточных для ингибирования воспаления или уменьшения риска развития воспалительного заболевания у указанного пациента.
2. Способ по п.1, в котором указанным трициклическим антидепрессантом является амоксапин, 8-гидроксиамоксапин, 7-гидроксиамоксапин, локсапин, локсапина сукцинат, локсапина гидрохлорид, 8-гидроксилоксапин, амитриптилин, клопрамин, доксепин, имипрамин, тримипрамин, дезипрамин, нортриптилин или протриптилин.
3. Способ по п.2, в котором указанным трициклическим антидепрессантом является амоксапин.
4. Способ по п.1, в котором указанным кортикостероидом является дексаметазон, бетаметазон, триамцинолон, триамцинолона ацетонид, триамцинолона диацетат, триамцинолона гексацетонид, беклометазона дипропионат, моногидрат беклометазона дипропионата, флуметазона пивалат, дифлоразона диацетат, флуоцинолона ацетонид, фторметолон, фторметолона ацетат, клобетазола пропионат, дезоксиметазон, флуоксиместерон, флупреднизолон, гидрокортизон, гидрокортизона ацетат, гидрокортизона бутират, гидрокортизон-натрия фосфат, гидрокортизон-натрия сукцинат, гидрокортизона ципионат, гидрокортизона пробутат, гидрокортизона валерат, кортизона ацетат, параметазона ацетат, метилпреднизолон, метилпреднизолона ацетат, метилпреднизолон-натрия сукцинат, преднизолон, преднизолона ацетат, преднизолон-натрия фосфат, преднизолона тебутат, клокортолона пивалат, флуцинолон, дексаметазона 21-ацетат, бетаметазона 17-валерат, изофлупредон, 9-фторкортизон, 6-гидроксидексаметазон, дихлоризон, меклоризон, флупредиден, доксибетазол, галопредон, галометазон, клобетазон, дифлукортолон, изофлупредона ацетат, фторгидроксиандростендион, беклометазон, флуметазон, дифлоразон, флуоцинолон, клобетазол, кортизон, параметазон, клокортолон, преднизолона 21-гемисукцината свободная кислота, преднизолона метасульфобензоат, преднизолона тербутат или триамцинолона ацетонида 21-пальмитат.
5. Способ по п.4, в котором указанным кортикостероидом является преднизолон.
6. Способ по п.1, в котором указанный трициклический антидепрессант вводят в дозе, эквивалентной 1-600 мг амоксапина.
7. Способ по п.6, в котором указанный трициклический антидепрессант вводят в дозе, эквивалентной 100-300 мг амоксапина.
8. Способ по п.1, в котором указанный кортикостероид вводят в дозе, эквивалентной 0,05-200 мг преднизолона.
9. Способ по п.8, в котором ука