Раствор для коррекции первичных нарушений гемостаза плазмозамещающими растворами нового состава
Иллюстрации
Показать всеИзобретение относится к фармацевтической химии и касается создания средства для коррекции нарушений гемостаза при гемодилюции путем использования плазмозамещающих растворов нового состава. Раствор содержит кристаллоидный или коллоидный плазмозамещающий раствор и ингибитор свертывающей системы крови антитромбин III. Предложенный плазмозамещающий состав позволяет избежать осложнений при трансфузиях. 1 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к медицине и касается способа коррекции нарушений гемостаза при гемодилюции путем использования плазмозамещающих растворов нового состава.
В условиях массированной кровопотери необходимо срочное восполнение потерянной крови. С этой целью используются различные кристаллоидные и коллоидные плазмозамещающие растворы, свежезамороженная плазма (СЗП), а также переливания эритроцитов, тромбоцитов, растворов альбумина и т.д.
При этом преследуются следующие основные цели.
Восполнение объема циркулирующей крови (ОЦК) для поддержания артериального давления, объема сердечного выброса, предупреждения коллапса сосудов, сохранения нормальных реологических характеристик крови и нормальной перфузии органов и тканей.
Поддержание нормального коллоидно-осмотического давления плазмы и ее кислотно-щелочного равновесия.
Поддержание кислородтранспортной функции крови и функций системы свертывания.
Для достижения первых двух целей обычно переливают различные плазмозамещающие растворы и растворы альбумина.
Обеспечение кислородтранспортной функции достигается переливанием эритроцитов, модифицированного гемоглобина или кислородпереносящих растворов типа перфторанов, а поддержание функций системы свертывания - переливанием СЗП, концентратов тромбоцитов, концентратов факторов протромбинового комплекса или отдельных факторов свертывания.
Нарушения гемостаза являются частыми осложнениями объемных трансфузий плазмозамещающих растворов, которые необходимы не только при массированной кровопотере в случае обширной травмы, но также при острых инфекциях с развитием сепсиса, ожогах, плановых операциях с ожидаемой объемной кровопотерей и т.п.
Важнейшей причиной, вызывающей эти нарушения, является гемодилюция, т.е. разбавление плазмы замещающими растворами коллоидов или кристаллоидов, не содержащими не только тромбоцитов, но и плазменных компонентов свертывающей, антисвертывающей и фибринолитической систем.
Принято считать, что подобное разбавление должно приводить к замедлению свертывания из-за снижения концентраций участвующих в нем факторов. Однако в условиях множественной травмы или при ряде операций в первый момент возникает сильная активация свертывания. Это обусловлено наличием большой раневой поверхности, на которой присутствует тканевой фактор, активирующий свертывание по внешнему пути. В результате подобной активации в первые часы после травмы происходит постоянное потребление факторов и ингибиторов свертывания. Это может привести к истощению в плазме данных компонентов и развитию диссеминированного внутрисосудистого свертывания (ДВС), на первой стадии которого происходит тромбоз сосудов, а затем, в результате полного потребления факторов свертывания, возникают опасные не останавливающиеся кровотечения.
Таким образом, хотя при переливании большого объема плазмозамещающих растворов чаще наблюдаются геморрагические осложнения, необходимо выделить случаи массированной кровопотери при травме (или операциях), когда возможна сильная активация свертывания и развитие ДВС. Использование больших объемов переливаемых растворов в этих случаях только усугубляет проблему, так как на сегодняшний день ни один из применяемых растворов не содержит компонентов для компенсации возникающей в гемостазе нехватки факторов и ингибиторов свертывания.
Большое число работ, как экспериментальных, так и с помощью математического моделирования системы свертывания крови, показало, что большая часть предшественников активных факторов свертывания присутствует в плазме в столь большом избытке, что только 80-90%-ное снижение их содержания может заметным образом изменить характеристики процесса свертывания (речь идет о таких параметрах как традиционные тесты по временам свертывания: протромбиновое время (ПВ) и частичное активированное тромбопластиновое время (АЧТВ). С другой стороны, этого нельзя сказать об ингибиторах свертывания, в первую очередь, антитромбине III (ATIII). Реакция ингибиторов с активными факторами подчиняется уравнению второго порядка, т.е. скорость ее прямо пропорциональна концентрации ингибитора. Расчеты показывают, что если при сильных изменениях концентрации большинства факторов свертывания в 10-100 раз порог наступления свертывания изменяется незначительно, то он прямо пропорционально связан со снижением концентрации ATIII. Замена половины ОЦК на плазмозамещающий раствор (т.е. снижение концентрации ATIII в 2 раза) вызовет сильное снижение порога свертывания. В этой ситуации даже незначительная активация системы приведет к потенциальному свертыванию. Таким образом, первичным нарушением гемостаза при гемодилюции должно быть ускорение свертывания из-за снижения концентрации ингибиторов.
Это хорошо известно и из клинических данных, которые показывают, что в ситуации травмы, ожога, тяжелого сепсиса часто развивается ДВС, первопричиной которого служит повышенная активация свертывания в системе.
Как было сказано выше, ни один из плазмозамещающих растворов на сегодняшний день не содержит компонентов для коррекции нарушений гемостаза. Применяемая в клинике тактика предполагает переливание 2U свежезамороженной плазмы на каждые 10U перелитых трансфузионных коллоидных и кристаллоидных растворов.
Известно использование для проведения плазмафереза у больных с ДВС-синдромом в качестве плазмозамещающего раствора реополиглюкина и свежезамороженной плазмы крови, что оказывает нормализующее воздействие на гемостаз (RU 2110996 С1). Переливание СЗП очень удобно, т.к. оно восполняет кровь сразу всеми факторами и ингибиторами, содержащимися в ней в физиологических концентрациях, что исключает возможность передозировки. Однако потребность в больших объемах плазмы и все более возрастающая угроза вирусного заражения СЗП заставляет искать возможные ее заменители.
Известно, что трансфузия 5%-ного раствора глюкозы, который предварительно облучают рентгеновским излучением в дозе 0,2-0,5 Гр/мл и вводят в организм новорожденного непосредственно до, после или одновременно с антибактериальными препаратами оказывает стимулирующее влияние на показатели антиэндотоксинового иммунитета при гнойно-септических заболеваниях. При этом происходит частичная коррекция нарушений гемостаза и кислотно-основного состояния крови больных с тяжелыми формами бактериальных инфекций. Способ позволяет избежать введения в организм новорожденного ребенка препаратов крови, что чревато различными осложнениями, в том числе внесением инфекций СПИД, гепатита (RU 2144837 С1). Данные способы имеют ограниченное применение.
Другим примером может быть применение плазмозамещающего средства на основе декстрана для длительной коррекции нарушений центральной и периферической гемодинамики. При этом средство содержит радиационно-модифицированный декстран, хлорид натрия и воду. Подобная модификация позволяет уменьшить адгезию тромбоцитов, что препятствует запуску патологических реакций внутрисосудистой агрегации тромбоцитов (RU 2043108 С1). Однако и в этом случае применение сопровождается нарушением гематологических показателей.
Задачей настоящего изобретения является создание плазмозамещающих составов, позволяющих избежать осложнений при объемных трансфузиях.
Задача решается новым составом, содержащим стандартный кристаллоидный или коллоидный плазмозамещающий раствор и ингибитор свертывающее системы крови антитромбин III в концентрации от 0,5 до 5 ед/мл.
Сущность изобретения
Как было показано выше, для сохранения функции гемостаза при объемных переливаниях плазмозаменителей критичным, в первую очередь, оказывается содержание в плазме ингибиторов свертывания. Таким образом, для создания плазмозамещающего раствора, позволяющего корректировать нарушения гемостаза, возникающие при гемодилюции, в настоящем изобретении предлагается добавление в обычные плазмозамещающие растворы (коллоидные или кристаллоидные) выделенного лиофильно высушенного концентрата антитромбина III при следующем соотношении компонентов:
| Антитромбин III | 0,5-5 ед/мл |
| Плазмозамещающий раствор | Остальное |
В качестве плазмозамещающих кристаллоидов могут быть использованы растворы, содержащие хлорид натрия. Среди них - 0,9% раствор хлорида натрия, растворы, содержащие дополнительно к хлориду натрия хлорид калия, или ацетата натрия. Другим раствором является раствор Рингера, содержащий хлориды натрия, калия и кальция, гидрокарбонат натрия или его модификацию с добавкой лактата.
В качестве коллоидных инфузионных растворов могут быть использованы производные гидроксиэтилкрахмала (ГЭК), декстрана (полиглюкин, реополиглюкин, реоглюман, лонгастерил, реомакродекс, неорондекс) или желатины (желатиноль, модежель, гелофузин).
Предпочтительно использование раствора среднемолекулярного гидроксиэтилкрахмала со следующими физико-химическими характеристиками: 130+20 кДа, степенью замещения 0,4, отношением С2/С6 более 8, например известного препарата Волювена (Medi.ru, Конгресс по нефрологии, Baron J.-Е., Новый гидроксиэтилкрахмал: ГЭК 130/0,4, Волювен).
Описание способа получения лиофильно высушенного концентрата антитромбина III
В качестве сырья для выделения концентрата ATIII использовали плазму донорской крови после удаления из нее факторов свертывания, т.н. ППУ.
ATIII выделяли методом аффинной хроматографии. В качестве аффинного сорбента использовали сорбент "Heparin Sepharose Fast Flow" производства "Amersham Biosciences", Швеция.
Предварительно проводили стадию вирусной инактивации сырья. В качестве способа вирусной инактивации использовали либо пастеризацию при +60°С в присутствии стабилизаторов, либо сольвент-детергентную обработку при комнатной температуре. ППУ после стадии вирусной инактивации загружали на колонну, заполненную сорбентом. Фракционирование осуществляли в ступенчатом градиенте ионной силы, создаваемом увеличением концентрации хлорида натрия в стартовом буфере. Элюат, содержащий ATIII, подвергали диализу и концентрированию, после чего стерильно разливали и лиофильно высушивали. В качестве стабилизатора использовали добавки аминокислот. Лиофильно высушенный препарат ATIII хранили при температуре +4-8°С.
Методы исследования гемостаза.
Для оценки статуса системы свертывания в настоящей работе было использовано два современных in vitro теста: тест генерации тромбина и измерение скорости роста сгустка в пространстве. В отличие от стандартных тестов измерения времен свертывания (ПВ и АЧТВ), которые проводятся в условиях максимальной активации свертывания по внешнему или внутреннему пути соответственно и, следовательно, не способны обнаружить состояние гиперкоагуляции в исследуемой системе, данные тесты проводятся при гораздо более слабой исходной активации, близкой к существующей в организме. Это делает их чувствительными как к состоянию гипо-, так и к состоянию гиперкоагуляции в исследуемых образцах плазмы.
Тест генерации тромбина, также как и стандартные тесты ПВ и АЧТВ, проводится в гомогенных (полностью перемешанных) образцах цитратной плазмы. При этом измеряется суммарное количество тромбина, образовавшегося в образце в ответ на стандартную рекальцификацию и активацию.
Измерение кинетики генерации тромбина в плазме проводили, непрерывно регистрируя расщепление медленного флюорогенного субстрата BOC-Ile-Gly-Arg-AMC (где ВОС - остаток бутоксикарбонила, а АМС - остаток 7-амино-4-метилкумарина), образующимся в ходе свертывания тромбином.
В ячейки стандартного плоскодонного 96-луночного планшета помещали 200 мкл цитратной бедной тромбоцитами плазмы (РРР), разбавленной в различных отношениях исследуемым плазмозамещающим раствором (рН 7,5), содержащим ATIII в концентрациях от 0,5 до 5 ед/мл, и 2 мкл раствора флюрогенного субстрата исходной концентрации 51,25 мМ. Пробы в планшете прединкубировали 10 мин. При 37°С. Затем во все ячейки одновременно вносили по 3 мкл раствора активатора, разбавленного буфером, содержащим 20 мМ HEPES, 145 мМ NaCI и дополнительно 866,7 мМ CaCI2 (рН 7,5). В качестве активатора использовали разбавленный в 8,85 или в 17,7 раза раствор кроличьего тромбопластина из стандартного теста для определения протромбинового времени (фирмы «Ренам», Россия). Финальное разбавление активатора при постановке эксперимента составляло 590 или 1180 раз соответственно.
Момент внесения активатора и перемешивания являлся началом отсчета времени реакции. Запись флюоресценции АМС, возникающей при гидролизе субстрата тромбином, образующимся в ходе свертывания, осуществляли при 37°С непрерывно на протяжении 45-50 минут с помощью флюориметрического ридера Fluoroscan II (LabSystem, Финляндия) (λвозб.=380 нм; λиспуск.=440 нм). Для каждого образца плазмы ставили 3 параллельные пробы. Полученные результаты усредняли. Ошибка параллельных измерений не превышала 2-5%. Измеренную в условных единицах флюоресценции концентрацию АМС переводили в абсолютные концентрации, измеряя в отдельных калибровочных пробах данной плазмы в присутствии соответствующих концентраций ATIII величину интенсивности сигнала раствора АМС известной концентрации. Линейность зависимости величины сигнала от концентрации АМС в исследуемой области была проверена предварительно. Концентрацию тромбина в каждый момент времени рассчитывали, дифференцируя кривую накопления АМС.
Обработка результатов осуществлялась с помощью стандартной графической программы Origin 6.0 (Microcal Software Inc., MA, USA). Так как суммарный сигнал образующегося АМС связан не только с амидолитической активностью свободного тромбина, но также с аналогичной активностью комплекса тромбин-α2-макрогобулин, то с помощью специально написанной программы производился учет активности этого комплекса и вычислялась активность свободного тромбина в каждый момент времени.
По кривой зависимости концентрации тромбина от времени определяли суммарное количество тромбина, образовавшегося за 40 минут (эндогенный тромбиновый потенциал, ЭТП).
Скорость роста сгустка в пространстве характеризует пространственную динамику свертывания, которое является процессом, развивающимся не только во времени, но и в пространстве. В данном методе с помощью измерения светорассеяния определяется размер сгустка в разные моменты времени после начала свертывания. Активация свертывания проводится в системе без перемешивания строго локализованным в пространстве активатором, в качестве которого использовали либо просто стеклянную пластинку со шлифованным краем для контактной активации свертывания по внутреннему пути, либо полиэтилентерфталатные пленки, покрытые фибробластами, несущими на поверхности тканевой фактор, активирующий свертывание по внешнему пути. В случае активации свертывания по внешнему пути в исходную плазму добавлялся ингибитор трипсина из кукурузы (CTI) в концентрации 200 мкг/мл, который предотвращает контактную активацию свертывания в системе.
Микрокамеру собирали в 35 мм полистироловой чашке Петри. При активации свертывания по внешнему пути торец стеклянной пластинки толщиной 1 мм оборачивали полиэтилентетфталатной пленкой, на которой были выращены фибробласты. После этого пластинку с пленкой фиксировали на дне чашки 2-сторонним скотчем. Торец стекла представлял собой боковой край микрокамеры, покрытый активатором. На верхнюю плоскость стекла таким же образом прикрепляли выступающую за край стекла закрашенную с внешней стороны черным полистироловую пластинку, которая формировала верхнюю поверхность микрокамеры. Рекальцифицированную плазму, свободную от тромбоцитов (финальная концентрация добавленного CaCl2 20 мМ), с добавкой или без ATIII аккуратно заливали между верхней пластинкой и дном камеры таким образом, чтобы она пришла в соприкосновение с боковой активирующей свертывание стенкой. Момент соприкосновения плазмы с активатором принимали за t=0. Затем чашку герметично закрывали и помещали в термостатируемую при 37°С кювету с прозрачным дном, через которое плазма в чашке освещалась светом красных диодов (λmax 660 нм). Изображение постоянной области микрокамеры (7.2×5.4 мм) каждые 30 сек фиксировалось видеокамерой OS-75D (Mintron Enterprise, Тайвань), сопряженной с платой захвата изображений EZ98 (Lifeview Inc., USA), позволяющей оцифровку и ввод в память компьютера изображений с видеокамеры.
Серии полученных изображений были затем обработаны. В процессе роста сгусток все дальше распространялся от поверхности активатора вглубь плазмы. Размер сгустка в каждом кадре был определен как расстояние от активатора до края сгустка, за который принимали точку, где величина светорассеяния сгустка составляла половину максимальной. Скорость роста сгустка была затем определена как тангенс угла наклона прямой зависимости размера сгустка от времени.
Оба использованных метода показали, что при разбавлении плазмы различными плазмозамещающими растворами в диапазоне до 2.0-2.5 раз происходит усиление свертывания. При этом добавление антитромбина III в состав разбавляющего раствора может скорректировать этот процесс.
Полученные нами оригинальные результаты согласуются с более ранними попытками зафиксировать ускорение свертывания при разбавлении плазмы кристаллоидными и коллоидными растворами с помощью тромбоэластографии. Однако разбавление плазмы влияет на различные параметры тромбоэластограммы в противоположных направлениях: оно приводит к укорочению измеряемых времен лаг-периода (ч) и реакции (k), что говорит об ускорении свертывания, но уменьшает максимальную силу сгустка (Amax), которая зависит от концентрации фибриногена и тромбоцитов в исследуемой плазме и уменьшение которой принято считать ослаблением свертывания. Таким образом, данные полученные с помощью тромбоэластографии выглядят не совсем очевидными.
Изобретение может быть также проиллюстрировано следующими примерами.
Пример 1
Получение концентрата АТIII
В качестве сырья использовали плазму после удаления факторов свертывания. Объем плазмы составил 42 л. Плазму пастеризовали в течение 11 ч при 60°С в присутствии стабилизатора - 50%-ной сахарозы. После разведения на 25% сырье наносили на колонну «Vantage S2», заполненную сорбентом «Heparin Sepharose FF». Объем сорбента составлял 1400 мл. Элюцию осуществляли увеличением концентрации NaCl в Tris-HCl буфере, содержащем 0.06 М цитрат натрия. Полученный элюат ATIII диализовали против 10 объемов диализующей жидкости и концентрировали в 5 раз. После концентрирования к раствору ATIII добавили 0.1 М глицин в качестве стабилизатора.
Выход по ATIII на стадии хроматографии составил 68% от загрузки.
После стерилизующей фильтрации концентрат ATIII разлили во флаконы из расчета 8 ед. ATIII/флакон и лиофильно высушили.
Пример 2
Усиление свертывания при разбавлении нормальной донорской плазмы кристаллоидным плазмозамещающим раствором (NaCl 0.9%) и его коррекция при введении в замещающий раствор концентрата ATIII в различных концентрациях
Кровь донора, взятая на 3.8%-ном цитрате натрия в соотношении кровь:цитрат=9:1 (20 мл), была центрифугирована 15 мин при 1500 g. Часть полученной таким образом бедной тромбоцитами плазмы (РРР) была далее центрифугирована 10 мин при 10000 g для получения свободной от тромбоцитов плазмы (PFP). Полученная РРР была использована для определения эндогенного тромбинового потенциала, а PFP - для измерения скоростей роста сгустков в пространстве.
РРР и PFP были использованы либо без предварительного разбавления, либо были разбавлены в 1.2; 1.5; 2; 2.5 или 3 раза либо физиологическим раствором (NaCI 0.9%) для переливаний, либо тем же раствором, но содержащим добавленный ATIII (в концентрациях 0.5, 1, 2 или 3 ед/мл). Концентрацию ионов свободного кальция во всех пробах после рекальцификации выдерживали постоянной. Описанными выше способами были измерены эндогенный тромбиновый потенциал (ЭТП) и скорость роста сгустка в пространстве (V) для каждого из разведений плазм в присутствии различных концентраций ATIII.
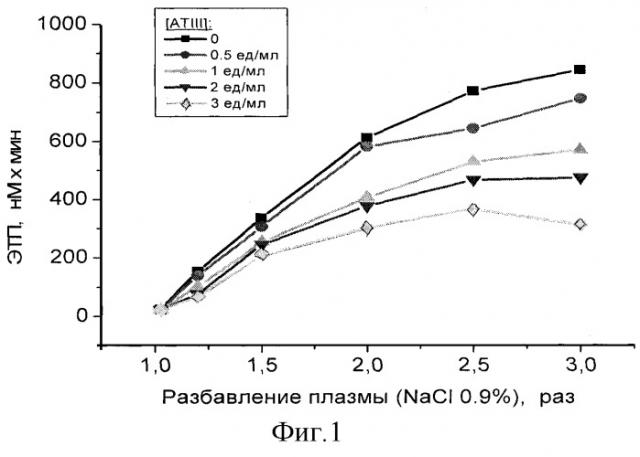
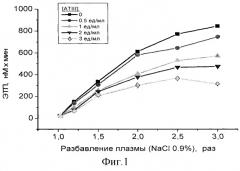
На фиг.1 представлены результаты по измерению ЭТП в сериях разбавлений РРР раствором NaCI 0.9%-ного, содержащим различные концентрации ATIII. Видно, что в отсутствие добавленного ингибитора при увеличении степени разведения плазмы замещающим раствором наблюдается существенное увеличение эндогенного тромбинового потенциала, что говорит об усилении свертывания в данных условиях. Необходимо отметить, что уже изменение ЭТП на 20% считается фактором риска для возникновения тромбоза. В то же время, в наших экспериментах при разведении исходной плазмы в 1.5-2.5 раза ЭТП в различных плазмах увеличивается в несколько раз. Добавление ATIII не отменяет полностью эффекта усиления свертывания из-за разведения плазмы, но значительно корректирует его, снижая величину ЭТП для различных разведений плазмы. Аналогичные выводы можно сделать из фиг.2, где представлены графики изменения скорости роста сгустка в пространстве при различных разбавлениях донорской PFP физиологическим раствором для переливаний в присутствии и отсутствие ATIII. Активация свертывания проводилась по внешнему пути (от пленки с фибропластами) в присутствии CTI (20 мкг/мл).
Пример 3
Коррекция свертывания при введении в коллоидные плазмозамещающие растворы 6%-ного гидроксиэтилкрахмала (130/0.4 или 200/0.5) в физиологическом растворе лиофильно высушенного концентрата ATIII.
РРР и PFP были приготовлены так же, как описано в примере 2. Разбавления этих плазм в 1.2; 1.5; 2; 2.5 или 3 раза были сделаны растворами стандартных коллоидных плазмозамещающих растворов 6%-ного гидроксиэтилкрахмала 130/0,4 («Волювен») или 200/0.5, содержащими различные концентрации добавленного концентрата ATIII (0, 1, 3 или 5 ед/мл). Концентрация ионов свободного кальция после рекальцификации во всех пробах поддерживалась постоянной. Были измерены ЭТП и скорости роста сгустка в пространстве для каждого из разбавлений плазм в присутствии различных концентраций ATIII.
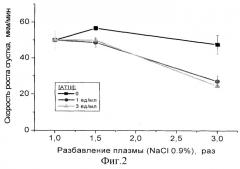
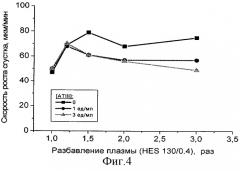
Полученные результаты представлены на фиг.3 и фиг.4. Так же, как и в случае разбавления плазмы простым физиологическим раствором (см. фиг.1 и 2), разбавление стандартным коллоидным раствором 6% гидроксиэтилкрахмала 200/0.5 (HES 200/0.5) вызывает повышение ЭТП в областях разведений до 2-2.5 раз, что свидетельствует об усилении активации свертывания в этих условиях. Добавление концентрата АТIII также дозозависимо изменяет измеряемые показатели.
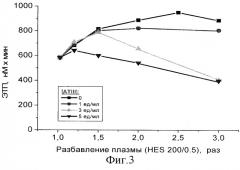
На фиг.4 представлены результаты, полученные при измерении скоростей роста сгустка в PFP, разбавленной в разных отношениях растворами 6%-ного HES (130/0.4), содержащими различные концентрации ATIII. Свертывание активировали по внутреннему пути (поверхностью стекла). Представленные данные показывают, что добавление АТIII в плазмозамещающий раствор существенно корректирует усиление скорости роста сгустка, вызванное разбавлением плазмы.
1. Раствор для коррекции первичных нарушений гемостаза при гемодилюции, отличающийся тем, что он содержит кристаллоидный или коллоидный плазмозамещающий раствор и ингибитор свертывающей системы крови антитромбин III при следующем соотношении компонентов:
| Антитромбин III | 0,5-5 ед/мл |
| Плазмозамещающий раствор | Остальное |
2. Раствор по п.1, отличающийся тем, что в качестве коллоидного плазмозамещающего раствора он содержит 6%-ный гидроксиэтилкрахмал 130/0,4 или 200/0,5 в физиологическом растворе.