Способ получения трансгенных растений, устойчивых к вирусной инфекции
Иллюстрации
Показать всеИзобретение относится к генной инженерии и может быть использовано в селекции растений. ДНК гена секреторной панкреатической нуклеазы, находящегося под управлением индуцибельного MAS2'-промотора, включают в рекомбинантную плазмиду р27. Сконструированным таким образом вектором посредством Agrobacterium-опосредованной трансформации инфицируют растительный материал, что позволяет придать регенерированным из последнего растениям повышенную устойчивость к широкому кругу вирусных инфекций. 2 ил., 3 табл.
Реферат
Изобретение относится к области биотехнологии, в частности к генетической инженерии высших растений, и касается способа получения трансгенных растений, устойчивых к вирусной инфекции.
Известен способ получения трансгенных растений с антивирусной устойчивостью, которая обеспечивается с помощью экспрессии сателлитной или специфической вирусной антисмысловой РНК в трансгенных растениях, а также продукцией в трансгенном растении вирусных белков [Murant A.F., Mayo M.A. Ann. Rev. Phytopatol., 1982, v.20, p.49-70]. Основными недостатками способа являются специфическая устойчивость только к одному вирусу (или группе близкородственных вирусов), а также нестабильность вновь созданных механизмов устойчивости к вирусной инфекции.
Известны способы получения трансгенных растений, содержащих рекомбинантную плазмидную ДНК, кодирующую синтез альфа-интерферона человека [De Zoeten G.A., Pauswick I.R., Horisberger H.A. Virology, 1989, v.172, p.213-222] и бета-интерферона человека [Патент РФ №2103361, кл. С 12 N 15/82, оп. 27.01.98]. Основным недостатком данных способов является то, что экспрессия альфа-интерферона не ингибирует вирусное размножение, а экспрессия бета-интерферона не обеспечивает постоянного высокого уровня антивирусной защиты растений.
Наиболее близким к заявляемому способу прототипом является способ получения трансгенных растений табака, экспрессирующих дрожжевую рибонуклеазу, специфически гидролизующую двуцепочечную РНК, которые проявляют устойчивость к широкому спектру растительных вирусов [Yuichiro Watanabe, Toshia Ogawa, Hisae Takahashi et. all, FEBS Letters, 1995, v.372, p.165-168]. Способ заключается в клонировании вышеописанной рибонуклеазы из дрожжей под контролем конститутивного промотора 35S из вируса мозаики цветной капусты, передаче полученной рекомбинантной плазмиды рВ1121рас в штамм Agrobacterium tumefaciens LBA4404 трехродительским скрещиванием и получении трансгенных растений табака путем трансформации листовых дисков Nicotiana tabacum cv. Xanthi-nc кокультивацией с Agrobacteria с последующим отбором на селективной среде.
Основными недостатками прототипа являются:
1. Использование рибонуклеазы, специфически гидролизующей двуцепочечную РНК, в то время как основная часть растительных вирусов имеет одноцепочечные геномы, что существенно ограничивает эффективность.
2. Использование несекреторной рибонуклеазы - фермента, известного своей цитотоксичностью, в то время как полученные заявляемым способом трансгенные растения секретируют фермент во внеклеточное пространство.
3. Использование сильного конститутивного промотора 35S из вируса мозаики цветной капусты, что приводит к постоянному накоплению цитотоксичного продукта, тогда как в заявляемом способе использован промотор MAS2', локально индуцируемый при поранении, что более физиологично для экспрессии гена, связанного с защитными функциями.
Технической задачей настоящего изобретения является повышение устойчивости растений к вирусным инфекциям путем трансгенеза.
Поставленная техническая задача достигается предлагаемым способом, заключающимся в следующем. Конструируют рекомбинантную плазмидную ДНК путем выделения гена панкреатической секреторной рибонуклеазы быка из геномной ДНК с использованием метода ПЦР с последующим клонированием полученного фрагмента в векторе рС27 под управлением индуцибельного MAS2' - промотора. Полученная рекомбинантная плазмида PC27BN состоит из следующих элементов:
- ДНК векторной плазмиды размером 12.5 т.п.н.
- фрагмента ДНК, содержащего ген панкреатической нуклеазы размером 455 п.н.
Описанную выше рекомбинантную плазмиду pC27BN, несущую ген панкреатической секреторной нуклеазы быка, переносят в штаммы Agrobacterium tumefaciens pGV2260 и AGLO, осуществляют трехродительское скрещивание с использованием плазмиды-помощника pRK2013 или прямую трансформацию, затем полученной таким образом агробактерией проводят трансформацию листовых дисков Nicotiana tabacum SRI кокультивацией с Agrobacteria с последующим отбором трансгенных растений на селективной среде.
Определяющими отличительными признаками заявляемого способа по сравнению с прототипом являются:
- в качестве векторной плазмиды используют для трансформации вектор рС27, в котором встроен индуцибельный поранением промотор MAS2', что позволяет резко увеличивать наработку трансгенного продукта при необходимости, что является более физиологичным для растения, в то время как в прототипе был использован вектор рВI121 с конститутивным промотором 35S для постоянной экспрессии трансгенного продукта.
- в качестве целевого гена используют панкреатическую секреторную рибонуклеазу быка, что позволяет эффективно защищать растения от широкого спектра растительных вирусов, имеющих одноцепочечные РНК-геномы, в то время как рибонуклеаза из дрожжей (прототип) специфично гидролизует только двуцепочечную РНК; кроме этого, панкреатическая рибонуклеаза быка локализуется в межклеточном пространстве и известна своей низкой цитотоксичностью для эукариотических клеток по сравнению с другими рибонуклеазами.
Изобретение поясняется следующими примерами конкретного выполнения способа.
Пример 1.
Конструирование плазмидной ДНК, содержащей ген панкреатической секреторный нуклеазы быка. Ген панкреатической рибонуклеазы быка был выделен методом полимеразной цепной реакции из геномной ДНК [Carcana A., Confalone E., Libonati M et al., Nucl. Acids Res., 1988, v.16, р.5491-5502], поскольку это относительно короткий ген, не содержащий интронов. В конструировании этот ген также был использован с последовательностью собственного лидерного пептида, поскольку была показана возможность продукции корректно процессированных белков человека в трансгенных растениях [Sijmons Р.С., Dekker B.M., Schrammeijer В. et al., Biotechnology, 1990, v.8, р.217-221]. Для полимеразной цепной реакции использовали праймеры:
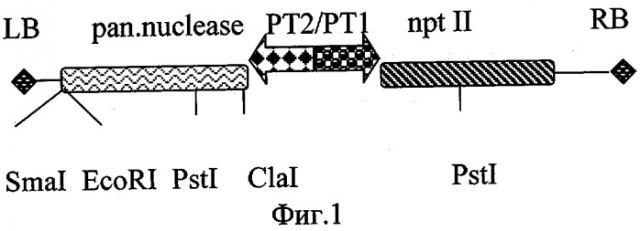
П3:5′ATCATGGCTCTGAAGTTCCC и П4:5′CCTACACAGTAGCATCAAAG. Фрагмент ДНК, полученный в результате амплификации, был клонирован в полилинкере плазмиды pBlueScript KS (Stratagene™) по сайту рестрикции EcoRV. Затем ген был перенесен в вектор рС27 по сайтам Clal и EcoRI под контроль промотора MAS2′. Таким образом была получена конструкция pC27BN. Схема Т-области полученного вектора приведена на фиг.1, где LB, RB - повторы, ограничивающие Т-область в бинарных векторах; pan. nuclease - ген панкреатической нуклеазы быка; РТ1/РТ2 - двунаправленный промотор гена маннопинсинтазы; npt II - ген неомицинфосфотрансферазы II E.coli; Smal, EcoRI, PstI, Clal - сайты рестрикции, использованные при конструировании и анализе вектора.
Пример 2.
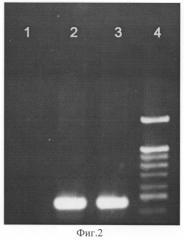
Получение трансгенных растений табака. Полученная по примеру 1 конструкция pC27BN, несущая ген панкреатической секреторной нуклеазы быка, была использована для трансформации клеток Agrobacterium tumefaciens штаммов pGV2260 и AGL0 путем трехродительского скрещивания с использованием плазмиды-помощника pRK2013 или путем прямой трансформации. Для агробактериальной трансформации в качестве исходных эксплантов были использованы листья трехнедельных растений табака Nicotiana tabacum SRI. Были получены 11 первичных трансформантов, устойчивых к канамицину (100 мг/л). Неомицинфосфотрансферазу (NPTII) в проростках тестировали по методу Рейса и соавторов [Reiss В., Sprendel R., Will Н. et al., Gene.1984, v.30, p.211-218]. Далее использовали только растения, устойчивые к канамицину и активно экспрессирующие неомицинфосфотрасферазу II (NPTII). На фиг.2 представлены результаты ПЦР анализа геномной ДНК проростков на наличие полноразмерной встройки целевого гена с праймерами П3-П4. Нанесения по дорожкам: 1 - нетрансгенный табак SR1; 2 - трансгенный табак SR1, экспрессирующий ген панкреатической нуклеазы быка; 3 - вектор pC27BN; 4 - маркерная ДНК.
Далее провели селекцию трансформированных растений по признаку высокого уровеня нуклеазной активности. Для измерения нуклеазной активности использовались растения одного возраста, выращенные стерильно в условиях климакамеры или в стандартных условиях теплицы. Листья отбирались приблизительно одного размера с одного уровня растений в каждом эксперименте. Нуклеазная активность листовых экстрактов оценивалась путем измерения изменения количества кислоторастворимого материала в суммарной РНК дрожжей [Blank А., McKeon Т.А. Proc. Natl Acad. Sci. USA 1989, v.86, р.3169-3173]. Результаты измерений нуклеазной активности приведены в таблице 1. В качестве контроля при измерении оптической плотности использовали реакционную смесь без добавления листового экстракта, время гидролиза в опыте составляло 60 минут [Galiana E., Bonnet P., Conrod S. et al., Plant Physiol., 1997, v.115, p.1557-1567]. Из представленных в таблице 1 данных видно, что уровень нуклеазной активности грубых листовых экстрактов трансгенных растений табака, полученных с использованием конструкции pC27BN, выше уровня активности контрольных растений. Так, нуклеазная активность экстрактов линий pC27BN-5 и pC27BN-8 более чем в 10 раз превышает активность экстрактов контрольных растений. Таким образом, заявляемый способ позволяет получать трансгенные растения, экспрессирующие ген панкреатической нуклеазы быка и эффективно повышать уровень нуклеазной активности в листьях трансгенных растений.
В таблице 2 представлены данные по тестированию устойчивости трансгенных растений табака линий 11-2, 11-3, 11-8, 11-10 к вирусной инфекции. Появление фенотипических симптомов и содержание антигена (мкг/мл) ВТМ в листьях контрольных (SR1) и трансгенных растений Nicotiana tabacum через 3 недели после инфекции демонстрирует повышенную устойчивость трансгенных растений к вирусу табачной мозаики вплоть до полной вирусоустойчивости при низких концентрациях вируса в иноку люме.
Пример 3.
С помощью конструкции pC27BN, описанной в примере 1, были получены трансгенные растения картофеля сортов Белоярский ранний и Каприз. Трансформация клубневых дисков проводилась по модифицированному методу [Snyder G.W., Belknap W.R. Plant Cell Repts, 1993, v.12, p.324-328]. Клубни промывали, обжигали в спирте и из камбиальной зоны вырезали диски толщиной 2-2,5 мм. Клубневые диски инкубировали с культурой A. tumefaciens в течение двух суток, затем отмывали в дистиллированной воде и помещали в среду MS с клафораном (200 мг/л) на 2 дня для отмывки от агробактерии. Излишки влаги удаляли с помощью фильтровальной бумаги и переносили диски на твердую агаризованную среду с гормонами и антибиотиками. Состав среды: соли MS (Sigma), сахароза (20 мг/л), витамины MS с добавлением тиамина (2.5 мг/л), пиридоксина (12.5 мг/л), никотиновой кислоты (12.5 мг/л), глицина (50 мг/л), фолиевой кислоты (0.5 мг/л) и биотина (0.05 мг/л), ормоны: 10 мкМ зеатин, 0.3 мкМ индолилуксусная кислота. Антибиотики: 50 мг/л канамицин, 200 мг/л клафоран.
Культуры выращивали при температуре воздуха 23°С с 16-часовым фотопериодом при освещенности 4-6 килолюкс.Через 2 недели часть дисков зазеленела, затем появились первичные каллусы, и через 7 недель были отобраны побеги, которые пересадили на среду без гормонов с канамицином (100 мг/л) для укоренения. В результате было получено 11 укорененных растений - трансформантов сорта Белоярский ранний и 3 растения сорта Каприз. После замера нуклеазной активности оставлено 5 растений сорта Белоярский ранний и два растения сорта Каприз. Неомицинфосфотрансферазу (NPTII) в проростках тестировали по методу Рейса и соавторов (см. пример 2). Пробирочные растения, выращенные в стандартных условиях, тестировали на уровень нуклеазной активности по методике, описанной выше в примере 2. В таблице 3 приведены результаты измерений уровня нуклеазной активности в листовых экстрактах трансгенных растений картофеля. В среднем уровень нуклеазной активности в экстрактах трансгенных растений в 2-3 раза выше, чем в экстрактах контрольных растений.
Использование предлагаемого способа позволит повысить устойчивость растений к вирусным инфекциям путем трансгенеза.
| Таблица 1 | |||||
| Линии растений | Средняя OD | Стандартная ошибка | |||
| Контроль | 0.8333 | 0.0667 | |||
| pC27BN-1 | 2.7833 | 0.3556 | |||
| pC27BN-2 | 1.0333 | 0.0444 | |||
| pC27BN-3 | 2.1333 | 0.1111 | |||
| pC27BN-4 | 1.6667 | 0.1111 | |||
| pC27BN-5 | 9.0000 | 0.6667 | |||
| pC27BN-6 | 1.2000 | 0.0667 | |||
| pC27BN-7 | 5.1333 | 0.5111 | |||
| pC27BN-8 | 9.6667 | 0.4444 | |||
| pC27BN-9 | 1.8333 | 0.1111 | |||
| pC27BN-10 | 7.5667 | 0.1556 | |||
| pC27BN-ll | 8.1000 | 0.0667 | |||
| Таблица 2 | |||||
| Линия | Концентрация ВТМ в инокулюме, мкг/мл | ||||
| 0.001 | 0.01 | 0.1 | 1 | 10 | |
| SRI | 0- | 29.3+ | 146.5+ | 125.8+ | 191.1+ |
| 11-2 | 0- | 0- | 0- | 103.1+ | 136.9+ |
| 11-3 | 0- | 0- | 0- | 87.6+ | 149.7+ |
| 11-8 | 0- | 0- | 0- | 74.8+ | 133.8+ |
| 11-10 | 0- | 0- | 0- | 95.5+ | 121+ |
| Таблица 3 | ||
| Линии растений | Средняя OD | Стандартная ошибка |
| Контроль | 0.9798 | 0.1251 |
| PC27BN-b4 | 2.9995 | 0.3688 |
| PC27BN-b5 | 3.0350 | 0.3560 |
| PC27BN-b7 | 3.1227 | 0.2431 |
| PC27BN-b8 | 2.6547 | 0.1722 |
| PC27BN-b11 | 2.6497 | 0.0736 |
| PC27BN-k1 | 1.8633 | 0.3271 |
| PC27BN-k2 | 2.3383 | 0.4311 |
Способ получения трансгенных растений, устойчивых к вирусной инфекции, включающий передачу вектора, содержащего ген, экспрессия которого в растении придает ему устойчивость к поражению вирусом, в штамм Agrobacterium и инфицирование последним растительного материала, отличающийся тем, что вектор конструируют на основе рекомбинантной плазмиды рС27, при этом ген, экспрессия которого придает растению устойчивость к поражению вирусом, включает фрагмент ДНК, содержащий последовательность гена секреторной панкреатической нуклеазы размером 455 п.н., находящегося под управлением индуцибельного МАS2'-промотора.