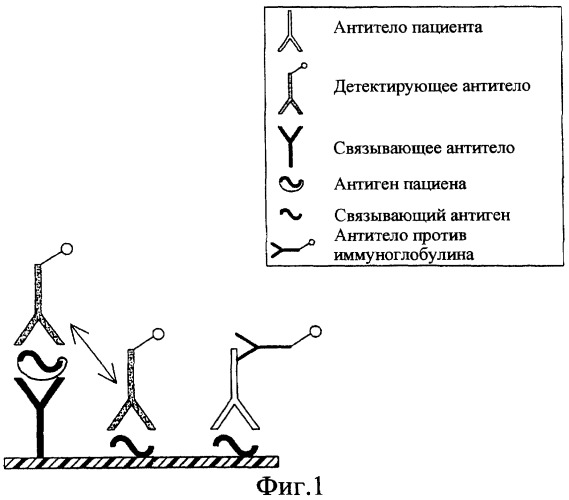
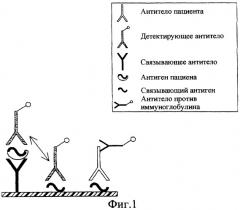
Способ одновременного обнаружения антигенов и антител против инфекционного микроорганизма
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к диагностике in vitro инфекции, вызванной микроорганизмом, а также касается применения реактивов и наборов для обнаружения антигенов и антител против инфекционного микроорганизма. Проводится одновременное обнаружение антигена микроорганизма и антител против данного антигена. Для обнаружения инфекции осуществляют контактирование биологической пробы со связывающим антителом против микроорганизма и связывающим антигеном из данного микроорганизма. Смесь инкубируют и выявляют образовавшиеся комплексы «антиген-антитело», с использованием меченых в случае необходимости детектирующего антитела и/или детектирующего антигена, при этом связывающий и/или меченый детектирующий антиген содержит фрагмент антигена микроорганизма, по меньшей мере, один эпитоп которого инактивирован, а связывающее и/или детектирующее антитело узнает нативный эпитоп связавшегося антигена. Предложены также набор и для обнаружения инфекции и пептиды или полипептиды белков вируса гепатита С и ВИЧ, с помощью которых возможно осуществление способа диагностики данных заболеваний. Использование способа позволяет повысить точность диагностики инфекции, вызванной микроорганизмом. 4 н. и 38 з.п. ф-лы, 13 табл., 2 ил.
Реферат
Изобретение относится к обнаружению in vitro инфекции, вызванной инфекционным микроорганизмом, в частности вирусным, и касается, в частности, обнаружения in vitro инфекции, вызванной вирусом гепатита С. Точнее изобретение относится к способу одновременного обнаружения антигена инфекционного микроорганизма, в частности вирусного, и антител против этого инфекционного микроорганизма, а также к реактивам и наборам для осуществления способа. В частности, изобретение относится к способу одновременного обнаружения антигена вируса гепатита С и антител против вируса гепатита С, а также к реактивам и наборам для его осуществления.
Инфекция, вызываемая вирусом гепатита С, называемого ранее гепатитом неА, неВ, представляет собой проблему в здравоохранении, в частности, в области переливания крови, которая была признана и вызывала озабоченность на протяжении длительного времени.
В заявке на патент ЕР 318216, опубликованной 31 мая 1989 г., описано клонирование фрагментов кДНК вируса, вызывающего гепатит С у человека, названного HCV (по-английски) или VHC (по-французски). В ней описаны также последовательность пяти генов, кодирующих неструктурные белки (NS1-NS5) вируса (около 78% от общего генома вируса гепатита С), антиген С 100-3 (содержащий 363 аминокислоты, (область NS3-NS4) слитый с супероксиддисмутазой), а также способ обнаружения антител против вируса гепатита C с помощью антигена С 100-3. Данный способ обнаружения антител против вируса гепатита С так называемого первого поколения позволил, в числе прочего, установить, что вирус гепатита С является главной причиной заболевания гепатитом неА, неВ, называемым теперь гепатитом С. Однако данный способ не позволяет обнаруживать более 70-80% сывороток, инфицированных данным вирусом. Такая недостаточная чувствительность не обеспечивает также раннего выявления инфекции.
Okamoto и др. (1990а), а также заявка на патент ЕР 388232, опубликованная 19 сентября 1990 г., описывают 5'-концевую последовательность генома вируса гепатита С, т.е. последовательность генов, кодирующих структурные белки (капсидные, кор, оболочечные) вируса, вызывающего гепатит С.
Okamoto и др. (1990b) опубликовали сведения о применении последовательности аминокислот 39-74 капсида вируса гепатита С в качестве мишени для обнаружения антител против вируса гепатита С твердофазным иммуноферментным анализом.
В статье Hosein и др. (1991 г.) описан иммунологический анализ по обнаружению антител против вируса гепатита С, основанный на использовании структурных (капсид, область АА 1-120) и неструктурных (NS3-NS4, область АА 1200-1800) синтетических пептидных антигенов. Он доказывает эффективность синтетических пептидов при обнаружении антител против вируса гепатита С и комбинации из структурных и неструктурных антигенов, повышающей чувствительность и, следовательно, обеспечивающей более ранний характер обнаружения. Описанный здесь анализ гарантирует более раннее обнаружение антител: за 4-10 недель. Из статьи также следует, что не имеется основного иммунодоминантного эпитопа, такого, как известный, например, для вирусов СПИДа.
Nasoff и др. (1991 г.) установили, что большая часть доминатных иммунореактивных эпитопов капсида локализована в N-концевой области (АА 1-40) и что антитела против этих эпитопов появляются вскоре после инфицирования.
Тесты по обнаружению антител против вируса гепатита С так называемого второго поколения (т.е. тесты, основанные на одновременном использовании иммобилизованных неструктурных и структурных антигенов) означают существенное продвижение вперед по сравнению с тестами первого поколения. Однако их чувствительность все еще недостаточна: в действительности они позволяют обнаружить не более 95-98% сывороток, зараженных вирусом гепатита С. Следовательно, такое обнаружение является недостаточно ранним и позволяет пропустить незамеченной инфицированную донорскую кровь при ее переливании. Действительно, для снижения риска в период после переливания крови необходимо выявлять присутствие самого вируса до появления антител и как можно раньше после заражения. Период между заражением и сероконверсией (т.е. появлением антител) называется "серологическим окном" («антительным окном»).
Разные коллективы авторов (Garson и др., 1990 г.; Shieh и др., 1991 г.) предлагали обнаруживать вирусную рибонуклеиновую кислоту с помощью полимеразной цепной реакции (PCR) в целях решения проблемы чувствительности и упомянутого выше требования раннего характера обнаружения. Действительно, данный способ обеспечивает чрезвычайно чувствительное и раннее обнаружение инфекции, вызванной вирусом гепатита С, а именно уже через несколько суток после инфицирования вирусом, т.е. за 4-8 недель до увеличения количества циркулирующих противовирусных антител. В настоящее время он является эталонным способом обнаружения вируса в биологических жидкостях.
Однако способ PCR для вируса гепатита С наталкивается на разные трудности. С одной стороны, он предусматривает проведение предварительных стадий извлечения и очистки РНК и затем ее обратную транскрипцию в кДНК, причем на этих предварительных стадиях часть вирусного материала теряется. С другой стороны, он требует применения специального дорогостоящего оборудования. Кроме того, он не позволяет одновременно обрабатывать большое количество проб, что часто является причиной заражения.
Другим подходом для раннего обнаружения инфекции, вызванной вирусом гепатита С, является обнаружение циркулирующего вирусного (капсидного) антигена. Этот антиген также появляется за несколько недель до образования сывороточных антител против вируса гепатита С. Takahashi и др., 1992 г., описали способ твердофазного иммуноферментного анализа (ELISA) для обнаружения капсидного антигена с помощью пары антител.
Однако обнаружение такого антигена весьма затруднительно, большей частью, вследствие малой доли выявляемых в крови антигенов и из-за качества имеющихся иммунологических реактивов.
Hajime Tokita и др., 2000 г., описали сэндвич-иммуноанализ с использованием пары моноклональных антител (5F11 и 5Е3), известный на рынке под названием "Immucheck F HCV Ag Core Kokusai" и являющийся весьма чувствительным. Авторы данной статьи подчеркивают, что мутация Thr49Pro в капсидном белке снижает чувствительность анализа. Пытаясь обнаружить капсидный антиген на ранней стадии, Peterson и др., 2000 г., описали способ обнаружения с помощью ELISA для капсидного антигена вируса гепатита C с использованием моноклональных антител против капсида без предварительной обработки пробы. В статье показано, что с помощью трех независимых методов анализа (обнаружение РНК вируса гепатита С посредством PCR, антител против вируса гепатита С и капсидного антигена с помощью ELISA) может быть эффективно обнаружен циркулирующий капсидный антиген вируса гепатита С в образцах крови, взятой на ранней серологически отрицательной стадии инфекции (т.е. через 1 сутки после обнаружения РНК).
Раннее обнаружение инфекции, вызванной вирусом гепатита С, в сочетании с возможностью выявления ответных реакций антител, следующих за серологической конверсией на протяжении всей инфекции, остается актуальной задачей, в первую очередь, в области переливания крови.
Совершенно необходимо располагать способом, являющимся простым, чувствительным, специфическим, воспроизводимым, дешевым, легко осуществимым и поддающимся автоматизации при массовом обнаружении для обнаружения, в первую очередь, антигена вируса гепатита С в период серологического окна для последующего слежения за серологической реакцией пациента после серологической конверсии и для одновременного обнаружения антител против вирусов гепатита С и антигена вируса гепатита С.
Однако при этом возникает главная проблема, касающаяся количества антигена вируса гепатита С и интерференции между антителами против вируса гепатита С в сыворотке и мечеными антителами против вируса гепатита С. Следовательно, введение антигена-мишени в твердую фазу с целью обнаружения заданного антитела, которая имела бы те же эпитопы, что и эпитопы, узнанные меченым(и) антителом (антителами), применяемым(и) с целью одновременного обнаружения антигена способом сэндвич, необратимо привело бы к связыванию меченого (меченых) антитела (антител) с твердой фазой и, следовательно, к ложноположительному результату.
Это особенно справедливо для системы одновременного обнаружения на одной и той же твердой фазе антител против капсида вируса гепатита С и капсидного антигена вируса гепатита С. Следовательно, иммобилизация капсидного антигена на ту же твердую фазу с целью обнаружения антител против капсида вируса гепатита С, имеющего те же эпитопы, что и эпитопы, узнанные посредством меченого (меченых) антитела (антител) против капсида вируса гепатита С, используемого (используемых) для обнаружения капсидного антигена, приводит к связыванию меченого (меченых) антитела (антител) с твердой фазой, что приводит к ложноположительному результату.
Для предупреждения риска интерференции Chiron Corp. провела тесты по обнаружению капсидного антигена и только антител против NS3/NS4 у пациентов. Для этого Chiron применила, с одной стороны, антиген NS3/4a, иммобилизованный на твердой фазе, для связывания антител против вируса гепатита С в тестируемой пробе и, с другой стороны, также иммобилизованные моноклональные антитела (с11-3 и с11-7) против капсида вируса гепатита С. Связанные антитела обнаруживали с помощью антигена, слитого с супероксиддисмутазой, в присутствии моноклонального антитела, меченного пероксидазой, в то время как связанный антиген обнаруживали с помощью другого моноклонального антитела, также меченного пероксидазой (VII European Congress of the International Society of Blood Transfusion (VII Европейский конгресс Международного общества по переливанию крови), г. Париж, 15-18 июля 2001 г.).
В связи с проблемой интерференции в заявке на патент ЕР 1020727 (заявитель "Advanced Life Science Institute") предложен способ одновременного обнаружения капсидного антигена вируса гепатита С и антител против капсида вируса гепатита С (тест типа "Combo"), согласно которому антиген связывается и метится антителами против разных капсидных эпитопов, служащих одновременно для связывания и выявления или обнаружения антител против капсида. Приведен представительный пример, в котором для одновременного теста по обнаружению антигена способом сэндвич и антител непрямым тестом используют для обнаружения антигена первое (иммобилизованое) антитело против эпитопов последовательности аминокислот от (АА) 100 до 130 капсида вируса гепатита С и второе (детектирующее) антитело против эпитопов последовательности АА40-50, а для обнаружения антител используемый иммобилизованный антиген содержит, в свою очередь, последовательности АА1-42 и АА66-80.
Однако этот способ не свободен от недостатков, в частности, по той причине, что для него требуется применение антител против эпитопов, относительно удаленных один от другого и являющихся в действительности менее значительными и мало иммуногенными. Кроме того, ему присущ недостаток, заключающийся в том, что из-за отсутствия последовательности АА43-65 не могут обнаруживаться антитела против указанной последовательности, и, следовательно, снижается чувствительность. Кроме того, при этом способе связывание капсидного антигена и антител против капсида происходит с помощью двух белковых капсидных зон, четко различающихся между собой, т.е. не наложенных одна на другую (АА 1-42 и АА 66-80 для обнаружения антител и АА 100-130 для обнаружения антигена), в отличие от настоящего изобретения.
В заявке на изобретение WO 01/96875 А2 (заявитель "CHIRON") описан в числе прочего тест по одновременному обнаружению капсида и антител против NS3 и NS4 (неполный тест "Combo", фиг.2), при котором в качестве детергента применяется N-лаурилсаркозин. Однако в ней очень кратко излагается полный тест "Combo", стр.33, фиг.8, т.е. тест по одновременному обнаружению капсидного антигена (способом сэндвич) и антител против капсида и неструктурных антибелков вируса гепатита С (сандвич двойного антигена). Для связывания антигена применяются два иммобилизованных антитела с11-3 и с11-7, способных узнавать обширный N-концевой участок (АА 10-53) капсида вируса гепатита С, а для обнаружения применяется третье антитело с 11-14, способное узнать С-концевой участок (АА 120-130) капсида вируса гепатита С. Для обнаружения антител используется иммобилизованный антиген, слитый с множественными эпитопами ("МЕРА 12", см. табл.2 в заявке WO 01/96875) и содержащий после слияния с фрагментом супероксиддисмутазы антигены NS3, NS4, NS5 и серии последовательностей капсида нескольких штаммов вируса гепатита С: АА 9-53, носителей мутации R47L, АА 64-88 и АА 67-84. Последовательности АА 54-63 и АА 54-66 в этих обеих сериях последовательности отсутствуют.
Однако реальное проведение полного теста "Combo " в заявке на патент WO 01/97875 А2 не описано. Следовательно, для среднего специалиста не представляется возможным определить четко и однозначно, является ли тест Combo согласно фиг.8 работоспособным, и еще в меньшей степени, может ли он решить стоящую проблему, т.е. по возможности рано обнаружить инфекцию, вызванную вирусом гепатита С. Как бы то ни было, остается очевидным, что в лучшем случае тест "Combo" согласно заявке WO 01/96875 А2 безусловно не обнаружит все антитела против недостающих последовательностей АА 54-63 и АА 54-66. Отсюда следует риск потери чувствительности.
В заявке на патент ЕР 1251353 А2 (заявитель "Ortho-Clinical Diagnostics") описан полный тест "Combo", при котором применяются те же антитела для обнаружения капсида, однако без уточнения их происхождения и специфичности эпитопов. Кроме того, в ней уточняется, что используемым детергентом является детергент типа BRIJ или MYRJ, который очевидно предпочтителен вместо N-лаурилсаркозина в наборе для обнаружения капсидного антигена, предлагаемом на рынке "Ortho Clinical Diagnostics" (см. пример 3 [0012]). Обнаружение антител против капсида проводится с помощью модифицированного капсидного антигена (мутагенезом): C22KSN▿47,48 (белок, слитый с супероксиддисмутазой и содержащий последовательность АА 10-99 капсида с делецией аминокислот 47 и 48) или C22KSR47L (белок, слитый с супероксиддисмутазой и содержащий последовательность АА 10-99 капсида, с лейцином, замещающим аргинин в позиции 47).
В заявке на патент WO 03/002749 А2 (заявитель "Abbott") описаны многочисленные антигены и тесты по обнаружению капсидного антигена вируса гепатита С. Только в полном тесте "Combo", который описывается в ней под названием "Real Combo" (фиг.1, стр.59), для обнаружения антител против капсида используется биотинилированный пептид, соответствующий аминокислотам 11-28 капсида и иммобилизованный на твердой фазе. Для обнаружения капсида заявкой предусматривается применение комбинация антител С11-14 (Advanced Life Science Institute) (узнающих последовательность капсида АА45-50) иммобилизованных на твердой фазе и СП-10 (узнающего последовательность АА 32-36 капсида), меченного акридином. Согласно заявке WO 03/002749А2 связывание капсидного антигена и антител против капсида происходит посредством двух отчетливо различающихся между собой капсидных сайтов, т.е. не наложенных друг на друга (АА 11-28 для обнаружения антител и АА 45-50 для обнаружения антигена) в отличие от настоящего изобретения.
Поэтому для решения стоящей проблемы авторы данного изобретения поставили своей целью создание альтернативного способа.
В настоящее время разработан способ одновременного обнаружения антигена вируса гепатита С и антител пациента против этого антигена, которым решается проблема интерференции и достигается уровень чувствительности и раннее обнаружение, приближающееся к уровню чувствительности при PCR, что позволяет полностью отслеживать серологическую реакцию пациента после серологической конверсии.
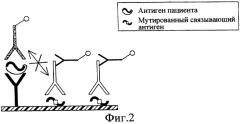
Авторы изобретения решили данную проблему, создав искусственно, путем изменения структуры, различающиеся эпитопы антигенов-мишеней для связывания антител. Модифицированные таким образом эпитопы оказались инактивированными. Одновременно антитела, предназначенные для связывания и/или обнаружения антигенов выбираются, в свою очередь, таким образом, чтобы они точно узнавали немодифицированные эпитопы, присутствующие на антигенах пациента, и не могли связываться с модифицированными антигенами, не содержащими более эти эпитопы. Ввиду того что эпитопы более не идентичны, то отсутствует конкуренция между антителами, используемыми для связывания и/или обнаружения антигена вируса гепатита С, и антителами пациента. В противоположность некоторым известным из уровня техники способам связывание капсидного антигена и связывание антител против капсида могут происходить в одной и той же белковой зоне капсида с исключением потери определенного количества антител против капсида при обнаружении, как это будет показано ниже.
Поскольку на N-концевом участке капсида идентифицируется множество эпитопов, то эта белковая зона оказывается наиболее пригодной для одновременного очень чувствительного обнаружения капсидного антигена и антител против капсида.
Благодаря данному изобретению становится возможным одновременно применять при обнаружении антител и антигенов наиболее иммуннореактивные последовательности и таким образом улучшить чувствительность обнаружения.
Само собой разумеется, что изобретение не ограничивается обнаружением только инфекции, вызванной вирусом гепатита С. Оно распространяется также на спосо6, реактивы и наборы, описываемые ниже и предназначенные для обнаружения и/или слежения за инфекцией, вызванной инфекционными микроорганизмами любого вида (например, вирусами, такими как вирусы, вызывающие разные виды гепатита А, В, С, D или Е, ретровирусы, в частности, вирусы СПИДа человека (ВИЧ-1, ВИЧ-1 группы 0, ВИЧ-2) или обезьяны, цитомегаловирус, флавивирусы, в их числе вирусы лихорадки денге, а также бактерии, микробные паразиты и пр.), для которых требуется одновременное обнаружение антигенов и антител. Изобретение, описанное в основном применительно к вирусу гепатита С, имеет более широкое значение и может быть легко понято специалистом.
Определение понятий
Термин "вирус гепатита С" применяется в данном случае для всех штаммов, всех типов, подтипов и генотипов вируса, вызывающего гепатит С. Способ согласно изобретению имеет своей целью обнаружение любой инфекции, вызванной вирусом гепатита С, какими бы ни были его происхождение и генотип. Это предполагает, в частности, хорошо известные типы и подтипы вируса, распространенные в Европе, США, Японии и т.д. (т.е. 6 основных генотипов: 1, 2, 3, 4, 5, 6 и их подтипов 1a, 1b, 3а, ...). См. Stuyver et al., 1994 г.; Bukh, 1995 г.
Под "вирусом иммунодефицита человека", или ВИЧ, понимаются любые штаммы, типы, подтипы, группы и генотипы ретровируса, вызывающего СПИД человека. Термином "ВИЧ" объеденены между собой, в частности, ВИЧ-1 (ВИЧ-1 группы М, ВИЧ-1 группы 0) и ВИЧ-2, а также их варианты.
В контексте изобретения "биологическая проба" представлена преимущественно биологической жидкостью, такой как кровь, плазма, сыворотка, моча, спинно-мозговая жидкость, слюна и пр.
Термин "антитело" относится к любому целому антителу или его функциональному фрагменту, содержащему или состоящему, по меньшей мере, из одного антиген-связывающего сайта, позволяющего этому антителу связываться, по меньшей мере, с одной антигенной детерминантой антигена. В качестве примера фрагментов антител можно указать на фрагменты Fab, Fab', F(ab')2, а также на цепочки scFv (single chain variable fragment), dsFv (double-stranded variable fragment) и пр. Такие функциональные фрагменты могут быть получены, в частности, генной инженерией.
Продуцирование моноклональных антител или моноспецифических поликлональных сывороток, применяемых в рамках настоящего изобретения, зависит от традиционных приемов, описываемых ниже более подробно.
Под "связывающим (иммобилизованным) антителом" понимается антитело или часть его, предпочтительно иммобилизованая на твердой фазе, способная связывать антиген микроорганизма, например, вируса гепатита С или ВИЧ в биологической пробе путем специфического узнавания (связывания).
Присутствие антител и антигенов в биологической пробе определяется "детектирующими средствами". Поскольку речь идет об обнаружении антигена, то изобретением предусматривается, в частности, обнаружение с помощью, по меньшей мере, одного "детектирующего антитела". Такое меченое детектирующее антитело способно связываться со связанным антигеном благодаря специфическому узнаванию, узнавая эпитоп, отличающийся от эпитопа, узнанного иммобилизованным антителом, или идентичный вследствие присутствия содержащего повторы фрагмента капсида. Если речь идет об обнаружении антител, то можно использовать, в частности, антитела против иммуноглобулина или против изотипа, например, мечеными антителами против иммуноглобулинов G.
Термин "меченый" означает как прямое мечение (посредством ферментов, радиоизотопов, флюорохромов, люминесцирующих соединений и пр.), так и непрямое мечение (например, посредством антител, которые, в свою очередь, были подвернуты прямому мечению, или посредством реактивов, представляющих собой меченую "стереоспецифическую пару", такую как - но не исключительно - пара "меченый авидин-биотин" и пр.).
Под "фрагментом антигена" подразумевается полный или часть природного или рекомбинированного белка инфекционного микроорганизма, такого как вирус гепатита С или ВИЧ, способный индуцировать образование антител в организме инфицированного пациента или иммунизированного животного. Речь может идти о полном или о части капсидного белка или о неструктурных белках вируса гепатита С, в частности NS3 и NS4, полученных или не полученных генной инженерией. Также может идти речь о полном или части белка, кодированном геном gag ВИЧ, в частности Р25 (ВИЧ-1) или Р26 (ВИЧ-2), или о белке, кодированном геном оболочки, в частности, gp41 (ВИЧ-1) или gp36 (ВИЧ-2).
Под "связывающим антигеном" понимается выделенный фрагмент антигена, предпочтительно иммобилизованный на твердой фазе, способный быть узнанным антителами против микроорганизма, такими, как антитела против вируса гепатита С или против вируса иммунодефицита человека, и способный обеспечивать специфическое связывание с последними.
Под "детектирующим антигеном" понимается меченый и измененный антиген в качестве связывающего антигена (т.е. содержащего, по меньшей мере, один эпитоп или инактивированный эпитоп). Он позволяет обнаружить вследствие конкуренции либо связанный антиген, либо антитела классическим способом сэндвич "антиген-антитело-антиген", называемым также способом "сэндвич двойного антигена" (Maiolini и др., 1978 г.).
Согласно изобретению связывающий антиген и/или, при необходимости, детектирующий антиген, используемый, в частности, при обнаружении антител способом сэндвич "антиген-антитело-антиген", содержит, по меньшей мере, один эпитоп или инактивированный эпитоп."Эпитоп" представляет собой последовательность аминокислот, которая узнается антителом и которая обеспечивает специфическое связывание с последним.
Что касается белков вируса гепатита С, то идентифицировано несколько эпитопов капсидного белка. Известны, в частности, эпитопы, локализованные между аминокислотой 16 и аминокислотой 40, а также между аминокислотой 44 и аминокислотой 47. Можно также сослаться, например, на статьи или публикации авторов Okamoto и др., 1990 г.; Nasoff и др., 1991 г.; Leahny и др., 1991 г.; Takahishi и др., 1992 г.; Sällberg и др., 1993 г.; Ishida, 1993 г.
Многочисленные эпитопы неструктурных белков вируса гепатита С также известны специалисту. Для белка NS3 известны эпитопы, локализованные между аминокислотой 1188 и аминокислотой 1493 (Yang и др., 1995 г.), между аминокислотой 1175 и аминокислотой 1334 (Yang и др., 1999 г.), а также эпитоп, расположенный между аминокислотой 1460 и аминокислотой 1532 (Clayes и др., 1995 г.).
Один из наиболее известных эпитопов NS4, а именно эпитоп 5-1-1 (АА 1689-1706), упомянут у Cerino и др., 1991 г.
Для ВИЧ в уровне техники также описано несколько эпитопов. В частности, речь идет об эпитопах белка Р25 ВИЧ-1 (группа М), локализованных между аминокислотами 293-350, а также об иммунодоминантном эпитопе белка gp41, описанного Gnann и др., 1987 г., или о варианте этой последовательности; также речь идет, например, об эпитопе белка Р26, в частности, об эпитопе последовательности, гомологичной последовательности эпитопа белка Р25 ВИЧ-1, описанного выше, или об эпитопе белка gp36 ВИЧ-2, в частности, об иммунодоминантном эпитопе белка gp36, описанного Gnann и др., 1987 г., или о варианте этой последовательности.
"Эпитоп" или "инактивированный эпитоп" означает, что структура (первичная, вторичная, третичная и/или четвертичная) эпитопа изменена таким образом, чтобы связывающий или детектирующий антиген, содержащий такой инактивированный эпитоп, не мог связываться со связывающим и/или детектирующим антителом против одновременно обнаруживаемого антигена при полном сохранении способности связывать антитела против микроорганизма, такие как антитела против вируса гепатита С или вируса иммунодефицита человека, возможно, присутствующие в биологической пробе, посредством узнавания других, не являющихся инактиврованными эпитопов. Следовательно, связывающие и/или детектирующие антитела выбираются таким образом, чтобы специфически узнавался соответствующий эпитоп в "интактном" виде, т.е. в "активном" или "нативном" виде на антигене, присутствующем в биологической пробе. В рамках настоящего изобретения этот эпитоп в нативном виде называется также "гомологичным" эпитопом инактивированного эпитопа.
Термин "специфично" в том случае, когда он относится к узнаванию или к специфическому связыванию антитела с антигеном, означает, что антитело взаимодействует с антигеном без существенного взаимодействия с другими антигенами, или применяется в том случае, когда речь идет о "специфическом" узнавании с помощью эпитопа, в частности, посредством квази-исключительного узнавания этого эпитопа. Предпочтительными являются константы ассоциации, превышающие 108 L.mol-1.
Связывающие и детектирующие антитела
Антитела, используемые в данном изобретении, являются специфическими антителами по отношению к антигену и вследствие этого представляют собой моноклональные или поликлональные моноспецифические антитела, т.е. они специфически узнают только один эпитоп.
Моноклональные антитела могут быть получены классическим способом лимфоцитарного слияния и выращивания гибридом, описанным Kohler и Milstein, 1975 г. Также известны и другие способы получения моноклональных антител (Harlow и др., 1988 г.). Моноклональные антитела могут быть получены иммунизацией млекопитающего животного (например, мыши, крысы, кролика, даже человека и пр.) с применением способа лимфоцитарного слияния, приводящего к образованию гибридом (Kohler и Milstein, 1975 г.).
Существуют также способы, альтернативные по отношению к этому распространенному способу. Например, можно продуцировать моноклональные антитела способом экспрессии нуклеиновой кислоты, клонированной на основе гибридомы. Также можно продуцировать антитела посредством экспрессии в фаге ("phage display") путем введения кДНК антител в векторы, являющиеся типичными нитчатыми фагами (например, fUSE5 для Е. coli., Scott и др., 1990 г.). Последние образуют банки и содержат на своей поверхности фрагменты scFv. Протоколы строения таких банков антител описаны у Marks и др., 1991 г.
Поликлональные антитела могут быть получены из сыворотки животного, иммунизированного от антигена пептидного происхождения обычными способами.
Как правило, можно применять, например, в качестве иммуногена, полипептид, в частности рекомбинированный, или олигопептид. В соответствии с классическим способом кроликов иммунизируют пептидным иммуногеном в эквивалентном количестве 1 мг согласно методике, описанной Benoit и et al., 1982 г. С интервалом в четыре недели животным вводили по 200 мкг антигена и через 10-14 суток их забивали. После третьего введения оценивали способность антисыворотки связываться с пептидным антигеном, меченным радиоактивным иодом с помощью хлорамина-Т. После этого проводили очистку с помощью ионообменной хроматографии на колонке с карбоксиметилцеллюлозой. Антитела элюировали и выделяли фракцию IgG с помощью методов, которые хорошо известны специалисту, например, на диэтиламиноэтил-Sephadex.
Для повышения специфичности поликлональной сыворотки антитела можно очищать с помощью иммуноаффинной хроматографии с использованием пептидов (таких как пептиды капсида АА 16-44 и АА 39-74 вируса гепатита С - в качестве неограничивающего примера), которые применялись для иммунизации и были иммобилизованы на твердой фазе. Антисыворотку приводят в контакт с таким иммобилизованным на твердой фазе пептидом в течение времени, достаточного для протекания иммунной реакции между пептидом и молекулой антитела, необходимой для образования иммунологического твердофазного комплекса.
В частности, заявители использовали специфические антитела против вируса гепатита С, которые приведены в нижеследующей таблице 1.
| Таблица 1 | ||
| Моноклональные антитела | Класс | Узнаваемый нативный эпитоп |
| Acm 1 | IgG2a | 44LGVR47(SEQ ID №19) |
| Acm 2 | IgG2a | 30IVGGVYL36(SEQ ID №20) |
| Acm 3 | IgG1 | 29QIVGGV34(SEQ ID №21) |
| Acm 4 | IgG1 | 29QIVGGV34(SEQ ID №21) |
| Acm 5 | IgG1 | 30IVGGVYL36(SEQ ID №20) |
| Acm 6 | IgG1 | 30IVGGVYL36(SEQ ID №20) |
Что касается теста "Combo" для обнаружения ВИЧ, то применяемое антитело представляет собой преимущественно моноклональное антитело, узнающее одну из следущих полипептидных последовательностей или соответствующую последовательность измененного штамма ВИЧ:
- эпитоп белка Р25 ВИЧ-1 группы М последовательности 308QASQEVKNWMTETLL322 (SEQ. ID №24);
- эпитоп белка Р26, в частности, эпитоп последовательности, гомологической по отношению к эпитопу белка Р25 ВИЧ-1 (последовательность SEQ ID №24), как, например, эпитоп, содержащий последовательность QTDPAVKNWMTQTLL SEQ ID №25) (изолят ВИЧ: ROD).
Само собой разумеется, что специалист в состоянии приготовить или приобрести моноклональные антитела, специфичность эпитопа которых будет сходна или идентична специфичности, описанной для указанных выше антител, и которые будут пригодны для осуществления настоящего изобретения.
Связывающие и/или детектирующие антигены
Связывающий и/или детектирующий антиген, используемый в изобретении, содержит, по меньшей мере, один инактивированный эпитоп. Инактивирование, по меньшей мере, двух эпитопов в антигене может оказаться необходимым в том случае, когда применяются два разных антитела, для которых присутствует риск взаимодействия со связывающим и/или детектирующим антигеном. Это имеет место, например, при иммуноанализах способом сэндвич, при которых применяются связывающее антитело, иммобилизованное на той же поверхности, что и связывающий антиген, и детектирующее антитело. Следовательно, связывающее антитело выбирается таким образом, чтобы оно специфически узнавало эпитоп на нативном антигене пациента, гомологичном одному из двух инактивированных эпитопов на связывающем антигене, в то время как детектирующее антитело выбирается так, чтобы оно специфично узнавало эпитоп на нативном антигене пациента, гомологичном другому из обоих инактивированных эпитопов на связывающем антигене.
Связывающий и/или детектирующий антиген может содержать или состоять из одного пептида, имитирующего полностью или частично эпитоп белкового антигена микроорганизма, в частности, вируса гепатита С или ВИЧ.
Предпочтительно речь идет о пептиде капсидного белка, причем обнаружение антител против капсидов происходит особенно эффективно, в частности, в случае хронических гепатитов, когда наблюдается очень мало антигенов и больше циркулирующих антител против капсидов. Речь может идти также о пептиде (пептидах) неструктурного белка, такого как NS3 и/или NS4. Также возможны комбинации из различных связывающих или детектирующих антигенов. Такой вариант осуществления, при котором применяются несколько разных связывающих и/или детектирующих антигенов, позволяет, например, одновременно обнаружить антитела против капсида и антитела против неструктурных белков NS3 и/или NS4 вируса гепатита С. Особо предпочтительно одновременное обнаружение антител против капсида и антител против NS3. Изобретение касается также одновременного обнаружения капсидного антигена, антитела против капсида, антитела против структурных капсульных белков Е1 и/или Е2, капсульного антигена Е1 и/или Е2 и/или антител против неструктурных белков NS3 и/или NS4 вируса гепатита С. Другие возможные комбинации также входят в объем настоящего изобретения.
Аналогично в объем изобретения входит одновременное обнаружение антигена gag, антитела против gag и/или антитела против капсулы вируса СПИДа (ВИЧ-1, ВИЧ-2 и пр.), последовательности которых опубликованы в статьях Wain-Hobson и др., 1985 г.; Ratner и др., 1985 г.; Sanchez-Pescador и др., 1985 г.; Guyader и др., 1987 г. Предпочтительно, чтобы обнаруживаемый антиген gag представлял собой белок Р25 ВИЧ-1 или Р26 ВИЧ-2, а искомые антитела против gag действовали против этих белков. Всегда предпочтительно, чтобы капсульные антигены, предназначенные для обнаружения антител против капсулы ВИЧ-1 и ВИЧ-2, представляли собой gp41 ВИЧ-1 и gp36 ВИЧ-2.
Аналогично обнаружение антигена NS1, описанное у Alcon и др., 2002 г., проводимое одновременно с обнаружением антител против NS1 и даже антител против NS2, NS3 и/или S4 вирусов лихорадки денге, входит в объем изобретения.
Способы применения специалисту хорошо известны.
Предпочтительно, поскольку это более практично, чтобы связывающие и/или детектирующие антигены представляли собой синтетические пептиды, полученные стандартными способами, хорошо известными среднему специалисту. В качестве примера можно упомянуть синтез по Меррифильду (Merrifield), являющийся эффективным с точки зрения чистоты, антигенной специфичности, отсутствия нежелательных вторичных продуктов, а также простоты применения (Marrifield, 1963 г.; R.C. Sheppard, 1971 г.; Atherton и др., 1989 г.). В качестве автоматического синтезатора пригоден синтезатор "9050 Plus Pep Synthesizer" ф. Millipore, синтезатор "Pioneer" ф. Perseptive, синтезатор "433A" ф. ABI (Applied Biosystems Inc.) или синтезатор "Symphony" ф. Rainin. Пептиды могут быть также получены путем синтеза в гомогенной фазе.
Инактивация эпитопов на связывающих и/или детектирующих антигенах может производиться разными способами. Единственное условие, необходимое для данной модификации эпитопов, состоит в том, чтобы связывающий и/или детектирующий антиген не мог связываться со связывающим и/или детектирующим антителом при сохранении в значительной степени способности связывать антитела против микроорганизма, в частности, антитела против вируса гепатита С или антивируса иммунодефицита человека, вероятно, присутствующих в биологической пробе.
Модификация, по меньшей мере, одной аминокислоты, предпочтительно двух аминокислот, в каждом целевом эпитопе может оказаться достаточной для инактивации эпитопа без дестабилизации остальных немодифицированных эпитопов. Такая модификация может быть достигнута, в частности, замещением аминокислоты, например, замещением остатка неглицина остатком глицина или аланина или замещением аминокислоты одного класса аминокислотой другого класса. Можно, например, заместить аминокислоту с полярной боковой цепью (такую, как аспарагин, глутамин, серин, треонин и тирозин) аминокислотой с неполярной боковой цепью (такой, как глицин, аланин, валин, лейцин, изолейцин, фенилаланин, метионин, триптофан и цистеин) и наоборот. Также можно заместить аминокислоту с щелочной боковой цепью (такую, как лизин, аргинин и гистидин) аминокислотой с кислой боковой цепью (такой, как аспарагиновая и глутаминовая кислоты), и наоборот, или же заместить аминокислоту, боковая цепь которой содержит кольцо (например, тирозин, фенилаланин), аминокислотой с линейной боковой цепью, и наоборот. Делеция одной или нескольких аминокислот или введение одной или нескольких аминокислот, в частности, неприродных аминокислот, в эпитоп также позволяет инактивировать этот эпитоп. Также возможны изменения функциональных групп аминокислот, а именно, групп ОН, NH2 или SH.
Из эффективных пептидов согласно настоящему изобретению можно указать на пептиды, производные от любого вида инфекционных микроорганизмов (таких, как вирусы, например, вирусы, вызывающие разн