Пептид, обладающий иммуногеропротекторным действием, фармацевтическая композиция на его основе и способ ее применения
Иллюстрации
Показать всеГруппа изобретений относится к лекарственным средствам для профилактики и коррекции возрастных нарушений клеточного и гуморального иммунитета и может быть использовано как средство, обладающее иммуногеропротекторным действием. Предлагается фармацевтическая композиция, обладающая иммуногеропротекторным действием, содержащая в качестве активного начала эффективное количество пептида глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1]. Предлагается пептид глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1], который обладает иммуногеропротекторным действием. Предлагается способ профилактики и коррекции возрастных нарушений клеточного и гуморального иммунитета путем стимулирования процессов пролиферации и дифференцировки лимфоцитов, заключающийся во введении пациенту фармацевтической композиции, содержащей в качестве активного начала пептид глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1] в дозе 0,01-100 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта. Изобретение обеспечивает создание пептида, обладающего иммуногеропротекторным действием, а также фармацевтической композиции, содержащей в качестве активного начала этот пептид, использование которой стимулирует процессы пролиферации и дифференцировки лимфоцитов за счет восстановления синтеза тканеспецифических белков, нормализации метаболических и молекулярно-генетических показателей при возрастных нарушениях клеточного и гуморального иммунитета. 4 н. и 2 з.п. ф-лы, 4 табл., 2 ил.
Реферат
Изобретение относится к лекарственным средствам для профилактики и коррекции возрастных нарушений клеточного и гуморального иммунитета и может быть использовано как средство, обладающее иммуногеропротекторным действием.
Одной из основных причин старения считают нарушения в функционировании иммунной системы как в целом, так и в отдельных ее звеньях. Старение сопровождается инволюцией органов иммунной системы, прежде всего тимуса [Петров Р.В., Хаитов P.M. Иммунный ответ и старение //Успехи современной биологии. - 1975. - Т.79, вып.1. - С.111-127; Хирокава К. Тимус и старение// Иммунология и старение. / Под ред. Т.Макинодана и Э.Юниса. - М.: Мир, 1980. - С.75-101]. Возрастная инволюция тимуса характеризуется снижением функциональной активности Т-лимфоцитов, нарушением синтеза белка в лимфоцитах, изменением соотношения субпопуляций иммунокомпетентных клеток и уменьшением продукции иммунорегуляторных пептидов. Возрастные изменения иммунологической реактивности связаны с нарушением структуры и функции генов, контролирующих иммунный ответ, в том числе генов системы гистосовместимости [Донцов В.И., Крутько В.П., Подколзин А.А. Фундаментальные механизмы геропрофилактики. - М.: Биоинформсервис, 2002, с.464].
Как известно, терапевтический потенциал многих пептидных препаратов проявляется в стимуляции иммунных и репаративных процессов. Пептиды вызывают метаболические изменения, управление которыми осуществляется через механизмы генной регуляции [Khavinson V.Kh., Malinin V.V. Gerontological Aspects of Genome Peptide Regulation. - Basel: Karger, 2005. - 104 p.]. Известны иммуностимуляторы пептидной природы: тактивин (патент Франции № 2570278), тимозин (Goldstein A.L. et.al, Proc. Nat. Acad. Sci. USA, 1972, v.69, p.1856-1863). Эти препараты и представляют собой набор полипептидов различной длины, воздействующих на различные звенья иммунного ответа, а также на другие физиологические функции организма, что ведет к появлению нежелательных побочных эффектов. Следует также отметить, что эти препараты получены из природного сырья, поэтому практически использование этих препаратов затруднено в связи со сложностью способов их извлечения, малым выходом, а также значительной вариабельностью их физико-химических свойств.
Известны синтетические пептидные иммуностимуляторы: аналоги тимопептина (патент США № 5013723), тимоген (патент РФ № 1737798, ЕР № 0445581).
С нарушениями работы иммунной системы ассоциируются многие заболевания пожилого и старческого возраста, к которым, прежде всего, относятся аутоиммунные заболевания, опухоли, болезни суставов, почек, амилоидоз, патология сердечнососудистой системы, инфекционные заболевания. Расширение диапазона неблагоприятных воздействий на организм человека вызывает преждевременное старение и ускоряет развитие возрастной патологии.
Исходя из этого, разработка эффективных иммуногеропротекторных средств становится все более актуальной.
Структурных аналогов, представленных в уровне техники, предлагаемый пептид не имеет.
Настоящим изобретением поставлена и решена задача получения пептида, который обладает иммуногеропротекторным действием, и фармацевтической композиции, содержащей этот пептид в качестве активного начала, а также способа ее применения.
Технический результат изобретения заключается в создании пептида, обладающего иммуногеропротекторным действием, а также фармацевтической композиции, содержащей в качестве активного начала этот пептид, использование которой стимулирует процессы пролиферации и дифференцировки лимфоцитов за счет восстановления синтеза тканеспецифических белков, нормализации метаболических и молекулярно-генетических показателей при возрастных нарушениях клеточного и гуморального иммунитета.
Для решения поставленной задачи и достижения указанного технического результата предложена группа изобретений, объединенных общим изобретательским замыслом.
Одним из объектов предложенной группы изобретений является фармацевтическая композиция, обладающая иммуногеропротекторным действием, содержащая в качестве активного начала эффективное количество пептида глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1] и фармацевтически приемлемый носитель. При этом фармацевтическая композиция находится в форме, подходящей для парентерального введения.
Другой аспект настоящего изобретения касается пептида глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1].
Обнаружено, что пептид глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1] обладает иммуногеропротекторным действием. Предлагается применение пептида глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1] для приготовления лекарственного средства, обладающего иммуногеропротекторным действием.
Следующий аспект настоящего изобретения касается способа профилактики и коррекции возрастных нарушений клеточного и гуморального иммунитета путем стимулирования процессов пролиферации и дифференцировки лимфоцитов, заключающегося во введении пациенту фармацевтической композиции, содержащей в качестве активного начала пептид глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH последовательности 1 [SEQ ID NO:1] в дозе 0,01-100 мкг/кг массы тела, по крайней мере, один раз в день в течение периода, необходимого для достижения терапевтического эффекта. При этом введение осуществляют парентерально.
Пептид глутамил-аспартил-пролин общей формулы: H-Glu-Asp-Pro-OH получают классическим методом пептидного синтеза в растворе.
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера, полученные в процессе проведения исследований по методикам, принятым в данной области.
Пептид глутамил-аспартил-пролин со следующей аминокислотной последовательностью: H-Glu-Asp-Pro-OH, проявляет биологическую активность, а именно обладает иммуногеропротекторным действием путем стимулирования процессов пролиферации и дифференцировки лимфоцитов за счет восстановления синтеза тканеспецифических белков, нормализации метаболических и молекулярно-генетических показателей при возрастных нарушениях клеточного и гуморального иммунитета.
Стимулирующее действие пептида H-Glu-Asp-Pro-OH на функциональную активность лимфоцитов выявлено при его экспериментальном изучении.
Изучение биологической активности пептида H-Glu-Asp-Pro-OH проводили на эксплантатах тимуса, в культуре эпителиальных клеток тимуса, в экспериментальной модели радиационного старения и на лимфоцитах пациентов старческого возраста.
Понятие «фармацевтическая композиция» подразумевает различные лекарственные формы, содержащие пептид H-Glu-Asp-Pro-OH, которые могут найти лечебное применение в медицине в качестве средства, обладающего иммуногеропротекторным действием.
Для получения фармацевтических композиций, отвечающих изобретению, эффективное количество пептида H-Glu-Asp-Pro-OH как активное начало смешивают с фармацевтически приемлемым носителем согласно принятым в фармацевтике способам компаундирования.
Понятие "эффективное количество" подразумевает использование такого количества активного начала, которое в соответствии с его количественными показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной лекарственной форме.
Носитель может иметь различные формы, которые зависят от лекарственной формы препарата, желаемой для введения в организм.
Для парентерального введения носитель обычно включает физиологический раствор или стерильную воду, хотя могут быть включены другие ингредиенты, способствующие стабильности, или для сохранения стерильности.
Сущность изобретения поясняется фигурами и таблицами.
На Фиг.1 показано влияние пептида H-Glu-Asp-Pro-OH на развитие эксплантатов тимуса старых крыс.
На Фиг.2 показано влияние пептида H-Glu-Asp-Pro-OH на развитие эксплантатов селезенки старых крыс.
В Таблице 1 представлено влияние пептида H-Glu-Asp-Pro-OH на пролиферацию тимусных эпителиальных клеток, подвергшихся 1, 4 и 7 пассажам.
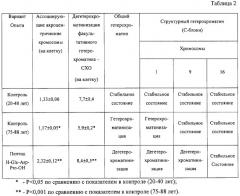
В Таблице 2 представлено влияние пептида H-Glu-Asp-Pro-OH на хроматин в лимфоцитах лиц старческого возраста.
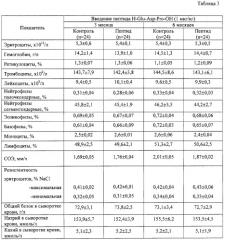
В Таблице 3 представлено влияния пептида H-Glu-Asp-Pro-OH на морфологические и биохимические показатели периферической крови морских свинок при изучении токсичности.
В Таблице 4 представлено влияние пептида H-Glu-Asp-Pro-OH на показатели клеточного и гуморального иммунитета у лиц пожилого и старческого возраста, подвергшихся воздействию малых доз ионизирующего излучения.
Изобретение иллюстрируется примером синтеза пептида формулы глутамил-аспартил-пролин (H-Glu-Asp-Pro-OH) (пример 1), примерами испытания биологической активности пептида (примеры 2, 3, 4, 5, 6), примером токсичности (пример 7) и примером результатов клинического применения пептида, демонстрирующим его фармакологические свойства и подтверждающим возможность достижения терапевтического эффекта (пример 8).
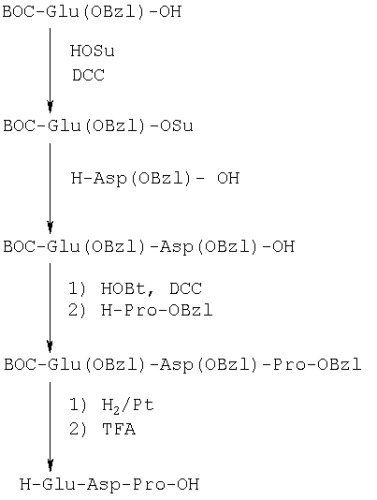
Пример 1. Синтез пептида H-Glu-Asp-Pro-OH
1. Название соединения: глутамил-аспартил-пролин.
2. Структурная формула:
H-Glu-Asp-Pro-OH
3. Брутто-формула без противоиона: C14H21N3O8.
4. Молекулярный вес без противоиона: 359,33.
5. Противоион: ацетат.
6. Внешний вид: белый аморфный порошок без запаха.
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме:
BOC - трет.бутилоксикарбонильная группа,
OSu - N-оксисукцинимидный эфир,
DCC - N,N'-дициклогексилкарбодиимид,
OBzl - бензиловый эфир,
TFA - трифторуксусная кислота,
HOBt - N-оксибензотриазол.
6. Характеристики готового препарата:
- содержание основного вещества: 97,19% (по ВЭЖХ, 220 нм),
- ТСХ - индивидуален, Rf=0,67 (ацетонитрил-вода 2:1),
- содержание влаги: 6%,
- рН 0,01% раствора: 4,7,
- Удельное оптическое вращение: [α]D 22: -29°(с=1, H2O), "Polamat A", Carl Zeiss Jena.
Пример синтеза:
1) BOC-Glu(OBzl)-OSu, N-оксисукцинимидный эфир N-трет.бутилоксикарбонил-(γ-бензил)глутаминовой кислоты (I).
N-трет.бутилоксикарбонил-(γ-бензил)глутаминовую кислоту BOC-Glu(OBzl)-OH (33,7 г, 0,1 моль) растворяли в 50 мл N,N'-диметилформамида, охлаждали до температуры -10°С, добавляли при перемешивании охлажденные (4-6°С) растворы N,N'-дициклогексилкарбодиимида (23,0 г, 0,11 моль) в 30 мл N,N'-диметилформамида и N-гидроксисукцинимида (13,0 г, 0,11 моль) в 20 мл N,N'-диметилформамида. Реакционную смесь перемешивали в течение 12 ч при охлаждении льдом и далее в течение суток при комнатной температуре. Выпавшую N,N'-дициклогексилмочевину отфильтровывали и полученный раствор активированного эфира использовали без выделения на следующей стадии.
2) BOC-Glu(OBzl)-Asp(OBzl)-OH, N-трет.бутилоксикарбонил-(γ-бензил)глутамил-(β-бензил)аспартат (II).
(β-Бензил)аспарагиновую кислоту H-Asp(OBzl)-OH (28,0 г, 0,12 моль) и 36 мл (0,12 моль) триэтиламина суспендировали в 50 мл N,N'-диметилформамида и перемешивали в течение 1 ч. Затем добавляли порциями раствор активированного эфира ВОС-Glu(OBzl)-OSu (I), полученный на предыдущей стадии. Реакционную смесь перемешивали при комнатной температуре в течение 2 суток. Затем подкисляли 0,5 н. серной кислотой до рН 2-3 и экстрагировали этилацетатом 4×50 мл. Вытяжки объединяли и последовательно промывали 0,5 н. Н2SO4 3×50 мл, водой 2×50 мл, 5% раствором NaHCO3 2×50 мл, водой 2×50 мл, насыщенным раствором NaCl 2×50 мл. Органический слой сушили над Na2SO4, упаривали растворитель в вакууме, остаток кристаллизовали под гексаном. Получено 50 г продукта (92%). Rf=0,34 (бензол-ацетон 2:1).
3) BOC-Glu(OBzl)-Asp(OBzI)-Pro-OBzl (III), бензиловый эфир N-трет.бутилоксикарбонил-(γ-бензил)глутамил-(β-бензил)аспартил-пролина (III).
1,2 г (2,2 ммоль) дипептида и 0,40 г (3 ммоль) оксибензотриазола растворяли в тетрагидрофуране (5 мл) и охлаждали до температуры -10°С. 0,62 г (3 ммоль) дициклогексилкарбодиимида растворяли в 5 мл тетрагидрофурана и охлаждали до той же температуры. 0,84 г (3,5 ммоль) тозилата бензилового эфира пролина растворяли в 10 мл тетрагидрофурана, добавляли 0,5 мл (3,5 ммоль) триэтиламина и охлаждали до той же температуры. При охлаждении на ледяной бане и интенсивном перемешивании объединяли растворы дипептида с оксибензотриазолом и карбодиимида, через 10 мин добавляли раствор тозилата бензилового эфира пролина. Реакционную смесь перемешивали в течение 3 ч при охлаждении льдом и в течение 1 суток при комнатной температуре. Выпавшую дициклогексилмочевину отфильтровывали, фильтрат упаривали в вакууме, остаток растворяли в этилацетате (100 мл). Раствор промывали последовательно 0,5 н. серной кислотой, водой, 5% раствором бикарбоната натрия, водой, сушили над безводным сульфатом натрия. Этилацетат упаривали в вакууме, кристаллизовали остаток в системе этилацетат/гексан. Перекристаллизацию проводили из изопропанола. Получено после сушки в вакууме 0,83 г продукта (65%). Rf=0,86 (бензол-ацетон 1:1).
4) H-Glu-Asp-Pro-OH (IV), глутамил-аспартил-пролин.
Защищенный трипептид BOC-Glu(OBzl)-Asp(OBzl)-Pro-OBzl (III) (0,8 г) растворяли в смеси метиловый спирт-вода (3:1) (20 мл) и гидрировали над катализатором Pd/C (5%) в течение 4 ч. Катализатор отфильтровывали, растворитель упаривали в вакууме, остаток сушили в вакууме над КОН и P2O5. Далее продукт растворяли в 10 мл смеси хлористый метилен-трифторуксусная кислота (5:1) и выдерживали при комнатной температуре в течение 2 ч. Полноту прохождения реакции деблокирования контролировали по ТСХ в системе ацетонитрил-вода (1:3). Растворитель упаривали в вакууме, остаток сушили в вакууме над КОН.
Для очистки 290 мг препарата растворяли в 4 мл 0,01% трифторуксусной кислоты и подвергали высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50×250 мм Diasorb-130-C16T, 7 mkm. Хроматограф Beckman System Gold, 126 Solvent Module, 168 Diode Array Detector Module. Условия хроматографирования: А: 0,1% TFA; В: MeCN/0,l% TFA, градиент В 0→50% за 100 мин. Объем пробы 5 мл, детекция при 215 нм, сканирование при 190-600 нм, скорость потока 10 мл/мин. Отбирали фракцию основного пика. Растворитель упаривали в вакууме при температуре не выше 40°С, упаривание многократно (не менее 5 раз) повторяли с 10 мл 10% раствора уксусной кислоты.
Окончательно остаток растворяли в 20 мл деионизованной воды и лиофилизовывали. Получено 125 мг очищенного препарата в виде аморфного белого порошка без запаха.
5) Анализ готового препарата.
- Содержание основного вещества определяли методом ВЭЖХ на колонке Phenomenex С 18 LUNA 4,6×150 mm. A: 0,1% TFA, В: MeCN; grad.B 0-100% in 10 min. Скорость потока 1 мл/мин. Детекция при 220 нм, сканирование 190-600 нм, проба 20μl. Содержание основного вещества 97,19%.
- ТСХ: индивидуален, Rf=0,67 (ацетонитрил-вода 2:1, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление хлор/бензидин).
- Содержание влаги: 6% (гравиметрически по потере массы при сушке 20 мг при 100°С).
- рН 0,01% раствора: 4,7 (потенциометрически).
- Удельное оптическое вращение: [α]D 22: -29°(с=1, H2O), "Polamat A", Carl Zeiss Jena.
Пример 2. Влияние пептида H-Glu-Asp-Pro-OH на развитие эксплантатов тимуса и селезенки старых крыс
Эксперименты проведены на 35 фрагментах тимуса и 45 фрагментах селезенки крыс в возрасте 24 мес. Питательная среда для культивирования эксплантатов состояла из 35% раствора Игла, 25% фетальной сыворотки теленка, 35% раствора Хенкса, 5% куриного эмбрионального экстракта, в среду добавляли глюкозу (0,6%), инсулин (0,5 ед./мл), пенициллин (100 ед./мл), глютамин (2 мМ). Фрагменты тимуса и селезенки помещали в эту среду и культивировали в чашках Петри в термостате при 36,7°С в течение 2 суток.
В экспериментальную среду добавляли пептид H-Glu-Asp-Pro-OH в концентрациях 0,5,10 и 100 нг/мл.
Критерием биологической активности служил индекс площади (ИП) - соотношение площади всего эксплантата вместе с зоной роста к исходящей площади фрагмента тимуса или селезенки. Значения ИП выражали в процентах, контрольное значение ИП принималось за 100%.
Установлено, что через 1 сутки культивирования происходило распластывание эксплантатов на коллагеновой подложке и начиналось выселение пролиферирующих и мигрирующих клеток по периферии эксплантата. На 3-и сутки культивирования при концентрации пептида 0,5 нг/мл наблюдалось достоверное повышение ИП эксплантатов тимуса на 24% по сравнению с контрольными значениями ИП (Фиг.1). При исследовании эксплантатов тимуса на более длительных сроках культивирования (7 дней) было выявлено аналогичное стимулирующее действие пептида в той же концентрации.
При культивировании эксплантатов селезенки с пептидом H-Glu-Asp-Pro-OH наблюдалось достоверное повышение ИП эксплантатов на 28% при концентрации пептида 10 нг/мл (Фиг.2). При исследовании на 7-е сутки культивирования было выявлено стимулирующее действие пептида в той же концентрации, но менее выраженное.
Таким образом, в отношении тканей тимуса и селезенки старых крыс пептид Н-Glu-Asp-Pro-OH оказывал тканеспецифическое действие, проявляющееся в стимуляции роста эксплантатов.
Пример 3. Влияние пептида H-Glu-Asp-Pro-OH на продукцию лимфоцит-активирующих факторов у мышей разного возраста
Одним из информативных показателей, характеризующих функции иммунной системы, является изменение продукции мононуклеарными фагоцитами лимфоцит-активирующих факторов (ЛАФ), включающих цитокины ИЛ-1, ИЛ-6 и ФНОα.
Изучали особенности продукции ЛАФ перитонеальными макрофагами у молодых и стареющих мышей, а также действия на нее пептида H-Glu-Asp-Pro-OH. ЛАФ-активность макрофагов оценивали по их способности оказывать комитогенное действие на пролиферацию тимоцитов, стимулированных субоптимальными дозами пектинов в условиях in vitro.
Установлено, что резидентные макрофаги стареющих, 19-20-ти месячных, мышей, так же как и молодых, 2-х месячных, животных, не продуцируют ЛАФ без дополнительной стимуляции. Выделение ЛАФ макрофагами после их стимуляции ЛПС менее выражено у стареющих мышей, чем у молодых животных.
Результаты исследования показали, что пептид H-Glu-Asp-Pro-OH, вносимый в культуральную среду в последовательных разведениях до конечной концентрации от 0,5 до 500 нг/мл, индуцирует продукцию ЛАФ нестимулированными перитонеальными макрофагами стареющих мышей и усиливает продукцию ЛАФ под влиянием ЛПС. Такая же тенденция в изменении продукции ЛАФ макрофагами наблюдалась при действии на них пептида H-Glu-Asp-Pro-OH и у молодых мышей, но не во всем диапазоне использованных концентраций.
Результаты исследования показали, что изменение продукции ЛАФ макрофагами является одним из механизмов нарушений функций иммунной системы при старении, вследствие чего пептид H-Glu-Asp-Pro-OH может применяться для их коррекции.
Пример 4. Влияние пептида H-Glu-Asp-Pro-OH на пролиферативную активность эпителиальных клеток тимуса при старении клеточных культур
Исследование проводили in vitro в культуре тимусных эпителиальных клеток, в качестве которых использовали клетки суспензионной линии VTEC2.H/S, полученной путем трансформации тимусных эпителиальных клеток эмбрионального тимуса человека материалом, содержащим вирус SV40, и последующего клонирования трансформированных клеток.
Пептид H-Glu-Asp-Pro-OH вводили в культуры клеток в последовательных разведениях до конечных концентраций 2, 20 и 200 нг/мл. Пролиферацию тимусных эпителиальных клеток, прошедших 1, 4 и 7 пассажей, оценивали радиометрическим методом по включению 3H-тимидина.
Установлено, что пептид H-Glu-Asp-Pro-OH в трех испытанных концентрациях существенно усиливал пролиферацию тимусных эпителиальных клеток, особенно в 7 пассаже, причем наиболее выраженным был эффект пептида в концентрации 200 нг/мл (Таблица 1).
Полученные данные свидетельствуют о способности пептида H-Glu-Asp-Pro-OH усиливать пролиферацию тимусных эпителиальных клеток в старых культурах, что подтверждает иммуногеропротекторное действие пептида.
Пример 5. Влияние пептида H-Glu-Asp-Pro-OH на клетки тимуса крыс при преждевременном старении, вызванном воздействием ионизирующего излучения
Эксперименты выполнены на 40 самцах белых крыс линии Вистар в возрасте 2-х месяцев, имеющих массу тела 180-200 г. Для моделирования преждевременного старения использовали гамма-облучение на аппарате ЛУЧ-1 (источник 60Со; мощность дозы 17,166×10-4 Гр/с). Животные получали ежедневную дозу 6 Гр в течение 5 дней. Все животные были разделены на 6 групп:
1 и 1a - интактные крысы;
2 и 2а - облученные крысы;
3 и 3а - облученные животные, которым вводили пептид H-Glu-Asp-Pro-OH подкожно через 24 часа после первого сеанса облучения по 0,5 мкг на животное в 0,5 мл стерильного 0,9% физиологического раствора NaCl в течение 10 дней.
Животным 2 и 2а групп вводилось эквивалентное количество стерильного физиологического раствора по той же схеме. Умерщвление животных и выделение тимуса проводили под нембуталовым наркозом (50 мг/кг). Тимус у животных 1-3 групп брали на 14 сутки от начала эксперимента, а у 1а-3а групп - на 21 сутки от начала эксперимента.
Для свето-микроскопических исследований кусочки тимуса фиксировали в течение 24 ч в кислой жидкости Буэна. Обезвоживание материала и заливка в парафин проводились по общепринятым методикам. Парафиновые срезы (7 мкм) помещали на предметные стекла, покрытые пленкой из поли-L-лизина (Sigma). Общегистологическое и иммуногистохимическое изучение проводили с использованием микроскопа Jenamed-2 (Zeiss). Обзорную окраску препаратов осуществляли гематоксилином - эозином. Тучные клетки селективно окрашивали 1% раствором толуидинового синего (Fluka) в 0,5 М HCl при рН 0,5.
Для электронной микроскопии кусочки тимуса фиксировали по Карновскому. Обезвоживание материала и заливку в смесь эпонов проводили по общепринятым методикам. Ультратонкие срезы (100 нм), приготовленные на ультрамикротоме LKB-7A (LKB), контрастировали уранил-ацетатом и цитратом свинца. Электронно-микроскопическое исследование осуществляли в электронном микроскопе JEM-100S (Jeol).
Для изучения пролиферативной активности клеток использовали мышиные моноклональные антитела к пролиферативному клеточному ядерному антигену (proliferative cell nuclear antigen - PCNA, клон PC 10, Calbiochem, титр 1:50). Визуализацию иммуногистохимической реакции проводили авидин-биотин-пероксидазным методом с использованием набора для выявления мышиных иммуноглобулинов (ABP-kit, Vectastain).
Морфометрические исследования выполнены с помощью системы компьютерного анализа микроскопических изображений Imstar с применением пакета лицензионных программ Morphostar и Colquant-2, согласно основным принципам стереологии и морфометрии. Для каждого животного подсчет соответствующих структур проводили в 10 визуальных полях зрения по трем срезам. Тестовая площадь включала не менее 10000 ядер тимоцитов. Тучные клетки в тимусе измеряли на площади не менее 5 мм2. Индекс пролиферативной активности (I PCNA) вычисляли по формуле: IPCNA(%)=NPCNA/Nядер×100.
При световой микроскопии на гистологических срезах, окрашенных гематоксилином-эозином, тимус контрольных животных имеет дольчатое строение. Форма и размеры долек вариабельны. Между дольками видны тонкие прослойки соединительной ткани, содержащие мелкие кровеносные сосуды. В дольках отчетливо различаются расположенное снаружи корковое вещество и центрально расположенное мозговое вещество.
Внутри коркового слоя находятся, главным образом, неделящиеся малые тимусные лимфоциты, расположенные между эпителиальными клетками коры. Эпителиальные клетки немногочисленны, имеют звездчатую форму за счет длинных и тонких цитоплазматических отростков, которые, соединяясь друг с другом, образуют сеть, в которой располагаются тимоциты коркового вещества. Тимоциты имеют округлое хорошо окрашенное ядро с ядрышками. В мозговом веществе количество лимфоцитов существенно меньше, чем в корковом, а клеточный состав представлен в основном эпителиальными клетками.
На 14-е и 21-е сутки после облучения (2, 2а группы) на гистологических срезах, окрашенных гематоксилин-эозином, отмечается нарушение структурной организации тимуса, выражающееся, прежде всего, в атрофических изменениях. Количество долек и их размеры значительно уменьшены. Деление на корковое и мозговое вещество стирается, граница между слоями фактически исчезает. В мозговом веществе незначительно увеличено содержание лимфоцитов. Соотношение между паренхимой и стромой нарушено в сторону увеличения последней. Кортикальные тимоциты представлены преимущественно большими и средними лимфоцитами. В тельцах Гассаля отмечается распад и дегенерация клеток.
При микроскопическом анализе препаратов тимуса животных, которым после первого сеанса облучения вводился пептид H-Glu-Asp-Pro-OH (3, 3а группы), отмечались менее выраженные инволютивные изменения по сравнению с животными 2 и 2а групп.
Электронно-микроскопическое изучение тимуса животных контрольных групп показало, что в корковом веществе долек тимоциты образуют скопления, состоящие из клеток, имеющих сходные размеры и морфологическую структуру. Эти клетки имеют крупные ядра с конденсированным по периферии хроматином, одним-двумя ядрышками крупного размера, и узкий ободок цитоплазмы, содержащий небольшое число митохондрий и полирибосом. Среди этих клеток встречаются крупные тимоциты, имеющие более широкий ободок цитоплазмы и содержащие большое число митохондрий, так называемые активированные лимфоциты.
Тучные клетки встречаются в междольковой соединительной ткани, вблизи кровеносных сосудов. Ретикуло-эпителиальные клетки, которые чаще хорошо видны в мозговом веществе долек, имеют отростчатую форму, рыхлое ядро неправильной формы и цитоплазму, богатую канальцами эндоплазматического ретикулума.
При радиационном старении у животных 2 группы среди наиболее выраженных изменений в тимусе отмечены следующие: отслоение участков наружной ядерной мембраны, нарушение тесных контактов между отдельными тимоцитами. Однако облучение не уменьшает числа делящихся тимоцитов, находящихся на разных стадиях митоза.
Среди тучных клеток наблюдаются различия в реакции на облучение. Так, одни клетки не отличаются по своей структуре от мастоцитов контрольных животных, тогда как в других наблюдается образование обширных вакуолей, в которых одновременно может находиться до десятка секреторных гранул различной степени электронной плотности, отражающей разные стадии лизиса секреторного материала. В ретикуло-эпителиальных клетках наблюдается заметное отслоение наружной мембраны, расширение мембран эндоплазматического ретикулума, появление многочисленных мелких вакуолей, набухание и лизис крист митохондрий.
На 21 день после начала эксперимента у животных при радиационном старении (группа 2а) в корковом веществе долек тимуса не наблюдается выраженных изменений по сравнению с группой 2.
У животных, которым вводился пептид H-Glu-Asp-Pro-OH, в модели радиационного старения на 14 сутки от начала облучения выраженных изменений со стороны тимоцитов не отмечено. В корковом веществе тимуса они располагаются, тесно прилегая друг к другу, имеют относительно одинаковые по размеру ядра с одним - двумя ядрышками. Ободок цитоплазмы очень тонкий, встречаются единичные митохондрии, в которых хорошо просматриваются кристы. В ретикуло-эпителиальных клетках наблюдается слабо выраженное отслоение кариолеммы и уменьшение вакуолизации цитоплазмы.
На 21 сутки после облучения у животных, получавших пептид H-Glu-Asp-Pro-OH (группа 3а) обращает на себя внимание скопление тучных клеток не только в междольковой соединительной ткани, но и в корковом веществе долек тимуса. При электронно-микроскопическом исследовании тимуса облученных животных, получавших пептид H-Glu-Asp-Pro-OH, в корковом веществе появляются гранулярные лейкоциты, а также плазматические клетки, располагающиеся небольшими группами. Ретикуло-эпителиальные клетки не обнаруживают выраженных морфологических изменений, но количество секреторных гранул в их цитоплазме снижается.
Таким образом, проведенные исследования показали, что после фракционированного облучения в диапазоне сублетальных доз, моделирующего преждевременное старение, в тимусе животных, получавших пептид H-Glu-Asp-Pro-OH, выявляются особенности структурно-функциональной организации, проявляющиеся в основном на ультраструктурном уровне. Инфильтрация коркового вещества зернистыми лейкоцитами и плазматическими клетками при этом, возможно, связана именно с интенсификацией репаративных процессов, так как известно, что гранулоциты чувствительны к активации различными гуморальными и клеточными факторами. Скопление тучных клеток в корковом веществе может быть вызвано тем, что для окончательной дифференцировки мастоцитов требуется присутствие ИЛ-3, продуцируемого Т-лимфоцитами.
При компьютерном анализе микроскопических изображений в 1 группе установлено, что основная популяция пролиферирующих клеток в тимусе интактных животных (IPCNA=26%) располагается в корковом веществе с тенденцией концентрироваться в периферической зоне долек, контурированных соединительнотканными перегородками. В тимусе животных контрольной группы тучные клетки составляют относительно небольшую фракцию клеток (16±2 на 1 мм2) и сосредоточены в виде характерных цепочек в тонких соединительнотканных перегородках. Во 2 группе PCNA-позитивные ядра сосредоточены преимущественно в периферической зоне редуцированных долек. Обращает на себя внимание увеличение числа тучных клеток в соединительнотканных перегородках (27±3). Высокий IPCNA и гиперплазия тучных клеток свидетельствуют о начавшемся периоде пострадиационного восстановления тимуса. В 3 группе под воздействием пептида H-Glu-Asp-Pro-OH в тимусе регистрируется активизация восстановительных процессов по индексам пролиферации. IPCNA достигает 55%. Пролиферативная активность в экстрамедуллярных зонах кроветворения. Обращает на себя внимание увеличение числа тучных клеток в тимусе облученных животных после введения пептида H-Glu-Asp-Pro-OH (32±5).
Результаты проведенного компьютерного анализа микроскопических изображений показали, что у облученных животных, получавших пептид H-Glu-Asp-Pro-OH, усиливается пролиферативный потенциал клеток. Эти данные показывают, что пептид H-Glu-Asp-Pro-OH может оказывать положительное влияние на купирование отдаленных последствий облучения и тем самым оказывать иммуногеропротекторное действие в радиационной модели преждевременного старения.
Пример 6. Влияние пептида H-Glu-Asp-Pro-OH на хроматин в лимфоцитах крови людей старческого возраста in vitro
Известно, что необходимым условием для транскрипционной активности генов является активный хроматин. При старении происходит усиленный процесс гетерохроматинизации, сопровождающийся инактивацией активных ранее генов.
Изучали влияние пептида H-Glu-Asp-Pro-OH на систему хроматиновых доменов в культурах лимфоцитов лиц старческого возраста, в частности на реактивацию хроматина - дегетерохроматинизацию гетерохроматиновых спутничных нитей (активность синтетических процессов рибосомных генов), общего гетерохроматина, структурного гетерохроматина (изменчивость С-блоков 1, 9 и 16 хромосом) и факультативного гетерохроматина.
Исследования проводились на хромосомах 150 ФГА-стимулированных и 40 ФГА-нестимулированных культур лимфоцитов, полученных от 95 практически здоровых индивидов в возрасте 75-88 лет (контроль - 25 доноров в возрасте 20-40 лет). Изучали по 2 клеточные культуры от каждого индивида - интактную и с добавлением пептида H-Glu-Asp-Pro-OH в культуральную среду до конечной концентрации пептида 0,01 мкг/мл. Для изучения каждого параметра анализировали от 30 до 50 метафаз как интактных, так и обработанных пептидом культур лимфоцитов (по 10 культур).
Для определения активности рибосомных генов в интактных культурах и при действии пептида применяли методы Ag-бендирования и учета ассоциаций районов ядрышковых организаторов (РЯО) акроцентрических хромосом. Изменчивость уровня активности определяли путем сравнения двух биномиальных совокупностей.
Определяли полиморфизм структурного С-гетерохроматина 1, 9 и 16 хромосом. Для сравнительного анализа С-окрашенных хромосом интактных и обработанных пептидом культур применяли стандартную систему классификации, согласно которой размеры С-сегментов 1, 9, 16 хромосом сравнивали с коротким плечом 16 хромосомы и результаты распределяли на 5 категорий - а, b, с, d, е. Об изменчивости факультативного гетерохроматина судили по частоте сестринских хроматидных обменов (СХО) в интакных и обработанных пептидом лимфоцитах.
Анализ частоты выявляемости Ag-положительных РЯО показывает, что аргентофильность определенных акроцентриков различается в контрольных и обработанных пептидом культурах клеток (Таблица 2). Обнаружено, что количество Ag-положительные РЯО ассоциирующих акроцентриков на одну клетку в культурах, обработанных пептидом, статистически достоверно повышено по сравнению с показателями контрольных культур у лиц старческого возраста. Следует отметить, что под действием пептида H-Glu-Asp-Pro-OH происходило равномерное нарастание частоты ассоциаций DD-, DG- и GG-типов.
Повышение количества Ag-положительных РЯО и частоты ассоциаций акроцентрических хромосом в культурах лимфоцитов, подвергшихся действию пептида H-Glu-Asp-Pro-OH, свидетельствует о дегетерохроматинизации спутничных нитей, обусловливающей активацию рибосомных генов при старении.
Установлено, что пептид H-Glu-Asp-Pro-OH в лимфоцитах лиц старческого возраста разворачивает высшие уровни организации хроматина, дегетерохроматинизирует общий (факультативный и структурный) гетерохроматин (Таблица 2).
Данные гетероморфизма (уменьшение размеров крупных блоков) структурного гетерохроматина (С-сегменты) отдельно по 1, 9 и 16 хромосомам в интактных и обработанных пептидом H-Glu-Asp-Pro-OH лимфоцитах лиц старческого возраста представлены в Таблице 2. При воздействии пептидом H-Glu-Asp-Pro-OH гетероморфными оказались 1 и 9 хромосомы. При этом степень выраженности гетероморфизма для указанных хромосом статистически достоверна.
Известно, что 1 и 9 хромосомы отличаются выраженной вариабельностью абсолютного и относительного размеров С-гетерохроматина при некоторых патологиях и при действии химических веществ, в то время как распределение вариантов С-сегментов гетерохроматина по 16 хромосоме остается стабильным. Кроме того, отмечается достоверное увеличение С-сегментов 1 хромосомы (гетерохроматинизация прицентромерного гетерохроматина) у лиц старческого возраста.
Согласно полученным результатам воздействие пептида H-Glu-Asp-Pro-OH на лимфоциты обусловливает уменьшение размеров С-блоков 1 и 9 хромосом, что свидетельствует об избирательной способности пептида вызывать деконденсацию (дегетерохроматинизацию) структурного гетерохроматина в клетках лиц старческого возраста.
Пептид H-Glu-Asp-Pro-OH вызывал повышение частоты сестринских хроматидных обменов в клетках лиц старческого возраста (Таблица 2). Выявленное возрастание значений СХО в лимфоцитах лиц старческого возраста происходит за счет деконденсации гетерохроматинизированных эухроматиновых районов хромосом, обусловленной действием пептида H-Glu-Asp-Pro-OH.
Таким образом, пептид H-Glu-Asp-Pro-OH вызывает деконденсацию плотноупакованных фибрилл хроматина, что коррелирует с восстановлением экспрессии генов, репрессированных в результате гетерохроматинизации эухроматиновых районов хромосом при старении.
Пример 7. Изучение токсичности пептида H-Glu-Asp-Pro-OH
Общетоксическое действие пептида H-Glu-Asp-Pro-OH исследовали в соответствии с требованиями «Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ» (2000): острой токсичности при однократном введении препарата, а также подострой и хронической токсичности при длительном введении пептида.
Исследование по изучению острой токсичности проведено на 60 белых беспородных мышах-самцах массой 18-21 г. Животные были рандомизированно разделены на 6 равных групп. Препарат вводили животным однократно внутримышечно в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг в 0,25 мл стерильного 0,9% раствора NaCl. Животным контрольной группы в том же объеме вводили стерильный 0,9% раствор NaCl.
Исследования по изучению подострой токсичности проведено на 50 белых беспородных крысах-самцах с массой тела 170-210 г. Ежедневно однократно животным подопытных групп ввод