Способ получения водорода
Иллюстрации
Показать всеДанное изобретение относится к получению водорода и диоксида углерода. Способ включает следующие операции: а) окисление твердого вещества в первой реакционной зоне с получением водорода; b) переход окисленной формы твердого вещества в другую реакционную зону, в которую подают поток восстановителя, выбираемого из углеводородов, и его реакцию с потоком восстановителя с получением диоксида углерода; с) извлечение восстановленной формы твердого вещества и подача его в первую реакционную зону. При этом осуществляют подачу тепла с помощью дополнительного блока поддержания температурного режима, расположенного между двумя реакционными зонами, с использованием тепла, которое получается при дальнейшем окислении твердого вещества воздухом. Подачу тепла осуществляют предпочтительно в ходе одной из двух операций: (b) или (с). В твердом веществе присутствует по меньшей мере один окислительно-восстановительный элемент в виде бинарного соединения. Изобретение позволяет повысить эффективность процесса за счет подачи тепла в реакционные зоны с помощью дополнительного блока. 28 з.п. ф-лы, 6 ил., 6 табл.
Реферат
Данное изобретение относится к способу получения водорода, который по существу заключается в том, что твердое вещество подвергают окислению, а полученную таким образом окисленную форму обрабатывают углеводородом; суммарная реакция приводит к образованию водорода или веществ, которые легко можно преобразовать в водород, а также СО2, который получают в потоке в высокой концентрации, который можно удалить в откачиваемый резервуар или в океан.
Известно что водород образуется в качестве продукта многочисленных химических реакций, некоторые из которых используют для его получения. В способах, более интересных с промышленной точки зрения, процесс начинается с углеводородов или угля. Водород получают из углеводородов посредством различных процессов пиролиза и крекинга, а в основном - на нефтеперерабатывающих предприятиях при каталитическом реформинге или же в нефтехимии из синтез-газов (СО+H2), которые, в свою очередь, получают реакцией углеводородов с паром (паровой реформинг) или с кислородом (частичное окисление).
Реакция парового реформинга газообразного метана
СН4+Н2Опар.→СО+3Н2
является эндотермической, и обычно ее проводят при очень высоких температурах.
За первой операцией реформинга следует ввод пара для осуществления операций превращения с изменением соотношения оксида углерода и водорода (высоко- и низкотемпературной), декарбонизация посредством промывки, а также последующая очистка Н2 от остаточного СО посредством превращения СО в метан. На заводах с более совершенной технологией после первой операции превращения с изменением соотношения оксида углерода и водорода (при высокой температуре) блок АРД (адсорбции путем разности давлений) позволяет непосредственно отделить Н2.
Эффективность и величина капиталовложений в завод для получения H2 зависят в основном от соотношения Н2О/СН4, температуры на выходе с операции реформинга (800-900°С), конфигурации секции превращения с изменением соотношения оксида углерода и водорода, предварительного нагрева воздуха и эффективности блока АКД.
Прямое частичное окисление метана до синтез-газа
СН4+1/2 О2→СО+2Н2
может также протекать при умеренной температуре, но селективность реакции, которую трудно контролировать из-за присутствия реакции полного сгорания, ограничивает ее промышленное применение.
В настоящее время начинают широко применять способ, который включает сгорание метана до СО2 и H2O одновременно с реакцией реформинга СН4, который не прореагировал, посредством Н2О и CO2 (автотермический реформинг), так что экзотермичность одной реакции уравновешивается эндотермичностью другой. В последнем случае, однако, имеется недостаток использования чистого кислорода для сжигания метана, что требует запуска вспомогательного криогенного блока для отделения кислорода из воздуха.
Количество источников, иллюстрирующих вышесказанное, очень велико, и здесь дается ссылка на вводную часть патента США 4888131, как на перечень и сводку данных материалов.
Известно, что значение Н2 определяется тем фактом, что этот газ применяют как в переработке нефти (гидрокрекинг, гидроочистка), так и в нефтехимии (синтез МеОН, ДМЭ, NH3, углеводородов с помощью синтеза Фишера-Тропша).
Принятый в настоящее время способ реформинга топлива и особенно строгие технические требования по качеству продукта и содержанию серы в дизельном топливе приведут к все возрастающему спросу на Н2 со стороны нефтеперерабатывающих предприятий. Кроме того, имеется также возрастающий интерес к использованию водорода, как направлению энергетики, из-за его потенциальных характеристик как «чистого топлива», так как он не создает вредных выбросов и не производит CO2.
Итак, Заявитель обнаружил усовершенствованное в отношении технологии и осуществимое в промышленности решение для производства водорода высокой чистоты из воды и природных газов с преобразованием углерода из углеводородов по существу в CO2 в потоке с высокой концентрацией, без инертных продуктов.
Отличительной особенностью этого способа является производство газа в раздельных зонах для того, чтобы избежать ограничения изменения соотношения оксида углерода и водорода в водяном газе термодинамическими равновесными концентрациями или же применения высоких температур для конверсии метана, что в существующей практике рассматривается в качестве необходимых условий.
Фактически предмет данного изобретения относится к способу получения водорода, который основан на применении окислительно-восстановительного твердого вещества, которое при прохождении между двумя реакционными зонами восстанавливается в присутствии подходящего восстановительного потока, предпочтительно углеводорода в одной из этих зон и снова окисляется подходящим агентом в другой из них с образованием восстановленной формы окисляющего агента.
Другой отличительной особенностью способа по данному изобретению является применение Н2O и CO2 в качестве окисляющих агентов для твердого вещества. Это вещество, в свою очередь, отличается тем, что может существовать по меньшей мере в двух формах, более восстановленной форме и более окисленной форме, которые существенно различаются по содержанию кислорода и тем, что оно циклически и обратимо переходит от более восстановленной формы к более окисленной форме.
Таким образом, согласно данному изобретению водород получают способом, который включает следующие операции:
a) окисление твердого вещества в первой реакционной зоне;
b) переход окисленной формы твердого вещества в реакционную зону, в которую подают восстановительный поток, и его реакция с указанным восстановительным потоком;
c) извлечение восстановленной формы твердого вещества и подача его в первую реакционную зону;
d) подача тепла, осуществляемая предпочтительно в ходе одной из операций b)или с).
Этот способ может также включать другие операции в зависимости от степеней превращения и селективностей участвующих реакций; таким образом, водород получают посредством способа, который включает следующие операции:
- окисление твердого вещества в первой реакционной зоне; получение Н2 или СО в зависимости от окисляющего соединения;
- переход окисленной формы твердого вещества в последующую реакционную зону, в которой происходит восстановление твердого вещества посредством его реакции с углеводородом;
- извлечение восстановленной формы твердого вещества и подача его в последующую реакционную зону;
- подача газовой фазы, полученной в ходе восстановления твердого вещества, в соответствующую секцию разделения, которая позволяет осуществить более или менее полное отделение продуктов полного сгорания (CO2 и Н2O) от любого возможного непрореагировавшего углеводорода и от любых возможных образующихся побочных продуктов;
- возможная рециркуляция вышеуказанного газового потока в реакционную зону, в которой происходит восстановление оксида, и/или в дополнительную реакционную зону для осуществления полного превращения вышеуказанного потока в продукты полного сгорания (CO2 и Н2O);
- удаление из цикла продуктов полного сгорания (CO2 и Н2O), поступивших из секции очистки.
В то время как окислительно-восстановительное твердое вещество может быть выбрано из широкого круга соединений, которые будут описаны ниже в данном изобретении, окисляющий агент согласно способу по данному изобретению может состоять из Н2O, CO2 или их смеси; повторное окисление твердого вещества окисляющим агентом можно провести в одну операцию или посредством нескольких операций, включающих также, в дополнение к вышеуказанным окисляющим агентам, применение O2, воздуха или обогащенного воздуха по меньшей мере на одной из этих операций. Если окисляющий агент не превращается полностью в первой реакционной зоне, газовую фазу, полученную в этой реакционной зоне, можно отправить в систему охлаждения и разделения с отделением и рециркуляцией непрореагировавшего окисляющего агента в ту же реакционную зону.
Не вдаваясь в подробности механизма различных реакций, участвующих в процессе по данному изобретению и, естественно, не ограничивая его область, можно представить общие схемы превращений, осуществляемых вышеприведенными операциями (совместно с различными окислительно-восстановительными реакциями), следующим образом, при рассмотрении случая, когда в качестве окисляющих агентов используют соответственно Н2O и CO2, а в вышеуказанную зону восстановления в качестве углеводорода подают метан.
В первом случае происходит прямое получение водорода, в то время как во втором случае необходимо прибегнуть к традиционным технологиям, которые предоставляют простые и эффективные способы применения СО для получения водорода: например, посредством одной или более операций превращения с изменением соотношения оксида углерода и водорода
СО+Н2O↔CO2+Н2
с последующей очисткой Н2 в соответствии с вышеописанными способами.
В обоих случаях 1) и 2) процесс является эндотермическим и, следовательно, для процесса получения водорода предпочтительно, в дополнение к трем вышеописанным операциям, включать промежуточную операцию подвода необходимого тепла.
Обращаясь снова, с чисто иллюстративными целями, к схемам реакционных преобразований, которые, предположительно, происходят в отдельных реакционных зонах, вышеприведенные схемы 1) и 2) можно изобразить как результат следующих реакций:
в случае применения Н2О в качестве окисляющего агента и оксидов а качестве окислительно-восстановительных твердых веществ:
Me представляет собой элемент и окислительно-восстановительные элементы, присутствующие в твердом веществе, а х и у коррелируют с валентностью и состоянием окисления самого Me, причем х≥1 и у≥0.
В случае использования CO2 в качестве окисляющего агента:
Me, x и у имеют тот же смысл.
Переход формы окисления твердого вещества от 3 к 4 (или от 4 к 3) и от 5 к 6 (или от 6 к 5) соответственно проводят затем путем соответствующего подвода тепла, что, следовательно, является существенной операцией процесса производства водорода по данному изобретению: тепло, таким образом, может быть подведено прямо или косвенно, и задачей специалистов в данной области является решить, какую конкретную процедуру применить, причем любой выбор, естественно, включается в область данного изобретения.
Тепло можно подвести путем сжигания части образовавшегося водорода или путем сжигания метана, природного газа или других углеводородов, или даже путем использования тепла, которое получается при дальнейшем окислении твердого вещества воздухом.
Как часть, так и все тепло можно подводить преимущественно в отдельную реакционную зону посредством сжигания в более или менее разбавленном молекулярном кислороде (О2) продуктов неполного сгорания и, возможно, непрореагировавших углеводородов, присутствующих в газовом потоке, выходящем из реакционной зоны, где восстанавливается твердое вещество.
Опять-таки, на основе их опыта, специалисты в данной области будут предполагать и устанавливать оптимальные условия, также и в отношении реакций, на которых основан способ получения водорода по данному изобретению.
Твердыми веществами, которые можно использовать, являются такие вещества, которые, включая по меньшей мере один элемент Me, отличаются тем фактом, что Me выбран из элементов, которые имеют по меньшей мере два состояния окисления стабильные в условиях реакции, которые отличаются по содержанию кислорода и в том отношении, что они способны циклически переходить от более восстановленной формы к более окисленной форме и наоборот.
Можно использовать твердые вещества, содержащие один или более элементов в интервале от 20 до 80 мас.% сами по себе или в смеси с другими элементами, которые не подвергаются окислительно-восстановительным реакциям; полученную таким образом реакционноспособную фазу можно, в свою очередь, использовать саму по себе или соответственным образом распределенную в (или нанесенную на) таких соединениях, как оксид кремния, оксид алюминия или другие чистые оксиды, такие как оксиды магния, кальция, церия, циркония, титана, лантана, а также их смеси.
В зависимости от способов получения и очистки, посредством которых получают эти оксиды, в случае оксида церия или лантана обычно присутствуют редкоземельные элементы, такие как празеодим и тербий, а в случае оксида циркония - гафний. Некоторые из этих элементов, которые можно применять в качестве носителя или диспергирующей фазы, также подвергаются окислительно-восстановительным реакциям; это относится, например, к церию и празеодиму.
В твердом веществе могут также присутствовать второстепенные компоненты, называемые промоторами или активаторами; они обычно принадлежат к группе благородных металлов, таких как Pt, Pd, Au и Rh, предпочтительно в количестве в интервале от 0,01 до 2 мас.%, или, чаще, к переходным металлам, таким как, например, V, Cr, Mn, Ni, Nb, предпочтительно в количестве в интервале от 0,1 до 15 мас.%.
Окислительно-восстановительные элементы (Me), которые могут присутствовать в твердых веществах, которые следует использовать в способе по данному изобретению, предпочтительно выбирают из группы, включающей Се, Pr, Ni, Fe, V, Мо, W в виде солей, оксидов или ангидридов.
Эти окислительно-восстановительные элементы могут присутствовать в виде бинарных соединений, соответствующих формуле
где Me является одним или более элементом, выбранным из группы, включающей из Се, Fe, W, Ni;
или же в виде соединений, соответствующих формуле
где Me - один или более элемент, выбранный из группы, включающей Се, Pr, Со, Ni, Fe, Мо и W,
Z - один или более элемент, выбранный из группы, включающей Се, Zr, V и Мо; х≥1, у≥0 и z≥1.
Особые преимущества имеет использование твердых веществ, содержащих в качестве основного окислительно-восстановительного элемента Fe, предпочтительно в количестве в интервале от 20 до 60 мас.% Fe, в свою очередь, является предпочтительным в описанном процессе, если оно присутствует в твердом веществе в виде бинарного соединения совместно с бинарным соединением церия и/или тройных соединений, соответствующих формуле (8), где Me=Fe и Z=Се, конкретнее CeFeO3. Cr является особенно эффективным в качестве элемента-промотора в смесях бинарных или тройных соединений на основе Fe и Се. Наиболее широко применяемые тройные соединения при Me=Мо или Me=V выбирают из группы, включающей CoMoO4, NiMoO4, Fe2(MoO4)3, (NiCo)MoO4, Cr2(MoO4)3, MnMoO4 и Се2(МоО3)3, CoVOx, FeVOx, NiVOx и CrVOx.
Предпочтительная конфигурация способа включает подачу Н2О в первую реакционную зону (R1) с образованием чистого водорода. Получение CO2 происходит во второй реакционной зоне (R2), и, следовательно, образование этих двух видов газа не ограничено равновесием между компонентами водяного газа (WGS), которое обуславливает в целом технологию парового реформинга природного газа. Поток, выходящий из R2, состоит из воды и СО2, который после отделения от воды путем конденсации является единственным соединением, присутствующим в выходящем потоке. Таким образом, если требуется производить водород без выделения СО2, его удаление возможно при значительно более низкой стоимости, чем в случае парового реформинга, где следует применять операции изменения соотношения оксида углерода и водорода в водяном газе и отделение СО2 посредством промывки аминами.
Если операция восстановления материала дает, кроме СО2 и Н2О, еще СО и Н2, можно ввести секцию разделения, чтобы сделать процесс более гибким. Эта секция разделения может использовать различные известные технологии, такие как фракционированная конденсация, селективная абсорбция газ-жидкость с абсорбцией физического и/или химического типа, селективная абсорбция (газ - твердое вещество) с регенерацией путем изменения температуры или давления (APT/TSA, АРД/PSA) и использования мембран.
Наличие секции разделения имеет следующие преимущества:
- необязательно следует получать очень высокие степени превращения и селективности при сжигании углеводорода во второй реакционной зоне, что, следовательно, расширяет диапазон окислительно-восстановительных твердых веществ, которые можно применять;
- возможна работа всего цикла в относительно узких температурных интервалах и, следовательно, с ограниченными проблемами термического обмена между различными зонами, а также работа второй реакционной зоны при относительно умеренных уровнях температуры.
Этот способ является даже более гибким в том отношении, что восстановление твердого вещества можно осуществить с газами, содержащими СО+Н2 из различных источников. Таким образом, секция разделения позволяет также использовать для этой цели газ, выходящий из реактора R2, вновь направляя его в тот же реактор после удаления CO2 и Н2O. Этот газ возможно также подходящим образом рециркулировать в реактор R3 и сжечь его там, чтобы дополнить термический баланс. Этот поток можно также использовать в качестве топлива для получения электрической энергии посредством соответствующей системы газовая турбина/генератор электроэнергии или камера сгорания/получение пара/паровая турбина/генератор электроэнергии.
Углеводород, который подают в реакционную зону, в которой восстанавливается твердое вещество, может быть выбран из нескольких видов, принадлежащих к этой группе соединений, при этом особенное внимание следует уделить использованию алифатических углеводородов, в частности метана и природного газа, даже если для этой цели могут быть пригодны другие восстанавливающие агенты, такие как, например, отработанные газы химических заводов.
В случае, когда в качестве окисляющего агента применяют CO2, СО, образующийся в первой реакционной зоне, можно использовать сам по себе для химических применений, или же его можно использовать для получения водорода посредством, как уже упоминалось, одной или более операций превращения с изменением соотношения оксида углерода и водорода в паровой фазе.
В область данного изобретения включено также применение в первой фазе окисления окисляющего агента, состоящего из смеси Н2O и CO2; в этом случае получается синтез-газ.
Секция разделения может использовать различные способы разделения, такие как фракционированная конденсация, селективная абсорбция газ-жидкость, с абсорбцией как физического, так и/или химического типа, селективная адсорбция (газ - твердое вещество) с регенерацией под воздействием температуры или давления (АРД, APT) и при использовании мембран.
Дальнейшие подробности можно получить при рассмотрении следующих примеров, которые приведены для лучшего иллюстрирования данного изобретения, но никоим образом не ограничивают его область.
Пример 1
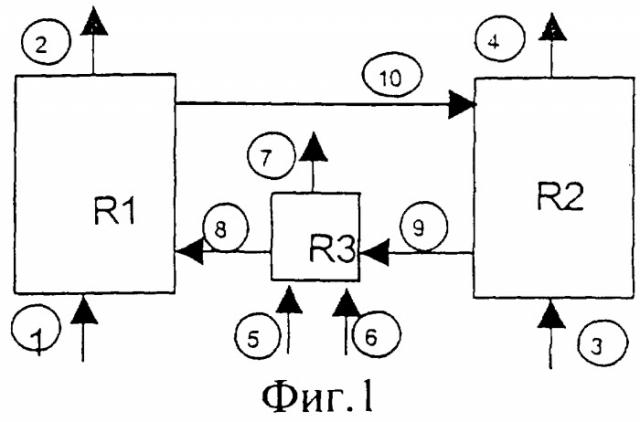
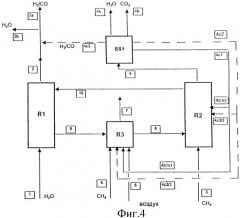
Ссылаясь на схему Фиг.1, R1 и R2 соответственно представляют собой первую реакционную зону (получение Н2) и вторую реакционную зону (восстановление оксида метаном), в то время как R3 представляет собой дополнительный блок поддержания температуры, где водород используют в качестве топлива (косвенный теплообмен).
В первую реакционную зону (R1) подают воду (линия 1) и получают Н2 (линия 2). Во вторую реакционную зону (R2) подают метан (линия 3), и образуются продукты его сгорания: диоксид углерода и вода (линия 4). В дополнительный блок (R3) поддержания температуры подают совместно водород (линия 5) и воздух (линия 6); при этом получают H2О и азот (линия 7).
Схема дополнена линиями перемещения вещества, которые соединяют три вышеупомянутые зоны и перемещают восстановленное твердое вещество, выходящее из R2, в дополнительный блок R3 поддержания температуры (линия 9), нагретое твердое вещество - в реактор получения водорода (линия 8), а окисленное твердое вещество - обратно в R2 (линия 10).
В принципе, предполагаемые реакции и относительный тепловой эффект реакций можно оценить следующим образом (D.Stull, E.Westrum. Термодинамика органических соединений):
| в R1 Н2О⇒H2 | ΔН=241,8 кДж/моль (57,8 ккал/моль) |
| в R2 CH4⇒CO2+2Н2О | ΔН=-801,9 кДж/моль (-191,7 ккал/моль) |
| в R3 1/2O2+Н2⇒Н2О | ΔН=-241,8 кДж/моль (-57,8 ккал/моль) |
| в R1 MeOx⇒MeO(x+1) | ΔН=-4,183Х кДж/моль (-X ккал/моль) |
| в R2 MeO(x+1) ⇒МеОх | ΔН=4,183Х кДж/моль (X ккал/моль), |
где Х - характеристика, связанная с химической природой твердого вещества. На основе известных термодинамических свойств, таких как теплота образования окисленной фазы и восстановленной фазы в равновесии друг с другом (Perry's Chem. Eng. Handbook), можно установить перечень элементов и количество тепла, связанное с окислительно-восстановительными реакциями, в которых они участвуют; при этом некоторые из них приведены с иллюстративными целями в Таблице 1 ниже.
Таблица 1 приводит реакцию, относящуюся к окислительно-восстановительному элементу, содержащемуся в твердом веществе, и теплоту образования двух форм, рассматриваемых при стандартных условиях: окисленной формы (DHox) и восстановленной формы (Dhred).
Известно, что при более точном определении тепло, поглощенное/выделенное при окислительно-восстановительной реакции твердого тела должно включать также количество тепла, связанное с изменением теплоемкости твердого вещества при постоянном давлении при изменении температуры, возникающем в массе реагента; однако это последнее количество тепла обычно невелико по сравнению с изменением теплоты образования, определенной при стандартных условиях, и, следовательно, DH°, приведенная в Таблице 1, дает достаточное приближение термодинамической характеристики материала и, таким образом, может использоваться для расчета массового и термического баланса, описанного ниже. Следует указать, однако, что это значение лишь приближается к термодинамической характеристике материала, если элемент, который образует носитель или диспергирующую фазу, сам не подвергается окислительно-восстановительной реакции или не реагирует с восстановленной и/или окисленной формой окислительно-восстановительного элемента с образованием других фаз или соединений с относительным выделением и/или поглощением теплоты образования, которая может быть прибавлена к теплоте образования окислительно-восстановительного элемента.
Также следует отметить, что реакции, приведенные в Таблице 1, являются теоретическими, и должна быть внесена поправка на реальный фактор сдвига окислительно-восстановительной реакции при используемых условиях эксперимента.
Возможность проведения экспериментальных измерений тепла, участвующего в обмене при окислительно-восстановительной реакции твердого вещества в условиях реакции, которые можно провести такими приборами как ДСК (дифференциальный сканирующий калориметр) или ДТА (дифференциальный термический анализатор), позволяет лучше определить приведенный ниже баланс.
| Таблица 1 | ||||
| Окисленная форма | Восстановленная форма | DHox «Дж/моль (ккал/моль) | DHred кДж/моль (ккал/моль) | DH°кДж/моль (ккал/моль) |
| А 2CeO2=1Се2O3+0,5O2 | -1037,0(-247,9) | -1819,2(-434,9) | 254,7(60,9) | |
| F 1Fe2O3=2FeO+0,5O2 | -822,0(-196,5) | -264,8(-63,3) | 292,4(69,9) | |
| G 1Fe3O4=3Fe+2O2 | -1111,8(-265,8) | 0(0) | 1111,8(265,8) | |
| Н 1Fe3O4=3FеО+0,5O2 | -1111,8(-265,8) | -815,7(-195) | 296,2(70,8) | |
| I 1МоО3=1MoO2+0,5O2 | -745,0(-178,1) | -589,0(-140,8) | 156,0(37,3) | |
| L 1NiO=1Ni+0,5O2 | -239,7(-57,3) | 0(0) | 239,7(57,3) | |
| М 2РrO2=1Pr2O3+0,5O2 | -961,7(-229,9) | -1822,5(-435,7) | 100,8(24,1) | |
| P 1V2O5=1V2O3+1O2 | -1551,5(-370,9) | -1218,5(-291,3) | 333,0(79,6) | |
| Q 1WO3=1WO2+0,5O2 | -842,5(-201,4) | -589,4(-140,9) | 253,1(60,5) |
Таким образом, можно установить массовый/тепловой баланс применительно к Фиг.1, который, предполагая справедливость всех вышеуказанных допущений и всех отдельных проведенных операций, отличается 100% эффективностью и может стать самосогласованным с термической точки зрения путем уравнивания эндотермичности реакционных зон 1 и 2 дополнительным блоком поддержания температурного режима.
Для баланса по массе, приведенного в таблице 2 по отношению к основным компонентам, в качестве основы для расчета было принято, что образуется 50 т/ч водорода (линия 2) при использовании элемента, имеющего термодинамические свойства, приведенные в строке 1 Таблицы 1 и в предположении, что этот оксид нанесен на подложку, составляющую 50 мас.%.
| Таблица 2 | ||||||||||
| Линия | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| т/ч | т/ч | т/ч | т/ч | т/ч | т/ч | т/ч | т/ч | т/ч | т/ч | |
| Н2 | 50 | 8,5 | ||||||||
| Н2О | 450 | 225 | 76,9 | |||||||
| СО2 | 275 | |||||||||
| СО | ||||||||||
| М | 3200 | 3200 | ||||||||
| МО | 3600 | |||||||||
| N2 | 222,4 | 222,4 | ||||||||
| O2 | 68,3 | |||||||||
| СН4 | 100 | |||||||||
| Носитель | 3200 | 3200 | 3200 | |||||||
| Итого | 450 | 50 | 100 | 500 | 8,5 | 290,7 | 299,3 | 6400 | 6400 | 6800 |
Из данных, приведенных в Таблице 2, можно видеть, что можно получить от 100 т/ч метана, чистое производство водорода составляет 41,5 т/ч (при 100% чистоте). 41,5 т/ч Н2 обеспечивается получением 50 т/ч в реакционной зоне 1 и потреблением 8,5 т/ч в блоке поддержания температурного режима; одновременно происходит образование концентрированного потока CO2 и H2O без инертных продуктов, который составляет 500 т/ч, при рециркуляции 6400-6800 т/ч твердого вещества между двумя реакционными зонами.
Таким образом, следует отметить, что преимущественным аспектом предлагаемого способа является получение газов в результате восстановления твердого вещества (СО2 и Н2О) и получение Н2 в раздельных зонах, что значительно снижает стоимость отделения и очистки водорода.
Если термодинамические характеристики твердого вещества известны, можно оценить термические уровни двух реакционных зон. Таблица 3, приведенная ниже, указывает температуры, относящиеся к линиям 8, 9 и 10, рассчитанные для нескольких значений DH°. Эти расчеты были проведены без учета (в первом приближении) ощутимого тепла газовых потоков и путем приписывания теплопереноса в системе только движению твердого вещества, которое характеризуется удельной теплоемкостью (Ср), равной 1,05 Дж/г/°С(0,25 кал/г/°С). В описанной ситуации из-за массового эффекта перенос тепла твердым веществом преобладает над теплом, связанным с газовыми потоками; более того, ощутимое тепло газовых потоков может быть извлечено путем соответственного теплового обмена между входящими и выходящими потоками двух реакционных зон.
| Таблица 3 | ||||
| DH° кДж/моль (ккал/моль) | Линия 8 (°С) | Линия 9 (°С) | Линия 10 (°С) | |
| А | 154,8(37) | 700 | 565 | 399 |
| В | 234,2 (56) | 700 | 657 | 691 |
| С | 255,2(61) | 600 | 539 | 618 |
| D | 292,8 (70) | 600 | 443 | 778 |
Можно видеть, что с изменением теплообмена по твердому веществу температурный профиль двух реакционных зон изменяется, достигая, например, в предположении использования элемента, имеющего термодинамические характеристики, приведенные в Таблице 3, строка В, по существу плоского профиля.
Следует также указать, что температура цикла получения водорода в целом ниже, чем температура, которая используется обычно в существующих способах получения водорода паровым реформингом или автотермическим реформингом метана, и это является еще одним преимущественным аспектом предложенного способа.
Пример 2
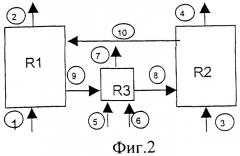
Применительно к схеме, приведенной на Фиг.2, R1 и R2 соответственно представляют собой первую реакционную зону (получение Н2) и вторую реакционную зону (восстановление оксида метаном), в то время как R3 представляет собой дополнительный блок поддержания температурного режима, в котором применяемым топливом является метан в качестве альтернативы водороду.
В первую реакционную зону (R1) входит вода (линия 1) и получается Н2 (линия 2) Метан (линия 3) подают во вторую реакционную зону (R2), и получаются продукты его сгорания: диоксид углерода и вода (линия 4). Метан (линия 5) и воздух (линия 6) совместно поступают в дополнительный блок (R3) поддержания температурного режима, и получаются Н2O, диоксид углерода и азот (линия 7).
Схема дополнена линиями переноса веществ, которые соединяют три вышеупомянутые зоны и перемещают восстановленное твердое вещество, выходящее из R2, в реактор получения водорода (линия 10), а окисленное твердое вещество в дополнительный блок R3 поддержания температурного режима (линия 9) и нагретое твердое вещество - снова в реактор R2 (линия 8).
При тех же предположениях, что и в примере 1, производство 50 т/ч (линия 2) требует 121 т/ч метана, который распределяется между реакцией восстановления (линия 3) и поддержанием температурного режима (линия 5). Из реактора R2 выходит поток 500 т/ч, состоящий из CO2 и Н2О. Твердое вещество имеет содержание способного к обратимому обмену кислорода около 6 мас.%. Состав различных потоков указан в Таблице 4. Температуры выходящих потоков составляют 534°С (линия 8), 399°С (линия 9) и 700°С (линия 10) соответственно.
Пример 3
При рассмотрении схемы, приведенной на Фиг.2, R1 и R2 представляют соответственно первую реакционную зону (получение СО) и вторую реакционную зону (восстановление оксида метаном), в то время как R3 представляет собой дополнительный блок поддержания температурного режима, в котором метан используется как топливо.
СО2 (линия 1) входит в первую реакционную зону (R1), и получается СО (линия 2). Метан (линия 3) подают во вторую реакционную зону (R2), и получаются продукты его сгорания: CO2 и Н2О (линия 4). Метан (линия 5) и воздух (линия 6) подают совместно в дополнительный блок (R3) поддержания температурного режима, и получают Н2О, диоксид углерода и азот (линия 7).
Для расчета состава различных потоков предполагали получение 140 т/ч монооксида углерода, из которого можно получить около 112000 Нм3 водорода при использовании обычных способов.
Принимая те же допущения, что и в примере 1, для указанного производства требуется около 28 т/ч метана. Твердое вещество имеет содержание способного к обратимому обмену кислорода около 6% мас.
Пример 4
При рассмотрении схемы, приведенной на Фиг.2, R1 и R2 представляют собой соответственно первую реакционную зону (получения Н2) и вторую реакционную зону (восстановление оксида метаном), в то время как R3 представляет собой дополнительный блок поддержания температурного режима, в котором водород используют в качестве топлива.
Воду подают (линия 1) в первую реакционную зону (R1) и получают Н2 (линия 2). Метан подают (линия 3) во вторую реакционную зону (R2) и получают продукты его сгорания: диоксид углерода и воду (линия 4). Водород (линия 5) и воздух (линия 6) подают совместно в дополнительный блок (R3) поддержания температурного режима и получают Н2O и азот (линия 7).
Для расчета состава различных потоков предполагают получение водорода 150000 Нм3/ч, равное 13,4 т/ч. Твердое вещество имеет содержание способного к обратимому обмену кислорода около 6 мас.%.
Потребление метана для получения в чистом виде 124373 Нм3/ч водорода составляет 37500 Нм3/ч, из которых 25627 Нм3/ч отправляют в блок поддержания температурного режима. Состав потоков указан в Таблице 4.
В случае предложенной схемы удельное потребление метана, измеряемое в энергии на объем Н2, равно 10,71 ГДж (2,56 Гкал) на получение в чистом виде 1000 Нм3 H2 при использовании величины теплотворной способности метана менее 35555,5 кДж/Нм3 (8500 ккал/Нм3); кроме того, удельное выделение СО2 равно примерно 300 Нм3 на 1000 Нм3 полученного Н2. Последнее значение представляет собой преимущественный аспект данного способа с позиций эффективности в отношении защиты окружающей среды, так как оно значительно ниже обычных значений для выделения CO2 в окружающую среду для других известных способов получения Н2. Например, паровой реформинг метана характеризуется удельной эмиссией CO2, которая обычно составляет более 360 Нм3 на 1000 Нм3 Н2 (Modern Production Technologies in Nitrogen 1997 CRU Publishing Ltd, стр.102-115).
| Таблица 4 | ||||||||||
| Линия | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Нм3/ч | Нм3/ч | Нм3/ч | Нм3/ч | Нм3/ч | Нм3/ч | Нм3/ч | т/ч | т/ч | т/ч | |
| Н2 | 150000 | 25627 | ||||||||
| Н2O | 150000 | 75000 | 25627 | |||||||
| СО2 | 37500 | |||||||||
| CO | ||||||||||
| М | 857 | |||||||||
| МО | 964 | 964 | ||||||||
| N2 | 47654 | 47654 | ||||||||
| O2 | 12814 | |||||||||
| CH4 | 37500 | |||||||||
| Носитель | 857 | 857 | 857 | |||||||
| Итог | 150000 | 150000 | 37500 | 112500 | 25627 | 60468 | 73281 | 1821 | 1821 | 1714 |
Пример 5 (сравнительный)
Нижеприведенная Таблица 5 указывает потребление энергии для различных конфигураций способа, связанных с производством водорода при паровом реформинге природного газа, которые можно применить на заводах с объемом производства Н2 до 566000 Нм3/ч; причем приведенные данные включают потребление энергии при использовании природного газа в качестве топлива и сырья (питания) и указаны для трех конфигураций типичных способов (Modern Production Technologies in Nitrogen 1997 CRU Publishing Ltd, стр.102-115), где базовый вариант характеризуется температурой на выходе реформинг-установки 850°С, отношением пара к углероду 3,2 и эффективностью блока АРД 86%. Из приведенных данных можно видеть, ч