Способ выявления парвовируса b19 человека в биологическом образце (варианты) и набор для его осуществления
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предложен способ выявления парвовируса В19 человека. Способ предусматривает выделение нуклеиновых кислот и амплификацию выделенных аминокислот с использованием смыслового и антисмыслового праймера. При этом выделение нуклеиновых кислот проводят путем взаимодействия биологического образца с твердой подложкой, включающей связанные с ней захваченные парвовирус-специфичные нуклеиновые кислоты. В качестве смысловых праймеров используют праймеры SEQ ID NO:60 и 88, а в качестве антисмысловых праймеров SEQ ID NO:59 и 89. Предложен также набор для осуществления такого способа. Изобретение позволяет выявлять парвовирус В19 человека в биологическом образце. Изобретение может быть использовано в медицине и вирусологии. 3 н. и 23 з.п. ф-лы, 12 ил., 1 табл.
Реферат
Область техники
Настоящее изобретение относится, главным образом, к диагностике вирусов. В частности, изобретение относится к анализам на основе нуклеиновой кислоты для точной диагностики инфекции, вызванной парвовирусом В19, а также к праймерам и зондам для применения в указанных анализах.
Предпосылки к созданию изобретения
Парвовирус В19 человека является членом семейства Parvoviridae, рода Erythrovirus и представляет собой маленький 22 нм двадцатигранный безоболочечный вирус с линейной одноцепочечной молекулой ДНК, состоящей приблизительно из 5600 нуклеотидов. Вирусный геном кодирует три главных белка, VP1, VP2 и NS1. См. Shade et al., J. Virol. (1986) 58:921-936 и фиг.1 в настоящей заявке. VP1 (83 кДа) и VP2 (58 кДа) представляют собой структурные капсидные белки. Указанные два белка кодируются в перекрывающихся рамках считывания приблизительно от нуклеотидов 2444 до 4789 и от 3125 до 4789, соответственно. VP2 составляет 95% капсида, а белок больших размеров VP1 - только 5% капсида. VP1 требуется для зрелой конформации вируса. NS1 (77 кДа) представляет собой неструктурный белок и присутствует только в ядерной фракции инфицированных клеток и отсутствует в цитоплазме и интактных вирионах в сыворотке крови.
Парвовирус В19 был первым вирусом, открытым в сыворотке здоровых доноров крови, и является единственным членом семейства Parvoviridae, известным как патогенный для человека. Данный вирус связан с обширным рядом болезненных проявлений. Парвовирус В19 человека обычно вызывает бессимптомную или умеренную самоограничивающуюся инфекцию у детей. У взрослых парвовирус В19 может вызывать сыпь, преходящую симметричную полиартралгию и артрит. Парвовирус В19 связан с преходящим апластическим кризисом (ТАС) у пациентов с имеющимися гемолитическими нарушениями. Сообщается о хронической инфекции В19 и персистирующей анемии у иммуноскомпрометированных пациентов с острым лейкозом, врожденными иммунодефицитами, СПИДом и состояниями после пересадки костного мозга. Парвовирус В19 также связан с внутриутробной гибелью плода у беременных женщин.
В большинстве стран инфицирование вирусом В19 обычно наблюдается в детстве; приблизительно 50% детей к 15-летнему возрасту имеют анти-В19 антитела. Распространенность антител против В19 может в дальнейшем возрастать в течение жизни и достигает величин более 90% среди лиц старшего возраста.
При инфицировании парвовирусом В19 человека первоначальная репликация вируса, как полагают, происходит в дыхательных путях. Затем вирус поражает клетки костного мозга. Это приводит к широкомасштабной репликации вируса с виремией, по сообщениям, от 102 до 1014 частиц/мл, наблюдающейся через 7-10 дней после инфицирования, но до появления симптомов. Исчезновение виремии совпадает с выявлением специфичных IgM антител, уровень которых остается повышенным в течение двух - трех месяцев. Анти-В19 IgG антитела выявляются спустя несколько дней после появления антител IgM и сохраняются в течение всей жизни.
Отсутствие липидной оболочки и ограниченное содержание ДНК делают парвовирус В19 крайне резистентным к физико-химической инактивации. Парвовирус В19, особенно в высокой концентрации, может выдерживать обычную тепловую обработку продуктов крови, и документально подтверждена передача В19 через введение препаратов фактора VIII, прошедшего обработку растворителем и детергентом, и факторов VIII и IX, прошедших тепловую паровую или сухую обработку.
Парвовирус В19 человека нельзя выращивать в обычных клеточных культурах, что делает лабораторное выявление и выделение вируса крайне трудным. Так, в течение многих лет единственным источником антигена являлась сыворотка крови пациентов с виремией. В качестве попытки обойти указанные проблемы для использования в серологических анализах были получены рекомбинантные антигены. См., например, Sisk и Berman, Biotechnology (1987) 5:1077-1080; патент США № 6204044. Иммуноферментные анализы с захватом IgM использовались для выявления анти-В19 IgM, а также для диагностики недавнего заражения В19. Диагностическая эффективность ряда имеющихся в продаже тестов, однако, неоднородна. Кроме того, диагностические тесты на основе IgM не могут обнаружить вирус на виремической стадии инфицирования, а после того, как антитела IgM синтезированы, они могут оставаться в кровотоке в течение нескольких месяцев после окончания виремии.
Большая распространенность антител против В19 в здоровой популяции, а также тот факт, что виремия высокой степени обычно сохраняется в течение только одной недели, делают использование тестов на серологической основе непрактичными. Помимо этого, у иммуноскомпрометированных пациентов серологический диагноз может быть ненадежным.
Для обнаружения В19 используются анализы на основе гибридизации нуклеиновой кислоты, такие как дот-блоттинг и гибридизация in situ. Указанные анализы обычно имеют пределы обнаружения от 1 до 0,1 пг вирусной ДНК (˜104-105 вирусных частиц). ПЦР имеет более высокую чувствительность (˜100 геномных копий). Однако методики гибридизации ДНК занимают много времени и ограничены в применении, а ПЦР является непрактичной для скрининга больших количеств образцов.
Следовательно, остается потребность в разработке надежных диагностических тестов для обнаружения парвовируса В19 в виремических образцах с целью предотвращения передачи вируса с препаратами крови и плазмы или путем близкого личного контакта.
Краткое описание существа изобретения
Настоящее изобретение основано на открытии уникальных праймеров и зондов для применения в анализах на основе нуклеиновой кислоты, а также на разработке чувствительного надежного диагностического теста на основе нуклеиновой кислоты для обнаружения парвовируса В19 в биологических образцах от потенциально инфицированных лиц. В методике, описанной в настоящей заявке, используется экстрагированная ДНК-образец в качестве матрицы для амплификации консервативных областей последовательности генома В19, с использованием опосредованной транскрипцией амплификации (ТМА), как в анализе с 5'-нуклеазой, таком как методика TaqManTM. Данные способы позволяют обнаруживать ДНК В19 в виремических образцах, имеющих такие низкие вирусные титры как 103 вирусных частиц/мл. Соответственно, инфицированные образцы можно идентифицировать и исключить из трансфузии, а также не использовать их для изготовления препаратов крови. Зонды и праймеры, описанные в настоящем изобретении, также пригодны, например, для стандартных гидридизационных методов, а также для методик на основе ПЦР, амплификации на основе последовательности нуклеиновой кислоты (NASBA) и анализов, в которых используются разветвленные молекулы ДНК.
Соответственно, в одном варианте осуществления настоящее изобретение относится к способу обнаружения инфицирования парвовирусом В19 человека в биологическом образце. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень РНК;
(b) взаимодействие выделенной нуклеиновой кислоты парвовируса В19 с первым олигонуклеотидом, который включает первый праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части последовательности-мишени РНК для образования с ней комплекса, причем первый праймер дополнительно включает промотор для ДНК-зависимой РНК-полимеразы 5' и функционально связан со способной образовывать комплекс последовательностью, причем взаимодействие происходит в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(с) изменение первого праймера в реакции изменения с использованием последовательности-мишени РНК в качестве матрицы, с получением первого продукта удлинения ДНК-праймера, комплементарного последовательности-мишени РНК;
(d) отделение первого продукта удлинения ДНК-праймера от последовательности-мишени РНК с использованием фермента, который избирательно расщепляет последовательность-мишень РНК;
(е) обработку продукта удлинения ДНК-праймера вторым олигонуклеотидом, который включает второй праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части продукта удлинения ДНК-праймера, чтобы образовывать с ней комплекс, в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(f) удлинение 3'-конца второго праймера в реакции удлинения ДНК с получением второго продукта удлинения ДНК-праймера, в результате чего получают матрицу для ДНК-зависимой РНК-полимеразы;
(g) использование матрицы для получения множества РНК-копий последовательности-мишени с использованием ДНК-зависимой РНК-полимеразы, которая распознает последовательность промотора;
и (h) использование РНК-копий со стадии (g) для аутокаталитического повторения стадий с (b) по (g) для амплификации последовательности-мишени.
В некоторых вариантах осуществления настоящего изобретения способ дополнительно включает стадии:
(i) добавление меченого олигонуклеотидного зонда к продукту стадии (h), причем олигонуклеотидный зонд является комплементарным части последовательности-мишени, в таких условиях, которые обеспечивают гибридизацию зонда с последовательностью-мишенью, с образованием комплекса зонд:мишень; и
(j) выявление наличия или отсутствия метки как показателя наличия или отсутствия последовательности-мишени.
В дополнительных вариантах осуществления настоящего изобретения метка представляет собой сложный эфир акридиния.
В еще одних вариантах осуществления настоящего изобретения первый и второй праймеры и зонд, используемые в описанных выше способах, получают из VP1 области генома парвовируса В19 человека, такого как из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или 11А-11Z.
В другом варианте осуществления настоящее изобретение относится к способу обнаружения инфицирования парвовирусом В19 человека в биологическом образце. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень РНК;
(b) взаимодействие выделенной нуклеиновой кислоты парвовируса В19 с первым олигонуклеотидом, который включает первый праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части последовательности-мишени РНК, чтобы образовывать с ней комплекс, причем первый праймер дополнительно включает промотор для ДНК-зависимой РНК-полимеразы 5' и функционально связан со способной образовывать комплекс последовательностью, причем первый праймер включает последовательность, полученную из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z, а взаимодействие осуществляют в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(с) удлинение первого праймера в реакции удлинения с использованием последовательности-мишени РНК в качестве матрицы, с получением первого продукта удлинения ДНК-праймера, комплементарного последовательности-мишени РНК;
(d) отделение первого продукта удлинения ДНК-праймера от последовательности-мишени РНК с использованием фермента, который избирательно расщепляет последовательность-мишень РНК;
(е) обработку продукта удлинения ДНК-праймера вторым олигонуклеотидом, который включает второй праймер, включающий способную образовывать комплекс последовательность, достаточно комплементарную 3'-концевой части продукта удлинения ДНК-праймера, чтобы образовывать с ней комплекс, причем второй праймер получают из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z, а обработку осуществляют в таких условиях, которые обеспечивают образование комплекса олигонуклеотид/последовательность-мишень и инициацию синтеза ДНК;
(f) удлинение 3'-конца второго праймера в реакции удлинения ДНК, с получением второго продукта удлинения ДНК-праймера, в результате чего получают матрицу для ДНК-зависимой РНК-полимеразы;
(g) использование матрицы для получения множества РНК-копий последовательности-мишени с использованием ДНК-зависимой РНК-полимеразы, которая распознает последовательность промотора;
и (h) использование РНК-копий со стадии (g) для аутокаталитического повторения стадий с (b) по (g) для амплификации последовательности-мишени;
(i) добавление меченного сложным эфиром акридиния олигонуклеотидного зонда к продукту стадии (h), причем олигонуклеотидный зонд является комплементарным части указанной последовательности-мишени, и зонд получают из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U, причем зонд добавляют в таких условиях, которые обеспечивают гибридизацию зонда с последовательностью-мишенью, с образованием комплекса зонд:мишень; и
(j) выявление наличия или отсутствия метки как показателя наличия или отсутствия последовательности-мишени.
В еще одном варианте осуществления настоящее изобретение относится к способу амплификации нуклеотидной последовательности-мишени парвовируса В19. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень РНК;
(b) добавление одного или более праймеров, способных к гибридизации с последовательностью-мишенью РНК, причем один или более праймеров получают из полинуклеотидных последовательностей, изображенных на любой из фиг.2А-2U и фиг.11А-11Z;
(с) добавление олигонуклеотидного зонда, способного к гибридизации с последовательностью-мишенью РНК 3', сходной с одним или более праймерами;
(d) удлинение одного или более праймеров с использованием полимеразы.
В некоторых вариантах осуществления настоящего изобретения последовательность-мишень РНК стадии (а) подвергают обратной транскрипции для получения кДНК, и способ может дополнительно включать амплификацию кДНК с использованием полимеразной цепной реакции (ОТ-ПЦР) или асимметричной гэп-лигазной цепной реакции (RT-AGLCR). В других вариантах осуществления настоящего изобретения полимераза представляет собой термостабильную полимеразу, такую, без ограничения, как Taq-полимераза или Vent-полимераза. В дополнительных вариантах осуществления настоящего изобретения полимераза представляет собой ДНК-полимеразу I E.coli, фрагмент Klenow ДНК-полимеразы I E.coli или ДНК-полимеразу Т4.
В некоторых вариантах осуществления различных способов, описанных выше, обеспечивается внутренний контроль. Внутренний контроль может осуществляться с помощью последовательности, изображенной на фиг.12 (SEQ ID NO:92). В дополнительных вариантах осуществления настоящего изобретения внутренний контроль включает SEQ ID NO:90.
В дополнительных вариантах осуществления настоящее изобретение относится к способу обнаружения инфицирования парвовирусом В19 человека в биологическом образце. Способ включает:
(а) выделение нуклеиновой кислоты из биологического образца, предположительно содержащего ДНК парвовируса В19 человека, причем нуклеиновая кислота включает последовательность-мишень;
(b) взаимодействие выделенной нуклеиновой кислоты парвовируса В19 с меченным поддающейся обнаружению меткой зондом, достаточно комплементарным и способным к гибридизации с последовательностью-мишенью, причем зонд получают из полинуклеотидных последовательностей, изображенных на любой из фиг.2А-2U и фиг.11А-11Z, и причем взаимодействие происходит в таких условиях, которые обеспечивают образование комплекса зонд/последовательность-мишень; и
(с) выявление наличия или отсутствия метки как показателя наличия или отсутствия последовательности-мишени.
В других вариантах осуществления настоящее изобретение относится к полинуклеотиду, включающему нуклеотидную последовательность, включающую любую из нуклеотидных последовательностей, изображенных на фиг.2А-2U или фиг.11А-11Z.
В дополнительных вариантах осуществления настоящее изобретение относится к полинуклеотиду, как описано выше, в котором нуклеотидная последовательность состоит из нуклеотидной последовательности, изображенной на фиг.2A, 2B, 2C, 2D, 2E, 2F, 2G, 2H, 2I, 2J, 2K, 2L, 2M, 2N, 2O, 2P, 2Q, 2R, 2S, 2T, 2U, 11A, 11B, 11C, 11D, 11E, 11F, 11G, 11H, 11I, 11J, 11K, 11L, 11M, 11N, 11O, 11P, 11Q, 11R, 11S, 11T, 11U, 11V, 11W, 11X, 11Y или 11Z.
В еще одних вариантах осуществления настоящее изобретение относится к полинуклеотиду, включающему нуклеотидную последовательность, включающую любую из нуклеотидных последовательностей, изображенных на фиг.3А-3С или 4А-4С.
В дополнительных вариантах осуществления настоящее изобретение относится к полинуклеотиду, как описано выше, в котором нуклеотидная последовательность состоит из нуклеотидной последовательности, изображенной на фиг.3А-3С или на фиг.4А-4С.
В другом варианте осуществления настоящее изобретение относится к олигонуклеотидному праймеру, состоящему из промоторной области, распознаваемой ДНК-зависимой РНК-полимеразой, функционально связанной со специфичной для парвовируса В19 человека способной образовывать комплекс последовательностью приблизительно из 10-75 нуклеотидов. В некоторых вариантах осуществления настоящего изобретения промоторная область представляет собой промотор Т7, а указанная полимераза представляет собой РНК-полимеразу Т7. Помимо этого, специфичная для парвовируса В19 человека последовательность может состоять из VP1 области генома парвовируса В19 человека, такая как из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z.
В еще одних вариантах осуществления настоящее изобретение относится к олигонуклеотидному праймеру, состоящему из промотора Т7, функционально связанному со специфичной для парвовируса В19 человека способной образовывать комплекс последовательностью приблизительно из 10-75 нуклеотидов, причем специфичную для парвовируса В19 человека способную образовывать комплекс последовательность получают из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или 11А-11Z.
В другом варианте осуществления настоящее изобретение относится к олигонуклеотидному зонду, включающему специфичную для парвовируса В19 гибридизующуюся последовательность приблизительно из 10-50 нуклеотидов, связанную с меткой, представляющей собой сложный эфир акридиния. В некоторых вариантах осуществления настоящего изобретения специфичную для парвовируса В19 человека гибридизующуюся последовательность получают из VP1 области генома парвовируса В19 человека, такого как из полинуклеотидной последовательности, изображенной на любой из фиг.2А-2U или фиг.11А-11Z.
В еще одном дополнительном варианте осуществления настоящее изобретение относится к набору для диагностического исследования, включающему один или более олигонуклеотидных праймеров, описанных в настоящей заявке, и инструкции по проведению диагностического исследования. В некоторых вариантах осуществления настоящего изобретения набор для исследования дополнительно включает олигонуклеотидный зонд, включающий специфичную для парвовируса В19 гибридизующуюся последовательность приблизительно из 10-50 нуклеотидов, связанную с меткой, представляющей собой сложный эфир акридиния.
Указанные и другие аспекты настоящего изобретения будут очевидны для специалиста в данной области благодаря следующему подробному описанию и прилагаемым рисункам.
Краткое описание фигур
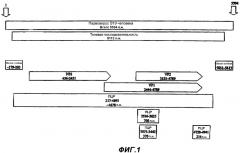
Фиг.1 представляет собой схему генома парвовируса В19 человека, изображающую различные кодирующие области вируса. Изображены три ПЦР фрагмента, один приблизительно из 700 п.н., соответствующих нуклеотидным положениям 2936-3635 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936; один приблизительно из 370 п.н. в пределах фрагмента из 700 п.н., соответствующих нуклеотидным положениям 3073-3442 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936; и один приблизительно из 214 п.н., соответствующих нуклеотидным положениям 4728-4941 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936.
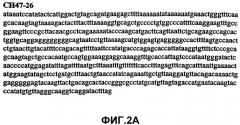
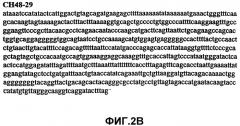
Фиг.2А-2U (SEQ ID NO:1-21) изображают последовательности ДНК из различных изолятов парвовируса В19 человека, которые включают последовательности, соответствующие нуклеотидным положениям 2936-3635 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936 (фрагмент из 700 п.н., изображенный на фиг.1). Фиг.2А (SEQ ID NO:1) представляет собой соответствующую последовательность из изолята СН47-26; фиг.2В (SEQ ID NO:2) представляет собой соответствующую последовательность из изолята СН48-29; фиг.2С (SEQ ID NO:3) представляет собой соответствующую последовательность из изолята СН33-2; фиг.2D (SEQ ID NO:4) представляет собой соответствующую последовательность из изолята СН33-3; фиг.2Е (SEQ ID NO:5) представляет собой соответствующую последовательность из изолята СН33-4; фиг.2F (SEQ ID NO:6) представляет собой соответствующую последовательность из изолята СН42-7; фиг.2G (SEQ ID NO:7) представляет собой соответствующую последовательность из изолята СН42-18; фиг.2H (SEQ ID NO:8) представляет собой соответствующую последовательность из изолята СН42-19; фиг.2I (SEQ ID NO:9) представляет собой соответствующую последовательность из изолята СН46-23; фиг.2J (SEQ ID NO:10) представляет собой соответствующую последовательность из изолята СН1-1; фиг.2K (SEQ ID NO:11) представляет собой соответствующую последовательность из изолята СН1-6; фиг.2L (SEQ ID NO:12) представляет собой соответствующую последовательность из изолята СН2-8; фиг.2M (SEQ ID NO:13) представляет собой соответствующую последовательность из изолята СН2-10; фиг.2N (SEQ ID NO:14) представляет собой соответствующую последовательность из изолята СН2-11C; фиг.2O (SEQ ID NO:15) представляет собой соответствующую последовательность из изолята СН5-13; фиг.2P (SEQ ID NO:16) представляет собой соответствующую последовательность из изолята СН7-22; фиг.2Q (SEQ ID NO:17) представляет собой соответствующую последовательность из изолята СН13-27; фиг.2R (SEQ ID NO:18) представляет собой соответствующую последовательность из изолята СН14-33; фиг.2S (SEQ ID NO:19) представляет собой соответствующую последовательность из изолята СН62-2; фиг.2T (SEQ ID NO:20) представляет собой соответствующую последовательность из изолята СН64-2; и фиг.2U (SEQ ID NO:21) представляет собой соответствующую последовательность из изолята СН67-2.
Фиг.3А-3С (SEQ ID NO:22) показывают последовательность ПЦР-фрагмента приблизительно из 4,7 т.п.н., показанного на фиг.1, из клона 2-В1 парвовируса В19. Последовательность представляет собой фрагмент из 4677 нуклеотидов, соответствующий нуклеотидным положениям 217-4893, описанным в Shade et al., J. Virol. (1986) 58:921-936. Изображенная последовательность содержит полную открытую рамку считывания парвовируса В19, которая кодирует NS1, VP1 и VP2, плюс дополнительные нетранслируемые последовательности 5' и 3'.
Фиг.4А-4С (SEQ ID NO:23) показывают последовательность ПЦР-фрагмента приблизительно из 4,7 т.п.н., показанного на фиг.1, из клона 2-В6 парвовируса В19. Последовательность представляет собой фрагмент из 4677 нуклеотидов, соответствующий нуклеотидным положениям 217-4893, описанным в Shade et al., J. Virol. (1986) 58:921-936. Изображенная последовательность содержит полную открытую рамку считывания парвовируса В19, которая кодирует NS1, VP1 и VP2, плюс дополнительные нетранслируемые последовательности 5' и 3'.
Фиг.5А (SEQ ID NO:24) и 5В (SEQ ID NO:25) показывают нуклеотидную и белковую последовательности NS1, соответственно, из клона 2-В1 парвовируса В19.
Фиг.6А (SEQ ID NO:26) и 6В (SEQ ID NO:27) показывают нуклеотидную и белковую последовательности VP1, соответственно, из клона 2-В1 парвовируса В19.
Фиг.7А (SEQ ID NO:28) и 7В (SEQ ID NO:29) показывают нуклеотидную и белковую последовательности VP2, соответственно, из клона 2-В1 парвовируса В19.
Фиг.8А (SEQ ID NO:30) и 8В (SEQ ID NO:31) показывают нуклеотидную и белковую последовательности NS1, соответственно, из клона 2-В6 парвовируса В19.
Фиг.9А (SEQ ID NO:32) и 9В (SEQ ID NO:33) показывают нуклеотидную и белковую последовательности VP1, соответственно, из клона 2-В6 парвовируса В19.
Фиг.10А (SEQ ID NO:34) и 10В (SEQ ID NO:35) показывают нуклеотидную и белковую последовательности VP2, соответственно, из клона 2-В6 парвовируса В19.
Фиг.11А-11Z (SEQ ID NO:62-87) изображают последовательности ДНК из различных изолятов парвовируса В19, которые включают последовательности, соответствующие нуклеотидным положениям 2936-3635 генома парвовируса В19, описанным в Shade et al., J. Virol. (1986) 58:921-936 (фрагмент из 700 п.н., изображенный на фиг.1). Фиг.11А (SEQ ID NO:62) представляет собой соответствующую последовательность из изолята СН80-1; фиг.11B (SEQ ID NO:63) представляет собой соответствующую последовательность из изолята СН81-3; фиг.11C (SEQ ID NO:64) представляет собой соответствующую последовательность из изолята B19SCL1-4; фиг.11D (SEQ ID NO:65) представляет собой соответствующую последовательность из изолята B19SCL2-1; фиг.11E (SEQ ID NO:66) представляет собой соответствующую последовательность из изолята B19SCL3-1; фиг.11F (SEQ ID NO:67) представляет собой соответствующую последовательность из изолята B19SCL4-3; фиг.11G (SEQ ID NO:68) представляет собой соответствующую последовательность из изолята B19SCL5-2; фиг.11H (SEQ ID NO:69) представляет собой соответствующую последовательность из изолята B19SCL6-2; фиг.11I (SEQ ID NO:70) представляет собой соответствующую последовательность из изолята B19SCL7-3; фиг.11J (SEQ ID NO:71) представляет собой соответствующую последовательность из изолята B19SCL8-2; фиг.11K (SEQ ID NO:72) представляет собой соответствующую последовательность из изолята B19SCL9-1; фиг.11L (SEQ ID NO:73) представляет собой соответствующую последовательность из изолята B19SCL9-9; фиг.11M (SEQ ID NO:74) представляет собой соответствующую последовательность из изолята B19SCL10-2; фиг.11N (SEQ ID NO:75) представляет собой соответствующую последовательность из изолята B19SCL11-1; фиг.11O (SEQ ID NO:76) представляет собой соответствующую последовательность из изолята B19SCL12-1; фиг.11P (SEQ ID NO:77) представляет собой соответствующую последовательность из изолята B19SCL13-3; фиг.11Q (SEQ ID NO:78) представляет собой соответствующую последовательность из изолята B19SCL14-1; фиг.11R (SEQ ID NO:79) представляет собой соответствующую последовательность из изолята B19SCL15-3; фиг.11S (SEQ ID NO:80) представляет собой соответствующую последовательность из изолята B19SCL16-2; фиг.11T (SEQ ID NO:81) представляет собой соответствующую последовательность из изолята B19SCL17-1; фиг.11U (SEQ ID NO:82) представляет собой соответствующую последовательность из изолята B19SCL18-1; фиг.11V (SEQ ID NO:83) представляет собой соответствующую последовательность из изолята B19SCL19-1; фиг.11W (SEQ ID NO:84) представляет собой соответствующую последовательность из изолята B19SCL20-3; фиг.11X (SEQ ID NO:85) представляет собой соответствующую последовательность из изолята B19SCL21-3; фиг.11Y (SEQ ID NO:86) представляет собой соответствующую последовательность из изолята B19SCL22-11; фиг.11Z (SEQ ID NO:87) представляет собой соответствующую последовательность из изолята B19SCL2-14.
Фиг.12 (SEQ ID NO:92) изображает пример последовательности, из которой можно получить внутренний контроль (IC) для захвата и амплификации мишени.
Подробное описание изобретения
Для осуществления настоящего изобретения будут использоваться, если не указано иное, обычные методы химии, биохимии, методики рекомбинантной ДНК и вирусологии, известные специалистам в данных областях. Данные методики исчерпывающим образом раскрыты в научной литературе. См., например, Fundamental Virology, 2-е издание, тома I и II (B.N. Fields and D.M. Knipe, eds.); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., последнее дополнение); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2-е издание, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Oligonucleotide Synthesis (N. Gait, ed., 1984); A Practical Guide to Molecular Cloning (1984).
Следует отметить, что в данном описании и прилагаемой формуле изобретения единственные формы существительных включают в себя и упомянутые значения во множественном числе, если в контексте ясно не указано иное. Так, например, ссылка на "антиген" включает в себя смесь двух или более антигенов и т.п. В тексте используются следующие аббревиатуры для аминокислот:
| Аланин: Ala (A) | Аргинин: Arg (R) |
| Аспарагин: Asn (N) | Аспарагиновая кислота: Asp (D) |
| Цистеин: Cys (C) | Глутамин: Gln (Q) |
| Глутаминовая кислота: Glu (E) | Глицин: Gly (G) |
| Гистидин: His (H) | Изолейцин: Ile (I) |
| Лейцин: Leu (L) | Лизин: Lys (K) |
| Метионин: Met (M) | Фенилаланин: Phe (F) |
| Пролин: Pro (P) | Серин: Ser (S) |
| Треонин: Thr (T) | Триптофан: Trp (W) |
| Тирозин: Tyr (Y) | Валин: Val (V) |
I. Определения
При описании настоящего изобретения будут использоваться следующие термины, которые имеют определения, указанные ниже.
Термины "полипептид" и "белок" относятся к полимеру, состоящему из аминокислотных остатков, и не ограничиваются минимальной длиной продукта. Так, пептиды, олигопептиды, димеры, мультимеры и т.п. включены в данное определение. Данное определение охватывает также полноразмерные белки и их фрагменты. Данные термины также включают постэкспрессионные модификации полипептида, например, гликозилирование, ацетилирование, фосфорилирование и т.п. Кроме того, для целей настоящего изобретения "полипептид" относится к белку, который включает модификации, такие как делеции, добавления и замещения (обычно консервативные по природе), нативной последовательности, при условии, что белок сохраняет желательную активность. Данные модификации могут быть преднамеренными, например, посредством сайт-направленного мутагенеза, или могут быть случайными, например, посредством мутаций хозяев, которые продуцируют белки, или посредством ошибок при ПЦР-амплификации.
Полипептид парвовируса В19 представляет собой полипептид, как определено выше, полученный из белка, кодируемого геномом В19, такой как полипептид из неструктурных белков, NS1 и NS2, а также из белков, которые образуют капсид вируса, VP1 (длиной около 781 аминокислоты) или VP2 (длиной около 554 аминокислот). Характерные последовательности NS1, VP1 и VP2 изображены на фиг.5-10 в настоящей заявке. Полипептид необязательно должен быть физически получен из парвовируса В19, а может быть получен синтетическим или рекомбинантным путем. Более того, полипептид может быть получен из любого из различных штаммов и изолятов парвовируса В19. Среди данных штаммов и изолятов известен ряд консервативных и вариабельных областей, и, в общем, аминокислотные последовательности, например, эпитопов, полученных из указанных областей, будут иметь высокую степень гомологии последовательности, например, гомологию аминокислотной последовательности более 30%, предпочтительно, более 40%, при сопоставлении двух последовательностей. Так, например, термин "VP1" полипептид относится к нативному VP1 из любого из различных штаммов и изолятов парвовируса В19. Полные генотипы и последовательности для упомянутых выше белков многих штаммов и изолятов парвовируса В19 известны. См., например, Shade et al., J. Virol. (1986) 58:921-936; Gallinella et al., J. Virol. Methods (1993) 41:203-211. Более того, эпитопы из парвовируса В19, полученные из указанных областей, также известны. См., например, патент США № 5436127 и международную публикацию № WO 91/12269.
Термины "аналог" и "мутеин" относятся к биологически активным производным ссылочной молекулы или к фрагментам указанных производных, которые сохраняют желательную активность, такую как иммунологическая реактивность в диагностических анализах. В общем, термин "аналог" относится к соединениям, имеющим последовательность и структуру нативного полипептида с одним или более добавлений, замещений (обычно консервативных по природе) и/или делеций аминокислот, по сравнению с нативной молекулой, при условии, что модификации не уничтожают иммуногенную активность. Термин "мутеин" относится к пептидам, имеющим один или более пептидомиметиков ("пептоидов"), например, которые описаны в международной публикации № WO 91/04282. Предпочтительно, аналог или мутеин имеет по меньшей мере такую же иммунологическую активность, как у нативной молекулы. Способы получения полипептидных аналогов и мутеинов известны специалистам в данной области и дополнительно описаны ниже.
Особенно предпочтительные аналоги включают замещения, которые являются консервативными по природе, т.е. такие замещения, которые имеют место в пределах семейства аминокислот, имеющих родственные боковые цепи. Конкретно, аминокислоты обычно разделяют на четыре семейства: (1) кислые - аспартат и глутамат; (2) основные - лизин, аргинин, гистидин; (3) неполярные - аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан; и (4) не имеющие заряда полярные - глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Например, можно с полным основанием предсказать, что изолированная замена лейцина на изолейцин или валин, аспартат на глутамат, треонин на серин или сходная консервативная замена аминокислоты на структурно родственную аминокислоту, не окажет большого влияния на биологическую активность. Например, полипептид, представляющий интерес, может включать приблизительно до 5-10 консервативных или неконсервативных аминокислотных замещений, или даже приблизительно до 15-25 консервативных или неконсервативных аминокислотных замещений, или любое целое число от 5 до 25, если желательная функция молекулы остается прежней. Специалист может легко определить области молекулы, представляющей интерес, которые могут перенести изменения, в соответствии со схемами Hopp/Woods и Kyte-Doolittle, хорошо известными специалистам в данной области.
Под "выделенным", если речь идет о полипептиде, подразумевают, что указанная молекула находится отдельно от целого организма, в котором молекулу находят в природе, или присутствует в практическом отсутствии других биологических макромолекул того же типа. Под термином "выделенный", если речь идет о полинуклеотиде, подразумевают молекулу нуклеиновой кислоты, лишенную, полностью или частично, последовательностей, обычно связанных с ней в природе; или последовательность, в том виде, в котором она существует в природе, но имеющую связанные с ней гетерологичные последовательности; или молекулу, отделенную от хромосомы.
Полинуклеотид, "полученный из" или "специфичный в отношении" обозначенной последовательности, относится к полинуклеотидной последовательности, которая включает смежную последовательность по меньшей мере приблизительно из 6 нуклеотидов, предпочтительно, по меньшей мере приблизительно из 8 нуклеотидов, более предпочтительно, по меньшей мере приблизительно из 10-12 нуклеотидов, и даже более предпочтительно, по меньшей мере приблизительно из 15-20 нуклеотидов, соответствующую, т.е. идентичную или комплементарную области обозначенной нуклеотидной последовательности. Полученный полинуклеотид не обязательно будет получен физически из нуклеотидной последовательности, представляющей интерес, но может быть получен любым способом, включая, без ограничения, химический синтез, репликацию, обратную транскрипцию или транскрипцию, который основан на информации, обеспеченной последовательностью оснований в области (областях), из которой получен полинуклеотид. В качестве такового он может представлять смысловую или антисмысловую ориентацию исходного полинуклеотида.
"Гомологичность" относится к проценту сходства между двумя полинуклеотидными или двумя полипептидными частями. Две ДНК или две полипептидные последовательности являются "практически гомологичными" друг с другом, когда последовательности имеют по меньшей мере приблизительно 50%, предпочтительно, по меньшей мере приблизительно 75%, более предпочтительно, по меньшей мере приблизительно 80%-85%, предпочтительно, по меньшей мере приблизительно 90%, и, наиболее предпочтительно, по меньшей мере приблизительно 95%-98% сходства последовательности по определенной длине молекул. Используемый в настоящей заявке термин "практически гомологичные" также относится к последовательностям, демонстрирующим полную идентичность конкретной ДНК или полипептидной последовательности.
В общем, "идентичность" относится к точному нуклеотид-нуклеотидному или аминокислота-аминокислотному соответствию двух полинуклеотидных или полипептидных последовательностей, соответственно. Процент идентичности можно определить прямым сравнением информации о последовательности между двумя молекулами путем сопоставления