Способ определения производных фенотиазина в биологических жидкостях
Иллюстрации
Показать всеИзобретение относится к области клинической лабораторной диагностики, а именно к способам определения производных фенотиазина в биологических объектах методом тонкослойной хроматографии (ТСХ). Способ включает обработку анализируемой пробы биологической жидкости щелочью, экстракцию определяемых веществ, дозирование экстракта в токе инертного газа азота и хроматографическое определение производных фенотиазина, при этом обработку пробы биологической жидкости проводят этанолом и щелочью в соотношении 10:1:1 соответственно до рН 10-13, экстракцию определяемых веществ ведут на твердом сорбенте с использованием сверхсшитого полистирола, экстракт смывают с сорбента хлороформом объемом не более 8 мл, вновь высушивают его в токе азота, а хроматографическое определение производных фенотиазина осуществляют методом тонкослойной хроматографии, где в качестве элюента используют смесь ацетона и аммиака, взятые в соотношении 100:1 соответственно. Изобретение обеспечивает простоту, доступность, эффективность и высокую селективность способа. 1 з.п. ф-лы, 4 ил.
Реферат
Изобретение относится к области клинической лабораторной диагностики, а именно к способам определения производных фенотиазина в биологических объектах методом тонкослойной хроматографии (ТСХ).
Известны различные способы определения лекарственных веществ в биологических объектах, по количественному содержанию которых можно судить об эффективности лечения данным препаратом.
Известен способ определения пармидина в биологических жидкостях (Пат. RU 2008668, МПК (5) G01N 30/06). Биологическая проба обрабатывается смесью 0,1н. серной кислоты и этанола, взятых в соотношении 10-50:50-90. Затем ее центрифугируют и определяют пармидин в супернатанте методом обращенно-фазовой высокоэффективной жидкостной хроматографии.
Известен способ количественного определения перфеназина в моче евразийской выдры методом газовой хроматографии - масс-спектрометрии (Journal of Chromatography, 2002, 769, 79-87). Метод включает энзиматический гидролиз, в котором 2 мл образца доводят до рН 5,2 ацетатным буфером, добавляют β-глюкоронидаза-арилсульфатазу из Helix pomatia и инкубируют при 55°С в течение 2 ч. Твердофазную экстракцию с использованием картриджа Bond Elut Certify, который предварительно кондиционируют 2 мл метанола и 2 мл деионизованной воды. Пропускают через картридж анализируемую пробу и трижды промывают картридж сначала 2 мл деионизованной воды, 1 мл 1М уксусной кислоты и 2 мл метанола и высушивают картридж. Далее промывают картридж 2 мл смеси хлороформ - 2-пропанол в соотношении 8:2, содержащей 2% аммиака. Полученный экстракт высушивают и модифицируют с MSTFA до O-TMS производного. Полученное производное анализируют методом газовой хроматографии - масс-спектрометрии.
К недостаткам известного способа относится трудоемкость, многооперационность пробоподготовки и использование сложного аппаратурного оформления.
Известен способ ТСХ-скрининга мочи (С.К. Еремин, Б.Н. Изотов, Н.В. Веселовская «Анализ наркотических средств», 1993). 50 мл Мочи подкисляют 2 н. соляной кислотой до рН 1-2. Двукратно экстрагируют 50 мл эфира по 3-5 минут. Эфирные вытяжки объединяют в экстракт 1. Водную фазу доводят до рН 9 добавлением аммиака и двукратно экстрагируют 50 мл смеси хлороформ - н-бутанол (9:1) в течение 3-5 минут. Органические вытяжки объединяют в экстракт 2. Органические растворители из экстрактов 1 и 2 удаляют в испарительных чашках в токе теплого воздуха. Сухие остатки экстрактов 1 и 2 растворяют в 10 мл хлороформа каждый. Далее проводят хроматографическое определение методом тонкослойной хроматографии. Используют одну из смесей растворителей: хлороформ - ацетон (9:1); диоксан - хлороформ - ацетон - 25%-ный аммиак (47,5:45:5:2,5); бензол - диоксан - 25%-ный аммиак (60:35:5); этилацетат - ацетон - (этанол - 25%-ный аммиак 1:1) (50:45:4); толуол - ацетон - этанол - 25%-ный аммиак (45:45:7,5:2,5); бензол; метанол - 25%-ный аммиак (100:1,5).
К недостаткам этого способа относится трудоемкость, многооперационность пробоподготовки и большой расход реагентов.
Известен способ количественного определения L-нафтола в моче животных с использованием жидко-жидкостной экстракции (Пат. RU 2011992, МПК (5) G01N 33/50). Согласно этому способу, 10 мл образца с добавкой определяемого вещества подщелачивают 20%-ным раствором едкого натра до рН 9-10 и проводят извлечение методом жидко-жидкостной с использованием 10 мл хлороформа в течение 2-3 минут, декантируют экстракт и отбрасывают, вносят 20%-ный раствор уксусной кислоты до рН 1-2, экстрагируют 10 мл хлороформа в течение 1-2 минут. Хлороформ отделяют, обезвоживают и упаривают до объема 30-50 мкл, наносят на пластинку и хроматографируют в системе гексан - ацетон (3:1), высушивают на воздухе и проявляют 0,2%-ного раствором прочного синего Б.
Недостатками этого способа являются высокая трудоемкость, связанная с большим количеством операций, обусловленных подготовкой образцов, и недостаточная селективность извлечения определяемого компонента.
Наиболее близким аналогом к заявляемому является способ количественного определения препаратов фенотиазинового ряда в биологических жидкостях (Пат. SU 826242, МПК (5) G01N 33/52). Согласно этому способу, определяемые вещества экстрагируют и разделяют методом жидкостной хроматографии на сильном катионите. В качестве элюентов используют смесь этанола и воды, взятых в соотношении 1:5-5:1 по объему с добавлением 0,1-5,0% смеси уксусной кислоты и диэтиламина в соотношении 5:4.
К недостаткам этого способа относятся высокая трудоемкость процедуры пробоподготовки, недостаточная селективность извлечения, а также использование сложного аппаратурного оформления.
Технической задачей заявляемого изобретения является разработка метода определения производных фенотиазина в биологических жидкостях методом тонкослойной хроматографии с использованием твердофазного извлечения определяемых компонентов.
Для решения технической задачи биологическую жидкость смешивают с этанолом и щелочью в соотношении 10:1:1 так, чтобы рН полученного аналита составлял 10-13 ед. рН. Общий объем аналита не должен превышать 16 мл. Подготовленный таким образом аналит пропускают через патрон, заполненный сверхсшитым полистиролом. Остатки воды и этанола удаляют, продувая патрон азотом. Экстрагированные на твердом сорбенте производные фенотиазина вымывают хлороформом объемом не более 8 мл. Из полученного элюата отдувают хлороформ в токе азота. Сухой остаток растворяют в небольшом объеме хлороформа и анализируют методом тонкослойной хроматографии. В качестве элюента может быть использована смесь ацетона и аммиака в соотношении 100:1.
Заявляемый способ отличается от прототипа тем, что на стадии подготовки аналита используется не жидко-жидкостная, а твердофазная экстракция определяемых веществ из аналита при подобранных компонентах и их соотношении, обеспечивающая одновременное извлечение и очистку от примесей при минимальном расходе растворителя. Обработка биологической жидкости щелочью до рН 10-13 обеспечивает переведение определяемых веществ в молекулярную форму, улучшая их сорбируемость, а добавка этанола уменьшает сорбцию мешающих веществ. Используемое упаривание в токе азота не требует нагрева элюата. Патрон с сорбентом может использоваться многократно. Кроме того, для приведения патрона в рабочее состояние его необходимо промыть последовательно 5 мл этанола, 5 мл 20% этанола и 5 мл дистиллированной воды.
Таким образом заявленная совокупность существенных признаков является новой и позволяет получить технический результат, не известный из уровня техники, то есть соблюдено требование изобретательского уровня.
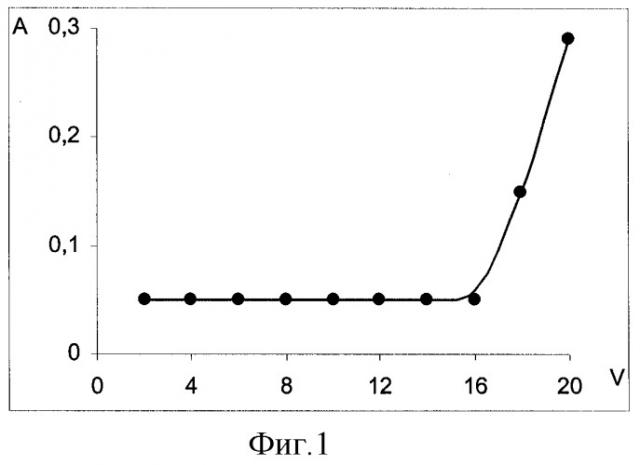
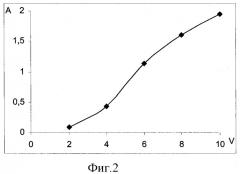
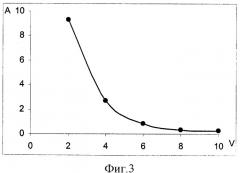
На фиг.1 представлена зависимость оптической плотности элюата от объема прокаченной смеси вода - этанол (9:1) через патрон; на фиг.2 - зависимость оптической плотности элюата от объема прокаченной смеси вода - этанол (8:2) через патрон; на фиг.3 - зависимость оптической плотности этанольного раствора от объема прокаченного через патрон хлороформа; на фиг.4 - схема хроматограммы смеси семи производных фенотиазина.
При изучении эффективности очистки пробы от посторонних веществ изучили сорбцию производных фенотиазина из водно-органических смесей. Известно, что добавка органического растворителя к водному раствору вещества уменьшает его сорбцию на твердом полимерном сорбенте. В качестве такой добавки использовали этанол. Для этого готовили растворы производных фенотиазина в водно-этанольных смесях с концентрацией производных фенотиазина 5 мкг/мл каждого и порциями по 2 мл прокачивали через патрон, измеряя оптическую плотность каждой порции элюата. В первом случае использовали соотношение воды и этанола 9:1 (см. фиг.1). Измерения проводили при длине волны 254 нм, оптическая плотность фонового раствора составляла 0,05. Как видно, при пропускании через патрон до 16 мл смеси определяемые вещества остаются на сорбенте. Во втором случае использовали соотношение воды и этанола 8:2 (см. фиг.2). Оптическая плотность фонового раствора при 254 нм составляла 0,09. В этом случае после прокачивания 2 мл смеси производные фенотиазина начинали вымываться с сорбента.
Для подтверждения эффективности использования щелочной среды приготовили растворы аминазина с рН 6 и 10. Прокачали через патрон и вымывали этилацетатом. Элюирование проводили порциями по 2 мл, элюат высушивали и растворяли в 2 мл этанола и затем измеряли оптическую плотность. В качестве максимального объема элюирования взяли объем равный 10 мл. После прокачивания 10 мл этилацетата оптическая плотность спиртового раствора в первом случае составила 0,56, а во втором 0,24. Этим экспериментом было выявлено, что эффективно использование щелочной среды с рН 10-13.
С целью минимизации объема элюата и оценки эффективности извлечения изучали процесс десорбции производных фенотиазина с применением различных органических растворителей. Так как большинство органических растворителей имеют полосы поглощения в УФ-области спектра, совпадающие с максимумами поглощения производных фенотиазина, каждую порцию элюата упаривали досуха в токе азота и сухой остаток растворяли в этаноле. Оптимальным растворителем с точки зрения его объема, необходимого для полного элюирования производных фенотиазина с поверхности сорбента, оказался хлороформ (см. фиг.3). На патрон наносили смесь семи фенотиазинов по 50 мг каждого.
Пример 1. Определение аминазина
Смешивают 10 мл мочи с добавкой аминазина в количестве 10 мкг, с 1 мл этанола и 1 мл 0,01 М NaOH и прокачивают смесь через патрон со сверхсшитым полистиролом (230 мг) со скоростью 1 мл/мин. Продувают патрон азотом для удаления остатков пробы. Смывают аминазин 8 мл хлороформа. Полученный экстракт высушивают в токе азота и добавляют 0,2 мл хлороформа. Наносят экстракт на стартовую линию на пластинку. Помещают пластинку в предварительно подготовленную камеру. В качестве элюента используют смесь ацетон - аммиак (100:1). После завершения процесса элюирования пластинку высушивают и опрыскивают 10%-ным раствором серной кислоты в этаноле. Фиксируют проявившееся определяемое вещество, а также сопутствующие соединения. Значение Rf аминазина составило 0,67.
Пример 2. Определение смеси производных фенотиазина
Смешивают 10 мл мочи с добавкой смеси производных фенотиазина в количестве 10 мкг каждого, с 1 мл этанола и 1 мл 0,01 М NaOH и прокачивают смесь через патрон со сверхсшитым полистиролом (230 мг) со скоростью 1 мл/мин. Продувают патрон азотом для удаления остатков пробы. Смывают производные фенотиазина 8 мл хлороформа. Полученный экстракт высушивают в токе азота и добавляют 0,2 мл хлороформа. Наносят экстракт на стартовую линию на пластинку. Помещают пластинку в предварительно подготовленную камеру. В качестве элюента используют смесь ацетон - аммиак (100:1). После завершения процесса элюирования пластинку высушивают и опрыскивают 10%-ным раствором серной кислоты в этаноле. Фиксируют проявившиеся определяемые вещества, а также сопутствующие соединения (см. фиг.4).
Из представленного следует сделать вывод, что предложенный способ определения производных фенотиазина в биологических жидкостях прост, доступен, эффективен и обладает высокой селективностью.
1. Способ определения производных фенотиазина в биологических жидкостях, включающий обработку анализируемой пробы биологической жидкости щелочью, экстракцию определяемых веществ, дозирование экстракта в токе инертного газа, азота и хроматографическое определение производных фенотиазина, отличающийся тем, что обработку пробы биологической жидкости проводят этанолом и щелочью в соотношении 10:1:1 соответственно до рН 10-13, экстракцию определяемых веществ ведут на твердом сорбенте с использованием сверхсшитого полистирола, экстракт смывают с сорбента хлороформом объемом не более 8 мл, вновь высушивают его в потоке азота, а хроматографическое определение производных фенотиазина осуществляют методом тонкослойной хроматографии, где в качестве элюента используют смесь ацетона и аммиака, взятые в соотношении 100:1 соответственно.
2. Способ по п.1, отличающийся тем, что используют объем аналита не более 16 мл.