Фармацевтический препарат, содержащий циклоспорин, и его применение
Иллюстрации
Показать всеДанное изобретение относится к химико-фармацевтической промышленности и касается фармацевтического препарата в коллоидной форме для местного применения при лечении и профилактике патологических изменений кожи, и/или придатков кожи, и/или слизистых оболочек, включая слизистые оболочки желудочно-кишечного тракта, мочеполовых путей и бронхиальной системы, и/или конъюнктивы, содержащий липофильную фазу в количестве 1-10% по массе, смесь поверхностно-активного вещества и вспомогательного поверхностно-активного вещества, при этом поверхностно-активное вещество выбрано из эфиров полиоксиэтиленглицерина и жирных кислот и эфиров полиоксиэтиленсорбитана и жирных кислот, и вспомогательное поверхностно-активное вещество выбрано из полоксамеров, блок-сополимеров полиоксиэтилена и полиоксипропилена в количестве 1-50% по массе, гидрофильную фазу в количестве 40-80% по массе, и в качестве активного ингредиента циклоспорин или его производные в концентрации 0,1-20% по массе. 8 н. и 9 з.п. ф-лы, 5 табл., 11 ил.
Реферат
Данное изобретение относится к коллоидным системам-носителям для фармацевтического средства, содержащим циклоспорин, для местного применения на кожу и слизистую оболочку, включающим в себя смесь поверхностно-активное вещество/вспомогательное поверхностно-активное вещество (моноолеат полиоксиэтиленглицерина/полоксамеры), гидрофильную фазу, например смеси пропиленгликоль/вода, липофильную фазу (изопропилпальмитат или олеиновую кислоту) и агенты, усиливающие проникновение.
Данное изобретение относится, в частности, к фармацевтическим препаратам, содержащим циклоспорин А (ЦсА), для местного применения при лечении патологических изменений кожи, придатков кожи или слизистых оболочек, в особенности, атопического дерматита и псориаза, к применению этих препаратов и способу их приготовления.
Известно, что ЦсА представляет собой циклический пептид из 11 аминокислот, с молярной массой 1202 г/моль, который продуцируется почвенным грибом Tolypocladium inflatum. ЦсА очень трудно растворим в воде (<0,04 мг/мл при 25°С), в то же время он легко растворим в маслах и спиртах. Его иммуномодулирующее действие основано на ингибировании высвобождения интерлейкина-1 из макрофагов и интерлейкина-2 из Т-хелперных клеток, которые, в свою очередь, активируют цитотоксические предшественники Т-клеток, от которых происходят цитотоксические Т-клетки. Таким образом, ингибируется транскрипция генов, кодирующих упомянутые цитокины. При этом ЦсА влияет только в небольшой степени на естественно возникающую защиту организма. С точки зрения галеновых средств, фармацевтическое средство представляет собой вещество, которое, в частности, не подходит для местного лечения, поскольку высокая липофильность делает проникновение через эпидермальный липидный барьер практически невозможным. В качестве причины неудачи предыдущих попыток получения и применения различных липофильных, гидрофильных и липосомных препаратов для местного применения, как правило, указывается неадекватное проникновение фармацевтического средства.
В дерматологии ЦсА, как оказалось, особенно пригоден при системном применении для лечения тяжелой формы псориаза и атопического дерматита. В дополнение, имеются сообщения и исследования в отношении эффективности после системного применения в случае множества других воспалительных дерматозов (например, язвенный дерматит, красный лишай, актинический ретикулоид, диссеминированная кольцевая гранулема).
В WO 9302664 описаны W/O микроэмульсии, которые содержат липофильную фазу (среднецепочечные триглицериды и поверхностно-активное вещество с низким значением гидрофильно-липофильного баланса (ГЛБ) в соотношении от 5:1 до 1,5:1), водную гидрофильную фазу, поверхностно-активное вещество с высоким значением ГЛБ и растворимый в воде терапевтический агент.
GB 2222770 включает в себя микроэмульсионные предконцентраты, включающие в себя ЦсА, гидрофильную фазу (пропиленгликоль или частичный эфир низкомолекулярных моно- или полиоксиалкандиолов) (транскутол/гликофурол), липофильную фазу (среднецепочечные триглицериды) и поверхностно-активное вещество (Cremophor RH 40). Эти системы пригодны для перорального применения и улучшают биодоступность по сравнению с существующими системами.
В ЕР 760237 описаны O/W микроэмульсии для нерастворимых в воде фармацевтически активных веществ, таких как ЦсА, которые полностью растворяются в диспергированных масляных каплях. Эти системы включают в себя С8-С20 замещенные растительные триглицериды, лецитин, а также другое поверхностно-активное вещество и липофильную фазу, содержащую пропиленгликоль.
WO 97/22358 включает в себя микроэмульсионные предконцентраты с ЦсА, причем фармацевтическое средство растворено в системе, включающей в себя гидрофобные (токоферолы или производные токоферола) и гидрофильные компоненты (пропиленкарбонат и полиэтиленгликоль с молекулярной массой <1000), а также поверхностно-активное вещество.
В WO 94/08603, WO 94/08605 и WO 99/39700 описаны фармацевтические препараты, в которых циклоспорин и его производные приведены в качестве возможного активного ингредиента в коллоидной системе.
В документе Tran HS et al, Site-specific immunosuppression using a new formulation of topical cyclosporine A with polyethylene glycol-8 glyceryl caprylate/caprate // J Surg Res. 1999, 83 (2), p.136-40, являющемся ближайшим аналогом заявленного изобретения, раскрыт препарат для местного применения, содержащий циклоспорин А и усилитель проникновения полиэтиленгликоль-8-глицерилкаприлат/капрат.
Однако ранее описанные системы обладают некоторыми существенными недостатками. Для растворения используют частичные органические растворители, которые затем нужно снова удалять из препарата без какого-либо остатка. Часто комбинации поверхностно-активное вещество/вспомогательное поверхностно-активное вещество для улучшения растворимости фармацевтического препарата используют в слишком высоких концентрациях (более чем 20% мас./мас.). В некоторых публикациях упоминаются системы, которые не состоят исключительно из ингредиентов, совместимых с кожей. Описаны некоторые микроэмульсионные предконцентраты, действительная структура которых, как полагают, образуется in situ только после применения. Кроме того, существующие системы обладают значительно большими диаметрами частиц.
Таким образом, задача настоящего изобретения заключается в том, чтобы предложить новую коллоидную систему-носитель для фармацевтического средства, которая по существу включает в себя дерматологически приемлемые ингредиенты, причем эта система-носитель для фармацевтического средства в то же время должна иметь относительно низкое содержание поверхностно-активного вещества/вспомогательного поверхностно-активного вещества.
Эта задача решена посредством отличительных признаков согласно п.1 формулы изобретения. Относительно применения, данное изобретение определено признаками по пунктам 14-20 формулы изобретения.
В соответствии с данным изобретением, таким образом, предложено, что фармацевтический препарат в коллоидной форме включает в себя четыре существенных компонента. Фармацевтический препарат по данному изобретению, следовательно, включает в себя липофильную фазу, смесь поверхностно-активного вещества и вспомогательного поверхностно-активного вещества, гидрофильную фазу и циклоспорин в качестве активного ингредиента в концентрациях, указанных в п.1.
Преимущество коллоидных систем-носителей для фармацевтического средства, в соответствии с данным изобретением, можно увидеть, в частности, в составе исключительно дерматологически приемлемых ингредиентов при сравнительно низком содержании поверхностно-активного вещества/вспомогательного поверхностно-активного вещества, а также малом размере диспергированных частиц.
С точки зрения материалов, в частности, масла, воски или жиры особенно пригодны для липофильной фазы для фармацевтического препарата по данному изобретению. В отношении липофильной фазы, можно применять все липофильные фазы, которые известны сами по себе на сегодняшний день из уровня техники. Особенно предпочтительны триглицериды, изопропилмиристат, 2-октилдодеканол, изопропилпальмитат или олеиновая кислота. Липофильная фаза содержится в препарате в количестве 1-10% по массе.
Существенной составной частью фармацевтического препарата по данному изобретению является смесь поверхностно-активного вещества и вспомогательного поверхностно-активного вещества, которую используют в количестве 1-50% по массе, предпочтительно 20-30% по массе. С точки зрения материалов, предпочтительными являются поверхностно-активные вещества, выбранные из эфиров полиоксиэтиленглицерина и жирных кислот, и эфиров полиоксиэтиленсорбитана и жирных кислот.Примеры вспомогательных поверхностно-активных веществ представляют собой полоксамеры, блок-сополимеры полиоксиэтилена и полиоксипропилена.
Особенно предпочтительное соотношение в смеси представляет собой массовое соотношение от 1,5 до 2,5 для поверхностно-активного вещества и от 2,5 до 3,5 для вспомогательного поверхностно-активного вещества. Авторы данного изобретения смогли доказать, что, в особенности, поддержание этого соотношения в смеси поверхностно-активного вещества/вспомогательного поверхностно-активного вещества является важным для стабильности и пригодности фармацевтического препарата (фиг.9-11).
Если смесь поверхностно-активное вещество/вспомогательное поверхностно-активное вещество включает в себя эфиры полиоксиэтиленглицерина и жирных кислот и полоксамеры в массовом соотношении 2:3, могут быть достигнуты особенно хорошие результаты.
Препарат по данному изобретению содержит, в дополнение, гидрофильную фазу, которая, как это известно само по себе из уровня техники, может включать в себя полиолы, воду или полиол, либо полиол-буферную смесь, либо только буфер. Концентрация этого компонента составляет 40-80% по массе, предпочтительно 60-75% по массе.
В еще одном предпочтительном воплощении данного изобретения предложено, в случае гидрофильной фазы, что смесь пропиленгликоля и воды используют в соотношении от 1:10 до 10:1. Наиболее предпочтительное соотношение смеси составляет 2:1.
В соответствии с данным изобретением, фармацевтический препарат содержит в качестве активного ингредиента циклоспорин и/или его производное в концентрации 0,1-20% по массе. Особенно предпочтительно, чтобы фармацевтический препарат содержал циклоспорин А и/или его производные. Предпочтительная концентрация при этом находится в пределах 0,01-10% по массе, наиболее предпочтительно 0,5-5% по массе.
Конечно, также возможно, чтобы в фармацевтическом препарате содержался наряду с циклоспорином А и/или его производным дополнительный активный ингредиент. Примеры активных ингредиентов этого типа представляют собой кортикостероиды, антибиотики, противогрибковые агенты и/или виростатические средства.
Как это известно само по себе из уровня техники, в фармацевтический препарат по данному изобретению могут быть добавлены также обычные добавки, такие как агенты, усиливающие проникновение. Если добавлены агенты, усиливающие проникновение, то предпочтительными являются диметилсульфоксид или короткоцепочечные спирты в концентрации 5-10% по массе.
Фармацевтический препарат по данному изобретению существует в коллоидной форме. При этом предпочтительно, чтобы дисперсная фаза имела диаметр частиц, находящийся в пределах от 5 до 200 нм. Особенно предпочтительно, чтобы диаметр частиц находился в диапазоне от 5 до 100 нм.
Фармацевтический препарат по данному изобретению особенно подходит для профилактики воспалительных заболеваний кожи и слизистой оболочки, для лечения и профилактики атопического дерматита, для лечения и профилактики псориаза.
Другие подходящие применения представляют собой лечение и профилактику коллагенозов, хронических ран, ожогов и/или хронических воспалительных заболеваний кожи и слизистой оболочки, а также лечение и профилактику хронических воспалительных заболеваний кишечника и лечение и профилактику воспалительных заболеваний глаз, а также после трансплантации.
Данное изобретение описано далее более подробно при помощи различных композиций и результатов тестов.
Состав и приготовление систем растворителей
Были разработаны три коллоидные системы-носители для фармацевтического средства, состав которых следует из Таблицы 1.
| Система с изопропилпальмитатом (ИПП) | м[г] | %[мас./мас.] | |
| Циклоспорин А 2,0% (мас./мас.) | Циклоспорин А | 0,2 | 2,0 |
| Tagat® O2/Synperonic® PE/L 101 2:3 | Tagat® O2 | 0,8 | 8,0 |
| 20,0% (мас./мас.) | Synperonic® PE/L 101 | 1,2 | 12,0 |
| Изопропилпальмитат (ИПП) 5,0% (масс./мас.) | Изопропилпальмитат | 0,5 | 5,0 |
| Пропиленгликоль/вода 2:1 73,0% (мас./мас.) | Пропиленгликоль | 4,87 | 48,7 |
| Вода | Доб. 10,0 | 24,3 | |
| Система с ДМСО | |||
| Циклоспорин А 2,0% (мас./мас.) | Циклоспорин А | 0,2 | 2,0 |
| Tagat® O2/Synperonic® PE/L 121 2:3 | Tagat® O2 | 0,8 | 8,0 |
| 20,0% (мас./мас.) | Synperonic® PE/L 121 | 1,2 | 12,0 |
| Олеиновая кислота 5,0% (мас./мас.) | Олеиновая кислота | 0,5 | 5,0 |
| Диметилсульфоксид (ДМСО) 5,0% | Диметилсульфоксид | 0,5 | 5,0 |
| (мас./мас.) | |||
| Пропиленгликоль/вода 2:1 68,0% (мас./мас.) | Пропиленгликоль | 4,53 | 45,3 |
| Вода | доб. 10,0 | 22,7 | |
| Система с олеиновой кислотой (ОК) | |||
| Циклоспорин А 1,5% (мас./мас.) | Циклоспорин А | 0,15 | 1,5 |
| Tagat® O2/Synperonic® PE/L 121 2:3 | Tagat® O2 | 0,8 | 8,0 |
| 20,0% (мас./мас.) | Synperonic® PE/L 121 | 1,2 | 12,0 |
| Олеиновая кислота 5,0% (мас./мас.) | Олеиновая кислота | 0,5 | 5,0 |
| Пропиленгликоль/вода 2:1 73,5% (мас./мас.) | Пропиленгликоль | 4,9 | 49,0 |
| Вода | доб. 10,0 | 24,5 | |
| Табл.1: разработанные коллоидные системы-носители для фармацевтического средства |
Приготовление систем осуществляли согласно конкретной последовательности следующих стадий:
- взвешивание фармацевтического средства,
- добавление смеси поверхностно-активное вещество/вспомогательное поверхностно-активное вещество,
- тщательное измельчение,
- добавление требуемого количества ИПП,
- тщательное перемешивание,
- добавление приготовленной смеси пропиленгликоля и воды,
- перемешивание до тех пор, пока не станет прозрачной, возможно, кратковременная обработка коллоидной системы ультразвуком.
В качестве эмульгаторов были выбраны полиоксиэтиленглицерина моноолеат (Tagat® O2) и полоксамеры (Synperonic® PE/L 101 или 121). Показано, что для приготовления системы-носителя особенно подходящей является комбинация обоих компонентов в массовом соотношении 2:3.
Смеси двух поверхностно-активных веществ и пропиленгликоля/воды готовили заранее. Сначала измельченное в порошок фармацевтическое средство осторожно растирали со смесью поверхностно-активного вещества, а затем добавляли липофильную фазу (изопропилпальмитат или олеиновую кислоту). Вслед за этим осуществляли добавление гидрофильной фазы (смесь пропиленгликоль/вода) и перемешивание до тех пор, пока смесь не станет прозрачной. В конце добавляли ДМСО. Если требовалось, систему оставляли на несколько минут в ультразвуковой ванне.
В качестве липофильных компонентов использовали изопропилпальмитат или олеиновую кислоту, которые обе действуют в качестве растворителей ЦсА. В дополнение, олеиновая кислота осуществляет функцию агента, усиливающего проникновение, для того чтобы облегчить проникновение ЦсА через роговой слой. Диметилсульфоксид добавляли для улучшения растворимости ЦсА в носителе и ввиду его свойств, усиливающих проникновение. В качестве смеси поверхностно-активного вещества/вспомогательного поверхностно-активного вещества были выбраны полиоксиэтиленглицерина моноолеат, который переносится кожей человека без какой-либо реакции при 100%-ной концентрации и хорошо переносится слизистой оболочкой, а также полоксамеры, которые разрешены для внутривенного введения.
Характеристика систем-носителей
Системы-носители для фармацевтического средства характеризовали, среди прочего, посредством динамического рассеяния лазерного света. Этот способ пригоден для определения размера коллоидных частиц в жидкой среде. Диаметры частиц, составляющие приблизительно 20 нм, смогли определить для препаратов, свободных от фармацевтического средства.
Анализ
Определение ЦсА осуществляли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) (модифицированного согласно Merck KgA - Darmstadt). Технические данные представлены в Таблице 2.
| Блок ВЭЖХ | Merck-Hitachi |
| L-4250 UV-VIS детектор | |
| AS-4000A Программируемый автоматический пробоотборник | |
| D-6000A Интерфейс | |
| L-6200A Программируемый насос | |
| Неподвижная фаза | Lichrospher® RP select В (Merck), 125×4 мм внутренний диаметр, 5 мкм |
| Подвижная фаза | Ацетонитрил/вода 70/30 (об/об) |
| Поток | 1 мл/мин, изократический |
| Температура | 60°С |
| Обнаружение | УФ 210 нм |
| Таб.2: Аналитические данные |
Тесты на высвобождение
Высвобождение фармацевтического средства in vitro из вышеупомянутых препаратов в зависимости от времени тестировали с помощью модельной системы многослойной мембраны.
Индивидуальные ячейки этой модели включают в себя, соответственно, основание и покровный диск, между которыми расположены слои мембраны. Сквозь отверстие в покровном диске (4 см2) на мембрану наносили определенное количество препарата (10-20 мг). В качестве акцептора служили додеканоловые коллоидные мембраны с содержанием додеканола 2%, которые готовили, используя аппарат для нанесения пленки. Емкость абсорбции акцептора определяли путем определения насыщающей растворимости ЦсА в додеканоле. Это важно для обеспечения того, чтобы достижение насыщающей растворимости фармацевтического средства в мембранах не являлось ограничивающим фактором для высвобождения. Путем использования трех мембран, расположенных одна над другой, были достигнуты условия поглощения в акцепторе.
Во время теста (30, 100, 300 и 1000 минут) модель находилась при температуре 32±1°С. После окончания времени тестирования избыток препарата осторожно удаляли, мембраны разделяли, экстрагировали смесью этанол-вода (80/20; об./об.) и подвергали определению содержания посредством ВЭЖХ. Определение проводили пять раз в течение времени тестирования.
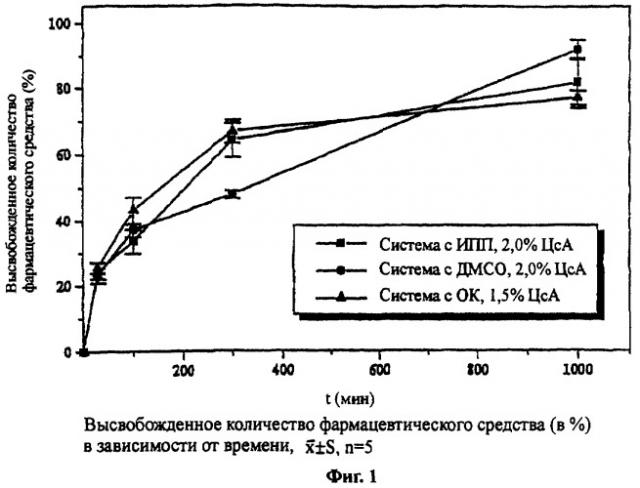
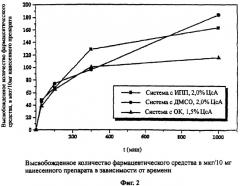
Из Фиг.1 можно определить, что все три препарата уже через 30 минут высвобождают приблизительно 25% содержащегося ЦсА. Высвобожденное количество фармацевтического средства возрастает в случае более длительного времени тестирования. На Фиг.2, для лучшего сравнения носителей с различной концентрацией, высвобожденные количества фармацевтического средства приведены на 10 мг примененного препарата.
Эти тесты проводили, для того чтобы удостовериться в том, что происходит достаточное высвобождение ЦсА из носителей и, следовательно, выполняется условие проникновения в кожу человека.
Тесты на проникновение
Использовали кожу груди человека, полученную при хирургической пластике по уменьшению груди. Кусочки кожи, нарезанные по размеру, хранили при -3°С. После размораживания жидкость, оставшуюся на поверхности, удаляли ватным тампоном и выштамповывали определенную поверхность 3,14 см2. На эту поверхность наносили приблизительно 6 мг радиоактивно меченного тестируемого препарата на см2 таким образом, что на поверхности кожи образовывалась по возможности однородная пленка. Затем кусочек кожи, лежащий на марле, натягивали на диффузионную ячейку Франца, которую хранили при температуре 32°С. То же самое было сделано до начала теста в заполненном состоянии до фазы равновесия на 30 минуте. Акцепторная среда, которую постоянно помешивали для уменьшения толщины диффузионного слоя, непосредственно примыкала к внутренней поверхности кожи или марле. Для имитации физиологических условий в качестве акцепторной жидкости использовали изотонический раствор NaCl. Тесты проводили соответственно на 3 разных операционных препаратах для трехкратного определения. После окончания воздействия кусочки кожи удаляли и фиксировали на пенополистироловой коробке, покрытой алюминиевой фольгой с помощью иголок. Затем тестируемые препараты протирали марлевым тампоном.
Удаление рогового слоя осуществляли через матрицу, содержащую круглое углубление (диаметр = 16 мм). Сквозь это углубление 20 полосок пленки Tesa (Tesa Film® 4 204, 33 м×19 мм; Со. Beiersdorf AG, Hamburg) удаляли с 2,0106 см2 поверхности кожи. Две последовательно полученные полоски, соответственно, измеряли вместе.
Из оставшегося куска кожи с помощью штампа Кромайера (диаметр 6 мм; Stiefel Laboratorium GmbH, Offenbach) примерно из центрального участка кожи выштамповывали 3 цилиндра с общей поверхностью 0,848 см2. С помощью замораживающего микротома полученные таким образом цилиндры ткани подвергали последовательно глубокой заморозке до -40°С и нарезали горизонтально по отношению к поверхности кожи. Срезы 10×20 мкм затем удаляли, чтобы убрать компоненты живого эпидермиса, и срезы 15×18 мкм брали для обработки дермы. После этого остались остаток и акцепторная среда.
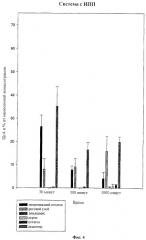
Из Фиг.3-5 следует, что в случае всех трех препаратов, уже через 30 минут >25% (ИПП 35%, ОА 32%, ДМСО 27%) содержащегося ЦсА проникает в акцептор. В случае более длительного времени тестирования проникающее количество фармацевтического средства слегка увеличивается. На Фиг.6-8, для лучшего сравнения носителей с различной концентрацией, количества проникающего фармацевтического средства приведены в мкг.
Ранее опубликованные данные о галеновых препаратах в отношении препаратов для местного применения, содержащих циклоспорин, выявили неадекватное высвобождение и/или проникновение действующего вещества. При этом были тестированы гидрофильные и липофильные стандартные системы или липосомальные препараты. Во многих случаях в публикациях не было никаких точных указаний в отношении содержания использованных препаратов, типа приготовления или медицинских данных. Две причины указаны в отношении отсутствия клинического эффекта. Во-первых, из-за сильной липофильности ЦсА происходит слишком низкое высвобождение и/или проникновение активного ингредиента в дермальные слои кожи. Во-вторых, при высокой молярной массе обнаружен фактор, значительно ингибирующий проникновение. Настоящие результаты впервые выявили скорости высвобождения и проникновения приблизительно 25-30% применяемой концентрации активного ингредиента в течение первых 30-100 минут в здоровую, то есть имеющую интактный барьер кожу ex vivo. Существенно, что при повреждении кожи (например, бляшки при псориазе) могут быть достигнуты более благоприятные условия для проникновения по сравнению со здоровой кожей.
Местное применение ЦсА по сравнению с системным лечением предоставляет существенные преимущества. В случае местного применения, даже при лечении на большой площади, должны быть приняты во внимание лишь минимальные и не имеющие клинического значения системные побочные эффекты. Известные нежелательные действия фармацевтических средств, в частности, нарушение функции почек и артериальная гипертония, либо не ожидаются вообще, либо ожидаются в более низкой степени. Применение возможно даже для пациентов, у которых уже имеются развившиеся побочные действия в результате системного лечения и которые поэтому больше не лечатся ЦсА. В дополнение, благодаря местному применению получают увеличенный спектр эффективности. При множестве воспалительных дерматозов образование и действие монооксида азота (NO), который образуется из L-аргинина посредством фермента NO-синтазы, является центральным для патогенеза. Результаты самых последних исследований выявили, что индукция и поддержание воспаления в случае псориаза по существу опосредованы NO. ЦсА, как известно, представляет собой достаточный блокатор NO-синтазы (NOS), которая присутствует также в дермальных микроваскулярных эндотелиальных клетках благодаря изоферментам eNOS и iNOS, и ингибируется высокой концентрацией в ткани ЦсА после местного применения в большей степени, чем после системного применения. В дополнение, ЦсА также обладает ингибирующим пролиферацию действием в отношении кератиноцитов, которые влияют синергически на действие в отношении псориатической кожи при местном применении. Снижение стоимости лечения на пациента вследствие меньшего требуемого количества ЦсА также является благоприятным.
Недостатки местного применения и связанной с этим меньшей системной концентрации наблюдаются прежде всего в отсутствии эффекта в отношении лимфатических узлов, в которых происходит существенный процесс активации на уровне Т-клеток. В дополнение, не следует ожидать терапевтического эффекта в отношении артропатического псориаза.
Представленные тесты, во-первых, показали, что можно разработать медицинскую систему, которая удовлетворяет условиям проникновения ЦсА в достаточной концентрации в верхние дермальные слои. Представлены стабильные системы-носители, в которые ЦсА может быть введен в достаточном количестве. Загрузка системы преднамеренно была выбрана очень высокой, для того чтобы полностью использовать медицинские свойства систем и для того чтобы обеспечить благоприятные предпосылки для клинического применения. Меньшие концентрации ЦсА могут быть достигнуты без труда с достаточной клинической эффективностью. Тесты на высвобождение выявили, что количества фармацевтического средства от 25 до 40% высвобождаются в релевантное время и доступны для проникновения в кожу.
Тесты на проникновение в условиях ex vivo показали существенную важность для доклинической разработки. Они делают понятным, что после соответствующей продолжительности применения (30-100 мин) достигается проникновение концентрации активного ингредиента приблизительно 25-30% в дермальные слои или, соответственно, через них, и тем самым ингредиент становится доступным в желаемом месте действия.
Составные части препаратов были выбраны в соответствии с дерматологической точкой зрения. Не содержатся никакие сильнодействующие сенсибилизирующие вещества, и сами тесты продемонстрировали хорошую переносимость, что делает появление раздражающего или токсического действия очень маловероятным, даже в случае нарушения барьерной функции при различных дерматозах. Основной областью показаний является псориаз хронического стационарного типа или атопический дерматит. В дополнение, дается множество возможных показаний в связи с системным лечением. Возможным рассматривается, в частности, применение при коллагенозах, ожогах, трансплантациях кожи или слизистой оболочки и хронических язвах.
Применение систем предложено не только в отношении наружной части кожи. Принципиально, имеется возможность применения на глаза после трансплантации роговицы, или для лечения рубцового пемфигоида слизистой оболочки, либо применения в области слизистой оболочки ротовой полости в случае красного лишая слизистой или в качестве клизмы в случае хронических воспалительных заболеваний кишечника (например, М.Crohn, язвенный колит), если необходимо, также в виде интралюминальной пены.
| Состав микроэмульсий (ME), содержащих ииклоспорин (CsA) и гидрокортизон (НС) | |||
| Микроэмульсия с изопропилпальмитатом (ИПП-МЕ) | м[г] | % [мас./мас.] | |
| Циклоспорин А 2,0% (мас./мас.) | Циклоспорин А | 0,2 | 2,0 |
| Гидрокортизон | Гидрокортизон | 0,2 | 2,0 |
| Tagat® O2/Synperonic® PE/L 101 2:3 | Tagat® O2 | 0,8 | 8,0 |
| 20,0% (мас./мас.) | Synperonic® PE/L 101 | 1,2 | 12,,0 |
| Изопропилпальмитат (ИПП) 5,0% (мас./мас.) | Изопропилпальмитат | 0,3 | 0 3 |
| Пропиленгликоль/вода 2:1 73,0% (мас./мас.) | Пропиленгликоль | 4,87 | 48,7 |
| Вода | доб. 10,0 | 24,3 | |
| Микроэмульсия с ДМСО (ДМСО-МЕ) | |||
| Циклоспорин А 2,0% (мас./мас.) | Циклоспорин А | 0,2 | 2,0 |
| Гидрокортизон | Гидрокортизон | 0,2 | 2,0 |
| Tagat® O2/Synperonic® PE/L 121 2:3 | Tagat® O2 | 0,8 | 8,0 |
| 20,0% (мас./мас.) | Synperonic® PE/L 121 | 1,2 | 12,0 |
| Олеиновая кислота 5,0% (мас./мас.) | Олеиновая кислота | 0,3 | 3,0 |
| Диметилсульфоксид (ДМСО) 5,0% (мас./мас.) | Диметилсульфоксид | 0,5 | 5,0 |
| Пропиленгликоль/вода 2:1 68,0% (мас./мас.) | Пропиленгликоль | 4,53 | 45,3 |
| Вода | доб. 10,0 | 22,7 | |
| Микроэмульсия с олеиновой кислотой (ОК-МЕ) | |||
| Циклоспорин А 1,5% (мас./мас.) | Циклоспорин А | 0,15 | 1,5 |
| Гидрокортизон | Гидрокортизон | 0,2 | 2,0 |
| Tagat® O2/Synperonic® PE/L 121 2:3 | Tagat® O2 | 0,8 | 8,0 |
| 20,0% (мас./мас.) | Synperonic® PE/L 121 | 1,2 | 12,0 |
| Олеиновая кислота 5,0% (мас./мас.) | Олеиновая кислота | 0,3 | 3,0 |
| Пропиленгликоль/вода 2:1 73,5% (мас./мас.) | Пропиленгликоль | 4,9 | 49,0 |
| Вода | доб. 10,0 | 24,5 |
Для приготовления микроэмульсий (ME), содержащих гидрокортизон, использовали способ, описанный выше для приготовления микроэмульсий в отсутствие гидрокортизона. Гидрокортизон добавляли сразу после добавления циклоспорина к липофильной фазе, а именно соответствующее количество микрокристаллического гидрокортизона растворяли в липофильной фазе при комнатной температуре. Все остальные стадии приготовления соответствуют приготовлению микроэмульсий в отсутствие гидрокортизона.
1. Фармацевтический препарат в коллоидной форме для местного применения при лечении и профилактике патологических изменений кожи, и/или придатков кожи, и/или слизистых оболочек, включая слизистые оболочки желудочно-кишечного тракта, мочеполовых путей и бронхиальной системы, и/или конъюнктивы, содержащий
а) липофильную фазу в количестве 1-10% по массе,
б) смесь поверхностно-активного вещества и вспомогательного поверхностно-активного вещества в количестве 1-50% по массе, причем смесь поверхностно-активное вещество/вспомогательное поверхностно-активное вещество используется в массовом соотношении от 1,5 до 2,5 для поверхностно-активного вещества и от 2,5 до 3,5 для вспомогательного поверхностно-активного вещества,
где поверхностно-активное вещество выбрано из эфиров полиоксиэтиленглицерина и жирных кислот и эфиров полиоксиэтиленсорбитана и жирных кислот, и вспомогательное поверхностно-активное вещество выбрано из полоксамеров, блок-сополимеров полиоксиэтилена и полиоксипропилена,
в) гидрофильную фазу в количестве 40-80% по массе, и
г) в качестве активного ингредиента циклоспорин и/или его производные в концентрации 0,1-20% по массе.
2. Фармацевтический препарат по п.1, отличающийся тем, что липофильная фаза выбрана из фармацевтических масел, восков или жиров.
3. Фармацевтический препарат по п.2, отличающийся тем, что липофильная фаза выбрана из триглицеридов, изопропилмиристата, 2-октилдодеканола, изопропилпальмитата или олеиновой кислоты.
4. Фармацевтический препарат по п.1, отличающийся тем, что смесь поверхностно-активное вещество/вспомогательное поверхностно-активное вещество включает в себя эфир полиоксиэтиленглицерина и жирных кислот и полоксамеры в массовом соотношении 2:3.
5. Фармацевтический препарат по п.1, отличающийся тем, что гидрофильная фаза выбрана из полиолов, воды или полиол-буферных смесей.
6. Фармацевтический препарат по п.5, отличающийся тем, что гидрофильная фаза представляет собой смесь пропиленгликоля и воды в соотношении от 1:10 до 10:1, предпочтительно 2:1.
7. Фармацевтический препарат по п.1, отличающийся тем, что циклоспорин А и/или его производные содержатся в концентрации 0,01-10% по массе, предпочтительно 0,5-5% по массе.
8. Фармацевтический препарат по п.1, отличающийся тем, что, по меньшей мере, один дополнительный активный ингредиент, например кортикостероид, содержится в дополнение к циклоспорину А и/или его производным.
9. Фармацевтический препарат по п.1, отличающийся тем, что дополнительно содержатся агенты, усиливающие проникновение, такие как, например, диметилсульфоксид или короткоцепочечные спирты, в концентрации 5-10% по массе.
10. Фармацевтический препарат по п.1, отличающийся тем, что дисперсная фаза имеет диаметры частиц, находящиеся в диапазоне от 5 до 200 нм.
11. Применение фармацевтического препарата по любому из пп.1-10 для лечения и профилактики воспалительных заболеваний кожи и слизистых оболочек.
12. Применение фармацевтического препарата по любому из пп.1-10 для лечения и профилактики атопического дерматита.
13. Применение фармацевтического препарата по любому из пп.1-10 для лечения и профилактики псориаза.
14. Применение фармацевтического препарата по любому из пп.1-10 для лечения и профилактики коллагенозов, хронических ран, ожогов и/или хронических воспалительных заболеваний кожи и слизистых оболочек.
15. Применение фармацевтического препарата по любому из пп.1-10 для лечения и профилактики хронических воспалительных заболеваний кишечника.
16. Применение фармацевтического препарата по любому из пп.1-10 для лечения и профилактики воспалительных заболеваний глаз.
17. Применение фармацевтического препарата по любому из пп.1-10 для лечения и профилактики реакций отторжения после трансплантации.