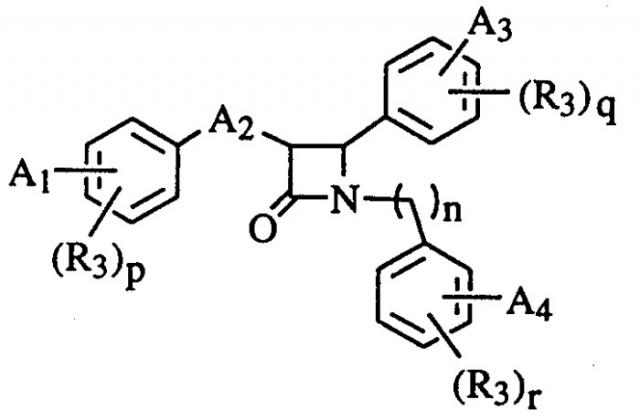
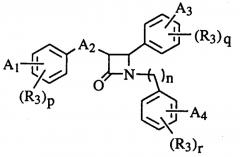
Бета-лактамы, способ получения указанных соединений и сывороточные гипохолестеринемические средства, содержащие такие соединения
Иллюстрации
Показать всеИзобретение относится к новым соединениям формулы (I)
где A1 означает Н, галоген, C1-C5алкил, группу формулы (а)
A2 означает C1-C5алкил, C1-C5алкоксильную цепь, C1-C5алкенил, гидроксиC1-C5алкил, карбонилC1-C5алкил;
A3 означает галоген или группу формулы (а);
A4 означает C1-C5алкил, Н, галоген, COOR1, C1-C5алкокси, группу формулы (a) и (b)
R1 означает водород, C1-C5 алкил,
R2 означает -CH2OH, -COOR1;
R3 означает -OH, -OC(O)-R1;
R4 означает -(CH2)kR5(CH2)l-;
R5 обозначает простую связь (-), -СН=СН-, -OCH2-, карбонильную группу или -СН(ОН)-, и R4 соединяется с тетрагидропирановым кольцом посредством углерод-углеродной связи;
k и l равны 0, 1 или целому числу более 1; k+l=10 или меньшему числу; n=0 или 1; p, g, r=0; причем один из A1, A2 и A4 в формуле I должен быть группой формулы (а), или их фармацевтически приемлемые соли. Описаны способы их получения. Соединения I могут быть использованы в качестве гипохолестеринемического средства для снижения уровня холестерина в сыровотке.
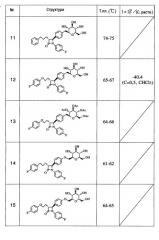
5 н.п. ф-лы, 3 табл.
Реферат
Данное изобретение относится к новым b-лактамам, способу получения таких соединений и сывороточным гипохолестеринемическим средствам, содержащим такие соединения.
Гиперхолестеринемия является фактором риска для атеросклеротической болезни сердца. Атеросклеротическая болезнь сердца является основной причиной смерти и распространенности сердечно-сосудистых заболеваний в мире (Lipid Research Clinics Program. J. Am. Med. Assoc., 1984, 251, 351 или 365). В последнее время в клиниках в качестве гипохолестеринемических средств используют ингибиторы редуктазы HMG-CoA. Показано, что ингибиторы редуктазы HMG-CoA имеют сильную гипохолестеринемическую активность, однако, сообщается, что они обладают нежелательным побочным действием (Mevacor in Physician's Desk Reference, 49th ED, Medical Economics Date Production Company, 1995, 1584). Поэтому нужны сильные и безопасные сывороточные гипохолестеринемические средства.
Сообщается, что встречающиеся в природе гликозиды обладают гипохолестеринемической активностью (M.A. Farboodniay Jahromi et al., J. Nat. Prod., 1993, 56, 989; K.R. Price, The Chemistry and Biological Significance of Saponins in Foods and Feeding Stuffs. CRC Critical Reviews in Food Science and Nutrition, CRC Press, 1987, 26, 27). Полагают, что такие гликозиды снижают уровень холестерина в сыворотке из-за ингибирования поглощения холестерина в тонкой кишке (P.A. McCarthy et al., J. Med. Chem., 1996, 39, 1935). Кроме того, сообщается о собственной гипохолестеринемической активности некоторых b-лактамов (S.B. Rosenblum et al., J. Med. Chem., 1998, 41, 973; B. Ram et al., Indian J. Chem., 1990, 29B, 1134, пат. США 4893597).
b-Лактамы сами обладают слабой ингибирующей активностью в отношении поглощения холестерина, и, кроме того, глюкурониды b-лактамов являются более сильными, чем исходные b-лактамы. В процессе всасывания b-лактамы после перорального приема быстро превращаются в тонкой кишке в глюкурониды, и образовавшиеся глюкурониды выделяются через желчные протоки в тонкую кишку. Такие конъюгированные производные b-лактам-О-глюкуроновой кислоты локализуются в слизистой оболочке тонкой кишки в месте действия и ингибируют всасывание холестерина (M. van Heek et al., Brit. J. Pharmacol., 2000, 129, 1748; J. Pharmacol. Exp. Ther., 1997, 283, 157). Поскольку вышеописанные b-лактамы обладают гипохолестеринемической активностью в тонкой кишке за счет конъюгированных производных b-лактам-О-глюкуронатов, синтезировали гипохолестеринемически активные подобные соединения, содержащие глюкозу или производные глюкуроновой кислоты (W.D. Vaccaro et al., Bioorg. Med. Chem. Lett., 1998, 8. 313). Однако полагают, что О-гликозидные связи в таких соединениях после перорального приема легко гидролизуются гликозидазой, присутствующей в тонкой кишке, и предполагается, что гипохолестеринемическая активность таких соединений будет падать. Имея в виду, что местом действия таких b-лактамов является слизистая оболочка тонкой кишки, необходимы более хорошие ингибиторы всасывания холестерина, обладающие высокой эффективностью и длительным периодом действия, действующие только в тонкой кишке. Ожидается, что идеальные ингибиторы всасывания холестерина не поглощаются в тонкой кишке и выводятся без всасывания в тонкой кишке, так что побочное действие после всасывания в тонкой кишке уменьшается.
Основной задачей настоящего изобретения являются новые гипохолестеринемические средства, содержащие в молекулах b-лактамную группу и С-гликозид, устойчивые к метаболизму под действием гликозидазы и гидролизу кислотами или основаниями. А именно, задачей настоящего изобретения являются гибридные молекулы b-лактама и С-гликозида как гипохолестеринемические средства.
Подробное описание изобретения
Авторы полагают, что гибридные соединения b-лактама и С-ликозидов являются метаболически устойчивыми против гликозидазы и гидролиза кислотами или основаниями (R.J. Linhald et al., Tetrahedron, 54, 9913-9959, 1998). Во-первых, предполагается, что b-лактам-С-гликозидные соединения являются устойчивыми в отношении действия гликозидазы, присутствующей в тонкой кишке, и такие гибриды, возможно, локализуются в слизистой оболочке в тонкой кишке длительное время. Во-вторых, авторы полагают, что такие соединения слабо абсорбируются в слизистой оболочке тонкой кишки, что уменьшает побочное действие. В попытках разработки новых b-лактамов с гипохолестеринемической активностью авторы обнаружили, что соединения общей формулы (I) являются превосходными гипохолестеринемическими средствами.
А именно, изобретение относится к соединениям общей формулы (I)
(I)
где А1, А3 и А4 представляют собой атом водорода, атом галогена, алкильную группу с одним-пятью атомами углерода, алкоксигруппу с одним-пятью атомами углерода, -COOR1, группу приведенной далее формулы (b)
(b)
где R1 представляет собой атом водорода или алкильную группу с одним-пятью атомами углерода или группу приведенной далее формулы (а)
(a)
где R2 представляет собой группу -СН2ОН, группу -СН2ОС(О)-R1 или группу -СО2-R1; R3 представляет собой группу -ОН или группу -С(О)-R1; R4 представляет собой -(CH2)kR5(CH2)l- (k и l равны 0, 1 или большему целому числу; k+l равно 10 или меньшему целому числу); R5 обозначает связь: простую связь (-), -СН=СН-, -ОСН2-, карбонильную группу или -СН(ОН)-;
один из А1, А3 и А4 в формуле (I) должен представлять собой группу вышеуказанной формулы (а). А2 представляет собой алкильную цепь с одним-пятью атомами углерода, алкоксильную цепь с одним-пятью атомами углерода, алкенильную цепь с одним-пятью атомами углерода, гидроксиалкильную цепь с одним-пятью атомами углерода или карбонилалкильную цепь с одним-пятью атомами углерода; n, p, q или r равны 0, 1 или 2,
или к их фармацевтически приемлемым солям.
Кроме того, данное изобретение относится к способу получения соединений общей формулы (I) и их фармацевтически приемлемых солей. Данное изобретение также относится к сывороточным гипохолестеринемическим средствам, содержащим соединения общей формулы (I) и их фармацевтически приемлемые соли. Кроме того, данное изобретение относится к сывороточному гипохолестеринемическому средству для комбинированной терапии с применением соединений общей формулы (I) и ингибиторов b-актамаз.
Фармацевтически приемлемые соли данного изобретения упоминаются далее. В качестве солей минеральных оснований можно назвать натриевые или калиевые соли соединений общей формулы (I). В качестве солей органических кислот можно назвать соли янтарной кислоты, малеиновой кислоты, толуолсульфоновой кислоты или винной кислоты. Соединения общей формулы (I) можно вводить перорально одни или в сочетании с фармацевтически приемлемыми носителями или разбавителями. Их можно вводить перорально в виде порошков, гранул, таблеток, капсул обычными фармацевтическими методами и также парентерально, а именно интраректальным способом, в виде суппозиториев и инъекций.
Дозировка колеблется в интервале 0,01-1000 мг в сутки и вводится в виде однократной дозы или нескольких доз. Однако будут иметь место вариации в зависимости от состояния, возраста и массы тела реципиента. Кроме того, сывороточная гипохолестеринемическая активность усиливается при комбинировании соединений общей формулы (I) с ингибиторами b-лактамаз.
Ингибиторы b-лактамаз, такие как клавулановая кислота, представляют собой лекарственные средства, ингибирующие разрушение b-лактамного кольца бактериями.
Далее приводятся примеры соединений, хотя указанные примеры не являются ограничительными.
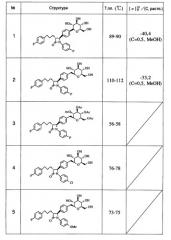
(1) (4S*,3R*)-4-{4-[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]фенил}-1-(4-фторфенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
(2) (4S*,3R*)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-фторфенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
(3) (3S,2R,4R,5R,6R)-2-[(4-{(4S*,3R*)-1-(4-Фторфенил)-3-[3-(4-фторфенил)пропил-2-оксоазетидин-4-ил}енил)метил]-4,5-диацетилокси-6-(ацетоксиметил)пергидро-2Н-пиран-3-илацетат
(4) (4S*,3R*)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-хлорфенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
(5) (4S*,3R*)-4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-метоксифенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
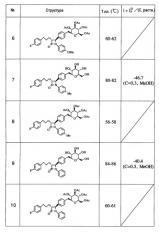
(6) (3S,2R,4R,5R,6R)-2-[(4-{(4S*,3R*)-1-(4-Метоксифенил)-3-[3-(4-фторфенил)пропил]-2-оксоазетидин-4-ил]фенил)метил]-4,5-диацетилокси-6-(ацетоксиметил)пергидро-2Н-пиран-3-илацетат
(7) (4S*,3R*)-4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-метилфенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
(8) (3S,2R,4R,5R,6R)-2-[(4-{(4S*,3R*)-1-(4-Метилфенил)-3-[3-(4-фторфенил)пропил]-2-оксоазетидин-4-ил}енил)метил]-4,5-диацетилокси-6-(ацетоксиметил)пергидро-2Н-пиран-3-илацетат
(9) (4S*,3R*)-4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-фенил-3-[3-(4-фторфенил)пропил]азетидин-2-он
(10) (3S,2R,4R,5R,6R)-2-[(4-{(4S*,3R*)-1-Фенил-3-[3-(4-фторфенил)пропил]-2-оксоазетидин-4-ил}енил)метил]-4,5-диацетилокси-6-(ацетоксиметил)пергидро-2Н-пиран-3-илацетат
(11) (4S*,3R*)-4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-фторфенил)-3-[3-(фенил)пропил]азетидин-2-он
(12) (4S*,3R*)-4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-фторфенил)-3-[2-(4-фторфенокси)этил]азетидин-2-он
(13) (3S,2R,4R,5R,6R)-2-[(4-{(4S*,3R*)-1-(4-Фторфенил)-3-[2-(4-фторфенокси)этил]-2-оксоазетидин-4-ил}енил)метил]-4,5-диацетилокси-6-(ацетоксиметил)пергидро-2Н-пиран-3-илацетат
(14) (4S*,3R*)-4-(4-{[(4S,5S,2R,3R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метокси}енил)-1-(4-фторфенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
(15) (4S*,3R*)-4-(4-{[(4S,5S,2R,3R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метокси}енил)-1-(4-фторфенил)-3-[2-(4-фторфенокси)этил]азетидин-2-он
(16) (4S*,3R*)-4-(4-{[(4S,5S,2R,3R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метокси}енил)-1-фенилметил-3-[3-(4-фторфенил)пропил]азетидин-2-он
(17) (2S,3S,4R,5R,6R)-6-[4-{(4S*,3R*)-1-(4-Фторфенил)-3-[3-(4-фторфенил)пропил]-2-оксоазетидин-4-ил}енил)метил]-3,4,5-тригидроксипергидро-2Н-пиран-2-карбоновая кислота
(18) Этиловый эфир 2-{4-[(4S*,3R*)-4-{[(5S,2R,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]-метил}енил-3-[3-(4-фторфенил)пропил]-2-оксоазетидинил]фенокси}-2-метилпропионовой кислоты
(19) 2-{4-[(4S*,3R*)-4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил-3-[3-(4-фторфенил)пропил]-2-оксоазетидинил]фенокси}-2-метилпропионовая кислота
(20) Этиловый эфир 2-{4-[(4S*,3R*)-4-{[(5S,2R,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил-3-[3-(4-метилфенил)пропил]-2-оксоазетидинил]фенокси}-2-метилпропионовой кислоты
(21) 2-{4-[(4S*,3R*)-4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил-3-[3-(4-метилфенил)пропил]-2-оксоазетидинил]фенокси}-2-метилпропионовая кислота
(22) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-фторфенил)азетидин-2-он
(23) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-фенилазетидин-2-он
(24) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-метилфенил)азетидин-2-он
(25) (4S,3R)-4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-торфенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
(26) (4S,3R)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-торфенил)-3-[3-(4-фторфенил)-3-оксопропил]азетидин-2-он
(27) (4S,3R)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-фенил-3-[3-(4-фторфенил)-3-оксопропил]азетидин-2-он
(28) (4S,3R)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-метилфенил)-3-[3-(4-фторфенил)-3-оксопропил]азетидин-2-он
(29) 4-[(4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-2-оксоазетидинил]бензойная кислота
(30) 4-[(4S,3R)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-3-[3-(4-фторфенил)-3-оксопропил]-2-оксоазетидинил]бензойная кислота
(31) 4-[(4S,3R)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-3-[3-(4-фторфенил)пропил]-2-оксоазетидинил]бензойная кислота
(32) 3-[(2E)-3-(4-Фторфенил)-2-пропенил](4S,3R)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-фторфенил)азетидин-2-он
(33) (4S,3R)-4-{4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]фенил}-1-(4-фторфенил)-3-[3-(4-фторфенил)пропил]азетидин-2-он
(34) (4S,3R)-4-{4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]фенил}-1-(4-фторфенил)-3-[3-(4-фторфенил)-3-оксопропил]азетидин-2-он
(35) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]фенил}-1-(4-фторфенил)азетидин-2-он
(36) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]фенил}-1-(4-метилфенил)азетидин-2-он
(37) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]-1-фенилазетидин-2-он
(38) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-1-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-(4-фторфенил)азетидин-2-он
(39) (4S,3R)-3-[(3S)-3-(4-{[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-3-гидроксипропил]-1-фенил-4-(4-фторфенил)азетидин-2-он
(40) (4R*,3R*)-4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-3-[3-(4-фторфенил)пропил]-1-(4-фторфенил)азетидин-2-он
(41) 3-((3S)-3-Гидрокси-3-фенилпропил)(4S,3R)-4-(4-{[(2S, 5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-фенилазетидин-2-он
(42) Этиловый эфир 4-[3-((3S)-3-(4-фторфенил)-3-гидроксипропил](4S,3R)-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-2-оксоазетидинил]бензойной кислоты
(43) 4-(4-{[(5S,2R,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)(4S,3R)-1-(4-метилфенил)-3-[3-(4-фторфенокси)этил]азетидин-2-он
(44) 3-(3-Фенилпропил)(4S,3R)-4-(4-{[(5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метил}енил)-1-фенилазетидин-2-он
(45) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]этен}енил)-1-(4-фторфенил)азетидин-2-он
(46) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]этил}енил)-1-(4-фторфенил)азетидин-2-он
(47) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]-1-пропен-3-ил}енил-1-(4-фторфенил)азетидин-2-он
(48) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]пропил}енил-1-(4-фторфенил)азетидин-2-он
(49) 3-((3S)-{4-[(2S,5S,3R,4R,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]фенил}-3-гидроксипропил]-(4S,3R)-1,4-бис(4-фторфенил)азетидин-2-он
(50) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метоксипропил-3-ил}енил-1-(4-фторфенил)азетидин-2-он
(51) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]метокси-2-пропен-3-ил}енил-1-(4-фторфенил)азетидин-2-он
(52) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]-1-бутен-4-ил}енил-1-(4-фторфенил)азетидин-2-он
(53) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]бутил}енил-1-(4-фторфенил)азетидин-2-он
(54) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]-1-пентен-5-ил}енил-1-(4-фторфенил)азетидин-2-он
(55) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]пентил}енил-1-(4-фторфенил)азетидин-2-он
(56)(4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]этил-2-ил}енил-1-фенилазетидин-2-он
(57) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)пергидро-2Н-пиран-2-ил]этил-2-ил}енил-1-(4-метилфенил)азетидин-2-он
(58) (4S,3R)-3-[(3S)-3-(4-Фторфенил)-3-гидроксипропил]-4-(4-{[(2S,5S,3R,4R,6R)-3,4,5-тригидрокси-6-(карбоксил)пергидро-2Н-пиран-2-ил]этил-2-ил}енил-1-(фенил)азетидин-2-он
Приводятся типичные способы получения соединений согласно изобретению, но они не ограничиваются указанными соединениями. Соединения, показывающие удельное вращение, получают в виде оптически активных соединений или выделяют в виде оптически активных соединений подходящими способами, и определяют удельное вращение.
Соединения общей формулы (I) можно получить в виде следующих соединений.
Способ 1
(1) (а) В случае, когда в соединениях общей формулы (I) R4 представляет собой -СН2-, соединение получают путем взаимодействий, описанных далее.
В качестве исходного вещества используют соединение (1-2), полученное взаимодействием тетрабензилглюкуронолактона (1-1) с реагентом Теббе (Tebbe) (T.V. Rajanbabu et al., J. Org. Chem., 1986, 51, 5458). Соединение (1-2) подвергают реакции сочетания по Сузуки с соединением (1-3) (C.R. Johnsone et al., Synlett, 1997, 1406) с последующим десилилированием, и получают соединение (1-4).
(b) Соединение (1-5) получают окислением гидроксильной группы соединения (1-4) с образованием альдегида (1-5).
(с) Альдегид (1-5) и амин (1-6) конденсируют в присутствии молекулярных сит и п-толуолсульфоновой кислоты, и получают соединение (1-7).
Имин (1-7) и соединение (1-8) подвергают реакции Штаудингера посредством кипячения с обратным холодильником в присутствии основания и получают b-лактам. В этой реакции, когда в качестве основания используют три-н-бутиламин, получают транс-b-лактам. Когда в качестве основания используют LDA (диизопропиламид лития), получают цис-b-лактам.
Кроме того, можно также получить асимметричный b-лактам, добавляя в реакционную смесь хиральный лиганд (A.M. Hafez et al., Org. Lett., 2000, 2(25), 3963-3965). Затем каталитическим гидрированием можно получить дебензилированное соединение (1-9).
(d) Соединение (1-10) получают ацетилированием соединения (1-9).
(2) В случае, когда в соединениях общей формулы (I) R4 представляет собой -СН2-, соединение получают путем взаимодействий, описанных далее.
Соединение (1-11) вводят во взаимодействие с реактивом Гриньяра (1-12) и получают соединение (1-13) (M.F. Wong et al., J. Carbohydr. Chem., 1996, 15(6), 763; C.D. Hurd et al., J. Am. Chem. Soc., 1945, 67, 1972; H. Togo et al., Synthesis, 1998, 409). С другой стороны, соединение (1-11) вводят во взаимодействие с реактивом Гриньяра (1-12) с последующим дегидроксилированием триэтилсилилгидридом. Образовавшуюся гидроксильную группу превращают в удаляемую группу, такую как тозильная группа или галоген, и полученное соединение вводят во взаимодействие с основанием, и получают олефин. Затем гидрированием олефина получают соединение (1-13). Соединение (1-13) превращают в реактив Гриньяра с помощью металлического магния и вводят во взаимодействие с ДМФА (диметилформамидом), и получают соединение (1-14). Соединение (1-15) получают взаимодействием реактива Гриньяра соединения (1-13) с сухим льдом (СО2).
Соединение (1-14) и соединение (1-15), полученные так, как описано выше, являются промежуточными соединениями синтеза соединений общей формулы (I) согласно способу 1-(1)-(с) и (d).
Способ 2
(1) В случае, когда в соединениях общей формулы (I) R4 представляет собой простую связь, соединения получают путем взаимодействий, описанных далее.
Тетрабензилглюкуронолактон (1-1) вводят во взаимодействие с соединением (2-1) с последующим взаимодействием с Et3SiH и BF3Et2O, и получают соединение (2-2) (J.M. Lancelin et al., Tetrahedron Lett., 1983, 24, 4833). Соединение (2-2) представляет собой промежуточное соединение синтеза соединений общей формулы (I) согласно способу 1-(1)-(b), (с) и (d).
(2) В случае, когда в соединениях общей формулы (I) R4 представляет собой простую связь, соединения получают путем взаимодействий, описанных далее.
Соединение (2-4) получают взаимодействием соединения (1-11) с реактивом Гриньяра (2-3) (F. Marquez et al., An. Quim., Ser. C, 1983, 79(3), 428).
(В формуле 1-11 Х имеет значения, указанные выше).
Соединение (1-14) получают превращением метильной группы соединения (2-4) в альдегидную группу (P.S. Portoghese et al., J. Med. Chem., 2000, 43, 2489).
Соединение (2-2) получают восстановлением соединения (1-14) NaBH4.
Способ 3
(1) В случае, когда в соединениях общей формулы (I) R4 представляет собой -ОСН2-, соединение получают путем взаимодействий, описанных далее.
(а) Соединение (3-1), полученное известным способом (D. Zhai et al., J. Am. Chem. Soc., 1988, 110, 2501; P. Allevi et al., J. Carbohydr. Chem., 1993, 12(2), 209), подвергают реакции Мицунобу с соединением (3-2), и получают соединение (3-3).
(b) Соединение (3-4) получают восстановлением метилэфирной группы соединения (3-3) LiAlH4 до спиртовой группы.
Соединение (3-4) является промежуточным соединением синтеза соединений общей формулы (I) по способу 1-(1)-(b), (с) и (d).
Способ 4
В случае, когда в соединениях общей формулы (I) один из А1, А3 и А4 является группой формулы, приведенной ниже, соединение получают путем взаимодействий, описанных далее.
Соединение (4-1) вводят во взаимодействие с алкиловым эфиром 2-бромизомолочной кислоты (4-2) в присутствии К2СО3 с последующим гидрированием, и получают соединение общей формулы (I). С другой стороны, гидролизом с гидроксидом лития получают соединение (4-3), и последующим удалением защитной группы получают соединение общей формулы (I).
Способ 5
В случае, когда в соединениях общей формулы (I) R2 представляет собой -СО2Н, соединение получают путем взаиммодействий, описанных далее.
Соединение (5-1) окисляют ТЕМРО (2,2,6,6-тетраметил-1-пиперидинилокси, свободный радикал), и получают соединение (5-2).
Способ 6
Соединение (6-3) получают взаимодействием соединений (6-1) и (6-2). Соединение (6-3) окисляют до сульфона с последующей реакцией Рамберга-Беклунда (P.S. Belica et al., Tetrahedron Lett., 1998, 39, 8225; F.K. Griffin et al., Tetrahedron Lett., 1998, 39, 8179) и получают соединение (6-4). Соединение (6-4) гидрируют с последующим взаимодействием с TBAF и получают соединение (1-4). Соединение (1-4) можно использовать как синтетический материал для получения соединения общей формулы (I) согласно способу 1.
Способ 7
(1) В случае, когда в соединениях общей формулы (I) R3 представляет собой -ОН- и -ОС(О)R1, соединения получают путем взаимодействий, описанных далее.
Соединение (7-3) получают гликозидированием соединения (7-1) соединением (1-11) в присутствии кислоты Льюиса (BF3·Et2O, SnCl4, AgOTf-Cp2HfCl2, и т.п.) (R.R. Schmidt et al., Synthesis, 1993, 325). Реакция проходит в две стадии, первая стадия представляет собой О-гликозидирование, и вторая стадия представляет собой О-гликозидную перегруппировку до С-гликозида. Кроме того, соединение (7-3) можно превратить в соединение (7-4) этерификацией фенольной гидроксильной группы. Соединения (7-3) и (7-4) можно использовать в качестве синтетических материалов для получения соединений общей формулы (I) согласно способам 1 и 3.
(2) В случае, когда в соединениях общей формулы (I) R3 представляет собой -ОН- и -ОС(О)R1, соединения получают путем взаимодействий, описанных далее.
Из соединения (7-6), полученного такой же процедурой, как в способе 7-(1), удаляют защитную группу и получают соединение (7-7). Одну из гидроксильных групп соединения превращают в трифлатную, затем осуществляют взаимодействие с монооксидом углерода и получают соединение (7-3) (R.E. Dolle et al., Chem. Commun., 1987, 904). Соединение (7-3) используют в качестве исходного вещества для соединений общей формулы (I) согласно способу 7-(1), 1 и 3.
Соединение (7-3) также получают той же реакцией сочетания соединения (7-11) с соединением (1-11) с образованием соединения (7-12), и последующей галоформной реакцией ацетильной группы получают соединение (7-3) (S. Kajigaeshi et al., Synthesis, 1985, 674).
(3) В случае, когда в соединениях общей формулы (I) R3 представляет собой -ОН- и -ОС(О)R1, соединения получают путем взаимодействий, описанных далее.
Соединение (7-10) получают арил-С-гликозидированием соединения (7-9) согласно способу 7(1). Соединение (7-10) используют в качестве исходного вещества для соединений общей формулы (I) согласно способу 8.
(В формуле 1-11 Z имеет значения, указанные выше.)
Способ 8
Способы получения оптически активных соединений (I)
(а) Бензилирование гидроксигруппы D-п-гидроксифенилглицина (8-1) с использованием способа E. Wunsch's (Chem. Ber., 1958, 91, 543) дает соединение (8-2).
Соединение (8-3) получают посредством защиты аминогруппы соединения (8-2) Вос-группой.
Соединение (8-3) превращают в соединение (8-4) путем гомологизации (W.W. Ogilvie et al., Bioorg. Med. Chem., 1999, 7, 1521). Затем получают соединение (8-5), удаляя защитную Вос-руппу соединения (8-4).
Циклизация соединения (8-5) с использованием способа W.W. Ogilvie (W.W. Ogilvie et al., Bioorg. Med. Chem., 1999, 7, 1521) дает b-лактам (8-6).
Соединение (8-5) также получают в виде оптически активного соединения способом, описанным далее.
А именно, взаимодействием соединения (8-7) с оптически активными производными аминокислот (8-8) в присутствии кислотного катализатора получают соединение (8-9). Соединение (8-9) восстанавливают непосредственно до соединения (8-11). Соединение (8-11) также получают восстановлением олефина (например, с NaHB(OAc)3, NaBH4) и обработкой сильной кислотой (например, НСО2Н, Et3SiH) (C. Cimarell et al., J. Org. Chem., 1996, 61, 5557) или гидрогенолизом. Соединение (8-11) дает соединение (8-5) реакцией переэтерификации с BnOH. Соединение (8-5) можно превратить в соединение (8-6) таким же способом, какой описан выше.
b-Лактам (8-6) N-алкилируют по способу D.M.T. Chan's (Tetrahedron Lett., 1998, 39, 2933) и затем дебензилируют, и получают соединение (8-12).
Соединение (8-13) получают реакцией сочетания по Сузуки соединения (8-12) и производных глюкозы (1-2) согласно способу C.R. Johnson (C.R. Johnson et al., Synlett., 1997, 1406).
Соединение (8-13) вводят во взаимодействие с LDA с последующим С-алкилированием метилакрилатом и получают соединение (8-14).
Соединение (8-14) по эфирной группе превращают в хлорангидрид, осуществляют сочетание с соединением (8-15) с использованием способа Negishi и получают соединение (8-16).
Соединение (8-16) дебензилируют до соединения (8-17) и затем осуществляют асимметричное восстановление кетонной группы соединения (8-17) по способу E.J. Corey (E.J. Corey et al., J. Am. Chem. Soc., 1987, 109, 7925).
(b) Соединение (8-13) вводят во взаимодействие с LDA с последующим взаимодействием с соединением (8-20) и получают соединение (8-21). Соединение (8-22) получают гидрированием соединения (8-21).
В случае, когда А1 в общей формуле (I) представляет собой
например, согласно способу 8, соединение 39 получают из указанного далее соединения (8-23), соответствующего соединению (8-15).
В случае, когда А4 в общей формуле (I) представляет собой
например, согласно способу 8, соединение 38 получают из указанного далее соединения (8-24), соответствующего соединению (8-12)
Соединение (8-25) также получают ферментативным разделением рацемата (S.J. Faulconbridge et al., Tetrahedron Lett., 2000, 41, 2679). Соединение (8-25) можно превратить в соединение общей формулы (2) сочетанием по Сузуки, как указано выше.
Способ 9
Способ получения оптически активных соединений (II)
Соединение (9-1) конденсируют с соединением (9-2) для получения соединения (9-3) по способу K. Tomioka (K. Tomioka et al., J. Chem. Soc., Chem. Commun., 1999, 715). Соединение общей формулы (I) получают удалением защитной группы соединения (9-3). Соединение (9-3) также получают взаимодействием силиленольного эфира с кислотой Льюиса вместо соединения (9-1).
Способ 10
Способ получения оптически активных соединений (III)
Соединение (10-1) конденсируют с соединением (9-2) для получения соединения (10-4) по способу E.J. Corey (E.J. Corey et al., Tetrahedron Lett., 1991, 32, 5287). Соединение общей формулы (I) получают удалением защитной группы соединения (10-4).
Способ 11
Способ получения оптически активных соединений (IV)
(R)-(+)-2,10-Камфорсультам (11-1) вводят во взаимодействие с хлорангидридом (11-2) и получают соединение (11-3). Соединение (11-5) получают реакцией сочетания соединения (11-3) и соединения (11-4) в присутствии кислот Льюиса (TiCl4, BF3·OEt2). Соединение (11-5) вводят во взаимодействие с BSA с последующим взаимодействием с TBAF (фторидом н-етрабутиламмония) и получают b-лактам (11-6).
Полученное соединение (11-6) превращают в соединение (8-15) таким же способом, как способ 8.
Соединение (11-6) можно использовать в качестве исходного вещества для получения соединения общей формулы (I) согласно способу 8. Кроме того, когда вместо соединения (11-4) используют соединение (11-7), таким же способом можно получить соединение (11-8), соответствующее соединению (11-6).
Соединение (11-9) можно получить из соединения (11-8) таким же способом, как способ 7.
Соединение (11-9) можно использовать в качестве исходного вещества для соединений общей формулы (I) согласно способу 8.
Способ 12
Соединение (11-6) подвергают реакции Хека с соединением (12-1), полученным способом, описанным в литературе (M. Yokoyama et al., Synthesis, 1998, 409), и получают соединение (12-2) (R.F. Heck et al., J. Am. Chem. Soc., 1968, 90, 5518). Соединение (12-2) можно использовать в качестве исходного вещества для соединений общей формулы (I) согласно способу 8.
Соединение (12-3) получают гидрированием соединения (12-2). Соединение (12-3) можно использовать в качестве исходного вещества для соединений общей формулы (I) согласно способу 8.
Способ 13
С-Гликозидирование соединения (13-1) соединением (1-11) (R6 представляет собой -Ме, -Br или -СН2OTBS) в присутствии кислоты Льюиса (BF3·OEt2, ZnCl2, AgOTf) дает соединение (13-2) (K.C. Nicolaou et al., J. Chem. Soc., Chem. Comm., 1984, 1153). R6 в соединении (13-2) превращают в альдегидную группу таким же способом, как способ 1-(1)-(6), 1-(2) или 2-(2). Полученное соединение можно использовать в качестве исходного вещества для соединений общей формулы (I) согласно способу 1.
Способ 14
Соединение (14-1) подвергают реакции сочетания, такой как реакция сочетания по Сузуки и реакция Гриньяра (Angew. Chem. Int. Ed. Engl., 2000, 4415), или алкилированию в присутствии основания. После удаления защитной группы получают соединение (14-3).
Способ 15
Соединение (15-1), полученное способом L. Dheilly (L. Dheilly et al., Carbohydr. Res., 1992, 224, 301), превращают в соединение (15-2) путем восстановления и галогенирования. Соединение (15-2) переводят в металлоорганический реактив (реактив Гриньяра, цинкорганический реактив) и затем вводят в реакцию сочетания с соединением (15-3) в присутствии палладиевых или никелевых катализаторов. Затем циклизацией получают соединение (15-4).
Способ 16
Соединение (16-1) можно получить реакцией Хека с использованием соединения (12-1) и соединения (15-3) так же, как в способе 12. Соединение (16-1) превращают в соединение общей формулы (I) согласно способу 17.
Способ 17
Соединение (17-1) обрабатывают гидроксидом лития для удаления камфорсультама и получают соединение (17-2). (Камфорсультам можно собрать и использовать повторно). Затем соединение (17-2) циклизуют с помощью POCl3 в растворителе, таком как дихлорметан или дихлорэтан, и получают соединение общей формулы (I). Соединение общей формулы (I) также получают с использованием конденсирующих агентов, таких как DCC (1,3-ициклогексилкарбодиимид) или DEPC (диэтилфосфорилцианид), в дихлорметане или ДМФА в присутствии основания. Кроме того, соединение общей формулы (I) также получают с использованием реагента Мицунобу DEAD (диэтилазодикарбоксилата) или DIAD (диизопропилазодикарбоксилата) с помощью Bu3P или Ph3P, или взаимодействием с (PyS)2, или после взаимодействия с 2,6-ихлорбензоилхлоридом или 2,4,6-трихлорбензоилхлоридом в присутствии NaH и обработки основанием, подобным раствору NaOH, с образованием соединения общей формулы (I).
Иначе, соединение (17-2) этерифицируют до соединения (17-3) с последующим взаимодействием с основанием, таким как LDA, LiHMDS (бис(триметилсилил)амид лития), NaHMDS (бис(триметилсилил)амид натрия), NaH, трет-BuOK, в растворителе, таком как ТГФ, и получают соединение общей формулы (I). Соединение общей формулы (I) также получают взаимодействием реактива Гриньяра, такого как EtMgBr, трет-BuMgBr, с соединением (17-3). Соединение общей формулы (I) получают с применением той же реакции к соединению (17-1).
Способ 18
Соединение (18-2) получают окислением SeO2 соединения (18-4) или окислением соединения (18-4) Pd(OAc)2-бензохинон-HClO4 и затем асимметричным восстановлением кетонной группы соединения (18-2) получают соединение (18-3). Соединение (18-3) также получают гидроборированием соединения (18-4). Когда используют хиральный бороводородный восстановитель, гидроборирование протекает стереоселективно.
В формулах в описаниях способов 1-18 А1, А2, А4, R3, R4, p, q, r и Z имеют значения, указанные ранее, и R6 представляет собой -СН=СН2, -СН2ОН. k равен целому числу =1, l равен 0 или целому числу =1, k+l равно целому числу =10.
Способ 19
(R7 представляет собой группу -ОАс или группу -OBn)
Соединение (19-2) получают