Пептиды, проявляющие антимикробную активность
Иллюстрации
Показать всеИзобретение относится к биохимии и может быть использовано в биотехнологии и медицине. Из яда среднеазиатского паука Lachesana tarabaevi выделены две формы пептида (H2N-Ser1-Met2-Trp3-Ser4-Gly5-Met6-Trp7-Arg8-Arg9-Lys10-Leu11-Lys12-Lys13-Leu14-Arg15-Asn16-Ala17-Leu18-Lys19-Lys20-Lys21-Leu22-Lys23-Gly24-Glu25-X, где Х - свободная карбоксильная группа или остаток лизина Lys26) с широким спектром антимикробного действия. Применение изобретения позволяет расширить ассортимент антимикробных средств. 4 ил., 2 табл.
Реферат
Изобретение относится к биохимии, конкретно к биологически активным пептидам, обладающим антимикробным действием, которые могут найти применение в биотехнологии и медицине.
Число известных антибиотиков растет высокими темпами, источником природных служат бактерии, грибы, растения и животные, многие являются продуктом химического синтеза de novo. Тем не менее, лишь около 200 антибиотиков находят реальное применение в медицинской практике, большинство же не используется в силу ряда причин (токсичности, инактивации в организме и др.). Ряд антибиотиков являются незаменимыми лечебными препаратами, применяющимися при инфекциях, ранее считавшихся неизлечимыми. Однако ввиду возрастания числа микроорганизмов, вызывающих инфекционные заболевания, а также ввиду изменения этиологической структуры инфекционных заболеваний актуальна проблема поиска новых антибиотиков.
Необходимость такого поиска еще более очевидна, если принять во внимание проблему резистентности микроорганизмов. При широком применении антибиотиков в качестве лечебных препаратов происходит быстрое накопление форм микроорганизмов, устойчивых к этим соединениям, клинически существенная резистентность возникает за период от нескольких месяцев до нескольких лет. Подавляющее большинство используемых антибиотиков относятся к одному из структурных классов соединений, среди которых только один является относительно новым, а остальные были введены в клиническую практику более 40 лет назад, т.е. налицо "инновационный вакуум" в области изобретения принципиально новых противомикробных средств [Walsh, С. 2003. Where will new antibiotics come from? Nat. Rev. Microbiol. 1: 65-70]. Необходимо отметить, что известны случаи устойчивости распространенных патогенов человека, таких как Enterococcus faecalis, Mycobacterium tuberculosis, Pseudomonas aeruginosa, Salmonella typhi, Staphylococcus aureus, Streptococcus pneumoniae. Vibrio cholerae и многих других, практически к любому из применяемых препаратов [Walsh, С. 2000. Molecular mechanisms that confer antibacterial drug resistance. Nature 406: 775-781].
В ходе исследований механизмов, лежащих в основе защитных реакций организма хозяина на появление патогена, открыт новый класс природных антибиотиков, продуцируемых животными и высшими растениями. Оказалось, что большую роль в отражении атаки патогенов иммунной системой хозяина играют т.н. антимикробные пептиды. На сегодняшний день благодаря накопленным экспериментальным данным сформировано представление об этих молекулах как универсальном и эволюционно древнем механизме защиты растительных и животных организмов от патогенов [Finlay, B.B., Hancock, R.E.W. 2004. Can innate immunity be enhanced to treat microbial infections? Nat. Rev. Microbiol. 2: 497-504].
Несмотря на существование более сильных антибиотиков, антимикробные пептиды обладают рядом преимуществ. Способность быстро убивать клетки-мишени, необычайно широкий спектр действия, активность в отношении штаммов, резистентных к другим антибиотикам, а также относительная трудность в селекции устойчивых мутантов in vitro позволяют рассматривать эти вещества в качестве основы для создания эффективных лекарств, особенно на фоне снижения эффективности обычных антибиотиков ввиду возрастания числа резистентных штаммов [Hancock, R.E.W., Lehrer, R. 1998. Cationic peptides: a new source of antibiotics. Trends Biotechnol. 16: 82-88].
На сегодняшний день известно несколько сотен антимикробных пептидов [Brahmachary, М. et al. 2004. ANTIMIC: a database of antimicrobial sequences. Nucleic Acids Res. 32: D586-D589], среди которых выделяют несколько структурных классов [Brogden, K.A. 2005. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? Nat. Rev. Microbiol. 3: 238-250]. Однако для большинства антимикробных пептидов мишенью действия, по-видимому, являются мембраны клеток патогенных организмов, а механизмом действия - нарушение нормальной проницаемости этих мембран. Для подавляющего большинства антимикробных пептидов характерны следующие структурные и функциональные особенности: общий положительный заряд молекулы и склонность к формированию амфипатических структур, что, как полагают, является основой их взаимодействия с мембранами, а также способность к ингибированию роста целого ряда микроорганизмов в концентрациях порядка 1-10 мкМ.
Предложено несколько моделей, призванных объяснить увеличение проницаемости мембран клеток-мишеней под действием антимикробных пептидов. Наиболее обоснованной на сегодня является модель формирования тороидальных липид-пептидных пор за счет активного встраивания молекул пептидов в липидный бислой [Yang, L. et al. 2001. Barrel-stave model or toroidal model? A case study on melittin pores. Biophys. J. 81: 1475-1485].
Особое место среди прочих занимают антимикробные пептиды, не содержащие в своем составе остатков цистеина, поскольку такая структурная особенность значительно облегчает их производство химическим или биотехнологическим путем и резко снижает себестоимость. Среди последних много внимания уделяется пептидам, склонным к организации в амфипатическую α-спираль при контакте с мембранами, обсуждаются подходы к оптимизации их свойств с целью повышения терапевтического потенциала [Tossi, A., Sandri, L., Giangaspero, A. 2000. Amphipathic, α-helical antimicrobial peptides. Biopolymers 55: 4-30].
В числе свойств, которые необходимо контролировать у потенциальных антибиотиков, цитотоксическое действие на клетки макроорганизма, чаще оцениваемое в стандартных тестах на гемолитическую активность. Наличие подобной активности у целого ряда антимикробных пептидов является серьезным недостатком и ограничивает возможность их применения в качестве лекарственных средств.
Наиболее близким к заявляемым пептидам по структуре и антимикробным свойствам является фрагмент липополисахарид-связывающего пептида из гранулоцитов кролика [Tossi, A. et al. 1994. Identification and characterization of a primary antibacterial domain in CAP 18, a lipopolysaccharide binding protein from rabbit leukocytes. FEBS Lett. 339: 108-112]. Фрагмент состоит из 21 аминокислотного остатка, полностью ингибирует рост некоторых бактерий в концентрациях 0,5-4 мкМ и не проявляет гемолитической активности при 50 мкМ. Полноразмерный липополисахарид-связывающий пептид из гранулоцитов кролика [Larrick, J.W. et al. 2000. U.S. patent №6103888] содержит 37 аминокислотных остатков, относится к группе кателицидинов и также активен в отношении ряда бактерий в концентрациях 0,5-4 мкМ.
Изобретение решает задачу расширения ассортимента антимикробных пептидов.
Поставленная задача решается за счет структуры пептида, имеющего следующую аминокислотную последовательность:
H2N-Ser1-Met2-Trp3-Ser4-Gly5-Met6-Trp7-Arg8-Arg9-Lys10-Leu11-Lys12-Lys13-Leu14-Arg15-Asn16-Ala17-Leu18-Lys19-Lys20-Lys21-Leu22-Lys23-Gly24-Glu25-X,
где Х - свободная карбоксильная группа (латарцин-1, LtAMP-1) или остаток лизина Lys26 (латарцин-1a, LtAMP-1a).
Название пептида латарцин происходит от начальных слогов латинского названия паука-продуцента Lachesana tarabaevi и окончания -цин, общепринятого для обозначения бактерицидных свойств вещества.
Заявляемые пептиды латарцины проявляют антимикробную активность в отношении ряда грамположительных (Arthrobacter globiformis, Bacillus subtilis, Micrococcus luteus) и грамотрицательных (Escherichia coli, Pseudomonas aeruginosa) бактерий, а также дрожжевых грибов (Pichia pastoris). Минимальные концентрации пептидов, необходимые для полного ингибирования роста перечисленных организмов in vitro (минимальные ингибирующие концентрации), составляют 0,4-17 мкМ. При этом латарцины LtAMP-1 и LtAMP1a характеризуются низкой гемолитической активностью (20%-ный лизис эритроцитов при концентрации пептидов 100 мкМ). Кроме того, заявляемые пептиды обладают противоопухолевой активностью: при концентрации 6,6 мкМ вызывают гибель 50% клеток аденокарциномы легкого человека. Таким образом, техническим результатом предлагаемого изобретения является высокая антимикробная и противоопухолевая активность пептидов LtAMP-1 и LtAMP1a, сочетаемая с низкой гемолитической, а значит, высокий терапевтический потенциал предполагаемых антибиотиков, что позволяет рассматривать их в качестве основы для создания лекарственных средств широкого профиля для борьбы с возбудителями инфекционных заболеваний различного происхождения, а также злокачественными опухолевыми образованиями.
Пептиды LtAMP-1 и LtAMP1a состоят из 25 и 26 аминокислотных остатков соответственно, т.е. являются сравнительно небольшими молекулами, что упрощает их получение химическим синтезом. Кроме того, пептиды являются линейными и не содержат остатков цистеина, что также упрощает их получение химическим синтезом или биотехнологически, поскольку исключает риск образования неактивных форм за счет некорректного замыкания дисульфидов.
Пептид латарцин-1 (LtAMP-1) получают из природного источника - яда среднеазиатского паука Lachesana tarabaevi Zonstein et Ovtchinnikov, 1999, который относится к семейству Zodariidae, отряду Araneae, классу Arachnida, типу Arthropoda.
Пептид латарцин-1a (LtAMP-1a) получают химическим синтезом, он является аналогом латарцина-1, отличается от последнего на С-концевой остаток лизина и демонстрирует идентичные латарцину-1 биологические свойства.
Заявляемые пептиды представляют собой новые соединения и не являются близкими гомологами уже известных белков или пептидов.
Изобретение иллюстрируют примеры.
Пример 1.
Выделение антимикробного пептида латарцина-1 (LtAMP-1) из яда паука Lachesana tarabaevi.
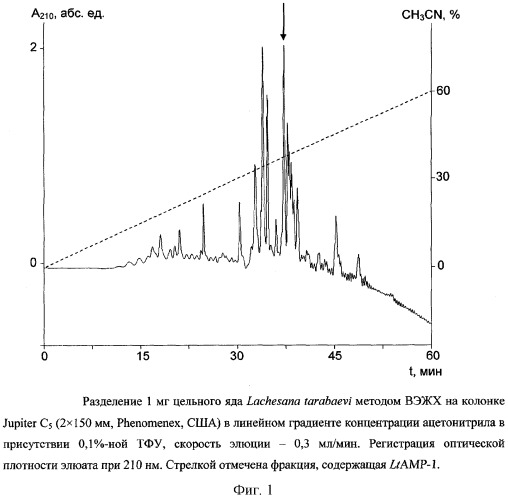
Цельный яд паука Lachesana tarabaevi подвергают разделению по методу ВЭЖХ на колонке с обращенной фазой Jupiter C5 (2×150 мм, размер пор 300 Å, диаметр частиц 5 мкм, Phenomenex, США). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 0 до 60% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 60 мин со скоростью элюции 0,3 мл/мин. Детекцию осуществляют по оптическому поглощению при 210 нм. Полученные фракции тестируют на способность ингибировать рост Escherichia coli DH5α. Пептид LtAMP-1 элюируется с колонки в составе фракции со временем удерживания 37 мин (фиг.1).
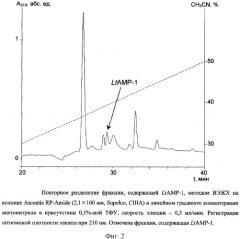
Выделенную фракцию далее разделяют по методу ВЭЖХ на колонке Ascentis RP-Amide (2,1×100 мм, диаметр частиц 3 мкм, Supelco, США). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 10 до 60% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 50 мин со скоростью элюции 0,3 мл/мин. Детекцию осуществляют по оптическому поглощению при 210 нм. Полученные фракции тестируют на способность ингибировать рост Escherichia coli DH5α. Пептид LtAMP-1 элюируется с колонки со временем удерживания 29,5 мин (фиг.2).
Содержание примесей в очищенной фракции, соответствующей LtAMP-1, составляет 5%, что подтверждается разделением по методу ВЭЖХ на аналитической колонке Luna C18 (1×150 мм, размер пор 100 Å, диаметр частиц 3 мкм, Phenomenex, США) в линейном градиенте концентрации ацетонитрила от 20 до 50% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 40 мин со скоростью элюции 50 мкл/мин, детекцию осуществляют по оптическому поглощению при 210 нм.
Пример 2.
Определение относительной молекулярной массы латарцинов LtAMP-1 и LtAMP-1a.
Индивидуальность очищенных веществ подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре ultraflex II TOF/TOF (Bruker Daltonik, Германия) с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0,1%-ную (v/v) трифторуксусную кислоту. Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Bruker Daltonik, Германия).
Измеренная моноизотопная молекулярная масса природного пептида LtAMP-1 составляет 3072,1 Да (расчетное значение составляет 3071,8 Да), синтетических LtAMP-1 и LtAMP-1a - 3071,5 Да и 3199,7 Да соответственно (расчетные значения: 3071,8 Да и 3199,9 Да соответственно).
Пример 3.
Установление аминокислотной последовательности латарцина-1.
Определение N-концевой аминокислотной последовательности очищенного пептида LtAMP-1 проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Precise 492 (Applied Biosystems, США). В результате устанавливают полную аминокислотную последовательность латарцина-1, состоящую из 25 аминокислотных остатков:
H2N-Ser1-Met2-Trp3-Ser4-Gly5-Met6-Trp7-Arg8-Arg9-Lys10-Leu11-Lys12-Lys13-Leu14-Arg15-Asn16-Ala17-Leu18-Lys19-Lys20-Lys21-Leu22-Lys23-Gly24-Glu25
Расчетная моноизотопная молекулярная масса пептида LtAMP-1 составляет 3071,8 Да, т.е. отличается от измеренной на 0,3 Да. Таким образом, антимикробный пептид латарцин-1 (LtAMP-1) является линейным пептидом и не содержит каких-либо химических модификаций. Анализ аминокислотной последовательности латарцина-1 (распределение гидрофобных и гидрофильных остатков, общий заряд молекулы) позволяет предположить склонность этого пептида к образованию амфипатической α-спирали при взаимодействии с мембранами.
Пример 4.
Химический синтез латарцина-1 (LtAMP-1) и его аналога - латарцина-1a (LtAMP-1a).
Пептиды синтезируют твердофазным методом в ручном варианте путем наращивания цепи с С-концевого остатка на 2-хлор-тритил-хлоридной (с нагрузкой 0,8-1,44 ммоль/г) смоле (PepChem, Германия), для временной защиты α-NH2-групп используют флуоренилметоксикарбонильную группу (Fmoc) [Chan, W.C., White, P.D. 2000. Fmoc Solid Phase Peptide Synthesis. University Press, Oxford]. Защиту боковых групп аминокислотных остатков выбирают с расчетом на конечное деблокирование трифторуксусной кислотой: для защиты боковых групп остатков Glu и Asp используют O-третбутильную группу, для Ser и Thr - третбутильную группу, для Trp - третбутилоксикарбонильную группу, для Gln и Asn - тритильную группу.
Для присоединения первой аминокислоты к смоле 1,5 экв (по отношению к количеству активных групп на смоле) Fmoc-защищенной аминокислоты растворяют в дихлорметане (из расчета 10 мл дихлорметана на 1 г смолы) с 1,5 экв диизопропилэтиламина. К полученному раствору добавляют еще 1,5 экв диизопропилэтиламина и приливают к сухой смоле, мягко перемешивают в течение 45 мин. Непрореагировавшие активные группы на смоле блокируют метанолом (из расчета 1 мл метанола на 1 г смолы) в течение 20 мин, после чего смолу промывают тремя объемами дихлорметана, тремя объемами N,N-диметилформамида и тремя объемами этанола, высушивают под вакуумом. Аминокислотные остатки присоединяют к пептидил-полимеру с образованием гидроксибензотриазолового эфира в присутствии 1,3-диизопропилкарбодиимида, для активации 1 экв аминокислоты используют 1,2 экв N-гидроксибензотриазола и 1 экв 1,3-диизопропилкарбодиимида. Для наращивания полипептидной цепи в ходе каждого синтетического цикла проводят конденсацию пептидил-полимера с 5 экв активированной Fmoc-аминокислоты (1-12 ч при 37°С), содержание непрореагировавших аминогрупп контролируют визуально по окрашиванию рН-зависимого индикатора бромфенолового синего.
Отщепление продукта от 2-хлор-тритил-хлоридного полимера с одновременным деблокированием боковых групп проводят смесью трифторуксусной кислоты, воды и этандитиола (95:2,5:2,5, v/v/v) из расчета 1 мл смеси на 50 мг смолы. Суспензию перемешивают в течение 2 ч, затем раствор пептида в трифторуксусной кислоте отфильтровывают от полимера. Продукт высаживают 10-кратным избытком (по объему) охлажденного диэтилового эфира, отфильтровывают, дважды промывают эфиром, после чего высушивают лиофильно. Восстановление окисленных остатков метионина проводят обработкой раствора пептида (2 мг/мл) в 10%-ной (v/v) уксусной кислоте метилмеркаптоацетамидом (10 экв на 1 экв остатков метионина) в течение 24-48 ч при 37°С.
Синтезированные пептиды подвергают очистке по методу ВЭЖХ на колонке с обращенной фазой Luna C18 (10×250 мм, размер пор 100 Å, диаметр частиц 10 мкм, Phenomenex, США). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 0 до 50% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 60 мин со скоростью элюции 2 мл/мин. Детекцию осуществляют по оптическому поглощению при 210 нм.
Содержание примесей в синтетических препаратах LtAMP-1 и LtAMP-1a составляет 1%, что подтверждается разделением по методу ВЭЖХ на аналитической колонке Luna C18 (1×150 мм, размер пор 100 Å, диаметр частиц 3 мкм, Phenomenex, США) в линейном градиенте концентрации ацетонитрила от 20 до 50% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 40 мин со скоростью элюции 50 мкл/мин, детекцию осуществляют по оптическому поглощению при 210 им.
Идентичность синтезированного LtAMP-1 природному доказывают при помощи масс-спектрометрического анализа, сравнением хроматографических подвижностей при разделении на аналитической колонке Luna C18 (1×150 мм, Phenomenex, США), а также сравнением их биологических свойств.
Пример 5.
Получение спектров поглощения пептидов LtAMP-1 и LtAMP-1a в УФ-области.
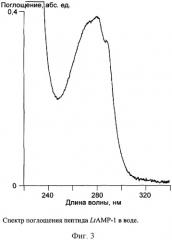
Для получения спектров поглощения в УФ-области выделенного с помощью хроматографических методов латарцина-1, а также химически синтезированных латарцинов LtAMP-1 и LtAMP-1a некоторое их количество (навеску) растворяют в 200 мкл чистой воды. Спектры поглощения получают на спектрофотометре U-3210 (Hitachi, Япония). Длина оптического пути (толщина кюветы) 1 см. Раствором сравнения служит чистая вода.
Концентрацию пептида определяют по спектру (фиг.3), используя расчетный молярный коэффициент поглощения при 280 нм, который составляет 11380 л/(моль×см), по формуле
С=(А280-А320)/ε, где
С - концентрация пептида в моль/л,
А280 - оптическая плотность раствора при 280 нм,
А320 - оптическая плотность раствора при 320 нм,
ε - молярный коэффициент поглощения при 280 нм.
Пример 6.
Получение спектров кругового дихроизма пептидов LtAMP-1 и LtAMP-1a.
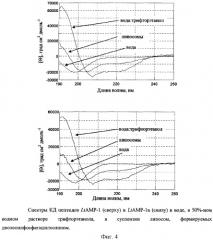
Спектры КД измеряют с помощью спектрополяриметра J-810 (Jasco, Япония) в кювете с длиной оптического пути 0,01 см в диапазоне длин волн 190-250 нм с шагом 1 нм. Исследуется конформация пептидов LtAMP-1 и LtAMP-1a в воде (рН˜5), в смеси воды (рН˜5) с трифторэтанолом в объемном соотношении 1:1 и в суспензии липосом, формируемых диолеилфосфатидилхолином (DOPC), диаметром 100 нм. В суспензии липосом присутствует 40 мМ натрий-фосфатный буфер (рН 7,5) и 83 мМ NaCl.
Моноламеллярные DOPC липосомы готовят методом экструзии. К сухому липиду (10 мг) добавляют 40 мМ натрий-фосфатный буфер (рН 7,5, 1 мл) и выдерживают взвесь при неинтенсивном перемешивании в течение 40-60 мин при комнатной температуре. Затем проводят 10 циклов замораживания-оттаивания взвеси с использованием холодильника на основе жидкого азота. Полученную суспензию липида продавливают с помощью экструдера (Avanti, США) 20 раз через поликарбонатную мембрану с размером пор 100 нм при комнатной температуре. В результате получают суспензию больших (диаметр 100 нм) моноламеллярных липосом в концентрации по липиду 10 мг/мл.
Концентрация пептидов в воде составляет 0,16 мМ, в растворе вода-трифторэтанол - 0,08 мМ, в суспензии липосом - 0,1 мМ. Молярное соотношение липид/пептид составляет 50:1. Спектры КД приведены (фиг.4) в единицах молярной эллиптичности [Θ], рассчитанной по формуле
[Θ]=115×Θэкспер/(10×С×l), где
Θэкспер - наблюдаемая эллиптичность в миллиградусах,
С - концентрация пептида в мг/мл,
l - длина оптического пути (толщина кюветы) в см,
115 - средний молекулярный вес одного аминокислотного остатка.
Оценку содержания элементов вторичной структуры (табл.1) проводят по программе CONTINLL [Provencher, S.W., Glockner, J., 1982. Estimation of globular protein secondary structure from circular dichroism. Biochemistry. 20, 33-37] для глобулярных белков.
| Таблица 1 | |||||
| Содержание элементов вторичной структуры для пептидов LtAMP-1 и LtAMP-1a по данным КД | |||||
| пептид | раствор | α-спираль | β-структура | β-изгиб | неупорядоченная структура |
| LtAMP-1 | вода, рН 5,0 | 8% | 28% | 23% | 42% |
| трифторэтанол:вода, 1:1 | 74% | 2% | 2% | 22% | |
| DOPC липосомы | 42% | 22% | 0 | 36% | |
| LtAMP-1a | вода, рН 5,0 | 7% | 28% | 22% | 43% |
| трифторэтанол:вода, 1:1 | 67% | 4% | 7% | 22% | |
| DOPC липосомы | 25% | 2% | 22% | 34% |
Анализ полученных спектров показывает, что (1) в водной среде латарцины LtAMP-1 и LtAMP-1a не склонны к образованию упорядоченной структуры, (2) в окружении, имитирующем мембраны (трифторэтанол), латарцины принимают α-спиральную конформацию, (3) LtAMP-1 и LtAMP-1a взаимодействуют с мембранами, по крайней мере, состоящими из диолеилфосфатидилхолина, и (4) при взаимодействии с мембранами частично образуют упорядоченную структуру типа α-спирали.
Пример 7.
Антимикробные свойства латарцинов LtAMP-1 и LtAMP-1a.
Для определения антимикробной активности фракций, полученных в ходе хроматографического разделения компонентов яда паука Lachesana tarabaevi, очищенного латарцина-1, а также синтетических LtAMP-1 и LtAMP-1a используют следующие штаммы микроорганизмов: Escherichia coli MH1, Escherichia coli DH5α, Pseudomonas aeruginosa PAO1, Arthrobacter globiformis BKM 348-10, Bacillus subtilis BKM B-504, Micrococcus luteus NCIMB 13267, Pichia pastoris GS115 ИБХ РАН, антимикробная активность оценивается по методу ингибирования роста культуры в жидкой среде. Определение минимальных концентраций пептидов, необходимых для полного ингибирования роста микроорганизмов (минимальных ингибирующих концентраций), проводят методом серийных разведений, используют модифицированную методику [Amsterdam, D. 1996. Susceptibility testing of antimicrobials in liquid media, pp.52-111. In Loman, V., ed. Antibiotics in laboratory medicine, 4th ed. Williams and Wilkins, Baltimore].
Бактерии культивируют в жидкой низкосолевой среде LB (1% бакто-триптон, 0,5% бакто-дрожжевой экстракт, 0,5% NaCl, pH 7) при 37°С и перемешивании со скоростью 220 об/мин, дрожжи - в жидкой среде YPD (1% бакто-дрожжевой экстракт, 2% бакто-пептон, 2% глюкоза, pH 5,3) при 30°С и перемешивании со скоростью 150 об/мин в течение 18 ч. Полученные культуры разбавляют в 200 раз, используя те же среды, и выращивают в тех же условиях в течение 3-5 ч до достижения экспоненциальной фазы роста (оптическая плотность культуры при 620 нм OD620˜0,3-0,5), после чего снова разбавляют, используя исходные среды, до концентрации клеток порядка 105 колоний образующих единиц (КОЕ) в 1 мл. Культуры помещают в стерильные 96-луночные планшеты, по 90 мкл в лунку, куда затем добавляют по 10 мкл растворов тестируемых веществ различных концентраций, получаемых серийными разведениями. Отрицательным контролем служит культура клеток с добавлением 10 мкл чистой воды, положительным - чистая среда для культивирования. Планшеты инкубируют в условиях, описанных выше, в течение 24 ч для бактериальных культур и 48 ч для дрожжевых, после чего измеряют OD620, минимальные ингибирующие концентрации определяют как наименьшие концентрации веществ, полностью подавляющие рост микроорганизмов. Опыт проводят в трех независимых повторах.
Результаты определения минимальных ингибирующих концентраций для латарцина-1 представлены в табл.2. Биологическая активность синтетического латарцина-1 идентична активности природного. Значения, полученные для латарцина-1 и латарцина-1а, одинаковы, т.е. С-концевой остаток лизина не оказывает влияния на антимикробные свойства заявляемых пептидов.
| Таблица 2 | ||
| Антимикробные свойства латарцинов LtAMP-1 и LtAMP-1a | ||
| штамм | минимальная ингибирующая концентрация, мкМ | |
| А. Грамотрицательные бактерии | ||
| Escherichia coli MH1 | 0,7 | |
| Escherichia coli DH5α | 1 | |
| Pseudomonas aeruginosa PAO1 | 4,1 | |
| Б. Грамположительные бактерии | ||
| Arthrobacter globiformis BKM 348-10 | 0,5 | |
| Bacillus subtilis BKM B-504 | 1 | |
| Micrococcus luteus NCIMB 13267 | 0,4 | |
| В. Дрожжевые грибы | ||
| Pichia pastoris GS 115 ИБХ РАН | 17 |
Пример 8.
Тестирование латарцинов LtAMP-1 и LtAMP-1a на гемолитическую активность. Гемолитическую активность пептидов определяют с использованием эритроцитов кролика. Свежую кровь получают из краевой вены уха кролика, 2 мл крови собирают в пробирку с 8 мл сбалансированного солевого раствора Хенкса, содержащего гепарин (10 ед/мл). Клетки осаждают центрифугированием в течение 5 мин при 180-220 g, ресуспендируют в растворе Хенкса до концентрации 1-3×107 кл/мл. Смешивают 10 мкл раствора пептида нужной концентрации с 1 мл полученной суспензии, в качестве отрицательного контроля к суспензии клеток добавляют 10 мкл чистого раствора Хенкса. Инкубируют при 37°С и перемешивании со скоростью 120 об/мин в течение 3 ч, после чего клетки осаждают центрифугированием в течение 3-5 мин при 4000 g. 100 мкл супернатанта отбирают в стерильные 96-луночные планшеты, выход гемоглобина из эритроцитов оценивают по оптической плотности при 414 нм. Гемолитическая активность образцов выражается в % от максимально возможного гемолиза, максимально возможный лизис эритроцитов (положительный контроль) получают за счет ресуспендирования клеток в чистой воде вместо раствора Хенкса также до концентрации 1-3×107 кл/мл.
В результате получают, что латарцины LtAMP-1 и LtAMP-1a выраженной гемолитической активностью не обладают, в концентрации 40 мкМ гемолиз составляет лишь 10%, в концентрации 100 мкМ - 20%.
Пример 9.
Тестирование латарцинов LtAMP-1 и LtAMP-1a на противоопухолевую активность.
Клетки аденокарциномы легкого человека А549 культивируют в среде Игла MEM с добавлением 2 мМ L-глутамина и 7% эмбриональной бычей сыворотки при 37°С во влажной атмосфере с 5%-ным содержанием СО2. За день до эксперимента клетки рассаживают в 96-луночные плоскодонные культуральные планшеты (0,3×106 клеток/мл, 150 мкл среды Игла MEM, содержащей 2 мМ L-GIn и 7% ЭБС, на лунку). Через 24 ч в лунки вносят исследуемые пептиды в нужной концентрации, в качестве отрицательного контроля в лунки добавляют чистую воду. Клетки инкубируют с различными концентрациями пептидов в течение 3 ч при 37°С, затем в лунки вносят флуоресцентные красители Hoechst33342 (10 мкМ, окрашивает ядра всех клеток) и пропидиум иодид (10 мкМ, окрашивает ядра мертвых клеток) и через 10 мин регистрируют флуоресцентные изображения клеток с помощью инвертированного флуоресцентного микроскопа Axiovert 200 M (Zeiss, Германия) с цифровой камерой AxioCam MRc (Zeiss, Германия) в области флуоресценции Hoechst33342 (фильтры на возбуждение - ВР 365/12, на эмиссию - LP 397) и в области флуоресценции пропидиум иодида (фильтры на возбуждение - ВР 510-560, на эмиссию - LP 590). По этим изображениям для каждой концентрации пептида подсчитывают общее число клеток (от 500 до 1000 клеток на одно измерение) и число мертвых клеток среди них, а затем рассчитывают концентрацию пептида, вызывающую гибель 50% клеток, ИК50. Результаты усредняют по трем независимым экспериментам.
В результате получают, что латарцины LtAMP-1 и LtAMP-1a обладают выраженной противоопухолевой активностью в отношении аденокарциномы легкого человека, ИК50=6,6 мкМ. Таким образом, латарцины LtAMP-1 и LtAMP-1a могут служить основой для создания противоопухолевых препаратов.
Пептид, проявляющий антимикробную активность, имеющий следующую аминокислотную последовательность:
H2N-Ser1-Met2-Trp3-Ser4-Gly5-Met6-Trp7-Arg8-Arg9-Lys10-Leu11-Lys12-Lys13-Leu14-Arg15-Asn16-Ala17-Leu18-Lys19-Lys20-Lys21-Leu22-Lys23-Gly24-Glu25-X,
где Х - свободная карбоксильная группа или остаток лизина Lys26.