Лекарственный препарат (варианты)
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к лекарственным средствам, воздействующим на иммунную систему. Лекарственный препарат содержит литиевую или калиевую соль 5-амино-2,3-дигидро-1,4-фталазиндиона. Препараты обладают противоопухолевым и антиоксидантным действием. Разработанные варианты лекарственного препарата отличаются по длительности и спектру действия, а также по фармакинетическим параметрам и в зависимости от чистоты выполнения могут применяться и при пероральном приеме, и при внутримышечном инъецировании, и для других медицинских процедур. 5 н. и 1 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Изобретение относится к медицине, а именно к лекарственным средствам, воздействующим на иммунную систему, а также к химико-фармацевтическому производству этих лекарственных средств.
Известен лекарственный препарат «натрия нукленат» - натриевая соль нуклеиновой кислоты, представляющая собой препарат иммуномодулирующего действия в виде белого или слегка желтоватого порошка, легко растворимого в воде с образованием опалесцирующих растворов, обладающий способностью стимулировать миграцию и кооперацию Т и В-лимфоцитов, повышать фагоцитарную активность макрофагов и активность факторов неспецифической резистентности (см., например, М.Д.Машковский «Лекарственные средства», М., Медицина, 1985, т.2, с.172).
Однако инъецирование этого препарата болезненно, и это вызывает необходимость дополнительного введения пациентам обезболивающих препаратов, что не всегда им показано.
Наиболее близким фармакологическим аналогом - прототипом является применяемый в качестве иммуномодулятора и обладающий также противовоспалительными и антиоксидантными свойствами лекарственный препарат - натриевая соль 5-амино-2,3-дигидрофталазин-1,4-диона, представляющий собой соль люминола в виде белого или светло-желтого легко растворимого в воде кристаллического порошка (см., например, патент РФ №2163122 с приоритетом от 01.08.2000, МПК: А61К 31/502, А61Р 37/02, 29/00).
Указанный выше лекарственный препарат обладает бифуркационной активностью. Так, введение пациенту натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона при слабой реакции клеточного иммунитета, например, при наличии злокачественных новообразований, вызывает активизацию макрофагов, которая проявляется выбросом ими TNF (фактора некроза опухолей), интерлейкинов и других острофазных белков. При воспалительных процессах этот иммуномодулятор на несколько часов подавляет активность макрофагов, но при этом одновременно усиливает микробицидную систему клеток.
Этот лекарственный препарат не вызывает аллергических реакций и других побочных явлений, однако он имеет ограниченный спектр (диапазон) действия, ограниченную продолжительность активности (пролонгации) в биосистемах, а, кроме того, из-за примесей (загрязнений), которые в нем имеются, не обеспечивает возможности длительного хранения его в водных растворах, приготовленных, например, для инъецирования, орошения или ингаляций.
Известен способ получения 5-амино-2,3-дигидрофталазиндиона-1,4 (люминола), включающий восстановление 3-нитрофталевой кислоты в водной среде гидразингидратом в присутствии скелетного никелевого катализатора с последующим упариванием раствора и его нагреванием при температуре 120°С в присутствии гидразингидрата и уксусной кислоты, который применяют в качестве хемилюминесцентора (см., например, авторское свидетельство СССР №130903 с приоритетом от 21.11.59, бюл. №16 за 1960).
Этот способ позволяет получать целевой продукт в виде порошка, обладающего хорошими люминесцентными свойствами. Однако применение люминола в качестве лекарственного препарата неэффективно, так как он практически нерастворим ни в воде, ни в физиологических и изотонических растворах разных типов, ни в обычных органических растворителях. Поэтому при применении люминола, например, в качестве люминофора его не очищают после синтеза, а используют в техническом виде.
Наиболее близким в плане синтеза лекарственных препаратов аналогом-прототипом является способ получения натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона (см., например, патент РФ №2155043 с приоритетом от 28.03.2000), включающий взаимодействие 3-нитрофталевого ангидрида с гидразингидратом в уксусной кислоте при температуре (90-120)°С с получением 5-нитро-2,3-дигидрофталазин-1,4-диона, путем восстановления которого гидразингидратом в водно-щелочной среде в присутствии скелетного никелевого катализатора выделяют 5-амино-2,3-дигидрофталазин-1,4-дион, после обработки которого гидроксидом натрия с добавлением низшего спирта или кетона получают целевой продукт.
Однако химическое строение и индивидуальность этого продукта, а также его чистота в указанном выше способе синтеза фактически ничем не подтверждены, кроме как указанием о применении для этой цели УФ-спектроскопии, которая по своим техническим возможностям не дает убедительного ответа на эти вопросы. В то же время техническая натриевая соль люминола, как и сам технический люминол, которые после их синтеза никак не очищаются, кроме основного вещества, содержат примеси хлоридов, сульфатов, тяжелых металлов (следов Ni-катализатора), нитро- и аминосоединений, ароматических кислот, активированного угля и др. Техническая натриевая соль люминола дополнительно загрязнена гидроксидом натрия, который был использован в процессе ее получения.
Проведенные исследования показали, что, хотя этот способ обеспечивает синтез продукта, обладающего лекарственными свойствами, полученный препарат оказывается загрязненным многочисленными примесями, что не дает возможности его хранения в водных растворах, приготовленных, например, для инъецирования, орошения или ингаляций. Кроме того, данный способ несовершенен технологически, поскольку применяемые при его осуществлении составляющие после выделения целевого продукта более не используются, а идут в отходы производства, причем в эти отходы попадает и не извлеченный из реакционной смеси остаток целевого продукта после отделения его основной массы из реакционной среды.
Сущность изобретения состоит в том, что лекарственный препарат, обладающий противоопухолевым и антиоксидантным действием, характеризуется тем, что он содержит щелочную соль 5-амино-2,3-дигидро-1,4-фталазиндиона в виде соответствующей литиевой соли.
Сущность изобретения состоит в том, что лекарственный препарат, обладающий противоопухолевым и антиоксидантным действием, характеризуется тем, что он содержит щелочную соль 5-амино-2,3-дигидро-1,4-фталазиндиона в виде соответствующей калиевой соли.
Сущность изобретения состоит в том, что лекарственный препарат, обладающий противоопухолевым и антиоксидантным действием, характеризуется тем, что он содержит щелочную соль 5-амино-2,3-дигидро-1,4-фталазиндиона и питьевую воду или воду для инъекций при следующем соотношении составляющих, мас.%: щелочная соль 5-амино-2,3-дигидро-1,4-фталазиндиона - 0,5-25,0; вода - остальное.
Сущность изобретения состоит в том, что лекарственный препарат, обладающий противоопухолевым и антиоксидантным действием, характеризуется тем, что он содержит щелочную соль 5-амино-2,3-дигидро-1,4-фталазиндиона и наполнитель в виде пяти- или шестиатомного спирта, например ксилита, или углевода, например глюкозы и/или витамина, например витамина С, при следующих соотношениях составляющих, мас.%: щелочная соль 5-амино-2,3-дигидро-1,4-фталазиндиона - 5,0-50,0; наполнитель - остальное.
Сущность изобретения состоит в том, что лекарственный препарат, обладающий противоопухолевым и антиоксидантным действием, характеризуется тем, что он выполнен в виде раствора щелочной соли 5-амино-2,3-дигидро-1,4-фталазиндиона и наполнителя в виде пяти- или шестиатомного спирта, например ксилита, или углевода, например глюкозы, и/или витамина, например витамина С, или в питьевой воде, или в воде для инъекций при следующем соотношении составляющих, мас.%: щелочная соль 5-амино-2,3-дигидро-1,4-фталазиндиона - 0,25-25,0; наполнитель - 0,25-25,0; вода - остальное.
При этом щелочная соль 5-амино-2,3-дигидро-1,4-фталазиндиона выполнена в виде соответствующей или технической соли, или химически чистой, или особой чистоты, или медикаментозной химически чистой, или медикаментозной особой чистоты.
Сущность изобретения состоит в том, что в способе производства лекарственного препарата, включающем воздействие водного раствора гидроксида щелочного металла на исходный состав, содержащий 5-амино-2,3-дигидро-1,4-фталазиндион, с последующим осаждением с использованием органического растворителя, полученного в результате этого воздействия промежуточного состава в виде щелочной соли 5-амино-2,3-дигидро-1,4-фталазиндиона, а также получение целевого продукта, производство лекарственных препаратов ведут повторяющимися циклами, в каждом из которых на исходный состав, содержащий коммерческий или технический, или химически чистый 5-амино-2,3-дигидро-1,4-фталазиндион, или их смеси, воздействуют водным раствором гидроксида щелочного металла, а промежуточный состав выделяют соответственно в виде технической или химически чистой соответствующей соли 5-амино-2,3-дигидро-1,4-фталазиндиона, после чего этот промежуточный состав растворяют в воде или в соответствующем гидрокарбонатном буферном растворе и обрабатывают, очищая от примесей, до получения целевого продукта соответственно в виде химически чистой или медикаментозной химически чистой, или особой чистоты или медикаментозной особой чистоты соли 5-амино-2,3-дигидро-1,4-фталазиндиона, которые после получения высушивают, причем оставшиеся после выделения промежуточного состава или целевого продукта маточные растворы обрабатывают, а полученные после этой обработки осадок и оставшиеся части маточных растворов или выводят из цикла, или смешивают или с исходным составом, или с реакционной смесью, получаемой в последующем цикле производства.
При этом для взаимодействия с 5-амино-2,3-дигидро-1,4-фталазиндионом выбирают водные растворы гидроксидов или лития, или калия, а целевой продукт получают соответственно или в виде литиевой, или в виде калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона.
При этом для взаимодействия 5-амино-2,3-дигидро-1,4-фталазиндиона с гидроксидами щелочных металлов их количество выбирают в соотношении их молей, равном 1:(0,85-3,0).
Кроме того, очистку щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона от примесей проводят с помощью адсорбционного хроматографирования путем пропускания в соответствующей хроматографической колонке водных растворов этих солей через слой сорбента, например через слой или оксида алюминия, или целлюлозы для хроматографии, или бентонитовых глин, причем массы щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона и сорбента выбирают в соотношении 1:(0,1-15).
Кроме того, выделение промежуточного состава - технических или химически чистых щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона производят путем введения в реакционную смесь, полученную после взаимодействия соответственно коммерческого, технического или химически чистого 5-амино-2,3-дигидро-1,4-фталазиндиона с водным раствором гидроксида щелочного металла, ацетона или изопропилового спирта, охлаждения этой реакционной смеси до температуры (-1-+15)°С и ее выдерживания при этой температуре в течение (0,25-24) часов.
При этом при обработке промежуточного состава - технических или химически чистых щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндион проводят кристаллизацию соответствующей полученной щелочной соли и получают соответственно химически чистый или особой чистоты продукт.
Кроме того, при обработке промежуточного состава вначале с помощью ионообменной хроматографии проводят процедуру полного или частичного ионного обмена, а затем проводят адсорбционное хроматографирование или кристаллизацию полученной после проведения этой процедуры щелочной соли.
При этом технические или химически чистые щелочные соли 5-амино-2,3-дигидро-1,4-фталазиндиона кристаллизуют или на воздухе, после чего получают соответственно химически чистые или особой чистоты щелочные соли 5-амино-2,3-дигидро-1,4-фталазиндиона, или, например, в боксе при соблюдении условий повышенной стерильности, например, в атмосфере очищенного воздуха или инертного газа и после чего получают соответственно медикаментозные химически чистые или медикаментозные особой чистоты щелочные соли 5-амино-2,3-дигидро-1,4-фталазиндиона.
Кроме того, кристаллизацию промежуточного состава проводят путем его растворения в воде или в водных растворах соответствующих гидрокарбонатов при температуре (45-80)°С, охлаждения водного раствора до температуры (-1-+15)°С и выдерживания его при этой температуре в течение (0,5-24) часов.
При этом количество промежуточного состава (щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона) при кристаллизации из воды или из гидрокарбонатных буферных растворов выбирают в соотношении их масс, равном 1:(2,0-12), причем кристаллизацию промежуточного состава в виде калиевой или натриевой солей 5-амино-2,3-дигидро-1,4-фталазиндиона проводят из водных буферных растворов соответственно гидрокарбоната калия или гидрокарбоната натрия.
При этом при кристаллизации из воды или из гидрокарбонатных буферных водных растворов используют или деионизованную (обессоленную), или дистиллированную воду.
Кроме того, воду предварительно подвергают кипячению в течение (0,1-2) часов, а при обработке промежуточного состава или целевого продукта после их выделения в виде щелочных солей 5-амино-2,3-дигидро-1,4 фталазиндиона производят их высушивание.
При этом высушивание промежуточного состава или целевого продукта в виде щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона после их выделения производят до безводного порошка или в сушильном шкафу при температуре (60-70)°С в течение 2-5 часов, или вначале на воздухе, например, при комнатной температуре или в потоке охлажденного до температуры (4-15)°С инертного газа, например, аргона или азота, а затем, например, в сушильном шкафу при температуре (60-70)°С в течение 2-5 часов.
Кроме того, высушивание промежуточного состава в виде калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона до безводного порошка, а в виде литиевой или натриевой солей 5-амино-2,3-дигидро-1,4-фталазиндиона до кристаллогидратов с двумя молями кристаллизационной воды проводят при комнатной температуре в течение 10-14 часов.
Кроме того, оставшиеся после выделения промежуточного состава или целевого продукта маточные растворы обрабатывают путем воздействия на них водным раствором кислоты или смеси кислот до получения осадка в виде 5-амино-2,3-дигидро-1,4-фталазиндиона, причем в качестве водного раствора кислоты или смеси кислот соответственно используют водный раствор или органической, например, уксусной или пропионовой, или неорганической, например, серной или соляной или ортофосфорной кислоты, или водный раствор смеси этих органических и неорганических кислот.
При этом в виде осадка из маточного раствора технической соли 5-амино-2,3-дигидро-1,4-фталазиндиона выделяют технический 5-амино-2,3-дигидро-1,4-фталазиндион, а из маточного раствора химически чистой соли или из маточного раствора медикаментозной химически чистой соли 5-амино-2,3-дигидро-1,4-фталазиндиона или особой чистоты соли или медикаментозной особой чистоты соли 5-амино-2,3-дигидро-1,4-фталазиндиона выделяют химически чистый 5-амино-2,3-дигидро-1,4-фталазиндион.
Кроме того, оставшийся после выделения промежуточного состава или целевого продукта маточный раствор обрабатывают путем отгонки или упаривания, причем при обработке путем отгонки или упаривания оставшегося после выделения промежуточного состава маточного раствора удаляют введенный ранее органический осадитель и (30-70)% воды, а при соответствующей обработке оставшегося после выделения целевого продукта маточного раствора удаляют (30-70)% воды.
При этом литиевую соль 5-амино-2,3-дигидро-1,4-фталазиндиона получают с помощью ионообменной хроматографии путем пропускания водного раствора натриевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона через ионообменную смолу (катионообменник), например, через ионообменную колонку, заполненную смолой «КУ-2-8чС» в Li+-форме, и промыванием этой колонки водой с одновременным контролем кислотности (рН) получаемого раствора.
Кроме того, литиевую соль 5-амино-2,3-дигидро-1,4-фталазиндиона получают с помощью ионообменной хроматографии путем пропускания водного раствора калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона через ионообменную смолу (катионообменник), например через ионообменную колонку, заполненную смолой «КУ-2-8чС» в Li+-форме, и промыванием этой колонки водой с одновременным контролем кислотности (рН) получаемого раствора.
При этом калиевую соль 5-амино-2,3-дигидро-1,4-фталазиндиона получают с помощью ионообменной хроматографии путем пропускания водного раствора натриевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона через ионообменную смолу (катионообменник), например, через ионообменную колонку, заполненную смолой «КУ-2-8чС» в К+-форме, и промыванием этой колонки водой с одновременным контролем кислотности (рН) получаемого раствора.
Кроме того, литиевую соль 5-амино-2,3-дигидро-1,4-фталазиндиона получают при пропускании через колонку с ионнообменной смолой в К+-форме водного раствора натриевой или калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона со скоростью (0,1-1,0) мл/мин, а калиевую соль 5-амино-2,3-дигидро-1,4-фталазиндиона получают при пропускании через колонку с ионнообменной смолой в К+-форме водного раствора натриевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона также со скоростью (0,1-1,0) мл/мин.
При этом при проведении ионообменной хроматографии используют растворы щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона в воде молярной концентрации (0,5-2,0), причем рабочий объем колонки для хроматографии выбирают из расчета 300-2000 см3 на 1 моль пропускаемой через эту колонку щелочной соли 5-амино-2,3-дигидро-1,4-фталазиндиона.
Проведенные исследования показали, что введение пациенту в качестве лекарственного препарата литиевой или калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона оказывает на пациента воздействие, сходное с вышеописанным воздействием натриевой соли люминола (см., например, патент РФ №2163122).
Так, при слабой реакции клеточного иммунитета, например, при наличии злокачественных новообразований при введении вышеуказанных препаратов наблюдается выброс TNF (фактора некроза опухолей), интерлейкинов и других острофазных белков, что свидетельствует об активизации макрофагов. Одновременно также специфически реагируют на введение лекарственного препарата Т-лимфоциты.
При воспалительных процессах данные лекарственные препараты во всех рассмотренных вариантах избирательно подавляют активность макрофагов, снижая соответственно уровень TNF и острофазных белков, что приводит к сглаживанию симптомов интоксикации. При этом происходит также активизация суперксидообразующей функции и фагоцитарной активности нейтрофильных гранулоцитов и соответствующее усиление микробицидной системы клеток и купирование воспалительного процесса.
Лекарственный препарат в каждом из полученных вариантов - не токсичен и его применение в диапазоне дозировок 20-2000 мг/сутки не вызывает аллергических реакций и других побочных явлений.
Особое значение имеет высокая биологическая активность и пролонгированное действие калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона, что позволяет существенно уменьшить дозы применения лекарственного препарата и увеличить интервалы между его приемами, например, по сравнению с интервалами между приемами препарата в виде натриевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона (прототип).
Лекарственный препарат, выполненный в виде химически чистых и смесей медикаментозных щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона, может применяться при пероральном приеме в виде порошков и таблеток или их капсулированных водных растворов, а также при проведении лечебных водных процедур или орального (ингаляции), или гинекологического, или уретрального, или проктологического орошения и клизмования соответственно в виде порошков или их капсулированных водных растворов или в составе липосом; лекарственный препарат, выполненный в виде медикаментозных особой чистоты солей, в соответствующих лекарственных формах можно использовать как и в ранее указанных процедурах, так и при внутримышечном инъецировании.
При этом варианты выполнения лекарственного препарата, обладая вышеуказанными свойствами, отличаются по длительности и спектру действия, а также и по фармакокинетическим параметрам, что позволяет назначать схему требуемого лечения с использованием выбранного варианта лекарственного препарата и формы его применения. Такое лечение может проводиться с учетом возможностей конкретного варианта, а также возможности перехода от одного варианта лекарственного препарата или формы его применения к другому варианту лекарственного препарата или соответственно другой лекарственной форме без негативного воздействия, вызываемого кардинальным изменением назначений, на пациента. Это может иметь значение и при учете экономической стороны лечения, поскольку стоимость лекарственного препарата напрямую зависит от сложности процедуры его получения.
Особое значение имеет устойчивость и стабильность при длительном хранении водных растворов входящих в лекарственные препараты медикаментозных химически чистых и особой чистоты щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона. Так, например, растворы всех вышеуказанных щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона в воде для инъекций сохранялись на свету в стеклянных закрытых сосудах более года без изменения своих физико-химических свойств, в то время как в контрольных опытах соответствующие растворы коммерческих и технических солей 5-амино-2,3-дигидро-1,4-фталазиндиона при тех же условиях хранения темнели уже через 3-5 дней. Такая устойчивость заявленных препаратов в водных растворах подтверждает возможность их применения в виде принятых фармацевтической промышленностью соответствующих лекарственных форм.
При этом отсутствие аллергических реакций и токсичности лекарственного препарата, выполненного в виде медикаментозных щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона, позволяет рекомендовать их использование в виде также профилактических средств, например, для профилактики респираторных (ингаляции верхних дыхательных путей или полоскания горла водным раствором лекарственного препарата) и других заболеваний.
Предложенный способ производства лекарственного препарата представляет собой высокотехнологичный процесс малоотходного и даже безотходного производства, обеспечивающий получение вариантов лекарственного препарата разной степени химической чистоты, в том числе и медикаментозных, что существенно расширяет возможности их использования и в случаях длительного хранения в водных растворах.
Изобретение подтверждается примерами:
Пример 1.
Больной Ж., 42 года.
Жалобы на приступообразный кашель, быструю утомляемость при физической нагрузке, частое повышение температуры.
При поступлении прослушиваются сухие хрипы справа.
Проведен курс лечения лекарственным препаратом.
Первые 3 дня один раз в день внутримышечно инъекции по 50 мг калиевой (соответственно медикаментозной особой чистоты) соли 5-амино-2,3-дигидро-1,4-фталазиндиона в 1 мл воды для инъекций, а затем назначен пероральный прием в течение 7 дней смеси калиевой и натриевой (соответственно медикаментозных химически чистых) солей 5-амино-2,3-дигидро-1,4-фталазиндиона в виде порошка по 100 мг при равном соотношении составляющих по 3 раза в день, через час после еды.
Спустя 10 дней после начала лечения рекомендовано продолжение приема указанной смеси калиевой и натриевой солей 5-амино-2,3-дигидро-1,4-фталазиндиона в таблетках по 25 мг один раз в день в течение 5-7 дней.
Через 2 недели после проведения лечения при обследовании пациента хрипов нет, общее состояние удовлетворительное.
Пример 2.
Больной Т., 27 лет.
Предполагает, что заболевание является осложнением после недавно перенесенного гриппа.
Высокая (до 39,6°С) температура в течение 10 дней, частые приступы изнурительного кашля, общая слабость. Назначенное ранее лечение (инъекции канамицина и перорально сульфадиметоксин по рекомендованной (М.Д.Машковский «Лекарственные средства», М., Медицина, 1985, т.2, с.286) схеме приема) не помогло.
При поступлении состояние средней тяжести, прослушиваются влажные хрипы.
Диагноз: двусторонняя пневмония.
Проведено лечение лекарственным препаратом.
Первые 5 дней через день внутримышечно инъекции калиевой (соответственно медикаментозной особой чистоты) соли 5-амино-2,3-дигидро-1,4-фталазиндиона по 300 мг в 3 мл воды для инъекций, с 7-го по 10-й день - инъекции соответствующей калиевой соли в смеси с аскорбиновой кислотой и глюкозой соответственно по 75 мг, 25 мг и 10 мг в 10 мл воды для инъекций один раз в день, затем в течение недели смесь калиевой и натриевой (соответственно медикаментозных химически чистых) солей 5-амино-2,3-дигидро-1,4-фталазиндиона в таблетках по 50 мг в равных долях и аскорбиновую кислоту в порошке по 50 мг по три раза в день перед едой.
На пятый день лечения температура нормализовалась.
При обследовании после проведенного лечения состояние удовлетворительное, хрипы не прослушиваются. На RG - затемнений нет.
Пример 3.
Больная П., 60 лет.
Прооперирована в июле 2000 года по поводу рака прямой кишки. Проведен курс химиотерапии. Ухудшение состояния.
В феврале-марте 2001 проведено лечение лекарственным препаратом, включавшее внутримышечное инъецирование смесью калиевой и натриевой солей (соответственно медикаментозных особой чистоты) 5-амино-2,3-дигидро-1,4-фталазиндиона по 100 мг смеси (соотношение составляющих: 70 мг калиевой и 30 мг натриевой солей) в 2 мл воды для инъекций по одному разу в сутки в течение 10 дней, прием таблеток натриевой соли (соответственно медикаментозной химически чистой) 5-амино-2,3-дигидро-1,4-фталазиндиона по 50 мг 2 раза в день за час до еды, а также клизмы перед сном: вначале очистительная прокипяченной питьевой водой, а затем лечебная, содержащая раствор 150 мг химически чистой калиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона на (50-150) мл прокипяченной воды в течение 20 дней.
При обследовании через 1,5 месяца после лечения состояние удовлетворительное.
Пример 4.
Больная В., 22 года.
В декабре 2000 года обнаружена опухоль (3×3×4) см3 левой молочной железы.
Маммография: фиброзно-кистозная мастопатия левой молочной железы.
Биопсия: обнаружены атипичные клетки.
Проведено внутримышечное инъецирование: вначале по одной в день ежедневно 15 инъекций водным раствором смеси литиевой и калиевой солей (соответственно медикаментозных особой чистоты) 5-амино-2,3-дигидро-1,4-фталазиндиона по 200 мг смеси солей (в соотношении 50 мг литиевой и 150 мг калиевой соли) в 4 мл воды для инъекций, затем после десятидневного перерыва ежедневно по одной в день 10 инъекций раствором (соответственно медикаментозных особой чистоты) литиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона (100 мг соли в 2 мл воды для инъекций), а также смазывание 2-3 раза в день области нахождения опухоли мазевым составом, включающим порошок литиевой соли (химически чистой) 5-амино-2,3-дигидро-1,4-фталазиндиона и мазевую основу (детский крем) в соотношении составляющих, об%: 50 на 50.
Через три недели после лечения опухоль практически не прощупывается, при повторной биопсии атипичные клетки не обнаружены.
Пример 5.
Больной А., 53 года.
Жалобы на постоянные головные боли, повышенную нервозность, перемежающуюся с сонливостью.
При обследовании: внутричерепное давление в норме, на томограмме головного мозга уплотнение 0,5×1,0×1,0 см3 в левой височной области.
Проведено внутримышечное инъецирование больного медикаментозной особой чистоты литиевой солью 5-амино-2,3-дигидро-1,4-фталазиндиона. Первый курс из 10 инъекций по 100 мг литиевой соли в 1 мл воды для инъекций по два раза в день ежедневно, а затем 15 инъекций в той же дозе по одному разу в день.
Через 20 дней после начала лечения у пациента практически прекратились головные боли.
При повторной томографии - состояние в норме.
Пример 6.
Больной П., 65 лет, с 40 лет болен сахарным диабетом.
Жалобы: затрудненное мочеиспускание с частыми позывами.
УЗИ: отмечена гипертрофия предстательной железы.
Диагноз: аденома (55-60) см3 предстательной железы.
Проведен курс лечения из 20 внутримышечных инъекций водного раствора 200 мг смеси литиевой и натриевой солей (соответственно медикаментозных особой чистоты) 5-амино-2,3-дигидро-1,4-фталазиндиона (соотношение составляющих: 100 мг литиевой и 100 мг натриевой солей 5-амино-2,3-дигидро-1,4-фталазиндиона) в 4 мл воды для инъекций, по одной инъекции в день. Затем назначен пероральный прием в течение 10 дней порошка смеси 100 мг литиевой соли 5-амино-2,3-дигидро-1,4-фталазиндиона (соответственно медикаментозной химически чистой) с ксилитом при равном соотношении составляющих по одному разу в день через час после еды.
После первых 20 инъекций аденома уменьшилась до (40-45) см3, а после курса приема порошка - до (28-30) см3, мочеиспускание нормализовано, общее состояние пациента удовлетворительное.
Пример 7.
Больная Р., 38 лет.
Диагноз: карционома легких (3 ст.) с метастазами в головной мозг.
При обращении состояние средней тяжести.
Проведено инъецирование (внутримышечно) водным раствором смеси литиевой, калиевой и натриевой солей (соответственно медикаментозных особой чистоты) 5-амино-2,3-дигидро-1,4-фталазиндиона - вначале 10 инъекций по две ежедневно по 325 мг смеси (соотношение составляющих: 25 мг литиевой, 100 мг калиевой и 200 мг натриевой соли) солей 5-амино-2,3-дигидро-1,4-фталазиндиона в 3 мл воды для инъекций, потом через день по 15 инъекций внутримышечно по 150 мг калиевой соли (соответственно медикаментозной особой чистоты) 5-амино-2,3-дигидро-1,4-фталазиндиона.
В процессе лечения наблюдалась положительная динамика.
Через две недели после начала лечения наблюдалось улучшение общего состояния больной, повышение тонуса. После проведения указанного курса лечения по результатам томографии метастазы не определяются, при УЗ обследовании отмечено некоторое уменьшение первичной опухоли и ее капсулизация.
Реализация способа производства лекарственного препарата (в приведенных далее вариантах) осуществляется циклами, каждый из которых начинают действием водных растворов соответствующих гидроксидов щелочных металлов (Li, Na, К) на исходный состав, содержащий 5-амино-2,3-дигидро-1,4-фталазиндион, а заканчивают получением соответствующего целевого продукта, причем циклы повторяют до получения, например, требуемого количества целевого продукта.
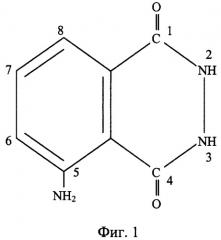
При описании производства лекарственного препарата исходный продукт, обозначенный в соответствии с систематической номенклатурой как 5-амино-2,3-дигидро-1,4-фталазиндион (см., например. Справочник химика. М.-Л.: Химия, 1965, т.II, с.760), представляет собой гидразид 3-амино-О-фталевой кислоты. Иногда в источниках информации для его обозначения используют наименование: 5-амино-2,3-дигидрофталазиндион-1,4 (см., например, вышеупомянутое авторское свидетельство СССР №130903) или по рациональной номенклатуре этот продукт называют 3-аминофталилгидразид (см., например, Е.Н.Huntress, L.N.Stanlry, A.S.Parker. J. Amer. Chem. Soc., 1934, v.56, p.p.241-242 или Ю.С.Шабаров. Органическая химия. М.: Химия, 2000, с.802).
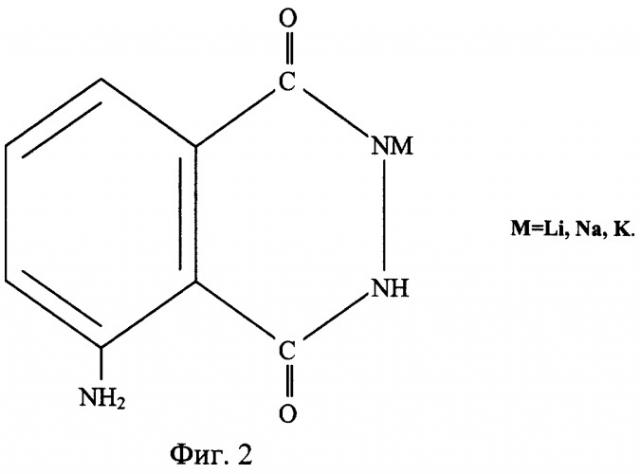
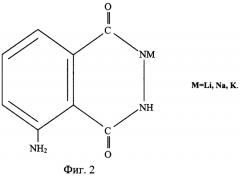
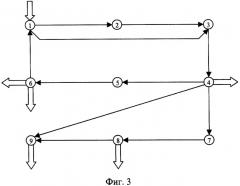
На фиг.1 представлена структурная формула 5-амино-2,3-дигидро-1,4-фталазиндиона (3-амино-О-фталилгидразида), на фиг.2 приведена структурная формула N - соли щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона (солей щелочных металлов (M=Li, Na, К) 3-амино-О-фталилгидразида). На фиг.3 представлена упрощенная схема химико-технологического процесса получения солей щелочных металлов M=Li, Na, К (щелочных солей 3-амино-О-фталилгидразида) или из коммерческого, или из технического, или из химически чистого 5-амино-2,3-дигидро-1,4-фталазиндиона.
Рассмотрим схему химико-технологического процесса (фиг.3).
Схема (фиг.3) содержит узлы (1, 2, 3, 4, 5, 6, 7, 8 и 9), характеризующие вводимые в данный процесс реагенты, соединенные графами (стрелками), условно определяющими вид воздействия на реагенты или их взаимодействия.
Здесь обозначено:
Узел 1 - Исходный состав, в качестве которого может быть коммерческий, технический или химически чистый 5-амино-2,3-дигидро-1,4-фталазиндион, а также 5-амино-2,3-дигидро-1,4-фталазиндион указанных выше типов с добавлением отходов производства, содержащих водные растворы солей щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона, маточные растворы и прочие остатки реакционных смесей предыдущих циклов.
Узел 2 - Водный раствор технических солей соответствующих щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона.
Узел 3 - Водный раствор технических или химически чистых солей соответствующих щелочных солей 5-амино-2,3-дигидро-1,4-фталазиндиона.
Узел 4 - Технические или химически чистые соответствующие соли щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона.
Узел 5 - Маточный раствор после отделения технических или химически чистых солей щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона.
Узел 6 - Получаемый в процессе технический или химически чистый 5-амино-2,3-дигидро-1,4-фталазиндион.
Узел 7 - Водный раствор химически чистых солей соответствующих щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона.
Узел 8 - Водный раствор химически чистых солей соответствующих щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона.
Узел 9 - Медикаментозные химически чистые и медикаментозные особой чистоты соли соответствующих щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона.
При этом термины: коммерческие, технические, химически чистые и особой чистоты - для используемых и получаемых соединений известны (см., например. Краткая химическая энциклопедия, М.: Советская энциклопедия, 1967, т.4, с.с.546-548, а также Несмеянов А.Н., Несмеянов Н.А. «Начала органической химии», М.: «Химия», 1969, т.1, с.с.26-27).
Граф 1-2 - Действие гидроксидом соответствующего щелочного металла на 5-амино-2,3-дигидро-1,4-фталазиндион.
Граф 1-3 - Действие гидроксидом соответствующего щелочного металла на 5-амино-2,3-дигидро-1,4-фталазиндион.
Граф 2-3 - Хроматографическая очистка технических солей 5-амино-2,3-дигидро-1,4-фталазиндиона.
Граф 3-4 - Осаждение технических или химически чистых солей 5-амино-2,3-дигидро-1,4-фталазиндиона и их выделение.
Граф 4-5 - Передача маточного раствора после отделения солей 5-амино-2,3-дигидро-1,4-фталазиндиона.
Граф 4-7 - Хроматографическая очистка технических солей 5-амино-2,3-дигидро-1,4-фталазиндиона.
Граф 4-9 - Кристаллизация или технических, или химически чистых солей 5-амино-2,3-дигидро-1,4-фталазиндиона.
Граф 5-6 - Обработка маточника водным раствором кислот и отделение 5-амино-2,3-дигидро-1,4-фталазиндиона.
Граф 6-1 - Передача выделенного 5-амино-2,3-дигидро-1,4-фталазиндиона в начало технологической цепочки (начало цикла).
Граф 7-8 - Осаждение химически чистых солей 5-амино-2,3-дигидро-1,4-фталазиндиона и их выделение.
Граф 8-9 - Кристаллизация химически чистых солей 5-амино-2,3-дигидро-1,4-фталазиндиона.
Кроме того, данная схема включает один вход (в узел 1) и выходы: два из узла 6 и по одному из узлов 4, 8 и 9.
Вход в узел 1 показывает, что здесь в эту схему (в процесс) вводят исходный состав: или коммерческий, или технический, или химически чистый 5-амино-2,3-дигидро-1,4-фталазиндион.
Выход из узла 4 показывает, что из этого узла из процесса выводят технические или химически чистые щелочные соли 5-амино-2,3-дигидро-1,4-фталазиндиона (промежуточный состав).
Первый и второй выходы из узла 6 показывают, что отсюда из процесса выводят соответственно технический или химически чистый 5-амино-2,3-дигидро-1,4-фталазиндион и отходы производства - водный раствор соответствующих щелочных солей органических и неорганических кислот или их смесей.
Выходы из узлов 8 и 9 показывают, что здесь из процесса выводят соответственно химически чистые соли 5-амино-2,3-дигидро-1,4-фталазиндиона (промежуточный состав) и медикаментозные химически чистые и медикаментозные особой чистоты соли 5-амино-2,3-дигидро-1,4-фталазиндиона (целевой продукт).
Таким образом, возможности химико-технологического процесса, другими словами, используемые в качестве исходного состава виды 5-амино-2,3-дигидро-1,4-фталазиндиона, а также получаемые в качестве промежуточного состава и в качестве целевого продукта соли щелочных металлов 5-амино-2,3-дигидро-1,4-фталазиндиона, концентрированно можно представить следующим образом:
Исходный состав: 5-амино-2,3-дигидро-1,4-фталазиндион коммерческий (продаваемый для применения, например, для использования в качестве люминофора); 5-амино-2,3-дигидро-1,4-фталазиндион технический (полученный из технических солей 5-амино-2,3-дигидро-1,4-фталазиндиона без дополнительн