Молекулярный комплекс для трансфекции клеток млекопитающих, содержащий плазмидную днк, модифицированный полиэтиленимин и молекулы-лиганды
Иллюстрации
Показать всеИзобретение относится к молекулярной биологии. Предложен молекулярный трансфицирующий комплекс (МТК), состоящий из: плазмидной ДНК, несущей необходимую генетическую информацию, полиэтиленимина, модифицированного ацилгидразидными группами и способного образовывать ионные комплексы с плазмидной ДНК, молекул-лигандов, необходимых для рецептор-опосредованного адресования МТК в определенные типы клеток и обеспечения возможности длительной циркуляции МТК в кровяном русле. Молекула-лиганд содержит одну или несколько альдегидных групп, что создает возможность присоединять такие молекулы после образования комплекса ДНК-ацилгидразидополиэтиленимин. Преимуществом изобретения является создание пригодных для трансфекции комплексов, которые могут храниться в замороженном или высушенном состоянии длительное время. Изобретение может быть использовано в медицине для целей генной терапии. 4 з.п. ф-лы, 7 ил.
Реферат
Изобретение относится к молекулярной биологии и может быть использовано в медицине для целей генной терапии, а также в научных исследованиях.
Основной процедурой генной терапии является введение в клетки соответствующих тканей или органов больного нормально функционирующих генов взамен отсутствующих или для исправления функционирования дефектных генов. В качестве носителей (так называемых «векторов») для вводимой ДНК в настоящее время чаще всего используются молекулярные конструкции на основе модифицированных вирусов. Однако в связи с высокой вероятностью развития очень опасных побочных проявлений при использовании вирусных векторов большое значение приобретает задача создания невирусных носителей, способных осуществлять трансфекцию, т.е. доставку ДНК в клетки с последующей экспрессией встроенных в плазмиду генов как in vitro, так и in vivo.
Уровень техники
Для осуществления трансфекции клеток эукариот (т.е. введения в клетки и последующей экспрессии в них плазмид, несущих желаемую генетическую информацию) в настоящее время в качестве «невирусных векторов» чаще всего применяются молекулярные комплексы плазмидной ДНК с полилизином, полиэтиленимином (ПЭИ), хитозаном и другими поликатионами.
Известны научные публикации (Bioorganic & Medicinal Chemistry Letters 10 (2000) 1233-1235; Gene Ther 1998 Oct; 5(10): 1425-33; Bioconjug Chem 1997 Nov-Dec; 8(6): 839-44), в которых лиганды, содержащие альдегидные группы, присоединяются к ПЭИ за счет образования с первичными аминными группами неустойчивых азометиновых связей и для получения устойчивых препаратов требуется дополнительная стадия восстановления азометинов до вторичных аминов.
Известны патенты (США № 6420176, № 6383811), в которых для получения трансфицирующих комплексов плазмидной ДНК используются препараты ковалентно модифицированного ПЭИ. Ни в одном из них, по нашим сведениям, не используется модификация этого катионного полимера введением остатков гидразина или ацилгидразидных групп.
Важным моментом для эффективной трансфекции in vivo является возможность присоединять к молекулам носителя так называемые адресные лиганды, которые узнавались бы специфическими рецепторами на поверхности определенных типов клеток и, тем самым, способствовали бы адресной доставке трансфицирующей конструкции в клетки определенных органов.
В большинстве уже опубликованных работ адресные лиганды присоединяют к векторным молекулам ковалентно до комплексования с плазмидной ДНК, что в ряде случаев затрудняет получение компактных комплексов. Поэтому желательно создание «универсальных носителей», в которых предусмотрена возможность присоединения так называемых сменных лигандов уже после получения хорошо компактизованных комплексов с ДНК.
Наиболее близким аналогом является патент США 6635476, в котором предлагается метод создания молекулярных трансфицирующих конструкций на основе ПЭИ, предусматривающий возможность подсоединения «сменных» лигандов. Однако в нем используется принципиально иной, чем предлагаемый в настоящем изобретении, и, по нашему мнению, более дорогой и трудоемкий способ присоединения лигандов, использующий специально синтезирумые «хелирующие» пептиды и ионы переходных металлов.
Раскрытие изобретения
Было решено использовать реакцию между производными гидразина (в частности, ацилгидразидными производными) и лигандами, содержащими альдегидные группы для создания нового типа невирусных векторов, способных присоединять лиганды уже после образования компактных комплексов между молекулами носителя и молекулами ДНК.
С этой целью молекулы поликатионного вектора, содержащего вторичные аминные группы, в качестве которого был избран ПЭИ, сначала алкилировали акриламидом (для N-алкилирования полиаминов, кроме акриламида, могут быть также использованы эфиры акриловых кислот (например, по методике, описанной в статье Sashiwa H; Yaamori N; Sunamoto J; Aiba S "Chemicai modification of chitosan, 17 - Michael reaction of chitosan with acrylic acid water" Macromolecular Biosci 2003, Vol 3, Iss 5, pp 231-233), а затем проводили гидразинолиз амидных групп (гидразинолиз амидных групп полиакриламида описан, например, в статье John К. Inman and Howard M. Dintzis "The Derivatization of Cross-Linked Polyacrylamide Beads. Controlled Introduction of Functional Groups for the Preparation of Special-Purpose, Biochemical Adsorbents" Biochemistry v.8, (N 10) (1969) pp.4074-4082. Именно из этой статьи были взяты условия проведения гидразинолиза амидных групп), получая ацилгидразидные «ответвления» от полимерных цепей носителя (см. фиг.1). Полученные таким способом молекулы ПЭИ-полигидразида (ПЭИ-ПГ) оказались способны образовывать комплексы с плазмидной ДНК, обладающие хорошей трансфицирующей активностью.
Кроме того, такие комплексы, несущие на себе ацилгидразидные группы, обладали способностью в мягких условиях ковалентно присоединять (с образованием гидразонов) любые лиганды, содержащие альдегидные группы (см. фиг.7). Последнее обстоятельство создает необычайно широкие возможности снабжать получаемые трансфицирующие конструкции самыми разнообразными адресными лигандами олиго- и полисахаридной природы, присоединять практически любые низкомолекулярные и полимерные вещества, в которые с помощью ряда химических реакций вводятся альдегидные группы. Например, очень просто проводить присоединение любых гликопротеидов (после периодатного окисления и диализа). Возможно, также вводить содержащие альдегидные группы «экранирующие полимеры», в частности производные полиэтиленгликоля, создавая так называемые «стелз-конструкции» (Moghimi SM, Szebeni J. "Stealth liposomes and long circulating nanoparticles" Progress Lipid Res. V.42 (N 6), pp.463-478 (2003)).
Мы подтвердили вышеописанную возможность экспериментально, введя в уже сформированные комплексы ДНК-ПЭИ-ПГ остатки сукцинилированного ограниченно деполимеризованного хитозана (сукц-ОДХ), несущие на себе альдегидные группы, причем введение данных лигандов значительно повышало трансфицирующую активность комплексов.
Осуществление изобретения
Пример 1.
Синтез производного ПЭИ, содержащего ацилгидразидные группы.
20 г полиэтиленимина (фирмы BDH, Англия) растворяли в 100 мл 96%-ного этилового спирта, добавляли 11,7 мл 2 М раствора акриламида в этиловом спирте и нагревали при 90°С в течение 4 часов. После охлаждения реакционной смеси ее диализовали против этилового спирта, добавляли 10 мл безводного гидразин-гидрата и нагревали в течение 5 часов при 60°С. Затем реакционную смесь охлаждали и вновь диализовали против деионизованной воды.
Пример 2.
Определение количества гидразидных групп, введенных в ПЭИ.
Раствор ПЭИ-ПГ-HCl (рН=3,0) обрабатывали заведомым избытком (ванилина) в течение 1 часа при комнатной температуре и подвергали истощающему диализу сначала против 1 н. раствора хлорида натрия, содержащего 0,005 н. HCl, а затем против деионизованной воды. Поскольку ванилин содержит альдегидную группу, он даже при рН 3 присоединяется к ацилгидразидным группам ПЭИ-ПГ, образуя устойчивые в кислой среде гидразоновые производные, содержащие бензольное кольцо. Тем самым, спектр УФ-поглощения полимера сильно изменяется, появляется пик при 280 нм. Это позволяет на основе молярной экстинкции ванилина рассчитать приблизительное количество остатков ванилина, приходящихся на 1 г ПЭИ-ПГ. В то же время проведение реакции и последующий истощающий диализ при рН приблизительно 3 приводит к удалению избытка молекул ванилина, поскольку образование азометиновых производных между альдегидными группами и аминогруппами ПЭИ носит (при кислом рН) равновесный характер.
Согласно нашим расчетам, содержание бензольных групп в очищенном продукте составляет 0,097 мол на 1 мол мономерных звеньев ПЭИ, т.е. степень замещения ацилгидразидными группами составляет приблизительно 9,7%.
Пример 3.
Ограниченная деполимеризация хитозана с помощью азотистой кислоты.
Была использована методика, приведенная в патенте США №5312908. Деполимеризацию хитозана (препарат московской фирмы «Сонат», содержащий по информации производителя 15% N-ацетилированных глюкозаминовых звеньев) проводили в течение 2 часов при температуре +5°С, рН=3 и молярном соотношении HNO2 к аминогруппам хитозана = 0,1. По окончании инкубации рН смеси доводили до 9 с помощью раствора NaOH, выпавший хитозан отделяли центрифугированием и вновь растворяли, добавляя уксусную кислоту до рН 4.
Для полного удаления низкомолекулярных продуктов реакции после 3-х циклов переосаждения ОДХ растворяли в 10 мл 0,05 М уксусной кислоты и диализовали 2 раза против 0,05 М АсОН и 1 раз против деионизованной воды, используя бензоилированную мембрану (фирмы «Сигма» США), пропускающую молекулы только менее 2 КДа.
Пример 4
Синтез препарата «Полиам-К».
В данном случае алкилирование исходного препарата ПЭИ проводили в более мягких (по сравнению с примером 1) условиях. 20 г полиэтиленимина (фирмы BDH, Англия) растворяли в 100 мл 96%-ного этилового спирта, добавляли 2 мл 2 М раствора акриламида в этиловом спирте и нагревали при 90°С в течение 2 часов. После охлаждения реакционной смеси ее диализовали против этилового спирта, добавляли 10 мл безводного гидразин-гидрата и нагревали в течение 5 часов при 60°С. Затем реакционную смесь охлаждали и вновь диализовали против деионизованной воды. Оценку содержания ацилгидразидных групп проводили, как описано в примере 2. Согласно нашим расчетам степень замещения ацилгидразидными группами составила приблизительно 1,2%.
К полученному препарату добавляли ОДХ в избытке по молям альдегидных групп и после диализа против деионизованной воды препарат подвергали лиофильному высушиванию.
Пример 5.
Сукцинилирование ОДХ.
Ацилирование ОДХ янтарным ангидридом проводили по методике, описанной в патенте США № 5665702, с тем отличием, что после ограниченной деполимеризации хитозана азотистой кислотой не проводилось восстановление альдегидной группы, образовавшейся на одном из концов молекулы. К раствору деполимеризованного хитозана добавляли раствор янтарного ангидрида в ацетоне. Молярное соотношение ангидрида к аминогруппам ОДХ составляло 0,75. Реакционную смесь перемешивали при комнатной температуре 24 часа. Сукц-ОДХ осаждали, добавляя большой избыток ацетона, собирали и промывали метанолом с помощью центрифугирования. Осадок растворяли в 0,5 М КОН и диализовали против деионизованной воды до рН 7. Степень ацилирования была оценена приблизительно = 0,45 с помощью количественного определения свободных аминогрупп нингидрином.
Пример 6.
Методика проведения трансфекции in vitro.
За 18-24 часа до трансфекции клетки рассевали в 6-24-луночные планшеты в такой концентрации, чтобы на следующий день образовался 40-60% монослой. Комплексы ДНК-поликатион готовили непосредственно перед трансфекцией. С этой целью разбавляли основной раствор плазмидной ДНК в PBS (рН 7,2), или 150 мМ растворе NaCl, или в деионизованной воде до концентрации 40 мкг/мл. Например: 2 мкл ДНК (1 мкг/мл) + 48 мкл PBS. Раствор поликатиона разбавляли до такой концентрации, чтобы при смешивании его в равных объемах с ДНК достигнуть желаемого соотношения аминных и фосфатных групп (N:P). Полученные растворы плазмидной ДНК и поликатиона тщательно перемешивали и инкубировали 20 минут при комнатной температуре. В случаях, когда использовали «сменные» лиганды, их добавляли к смеси ДНК-ПЭИ-ПГ и инкубировали еще 20 минут. Затем трансфекционную смесь интенсивно встряхивали и вносили в лунки с клетками в объеме, составляющем 1/10 от объема ростовой среды. Спустя 4 часа инкубации в лунках с клетками меняли среду. Через 48 часов производили анализ эффективности трансфекции.
Пример 7.
Модификация комплексов ДНК-ПЭИ-ПГ молекулами сукц-ОДХ непосредственно при подготовке трансфекции.
Трансфекционную смесь ДНК и ПЭИ-ПГ готовили, как описано в примере 5. Затем смесь интенсивно встряхивали, вносили в нее водный раствор сукц-ОДХ из расчета 2 моль альдегидных групп сукц-ОДХ на 1 моль гидразидных групп ПЭИ-ПГ и инкубировали еще 20 минут. Далее процедуру проводили, как описано в примере 5.
Пример 8.
Оценка эффективности трансфекции различных клеточных линий.
Через 48 часов после трансфекции клетки промывали фосфатно-солевым буфером (PBS) и фиксировали раствором, содержащим 0,25% глутаральдегида и 2% формальдегида, в течение 5-10 мин при 4°С. После двукратной промывки клетки покрывали in situ окрашивающим раствором, приготовленным на PBS (рН 7,2), содержащим 5 мМ желтой кровяной соли, 5 мМ красной кровяной соли, 2 мМ MgCl2 и 0,05% хромогенного субстрата X-gal, растворенного в минимальном объеме диметилформамида, и инкубировали при 37°С в течение 4-24 часов. Экспрессию гена β-галактозидазы выявляли при помощи микроскопического исследования по наличию ярко окрашенных синих клеток на фоне бесцветного монослоя клеток. Эффективность трансфекции определяли делением количества синих клеток на общее количество трансфецированных клеток и выражали в процентах.
Пример 9.
Количественный анализ на β-галактозидазу Е.coli в экстрактах эукариотических клеток.
Монослой трансфецированных клеток, выращенных на 12-лун. планшетах, трижды промывали PBS без солей кальция и магния. Вносили в лунки с клетками по 100 мкл буфера для лизиса (0,1 М фосфатный буфер, рН 7,5, 0.5% Тритон Х-100 v/v или 0.125% NP-40 v/v). Инкубировали смесь, покачивая на шейкере в течение 15 мин при 37°С. Для каждого исследуемого образца (лунка с клетками) готовили следующую реакционную смесь:
100X Mg2+ раствор(0,1 М MgCl2 4,5 М β-меркаптоэтанол) - 6 мкл
1X ONPG (4 мг/мл в PBS) - 130 мкл
PBS, рН 7,5 - 400 мкл
Реакционную смесь вносили в лунки, перемешивали покачиванием, инкубировали при 37°С до появления желтой окраски. Если фон был невысок, инкубацию вели в течение 1-2 часов. Фиксировали в рабочей тетради время и останавливали реакцию добавлением в лунки по 1 мл Na2CO3 (1 M). Определяли оптическую плотность раствора при длине волны 420 нм. Активность β-галактозидазы выражали в условных единицах (оптическая плотность реакционной смеси, инкубированной при 37°С на 50 тыс. трансфицированных клеток, пересчитанная на 1 час инкубации). Линейный участок в анализе находится в пределах 0,2-0,8 OD420. Если значения превышали этот предел, повторяли эксперимент, инкубируя реакционную смесь в течение меньшего времени.
Пример 10.
Сравнение результатов, полученных при in vitro трансфекции различных типов клеток разными молекулярными комплексами.
A) Эффективность трансфекции различных клеточных культур при помощи Полиам-К и ПЭИ-ПГ, определенная окрашиванием X-gal, составила 5-15% (Hela, MA-104), 20-25% (Vero, MeWo, CRFK) и 30-50% (COS-1), что в 3-15 раз больше, чем при помощи исходного препарата - ПЭИ 90 кД. Оптимальное соотношение N:P, обеспечивающее максимальную эффективность трансфекции при наименьшей токсичности, варьировало от 1:10 до 1:60 и зависело от типа клеток. Анализ подобных препаратов в электронном микроскопе выявил наличие компактных округлых наночастиц с диаметром 20-35 нм.
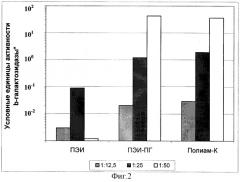
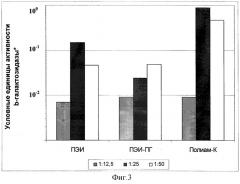
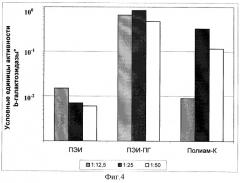
Б) Параллельно с выявлением процента клеток, экспрессирующих β-галактозидазу, определяли удельную активность β-галактозидазы в экстрактах клеток. Результаты экспериментов по трансфекции культур клеток Vero, MeWo, Hela и COS-1 представлены в виде гистограмм на фиг.2, 3, 4 и 5. Эффективность трансфекции различных клеточных культур при помощи Полиам-К и ПЭИ-ПГ, определенная по активности β-галактозидазы в экстрактах клеток, в большинстве экспериментов была значительно более высокой, чем при помощи ПЭИ 90 кД. Разница в активности β-галактозидазы в клетках, трансфицированных Полиам-К и ПЭИ-ПГ, в сравнении с ПЭИ 90 кД составила от 5 до 100 и более раз.
Обобщение полученных результатов показало, что оптимальное соотношение N:P, обеспечивающее максимальную эффективность трансфекции при наименьшей токсичности, варьировало от 1:10 до 1:60 и зависело от типа клеток. Длительное хранение препарата при 4°С (в течение нескольких месяцев) и многократное замораживание-оттаивание не приводило к значительному снижению эффективности трансфекции. Эффективность трансфекции не зависела от наличия в питательной среде эмбриональной сыворотки коров.
B) Показано, что обработка комплексов ПЭИ-ПГ/плазмидная ДНК препаратом сукц-ОДХ увеличивает эффективность временной трансфекции различных клеточных линий.
Эффективность временной трансфекции клеточных культур при помощи ПЭИ-ПГ, определенная окрашиванием X-gal, составила 2-4% (MeWo, MA-104) и 3-6% (Vero). Обработка комплексов ПЭИ-ПГ/плазмидная ДНК Сукц-ОДХ значительно повышала эффективность трансфекции, которая составила 8-12% (MA-104, Vero) и 15-20% (MeWo). Параллельно с выявлением процента клеток, экспрессирующих β-галактозидазу, определяли удельную активность β-галактозидазы в экстрактах клеток. Результаты экспериментов по трансфекции культуры клеток Vero представлены в виде гистограммы на фиг.6.
Обработка уже сформированных комплексов ДНК - ПЭИ-ПГ препаратом сукц-ОДХ, молекулы которого содержат на одном из своих концов альдегидные группы, приводит к образованию гидразонов. Таким образом, к поверхности наночастиц оказываются прикрепленными молекулы сукц-ОДХ, содержащие 15% N-ацетилированных глюкозаминовых звеньев. Как известно, на поверхности многих типов эукариотических клеток имеются рецепторы к молекулам N-ацетилглюкозамина (G.G.Krivtsov and R.I.Zhdanov. Targeted delivery of functional genes for gene therapy using carbohydrates containing vectors. Vopr Med Khim 46 (2000) 246-55 Review.). Можно предположить, что более высокие уровни трансфекции в случаях использования комплексов, содержащих сукц-ОДХ или ОДХ (Полиам-К), объясняются участием в интернализации компактизованных наночастиц механизмов рецептор-опосредованного эндоцитоза.
Приведенные примеры не ограничивают поле правовой защиты настоящего патента. По аналогии с приведенными примерами могут быть использованы любые другие лиганды, содержащие альдегидные группы (например, окисленные периодатом гликопротеиды, в частности иммуноглобуллины), или лиганды, к которым с помощью ряда химических реакций были присоединены альдегидсодержащие остатки (например, полиэтиленгликоль или сильно разветвленные полигидроксилсодержащие полимеры, «экранирующие» трансфицирующие комплексы от «захвата» клетками ретикулоэндотелиальной системы).
Описание графических материалов, иллюстрирующих предлагаемое изобретение.
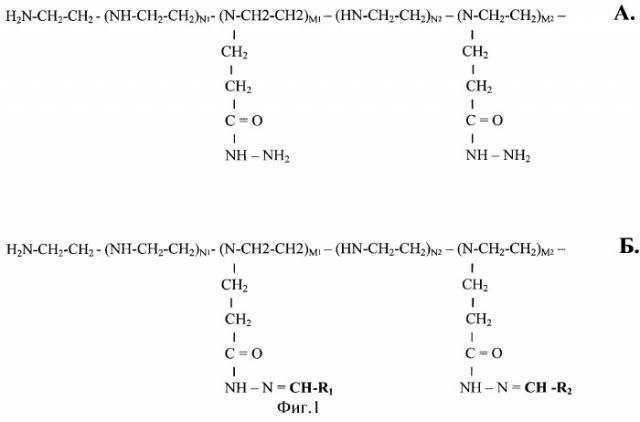
Фиг.1.
А) Химическая структура модифицированного ацилгидразидными группами линейного ПЭИ (ПЭИ-ПГ).
Б) Химическая структура ПЭИ-ПГ после присоединения альдегидных лигандов: R1 - CHO, R2 - СНО и т.д. до Ri - CHO.
Образующиеся молекулы содержат гидразоновые группы RiCH=N-N-CO-... Общее число мономерных звеньев N=Σni+Σmi, где i может варьировать от 0 до i.
Σni - общее число немодифицированных мономерных звеньев.
Σmi - общее число модифицированных мономерных звеньев.
По нашим данным (см. пример 2) Σni=0,903 N, a Σmi=0,097 N.
Фиг.2.
Эффективность временной трансфекции культуры клеток Vero комплексами плазмиды pCMV-b-GAL-SPORT с разными поликатионами.
* Оптическая плотность реакционной смеси при λ=420 нм, пересчитанная на 1 час цветной реакции с хромогенным субстратом ONPG при 37°С.
Фиг.3.
Эффективность временной трансфекции культуры клеток MeWo комплексами плазмиды pCMV-b-GAL-SPORT с разными поликатионами.
* Оптическая плотность реакционной смеси при λ=420 нм, пересчитанная на 1 час цветной реакции с хромогенным субстратом ONPG при 37°С.
Фиг.4.
Эффективность временной трансфекции культуры клеток Hela комплексами плазмиды pCMV-b-GAL-SPORT с разными поликатионами.
* Оптическая плотность реакционной смеси при λ=420 нм, пересчитанная на 1 час цветной реакции с хромогенным субстратом ONPG при 37°С.
Фиг.5.
Эффективность временной трансфекции культуры клеток COS-1 комплексами плазмиды pCMV-b-GAL-SPORT с разными поликатионами.
* Оптическая плотность реакционной смеси при λ=420 нм, пересчитанная на 1 час цветной реакции с хромогенным субстратом ONPG при 37°С.
Фиг.6.
Сравнение эффективности временной трансфекции культуры клеток Vero комплексами плазмиды pCMV-b-GAL-SPORT с ПЭИ-ПГ и ПЭИ-ПГ + сукцинилированный ОДХ.
* Оптическая плотность реакционной смеси при λ=420 нм, пересчитанная на 1 час цветной реакции с хромогенным субстратом ONPG при 37°С.
Комплексы ПЭИ-ПГ и Полиам-К с ДНК готовили в соотношении N:P=20:1.
Фиг.7. Схема получения молекулярного комплекса, содержащего плазмидную ДНК, ПЭИ-ПГ и молекулы-лиганды.
1) Смешивание плазмидной ДНК и ПЭИ-ПГ.
2) Добавление к образовавшемуся комплексу молекул-лигандов с альдегидными группами.
3) Готовый молекулярный комплекс, содержащий ковалентные гидразоновые группировки (см. фиг.1).
1. Молекулярный комплекс для трансфекции клеток млекопитающих, содержащий плазмидную ДНК, модифицированный полиэтиленимин и молекулы-лиганды, отличающийся тем, что в молекулы полиэтиленимина введены ацилгидразидные группы, а молекулы-лиганды содержат альдегидные группы.
2. Молекулярный комплекс по п.1, отличающийся тем, что молекулы-лиганды представляют собой деполимеризованный хитозан с молекулярной массой в пределах 2-20 кД, несущий на одном конце молекулы альдегидную группу.
3. Молекулярный комплекс по п.1, отличающийся тем, что молекулы-лиганды представляют собой N-сукцинилированный деполимеризованный хитозан с молекулярной массой в пределах 2-20 кД, несущий на одном конце молекулы альдегидную группу.
4. Молекулярный комплекс по п.1, отличающийся тем, что в молекулы-лиганды введены альдегидные группы.
5. Молекулярный комплекс по п.1, отличающийся тем, что в качестве лигандов используются гидрофильные полимеры, содержащие альдегидные группы.