Вещество для возмещения дефектов кости и способ его получения
Иллюстрации
Показать всеИзобретение относится к области медицины и касается материалов для возмещения дефектов кости и способу их получения. Вещество для возмещения дефектов кости содержит гидроксиапатит, трикальцийфосфат, коллаген, а также дополнительно содержит неколлагеновые белки костной ткани, компоненты берут в определном содержании на 100 г сухого вещества. Получают это вещество путем воздействия на костную ткань, сушки и стерилизации, при этом проводят деминерализацию костной ткани соляной кислотой, нейтрализацию полученного раствора щелочью, подщелачивание полученной суспензии оксидом кальция при рН 11,0-12,0, отмывание осадка водой до нейтральной реакции, далее осуществляют лиофильную сушку и стерилизацию для мобилизации пептидных факторов роста. Вещество, полученное предложенным способом, обладает значительно выраженными свойствами инициировать костеобразование, поскольку оно содержит ростовые факторы костной ткани. 2 н.п. ф-лы, 26 ил.
Реферат
Изобретение относится к медицине и ветеринарии, в частности к веществам для возмещения дефектов костей (костных кист, очагов остеонекроза, остеомиелитических секвестров) посредством имплантации в дефект остеоиндуцирующего материала, а также способам получения такого материала.
Известны материалы для возмещения дефектов [SU 561564, 2 А61К 37/00, 15.06.1977], также и костных, содержащих, в том числе коллаген и кальцийфосфатные вещества [RU 2091083 С1, 6 A61L 15/32, A61L 15/44, A61L 15/18, 27.09.1997; RU 2052796 С1, 6 A61L 15/32, 02.10.1996; RU 2034572 С1, 6 A61L 15/32, A 61L 15/44, 10.05.1995; RU 2117492 С1, 6 A61L 15/00, A61L 15/32, A61L 15/44, A61L 15/20, A61L 27/00, A61C 13/08, 20.08.1997].
Наиболее близким веществом является ранозаживляющее и остеопластическое средство (варианты) [RU 2117492 С1, 6 A61L 15/00, A61L 15/32, A61L 15/44, A61L 15/20, A61L 27/00, A61C 13/08, 20.08.1997], содержащее композитную структуру из коллагена и кальций фосфатного вещества, которая нанесена на одну сторону резорбируемой в живых тканях пленки до общей толщины средства 0,5-10 мм, по второму варианту композиционная структура из коллагена и кальцийфосфатного вещества нанесена на обе стороны пленки до общей толщины средства 1-15 мм, пленка же выполнена из поливинилпирролидона, поливинилкапролактата, полилактида, полигликолида, хитозана, альгината и коллагена.
Наиболее близким способом получения является способ получения губчатого коллагенсодержащего материала [RU 2052796 С1, 6 A61L 15/32, 02.10.1996], включающий приготовление уксуснокислого коллоидного раствора коллагена, осаждение суспензии волокнистого коллагена, смешивание ее с сшивающим агентом, замораживание, оттаивание и сушку, требует осаждения волокнистого коллагена путем изменения рН уксуснокислого раствора коллагена до 4,0-5,0, а сушку сформированного губчатого коллагенсодержащего материала совмещают с его стерилизацией, помещая в этанол и/или ацетон с последующим выдерживанием в стерильной среде, коллаген [RU 2052796 С1, 6 A61L 15/32, 02.10.1996] и кальцийфосфатные вещества (гидроксиапатит, трикальцийфосфат) - при получении этого материала приготавливают в отдельных технологических процессах и смешивают для получения конечного продукта, при этом коллаген и кальцийфосфатные вещества самостоятельно не обладают остеоиндуцирующими свойствами и приобретают их после связывания пептидных факторов роста, циркулирующих в крови.
Поэтому задачей настоящего изобретения является расширение ассортимента на основе создание материала с высокой остеопластической способностью, технологичного способа получения этого материала, делающего возможным в один этап получение композиции коллагена и кальцийфосфатных веществ, а также мобилизацию на ней пептидных факторов роста, разработка состава, более адекватного физиологическому статусу организма, способного к реализации оптимальной возможности индукции костеобразования пептидными факторами роста.
Решение указанной задачи достигается тем, что предложено вещество для возмещения дефектов костной ткани, имеющее следующий состав на 100 г сухого вещества, г: гидроксиапатита 69-70, трикальцийфосфата 23-30, костного коллагена 3,16-3,5, неколлагеновых белков, обладающих сродством к костному минералу и гидроксиапатиту, 0,64-0,7, а для его получения предложен способ, который включает деминерализацию костной ткани соляной кислотой, нейтрализацию полученного раствора щелочью, нейтрализацию полученной суспензии оксидом кальция до рН 11,0-12,0, отмывание осадка водой до нейтральной реакции, лиофильную сушку и стерилизацию, причем указанную костную ткань получают из костей забиваемых на предприятиях мясоперерабатывающей промышленности животных.
Анализ известных материалов, используемых для возмещения костных дефектов посредством имплантации, и способов их получения показывает, что предложенная совокупность состава вещества для возмещения костных дефектов и признаков способа его получения является новой, не является очевидной и явным образом не следует из уровня знаний в отрасли, поэтому предложение имеет изобретательский уровень. Изобретение является промышленно выполнимым, что показывает пример получения и использования предложенного вещества.
Пример конкретного выполнения. Диафизы трубчатых костей свиней очищают от мягких тканей, измельчают до частиц размером 2-5 мм, деминерализуют соляной кислотой при температуре 8-12°С при перемешивании, поддерживая рН в пределах 0,05-0,07. По завершении деминерализации частицы кости прокалываются иглой, полученный раствор отделяют от нерастворившихся частиц, нейтрализуют концентрированным раствором щелочи до рН 4-5, вносят небольшими порциями при перемешивании порошок кальция оксида до рН 11,0-12,0. Образовавшуюся суспензию выдерживают при комнатной температуре 48 часов, периодически перемешивая. Надосадочную жидкость удаляют, осадок отмывают дистиллированной водой до рН 7,3-7,5, лиофильно высушивают и стерилизуют радиационным методом.
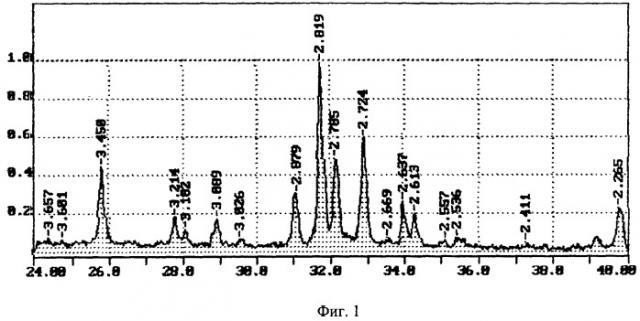
Для определения состава полученного материала навеску его прокаливают при 1000°С. При этом убыль массы, равная содержанию органических веществ, составляет 10-12%. Прокаленную пробу исследуют рентгенологически для качественного и количественного анализа на гидроксиапатит и трикальцийфосфат. По результатам рентгенструктурного анализа (фиг.1. Рентгенструктурный анализ. Дифрактограмма: тип анода - Cu, число интервалов - 1, режим - непрерывный, начальный угол - 24,000, конечный угол - 40,000, шаг - 0,20, экспозиция - 1,20, скорость 1, максимальный интервал - 468, углы - 2Тета, интенсивность - приведенная, вся шкала - 390) материал является двухфазным, при этом содержание гидроксиапатита составляет 70-80%, трикальцийфосфата - 20-30%. Другую навеску материала подвергают гидролизу в запаянных ампулах в 6 н. HCl при 105°С 16 ч для определения содержания коллагена по гидроксипролину и неколлагеновых белков - по тирозину. Содержание коллагена в материале составляет 2,5-3,5%, неколлагеновых белков костной ткани - 0,5-0,7%.
В ходе морфологического исследования осуществляют оценку структурных преобразований в костной ткани крыс, подвергнутых оперативному хирургическому моделированию дефекта костной ткани путем перфорации дистального эпифиза бедренной кости с последующим введением в костную рану препаратов, способных влиять на процессы остеорепарации, для сравнительного анализа эффективности их применения в качестве остеоиндукторов. Животных выводят из эксперимента путем передозировки тиопентала натрия с соблюдением правил проведения работ с использованием экспериментальных животных и требований Министерства здравоохранения Союза Советских Социалистических Республик №12000-496 от 2 апреля 1980 г.
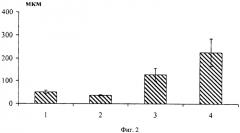
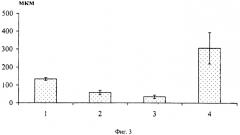
Биотестирование вещества для возмещения дефекта кости проводят на крысах, которым при соблюдении правил асептики и обезболивания малооборостистой дрелью с зубоврачебным бором создавали дефект диаметром 2,5 мм в области дистального эпифиза бедренной кости. Животных выводят из эксперимента в сроки 1 и 2 месяца после операции, препарируют оперированный фрагмент конечности и готовят гистологические препараты. Подсчитывают площадь, занимаемую костными балками (фиг.2. Площадь, занимаемая костными балками: 1 - гемостатическое, ранозаживляющее и остепластическое средство [RU 2091083 С1, 6 A61L 15/32, A61L 15/44, A61L 15/18, 27.09.1997], 2 - ранозаживляющее и остеопластическое средство (варианты) [RU 2117492 С1, 6 A61L 15/00, A61L 15/32, A61L 15/44, A61L 15/20, A61L 27/00, А61С 13/08, 20.08.1997], 3 - вещество для возмещения дефектов кости, 4 - контроль) в области дефекта, количество частиц (фиг.3. Размеры частиц: 1 - гемостатическое, ранозаживляющее и остепластическое средство [RU 2091083 С1, 6 A61L 15/32, A61L 15/44, A61L 15/18, 27.09.1997], 2 - ранозаживляющее и остеопластическое средство (варианты) [RU 2117492 С1, 6 A61L 15/00, A61L 15/32, A61L 15/44, A61L 15/20, A61L 27/00, А61С 13/08, 20.08.1997], 3 - вещество для возмещения дефектов кости, 4 - контроль). В опыте она в 4 раза больше, чем в контроле. Через 2 месяца после имплантации в опыте дефект заполнен начинающей перестраиваться новообразованной костной тканью, в контроле на месте дефекта кольцо новообразованной кости, в центре которого сохраняется не минерализованная соединительная ткань, - состояние, которое в опыте наблюдают через 1 месяц после имплантации (смотрите ниже).
Результаты исследований по группе №1, 1 месяц после операции. Входное отверстие плотно закрыто массивом волокнистого хряща (фиг.4. Входное отверстие плотно закрыто массивом волокнистого хряща, гематоксилин и эозин, окуляр (ок.) 10, объектив (об.) 10). В ответ на травму в пластическую реакцию вовлекаются главным образом мигрирующие клетки крови и местные соединительнотканные элементы, поэтому развитие пролиферата происходит за счет периоста и прилегающих мягких тканей. В области оперативного вмешательства обнаружены базофильно окрашенные частицы имплантата (фиг.5. Область введения имплантата: его базофильные частицы не отграничены от окружающей кости, а наоборот, тесно с ней консолидированы, гематоксилин и эозин, ок.10, об.20), они не отграничены от прилежащей костной ткани, а наоборот, тесно с ней консолидированы и пронизаны молодыми костными трабекулами, имеющими в своей основе юные формы коллагена (фиг.6. Юные изоформы коллагена в матриксе новообразованных костных трабекул, пикросириус, ок.10, об.10), что может свидетельствовать об активно протекающих процессах фибриллогенеза. Следует отметить, что растущие балки кости, утолщаясь, ассимилируют имплантированные частицы. Этот факт может отражать их роль не только как механического каркаса, но и пластического материала, на основе которого разворачивается остеогенез (фиг.7. Ассимиляция частиц имплантата костными балками, гематоксилин и эозин, ок.10, об.20). На границе между волокнистым хрящом и новообразованными костными балками, замещающими дефект кортикального слоя, регистрируется повышенная активность щелочной фосфатазы - маркера пролиферативной и биосинтезирующей активности костных клеток (фиг.8. На границе между волокнистым хрящом и новообразованными костными балками, замещающими дефект кортикального слоя, регистрируется повышенная активность щелочной фосфатазы, реактив Шиффа, ок.10, об.10), а коллаген представлен, в основном, юными изоформами (фиг.9. Юные изоформы коллагена на границе между волокнистым хрящом и новообразованными костными балками, пикросириус, ок.10, об.10), что подтверждает достаточно высокий метаболизм ткани.
Результаты исследований по группе №2, 1 месяц после операции. Входное отверстие дырчатого дефекта закрыто массивом волокнистого хряща (фиг.10. Входное отверстие дырчатого дефекта закрыто массивом волокнистого хряща, гематоксилин и эозин, ок.10, об.10), частицы имплантата окружены новообразованными костными балками (фиг.11. Частицы имплантата окружены новообразованными костными балками, гематоксилин и эозин, ок.10, об.10), а кость вокруг этого региона отличается положительной ШИК-реакцией (фиг.12. Высокая активность щелочной фосфатазы в кости вокруг имплантата, реактив Шиффа, ок.10, об.10), частицы имплантата не инкапсулированы, нетрудно видеть процесс их резорбирования с образованием лакун (фиг.13. Формирование резорбционных лакун вокруг частиц имплантата, гематоксилин и эозин, ок.10, об.10). В зоне дефекта на фоне интактной кости появляется хондроидная ткань (фиг.14. Хондроидная ткань в зоне дефекта, гематоксилин и эозин, ок.10, об.20). Для хондроида характерна яркая базофилия основного вещества. Далее происходит метаморфоз регенерата - в условиях анаэробиоза и адаптации клеток к брадитрофии дифференцировка их происходит в направлении формирования структур хондроидного пролиферата - гетерогенен по степени морфологической зрелости фибриллярного белка коллагена (фиг.15. Коллаген в зоне дефекта гетерогенен по степени морфологической зрелости, пикросириус, ок.10, об.10), что может явиться эквивалентом адаптивного ремоделирования микроархитектоники костных структур.
Результаты исследований по группе №3, 1 месяц после операции. Картина остеорепарации по своему структурному выражению напоминает таковую у животных первой и второй групп. Однако костные трабекулы, обрамляющие частицы имплантата, отличаются своей массивностью (фиг.16. Массивные костные балки между частицами имплантата, гематоксилин и эозин, ок.10, об.20), и активностью в метаболическом отношении, что хорошо подтверждается усилением реакции на щелочную фосфатазу внутри микрорегиона (фиг.17. Высокая активность щелочной фосфатазы в новообразованных костных балках, реактив Шиффа, ок.10, об.20), а также возрастание по степени морфологической зрелости и ориентационной упорядоченности фибриллярного белка коллагена (фиг.18. Возрастание коллагена по степени морфологической зрелости и ориентационной упорядоченности, пикросириус, ок.10, об.10), что свидетельствует о более быстром протекании репаративного процесса по сравнению с 1 и 2 группами. Вместе с тем, часть регенерата, развивающегося со стороны периоста и хорошо васкуляризированных зон дефекта, не проходит хондроидную стадию, то есть остеобластический процесс происходит на фоне соединительной ткани. Наоборот, в местах, где посттравматическое нарушение кровообращения сохраняется на более длительное время, регенерат претерпевает изменения хондроидного характера - здесь обнаружены гнезда с клетками, по форме напоминающие гиалиновый хрящ (фиг.19. Гнезда с хондробластоподобными клетками, гематоксилин и эозин, ок.10, об.40). Нельзя исключить, что после восстановления кровообращения они превращаются в остеобласты (по типу энхондрального окостенения). В костных балках вокруг хондроидных микрорегионов отмечена интенсивная остеобластическая реакция, здесь клетки по интрацеллюлярным показателям дают резко положительную реакцию на щелочную фосфатазу. Выявленный хондроидный пролиферат вне зоны повреждения является тем пластическим материалом, при помощи которого кровь восстанавливает потерю и создает морфологическую основу для развития костной ткани.
Результаты исследований по группе №4, 1 месяц после операции. Место введения имплантата практически полностью замещено регенератом десмальной природы, вокруг которого располагается молодая кость с гипертрофированными балочными структурами (фиг.20. Молодая кость представлена гипертрофированными балочными структурами, гематоксилин и эозин, ок.10, об.20), содержащими гетерогенные изоформы коллагена (фиг.21. Матрикс молодых костных балок содержит коллаген, гетерогенный по степени морфологической зрелости, пикросириус, ок.10, об.20) и характеризующиеся слабой активностью щелочной фосфотазы (фиг.22. Слабая активность щелочной фосфатазы в молодой кости, реактив Шиффа, ок.10, об.40).
Результаты исследований по группе №1, 2 месяца после операции. Область введения имплантата окружена сплошным кольцом оформленной костной ткани, в центре этого конгломерата практически не осталось крупных частиц препарата, в само же «кольцо» внедрены корпускулы различного размера, а в кости вокруг них располагаются резорбционные лакуны, содержащие остеокласты (фиг.23. Костное «кольцо» содержит частицы препарата различных размеров, гематоксилин и эозин, ок.10, об.20), коллаген различных степеней зрелости (фиг.24. Костное кольцо различных степеней зрелости, пикросириус, ок.10, об.10).
Результаты исследований по группе №2, 2 месяца после операции. Гистологическая картина аналогична первой группе, но в центре кольца присутствует большое количество соединительной ткани, которая постепенно оссифицируется (фиг.25. Частично оссифицированный центр регенерата, гематоксилин и эозин, ок.10, об.10), а в некоторых ее участках отмечена повышенная активность щелочной фосфатазы (фиг.26. Активность щелочной фосфатазы наблюдается в отдельных локусах, реактив Шиффа, ок.10, об.20).
Результаты исследований по группе №3, 2 месяца после операции. Гистологически картина аналогична второй группе.
Результаты исследований по группе №4, 2 месяца после операции. Регенерат оформленный, но толщина кольца меньше, чем в остальных группах, частицы имплантата лизированы в наименьшей степени.
Следует подчеркнуть, что во всех исследуемых группах, и особенно у животных третьей группы, отмечено благоприятное прогрессирование регенерата к двухмесячному сроку после оперативного вмешательства. У животных третьей группы зарегистрированная картина множественной оссификации в очагах хондроидного пролиферата с появлением клеток остеобластического ряда является выражением явлений метаморфоза хондроидных клеток в остеобласты. На рассматриваемой стадии они могут дифференцироваться в различных направлениях, определяемых в конечном счете условиями тканевого обмена. На основании полученных данных по всем показателям лидирует препарат, введенный животным группы №3, также получены положительные результаты по стимуляции роста кости в группах №1 и №2, в группе №4 активность как остеиндуктивная, так и остеокондуктивная наименьшая.
На основании полученных данных по всем показателям оказывает лучшее действие препарат, введенный животным группы №3, также дают положительные результаты по стимуляции роста кости в группах №1, №2, и №4. По результатам данного исследования следует, что предлагаемое вещество для возмещения дефектов кости обладает значительно более выраженными свойствами инициировать костеобразование, чем применяемые материалы, от которых оно отличается содержанием ростовых факторов костной ткани. Его промышленное производство может быть осуществлено путем масштабирования описанного способа. Источник получения - кость забиваемых на предприятиях мясоперерабатывающей промышленности животных - легко доступен. Применение предлагаемого вещества в медицине и ветеринарии не требует разработки новых методик в сравнении с используемыми в настоящее время.
Источники информации
1. SU 561564, 2 А61К 37/00, 15.06.1977.
2. RU 2091083 С1, 6 A61L 15/32, A61L 15/44, A61L 15/18, 27.09.1997.
3. RU 2052796 С1, 6 A61L 15/32, 02.10.1996.
4. RU 2034572 С1, 6 A61L 15/32, A61L 15/44, 10.05.1995.
5. RU 2117492 С1, 6 A61L 15/00, A61L 15/32, A61L 15/44, A61L 15/20.
A61L 27/00, А61С 13/08, 20.08.1997.
1. Вещество для возмещения дефектов кости, содержащее гидроксиапатит, трикальцийфосфат, коллаген, отличающееся тем, что оно дополнительно содержит неколлагеновые белки костной ткани, при этом состав на 100 г сухого вещества содержит, г:
| гидроксиапатит 69,0 | 70,0 |
| трикальцийфосфат 23,0 | 30,0 |
| коллаген 3,16 | 3,5 |
| неколлагеновые белки костной ткани 0,64 | 0,7 |
2. Способ получения вещества для возмещения дефектов кости путем воздействия на костную ткань, сушки и стерилизации, отличающийся тем, что проводят деминерализацию костной ткани соляной кислотой, нейтрализацию полученного раствора щелочью, подщелачивание полученной суспензии оксидом кальция при рН 11,0-12,0, отмывание осадка водой до нейтральной реакции, далее осуществляют лиофильную сушку и стерилизацию для мобилизации пептидных факторов роста.