Применение ингибиторов сох-2 для предупреждения иммунодефицита
Иллюстрации
Показать всеНастоящее изобретение относится к способу лечения или предупреждения инфекций, вызываемых родственным вирусом у животного, таких как SIV или FIV, или СПИД, а также к применению ряда ингибиторов циклооксигеназы изоформы 2 (СОХ-2) по указанному назначению. Предпочтительные ингибиторы COX-2: L-745337, рофекоксиб, NS398, SC58125, этодо-лак, мелоксикам, целекоксиб, DuP-697, DFU, трициклический MF, валдекоксиб, паракоксиб натрий, эторикоксиб или нимезулид - нестероидные противовоспалительные лекарственные средства. Они улучшают иммунные функции Т-клеток, снижают или отменяют иммунодефицит. 2 н. и 22 з.п. ф-лы, 18 ил., 6 табл.
Реферат
Настоящее изобретение относится к области лечения иммунодефицита и вирусных инфекций. Более конкретно, настоящее изобретение относится к использованию ингибиторов циклооксигеназы-2 (СОХ-2) или их производных в целях иммуномодуляции для лечения иммунодефицита и вирусных заболеваний, а в частности ВИЧ-инфекций и СПИДа и родственных состояний.
Простагландины играют важную роль в воспалительных процессах, и ингибирование образования простагландинов является главной целью при разработке противовоспалительных лекарственных средств. Нестероидные противовоспалительные средства (НСПВС) ингибируют циклооксигеназу (СОХ), которая представляет собой фермент, участвующий в биосинтезе промежуточных соединений простагландинов из арахидоновой кислоты. В клинической медицине используется несколько НСПВС, включая лекарственные средства, такие как индометацин, пироксикам, теноксикам, диклофенак, мелоксикам, тенидап, изоксикам, ацетилсалициловая кислота, дифлунизал, сулиндак, ибупрофен, напроксен и кетопрофен.
В настоящее время НСПВС являются широко распространенными лекарственными средствами, применяемыми во всем мире.
Эти НСПВС представляют собой клинически эффективные лекарственные средства и обладают жаропонижающим, противовоспалительным и антитромботическим действием. Главными показаниями для этого класса лекарственных средств являются артриты, включая остеоартрит и ревматоидный артрит, костно-мышечные боли и общие болезненные состояния. Однако эти лекарственные средства имеют серьезные побочные эффекты. Наиболее часто встречающимися побочными эффектами являются образование язв и кровотечения в области желудочно-кишечного тракта, ингибирование агрегации тромбоцитов и взаимодействие с другими лекарственными средствами.
В начале 1990-х годов была клонирована вторая изоформа фермента СОХ. В настоящее время эта новая изоформа СОХ известна как СОХ-2 (Vane et al., 1998, Ann. Rev. Pharmacol. Toxicol., 38, р.97-120).
В настоящее время хорошо известны две изоформы СОХ, СОХ-1 и СОХ-2 (недавно было также высказано предположение о существовании СОХ-3). СОХ-1 присутствует в большинстве тканей и может рассматриваться как фермент "домашнего хозяйства". Активность фермента СОХ-1 обеспечивает защиту, например, выстилки желудочно-кишечного тракта. Однако обычно СОХ-2 не присутствует в нормальных тканях, но она продуцируется в процессе воспаления. Некоторые из побочных эффектов НСПВС связаны с ингибированием фермента СОХ-1. НСПВС ингибируют как фермент СОХ-1, так и фермент СОХ-2 (см. таблицы 1-3):
| Таблица 1Величины IC50 и отношение СОХ-2/СОХ-1 для различных НСПВС в макрофагах морской свинки, используемой в качестве модели (величины IC50 взяты у Engelhart et al., J. Inflammatory Res., 44, p.422-43, 1995) | |||
| НСПВС | IC50 для СОХ-2-(мкмоль/литр) | IC50 для СОХ-1(мкмоль/литр) | Селективность по отношению к СОХ-2, СОХ-1/СОХ-2 |
| Мелоксикам | 0,0019 | 0,00577 | 3 |
| Диклофенак | 0,0019 | 0,000855 | 0,45 |
| Пироксикам | 0,175 | 0,00527 | 0,030 |
| Теноксикам | 0,322 | 0,201 | 0,6 |
| Индометацин | 0,00636 | 0,00021 | 0,03 |
| Теридеп | 47,8 | 0,393 | 0,008 |
| Таблица 2Величины IC50 для различных НСПВС в штатных клетках, ингибирующих СОХ-1 (коровьи эндотелиальные клетки) и СОХ-2 (стимулированные макрофаги)(величины IC50 взяты у Taketo et al., J. National Cancer Institute, 90, p.1529-1536, 1998) | |||
| НСПВС | IC50 для СОХ-2(мкмоль/литр) | IC50 для СОХ-1(мкмоль/литр) | Селективность по отношению к СОХ-2, СОХ-1/СОХ-2 |
| Аспирин | 50 | 0,3 | 0,006 |
| Индометацин | 0,6 | 0,01 | 0,02 |
| Толфенамовая кислота | 0,005 | 0,0003 | 0,06 |
| Ибупрофен | 15 | 1 | 0,07 |
| Ацетаминофен | 20 | 2,7 | 0,1 |
| Салицилат натрия | 100 | 35 | 0,35 |
| BW 755C | 1,2 | 0,65 | 0,5 |
| Флубипрофен | 0,025 | 0,02 | 0,8 |
| Карпрофен | 3 | 3 | 1 |
| Диклофенак | 0,35 | 0,5 | 1,4 |
| Напроксен | 1,3 | 2,2 | 1,7 |
| BF 389 | 0,03 | 0,15 | 5 |
| Таблица 3Ингибирование синтеза рекомбинантного PGH (СОХ-1 и СОХ-2) (величины IC50 взяты у Laneuvill et al., J. Fharm. Exp. Ther., 271, p.927-34, 1994) | |||
| НСПВС | IC50 для СОХ-2(мкмоль/литр) | IC50 для СОХ-1(мкмоль/литр) | Селективность по отношению к СОХ-2, СОХ-1/СОХ-1 |
| Индометацин | >1000 | 13,5 | <0,01 |
| Сулиндака сульфид | 50,7 | 1,3 | 0,03 |
| Пироксикам | >500 | 17,7 | 0,04 |
| Диклофенак | 20,5 | 2,7 | 0,13 |
| Флубипрофен | 3,2 | 0,5 | 0,16 |
| Меклофенемат | 9,7 | 1,5 | 0,15 |
| Фенилбутазон | >100 | 16,0 | <0,16 |
| Напроксен | 28,4 | 4,8 | 0,17 |
| Ибупрофен | 12,5 | 4,0 | 0,3 |
| Кетоголактрометамин | 60,5 | 31,5 | 0,5 |
| DHA (22-6) | 41 | 25,6 | 0,6 |
| 6-MNA | 93,5 | 64,0 | 0,7 |
| Этодолак | 60 | 74,4 | 1,2 |
| Салициловая кислота | >1000 | >1000 | ˜1 |
За последние десять лет было идентифицировано несколько новых селективных ингибиторов COX-2 и так называемых "преимущественных" ингибиторов COX-2. Было разработано несколько таких ингибиторов COX-2, и небольшая их часть недавно поступила в продажу. Некоторые из этих новых ингибиторов COX-2 не обнаруживали ингибирования COX-1 в клинических дозах. Интенсивные клинические исследования и клиническая практика по использованию этих ингибиторов COX-2 выявили, что эти новые ингибиторы COX-2 обладают значительными преимуществами с точки зрения их безопасности по сравнению с неселективными НСПВС. Обзорное описание ингибиторов СОХ-2 можно найти, например, у Golden et al., 1999, Osteoarthritis. 25, p.359-379, Mitchel et al., 1999, Brit. J. Pharmacol., 128, p.1121-1132, Lipsky, 1999, Am. J. Med., 106 (5B), p.515-575, Taketo, 1998, J. National Cancer Inst., 90, p.1529-1537, Griswold et al., 1996, Med. Res. Rev., 16, p.181-206 и Reitz et al., 1995, Ann. Rep. Med. Chem., 30, p.179-188.
Другими представляющими интерес публикациями, относящимися к различным ингибиторам СОХ-2, являются, например: Lane, 1997, J. Rheumatol., 24 (suppl. 49), p.20-24, Mehlish et al., 1998, Clin. Pharmacol. Ther., 63, p.1-8, Zhao et al., 1997, Arthritis Rheum., 40 (suppl.), S88, Ehrich et al., 1997, Arthritis Rheum., 40 (suppl.), S93, Maziasz et al., 1997, Arthritis Rheum., 40 (suppl.), S195, Mengle-Gaw et al., 1997, Arthritis Rheum., 40 (suppl.), S93, Morrison, 1999, Clin. Ther., 21, p.943-953, Chan et al., 1995, J. Pharmacol. Exp. Ther., 274, p.1531-37, Riendeau et al., 1997, Br. J. Pharmacol., 121, p.105-117, Black et al., 1999, J. Med. Chem., 42, p.1274-81, Cuo et al., 1996, J. Biol. Chem., 271, p.19134-39, Geiss, 1999, Scand. J. Rheumatol., 109 (suppl.), p.31-37, Warner et al., 1999, PNAS USA, 96, p.7563-68, Bjarnson et al., 1977, Scand. J. Gastroenterol., 32, p.126-130, Danneberg et al., 1999, Semin. Oncol., 26, p.499-504, Mitchell et al., 1993, PNAS USA, 90, p.11693-97, Futaki et al., 1994, Prostaglandins, 47, p.55-9, Futaki et al., 1993, J. Pharm. Pharmacol., 46, p.753-5, Masferrer et al., 1994, PNAS USA, 91, p.3228-32, Klein et al., 1994, Biochem. Pharmacol., 48, p.1605-10, Reitz et al., 1994, J. Med. Chem., 37, p.3878-81, Seibert et al., 1994, PNAS USA, 91, p.12013-17, Klein et al., 1996, Biochem. Pharmacol., 51, p.285-90, Nantal et al., 1998, 9th Intern. Conference Inflamm. Res. Assoc., Nov 1-5, Pennig et al., 1997, J. Med. Chem. 40, p.1347-65 and Puig et al., 2000, J. Med. Chem., 43, p.214-223.
Ингибиторы СОХ-2 представляют собой относительно широкую группу соединений с различными структурами. Соединения, которые селективно ингибируют СОХ-2, за последнее десятилетие описаны во многих патентных документах. Некоторыми из них являются WO 94/26781, WO 94/20480, WO 94/13635, WO 95/00501, WO 94/27980, WO 94/15932, WO 95/21817, WO 95/15316, WO 96/06840, WO 96/03388, WO 96/03387, WO 96/03392, WO 96/25405, WO 96/24584, WO 96/03385, WO 96/16934, WO 98/41516, WO 98/43966, WO 99/12930, ЕРО 673366, WO 98/41511, WO 98/47871, WO 99/20110, WO 99/23087, WO 99/14194, WO 99/14195, WO 99/15513 и WO 99/15503, и патенты США №№ 5380738, 5344991, 5393790, 5434178, 5474995, 5475018 и 5510368.
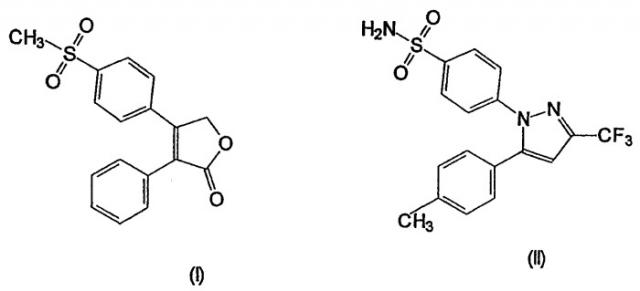
В настоящее время были получены два соединения, рофекоксиб (4-(4-метилсульфонил)фенил-3-фенил-2(5Н)-фуранон) (I), выпускаемый под товарным знаком Vioxx® и селекоксиб 4-(5-(4-метилфенил)-3-(трифторметил)-1Н-пиразол-1-ил)бензолсульфонамид (II), выпускаемый под товарным знаком Celebra®:
Рофекоксиб описан в WO 93/0500501, Merck Frosst Canada и кроме того, в работах Morrison, 1999, Clin. Ther., 21, p.943-953, Chan et al., 1995, J. Pharmacol. Exp. Ther., 274, p.1531-37 и Nantel et al., 1998, см.выше.
Целекоксиб описан в работах Geiss, 1999, Scand. J. Rheumatol., 109 (suppl.), p.31-37 и Penning et al., 1997, J. Med. Chem. 40, p.1347-65. Как указывалось, целекоксиб является в 375 раз более селективным по отношению к СОХ-2, чем по отношению к СОХ-1.
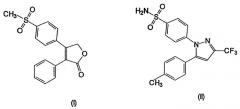
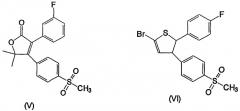
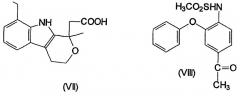
Несколько других ингибиторов СОХ-2 было оценено в биологических системах, и некоторыми из них являются BF 389 (III), CGP 28232 (IV), DFP, DFU (V), DuP 697 (VI), этодолак (VII), FK 3311 (VIII), флозулид (IX), L-745337 (X), мелоксикам (Mobic®, US 4233299, 4-гидрокси-2-метил-N-(5-метил-2-тиазолил)-1,1-диоксид-2Н-1,2-бензотиазин-3-карбоксамид) (XI), трициклический MF (XII), нимезулид (XIII), NS-398 (XIV) и SC-58125 (XV):
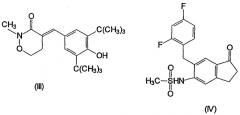
Другими описанными соединениями, ингибирующими СОХ-2, являются S-2474 (от Shionogi, EP 595546, 5(E)-(3,5-ди-трет-бутил-4-гидрокси)бензилиден-2-этил-1,2-изотиазолидин-1,1-диоксид) (XVI), JTE-522 или RWK-57504 (4-(4-циклогексил-2-метил-5-оксазолил)-2-фторбензолсульфонамид)(XVII), мезилат дарбуфелона (Pfizer, WO 94/03448, монометансульфонатная соль 2-амино-5-((3,5-бис(1,1-диметилэтил)-4-гидроксифенил)метилен-4(5Н)-тиазолон) (XVIII), 6089 (от Kotobuki Pharmaceutical)(XIX), валдекоксиб (Pharmacia, 4-(5-метил-3-фенил-4-изоксазол)бензолсульфонамид)(XX), паракоксиб-натрий (Pharmacia, натриевая соль N-((4-(5-метил-3-фенил-4-изоксазолил)фенил)сульфонил)пропанамид) (XXI), 4-(2-оксо-3-фенил-2,3-дигидрооксазол-4-ил)бензолсульфонамид (Almirall-Prodespharma)(XXII) и эторикоксиб (MK-633, Merck & Co.):
Вышеописанные соединения образуют предпочтительные ингибиторы СОХ-2, используемые в способах, описанных ниже.
Показаниями для применения ингибиторов СОХ-2 являются артрит, костно-мышечные боли и общие болезненные состояния, которые обычно устраняются классическими НСПВС, такими как индометацин, дихлорфенак и напроксен. Недавно было предложено использовать ингибиторы СОХ-2 в противораковой терапии, а также для предупреждения рака. Ингибиторы СОХ-2 могут быть также использованы при болезни Альцгеймера и других ассоциированных с деменцией процессах, протекающих в головном мозге.
Возможность клинического применения ингибиторов СОХ-2 обсуждается, например, в работах Nature, 367, p.215-216 (1994), in Drug News and Perspectives, 7, p.501-512 (1994), Annual Reports in Medicinal Chem., 30, p.179-188 (1995) и Oncogene, 18, p.7908-7916 (1999).
В этих работах не было высказано каких-либо конкретных предположений относительно возможности использования ингибиторов СОХ-2 в противовирусной терапии или, более конкретно, в терапии ВИЧ/СПИДа, и ингибиторы СОХ-2 не были тестированы на действие против ВИЧ. Кроме того, не было высказано каких-либо предположений относительно возможности использования ингибиторов СОХ-2 (или неселективных ингибиторов СОХ) в качестве иммуностимулирующих агентов для лечения иммунодефицита вирусного и невирусного происхождения.
ВИЧ-инфекция и СПИД являются главной угрозой для здоровья более чем 33 миллионов человек, инфицированных этим вирусом, во всем мире. Большинство инфицированных людей проживает в Африке (в регионе ниже Сахары) и в отдельных частях Азии. В настоящее время существует два класса соединений против СПИДа, которые используются в клинической практике; а именно, ингибиторы обратной транскриптазы ВИЧ и ингибиторы протеазы ВИЧ. Ингибиторы обратной транскриптазы ВИЧ могут быть подразделены на ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) и нуклеозидные ингибиторы обратной транскриптазы (NRTI).
Наиболее часто используемыми NNRTI являются невирапин, делавиридин, эфавиренц, эмивирин и Т180. Наиболее часто используемыми NRTI являются зидовудин, диданозин, ставудин и зальцитабин. Ингибиторами протеазы ВИЧ, имеющими клиническое применение, являются инклинавир, палинавир и саквиравир.
Существующие методы лечения ВИЧ-инфекций и СПИДа основаны на использовании комбинации нескольких лекарственных средств, так называемой смеси ингибиторов обратной транскриптазы и ингибиторов протеазы. Эти комбинации, называемые HAART (высокоактивная антиретровирусная терапия), являются достаточно эффективными и могут снижать количество вируса в крови пациента до недетектируемых уровней. Однако HAART не приводит к полному излечению пациента, поскольку этот вирус еще присутствует в иммунных клетках и через некоторое время заболевание может возникнуть снова, а после прерывания лечения часто наблюдаются пики виремии и быстрое прогрессирование СПИДа. Кроме того, иммунодефицит и ВИЧ-специфическое нарушение Т-клеточной функции все еще наблюдаются в процессе HAART-терапии. Указанная терапия требует длительного применения и является весьма дорогостоящей. Стоимость лишь одного лекарственного средства часто превышает 15000 долларов США. Кроме того, существуют и некоторые другие проблемы, связанные с этой терапией, и именно, трудности, связанные с соблюдением пациентом режима лечения (сложные схемы введения лекарственного средства), продуцирование резистентных вирусов, неидеальная фармакокинетика и побочные эффекты, такие как, например, подавление функции головного мозга и длительных метаболических эффектов.
Описание терапии против ВИЧ можно найти в недавно опубликованных обзорах, см., например, Hilgegroth, 1998, Pharm. uns. Zeit., 1998, 27, p.22-25, Hilgegroth, 1998, Pharm. uns Zeit., 7, p.111-116, Stellbrink, 1997, Dk Ärztebl., 94, p.2497-2503, Rettle et al., 1998, Int. J. STD AIDS, 9, p.80-87, De-Clercq, 1998, Antiviral Res., 38, p.153-179, Gait et al., 1995, TIBTECH, 13, p.430-438 & Redshaw et al., in "Emerging Drugs: The Prospects of Improved Medicines", Chapter 6, p.127-154, 1997.
В заключение можно сделать вывод, что, хотя комбинации множества лекарственных средств, таких как HAART, значительно улучшают прогноз для пациентов, страдающих ВИЧ-инфекцией, однако, получение новых соединений для противовирусной терапии ВИЧ, а в частности, агентов, стимулирующих иммунную систему, является крайне необходимым для современной медицины. Настоящее изобретение направлено на получение таких соединений.
Экспрессия СОХ-2 обычно ограничивается головным мозгом/отростками головного мозга, синовиальной жидкостью при артритах и участками поражения тканей. СОХ-2 не был обнаружен в нормальных лимфатических узлах или в лимфоцитах. Однако было неожиданно обнаружено, что у мышей, инфицированных вирусом, вызывающим иммунодефицитное состояние MAID, в клетках лимфатических узлов экспрессируются высокие уровни СОХ-2. Кроме того, положительные CD4+ и CD8+-Т-клетки, а также В-клетки из лимфатических узлов мыши с MAID содержали высокие уровни СОХ-2 (см. пример 2). Было установлено, что указанный фермент СОХ-2 может служить мишенью для направленной доставки иммуностимулирующего средства в целях ослабления симптомов иммунодефицита, например ослабления нарушения Т-клеточной функции, например, посредством генерирования антиген-специфического иммунного ответа.
Не претендуя на какую-либо конкретную теорию, можно предположить, что активность СОХ-2 способствует увеличению продуцирования PGE2, который, в свою очередь повышает уровни сАМР, активирующего путь передачи сигнала РКА, что приводит к нарушению функции лимфоцитов. Исследования, проведенные на мышах с MAID in vivo, продемонстрировали, что ингибиторы СОХ-2 улучшают иммунные функции Т-клеток (см. пример 6).
Настоящее изобретение относится к новому способу лечения или предупреждения иммунодефицита, а в частности к способу лечения ВИЧ-инфекций и СПИДа, предусматривающему введение субъекту терапевтически эффективного количества ингибитора СОХ-2, или его производного, или его фармацевтически приемлемой соли.
Таким образом, в первом своем аспекте, настоящее изобретение относится к способу лечения или предупреждения расстройства, характеризующегося повышенной СОХ-2-активностью, такого как расстройство, характеризующееся пониженной иммунной функцией (например, повышенной экспрессией СОХ-2) у человека или другого животного, где указанному животному вводят терапевтически эффективное количество ингибитора СОХ-2 или его производного или его фармацевтически приемлемой соли.
Используемый здесь термин повышенная СОХ-2-активность означает повышенные уровни активности, обусловленные продуцированием повышенного числа молекул СОХ-2 (например, повышенной экспрессией) и/или продуцированием более активных молекул (например, образующихся путем превращения латентных форм в активные формы или путем предотвращения ингибирования активных форм). Предпочтительно указанное расстройство характеризуется ослаблением иммунной функции, то есть иммунодефицитным состоянием, выражающимся, например, нарушением функции лимфоцитов. Используемый термин "иммунодефицит" означает нарушение функции клеток, участвующих в нормальных иммунных ответах, а в частности В- и Т-клеток. Таким образом, описанные здесь соединения могут быть использованы для достижения иммуностимулирующего эффекта в целях увеличения иммунных ответов. Таким образом, предполагается, что ингибиторы СОХ-2 обладают иммуномодулирующим действием. Предпочтительными состояниями, которые могут быть подвергнуты лечению, являются вирус-индуцированные иммунодефицитные расстройства.
Таким образом, применением вышеуказанного способа может быть, но не ограничивается им, лечение ВИЧ- или СПИД-ассоциированных расстройств у субъектов. Так например, приблизительно у 50% пациентов с вариабельным неклассифицируемым иммунодефицитом наблюдается нарушение Т-клеточной функции, аналогичное нарушению Т-клеточной функции при ВИЧ-инфекции, и у таких пациентов благоприятный эффект может давать иммуностимулирующее лечение. В соответствии с настоящим изобретением любой ингибитор СОХ-2 может быть введен субъекту, нуждающемуся в лечении ВИЧ-инфенции/СПИДа. Таким образом, предпочтительными состояниями для лечения способами настоящего изобретения являются инфекции, вызываемые ретровирусами, а в частности ВИЧ (и инфекции, вызываемые родственными вирусами у других животных, например SIV, FIV, MAIDS), и развивающийся в результате этих инфекций СПИД, а также вариабельный неклассифицируемый иммунодефицит и состояния, родственные вышеупомянутым состояниям.
Субъектами, которые могут быть подвергнуты лечению, являются предпочтительно человек и домашние питомцы, или сельскохозяйственные животные, такие как собаки, кошки, обезьяны, лошади, овцы, козы, коровы, кролики, крысы и мыши.
Альтернативно, настоящее изобретение относится к ингибитору СОХ-2, или его производному, или фармацевтически приемлемой соли, предназначенному для лечения или предупреждения расстройства, характеризующегося повышенной СОХ-2-активностью, описанной выше, или к использованию указанного ингибитора СОХ-2, его производного или его фармацевтически приемлемой соли для получения лекарственного средства для лечения или предупреждения расстройства, характеризующегося повышенной СОХ-2-активностью, описанной выше. Используемый здесь термин "лечение" означает снижение или ослабление одного или нескольких симптомов указанного расстройства предпочтительно до нормальных уровней, например инфекционности вируса, или снижение или ослабление нарушения иммунной функции. Термин "предупреждение" означает полное предупреждение, то есть отсутствие детектируемого инфекционного агента, например вируса, и/или поддержание его нормальных уровней, по сравнению с уровнями, соответствующими конкретному симптому (например, СОХ-2-активности), или снижение, или ослабление степени или продолжительности (то есть замедление) начала появления данного симптома.
Фермент циклооксигеназа-2 представляет собой новую мишень для терапии ВИЧ-инфекций/СПИДа. Термин "ингибитор СОХ-2" означает соединение, способное ингибировать фермент циклооксигеназу 2, но не оказывающее при этом значительного ингибирующего действия на циклооксигеназу-1, при его введении в конкретной концентрации. Таким ингибитором предпочтительно являются соединения, обладающие селективностью в пользу ингибирования циклооксигеназы-2 по сравнению с циклооксигеназой-1 (например, как было определено по отношению СОХ-1:СОХ-2 при IC80 в тесте WHMA, см. ниже), где указанное отношение составляет, по крайней мере, 10, более предпочтительно, по крайней мере, 50, и даже более предпочтительно, по крайней мере, 100. (Отношение селективности для одного конкретного соединения может варьироваться в зависимости от биологического анализа и формы, в которой оно выражено (предпочтительно это отношение выражается как СОХ-1:СОХ-2 при IC50 или IC80, см. таблицы 1-4). Указанные здесь отношения означают данные, полученные в одном или нескольких подходящих хорошо известных анализах на СОХ, проводимых предпочтительно с использованием очищенных человеческих ферментов, например, отношение величин IC50, определенных, например, Engelhart et al., 1995, см. выше. Однако, предпочтительно, указанным анализом является тест WHMA.
Ряд анализов на относительную активность СОХ-1 и СОХ-2 было осуществлено с использованием аналитических систем широкого ряда, от выделенных очищенных ферментов до интактных клеток и клеточных моделей, полученных от различных видов. Однако в настоящее время наиболее широко используемой моделью является анализ цельной крови человека (WBA) и модифицированная версия Уильяма Харви модифицированного анализа цельной крови человека (WHMA), который является предпочтительным анализом. Эти анализы позволяют использовать для тестирования легко доступные человеческие клетки, которые являются предпочтительным при введении данных соединений человеку. Следует также учитывать связывание НСПВС с белками плазмы. Кроме того, оценку селективности предпочтительно проводят при IC80, а не при IC50, вследствие того что кривые концентрации для ингибирования СОХ-2 и СОХ-1 не являются параллельными, а также вследствие того что большинство соединений используются в дозах, дающих постоянные концентрации в плазме, близкие к 80%-ному ингибированию (Warner et al., 1999, PNAS USA, 96, p.7563-7568).
В анализе WBA на СОХ-1, кровь обрабатывают тестируемым агентом, а затем, через 60 минут, кальциевым ионофором и инкубируют в течение 30 минут, после чего плазму собирают. Для анализа на СОХ-2 кровь обрабатывают аспирином для ингибирования СОХ-1, а через 6 часов обрабатывают липополисахаридом и тестируемым агентом и инкубируют в течение 18 часов, после чего плазму собирают. Затем с помощью радиоиммуноанализа оценивают содержание тромбоксана В2 в плазме, как показателя активности СОХ.
В тесте WHMA, анализ на СОХ-1 проводят, как описано выше. Для анализа на СОХ-2, кровь обрабатывают кондиционированной средой, взятой от культур эпителиальных клеток дыхательных путей человека (А549), обработанных интерлейкином 1β в течение 24 часов, и инкубируют с этой средой вместе с тестируемым агентом в течение 60 минут, после чего добавляют кальциевый ионофор, а через 30 минут добавляют диклофенак для прекращения продуцирования прозаноидов. Затем плазму собирают и анализируют с помощью радиоиммуноанализа на содержание в ней простагландина Е2, как показателя активности СОХ-2. В этом последнем анализе периоды инкубирования, проводимого для оценки активности СОХ-1 и СОХ-2, являются аналогичными, что делает эти активности более сравнимыми, а поэтому анализ WHMA является предпочтительным.
Селективность, определенная исходя из СОХ-2/WHMA-СОХ-1 при IC80, с использованием указанного анализа, показана в таблице 4, где величины 0,2 и 0,02 представляют 5- и 50-кратное увеличение селективности для СОХ-2, соответственно.
| Таблица 4(Отношение СОХ-2/СОХ-1 при IC80, определенное в соответствии с тестом WHMA и взятое у Warner et al., см. выше): | |
| Соединение | Отношение СОХ-2/WHMA-СОХ-1 при IC80 |
| Диизопропилфторфосфат | <0,01 |
| L-745337 | <0,01 |
| Рофекоксиб | 0,015 |
| NS398 | <0,05 |
| SС58125 | <0,01 (анализ WBA) |
| Этодолак | 0,043 |
| Мелоксикам | 0,091 |
| Целекоксиб | 0,11 |
| Нимезулид | 0,17 |
Поэтому в предпочтительном варианте осуществления изобретения отношение селективностей определяют в анализе WHMA при IC80, и соединения, имеющие отношение селективности СОХ-2:СОХ-1, составляющие менее чем 0,2, предпочтительно менее чем 0,05, например, менее чем 0,02, предпочтительно менее чем 0,01, например, <0,005, являются особенно предпочтительными для использования в способах настоящего изобретения. Альтернативно, предпочтительные соединения имеют отношение селективности СОХ-1:СОХ-2 (в соответствии с анализом WHMA при IC80), составляющее более чем 2, предпочтительно более чем 5, особенно предпочтительно более чем 50 или 100, как указывалось ранее.
Используемый здесь термин "ингибирование" означает снижение измеряемой активности циклооксигеназы-2. Это может быть достигнуто путем воздействия на транскрипцию, трансляцию, пост-трансляционную модификацию или активность СОХ-2. Однако предпочтительно такое ингибирование может быть достигнуто путем ингибирования ферментативной активности, то есть путем блокирования активного центра уже присутствующих активных молекул СОХ-2.
Предпочтительно ингибиторы СОХ-2, используемые для лечения иммунодефицита или вирусной инфекции, а в частности ВИЧ-инфекций и СПИДа, имеют IC50 для СОХ-2 примерно менее чем 0,5 мкмоль/литр, а более предпочтительно примерно менее чем 0,2 мкмоль/литр.
Описанный способ относится к использованию ингибиторов СОХ-2 или их производных для предупреждения и лечения различных состояний, включая иммунодефицит и вирусные инфекции, а в частности ВИЧ-инфекции и СПИД.
В одном из предпочтительных вариантов осуществления настоящего изобретения ингибитор СОХ-2, предназначенный для лечения в соответствии с настоящим изобретением, выбран из сульфонамидов кислоты.
В одном из предпочтительных вариантов осуществления настоящего изобретения ингибиторы СОХ-2, используемые в настоящем изобретении, выбраны из соединений нижеследующей общей формулы А, включая простые эфиры и тиоэфиры метансульфонамида
где Х представляет атом кислорода или серы или алкильную группу, а предпочтительно группу -СН2-;
R1 представляет циклоалкильную или арильную группу, которые могут быть, но необязательно, замещены одной или более группами или атомами, предпочтительно, одним или более атомами галогена, такого как фтор;
R2, R3, R4 и R5 независимо представляют атом водорода, нитро- или ацильную группу или алкильную группу, которая может быть, но необязательно, замещена одной или более группами (например, ацильной группой) или одним или более атомами, либо, альтернативно, R2 и R3, R3 и R4 или R4 и R5, взятые вместе с атомом углерода, с которым они связаны, образуют циклопентаноновую группу;
или их производного, или фармацевтически приемлемой соли.
В указанных соединениях Х предпочтительно представляет атом кислорода. В других предпочтительных соединениях R1 представляет арильную группу или арильную группу, замещенную одним или более атомами фтора, или циклоалкильную группу.
В других предпочтительных соединениях R2 и R3 представляют атомы водорода, а R4 представляет группу -NO2 или -СОСН3. Альтернативными предпочтительными соединениями являются соединения, в которых R2 представляет атом водорода, а R3 и R4, взятые вместе, образуют циклопентаноновую группу.
Особенно предпочтительными соединениями формулы А, используемыми в настоящем изобретении, являются описанные здесь соединения, такие как флозулид, NS-398, нимезулид, FK 3311 и L-745337.
В другом предпочтительном варианте осуществления настоящего изобретения ингибитор СОХ-2, используемый в настоящем изобретении, выбран из диарилгетероциклов.
Одним из примеров соединений семейства диарилгетероциклов, которые могут быть использованы в настоящем изобретении как ингибиторы СОХ-2, являются соединения нижеследующей общей формулы В
где Y представляет циклическую группу, предпочтительно выбранную из оксазолила, изоксазолила, тиенила, дигидрофурила, фурила, пирролила, пиразолила, тиазолила, имидазолила, изотиазолила, циклопентенила, фенила и пиридила;
n равно целому числу от 0 до 3;
m равно целому числу от 0 до 4;
R6 представляет кетоциклильную, циклоалкильную или арильную группу, которые могут быть, но необязательно, замещены одной или более группами или атомами, предпочтительно одним или более атомами галогена, такого как фтор;
R7 независимо представляет заместитель, которым может быть любая функциональная группа, предпочтительно атом водорода или атом галогена, предпочтительно фтора или брома, или алкильная группа (предпочтительно -СН3), которая может быть, но необязательно, замещена одной или более группами или атомами, предпочтительно одним или более атомами фтора, например -CF3;
R8 представляет алкильную группу, предпочтительно, -СН3 или NHR10, предпочтительно, -NH2;
R9 представляет атом галогена, предпочтительно фтор; и
R10 представляет атом водорода или алкильную группу, необязательно замещенную одной или более группами или атомами, предпочтительно ацильной группой;
или их производное, или фармацевтически приемлемая соль.
Соединения этого класса описаны в US 6025353 как антиангиогенные агенты и в US 6025353 также имеются дополнительное описание предпочтительных заместителей и соединений настоящего изобретения.
В указанных соединениях R8 предпочтительно представляет NH2- или -СН3. В других предпочтительных соединениях Y представляет пиразолильную, фурильную или тиенильную группу. R6 предпочтительно представляет арильную группу, необязательно замещенную одним или более атомами фтора. Предпочтительно n равно 1 или 2. R7 предпочтительно представляет атом брома, ацильную группу или замещенную алкильную группу, такую как CF3.
Особенно предпочтительными соединениями формулы В, используемыми в настоящем изобретении, являются описанные здесь соединения, такие как целекоксиб, рофекоксиб, DuP-697, SC-58125, DFP, DFU, CGP 28232 и трициклический MF.
Используемый здесь термин "алкил" означает любую длинноцепочечную или короткоцепочечную прямую, разветвленную или циклическую, алифатическую насыщенную или ненасыщенную углеводородную группу, необязательно моно- или полизамещенную гидроксигруппой, алкоксигруппой, ацилоксигруппой, нитрогруппой, алкоксикарбонилоксигруппой, аминогруппой, арильной группой, оксогруппой или галогеном, если это не оговорено особо. Ненасыщенные алкильные группы могут быть моно- или полиненасыщенными, и такими группами являются как алкенильные группы, так и алкинильные группы. Такие группы могут содержать вплоть до 40, предпочтительно от 1 до 10 атомов углерода.
Используемый здесь термин "циклические кольца" предпочтительно означает С5-7-кольцо, которое необязательно содержит один или несколько гетероатомов, выбранных из кислорода, азота и серы.
Используемый здесь термин "ацил" означает как карбоксилатную, так и карбонатную группы, так, например, ацилокси-замещенными алкильными группами является, например, алкилкарбонилоксиалкил. В таких группах, любая алкиленовая часть предпочтительно имеет число атомов углерода, определенное для вышеуказанных алкильных групп. Предпочтительными арильными группами являются фенильные и моноциклические 5-7-членные гетероароматические группы, а в частности, фенил и указанные группы сами могут быть, но необязательно, замещенными.
Характерными замещенными алкильными группами R1 являются алкоксиалкильная, гидроксиалкоксиалкильная, полигидроксиалкильная, гидроксиполиалкиленоксиалкильная группы и т.п., такие как алкоксиметильная, алкоксиэтильная и алкоксипропильная группы или ацилоксиметильная, ацилоксиэтильная и ацилоксипропильная группы, например, пивалоилоксиметил.
Используемые здесь замещенные группы могут быть моно- или полизамещенными гидроксигруппой, алкоксигруппой, ацилоксигруппой, нитрогруппой, алкоксикарбонилоксигруппой, аминогруппой, арильной группой, оксогруппой или галогеном, если не указано особо.
В другом предпочтительном варианте осуществления настоящего изобретения ингибитор СОХ-2 выбран из модифицированных классических НСПВС, например из их пролекарств, сложных эфиров или солей.
Новые селективные ингибиторы СОХ-2 были получены на основе химических структур классических НСПВС. Таким соединением может быть мелоксикам, которым является оксекам (СОХ-2-специфический аналог хорошо известного пироксикама) или производные уксусной кислоты, такие как этодолак (СОХ-2-специфический аналог диклофенака). Другими примерами некоторых наиболее предпочтительных соединений этого класса являются активные по отношению к СОХ-2 производные индометацина и зомепирак.
Дополнительный список семейств и подсемейств соединений настоящего изобретения приводится в патентах и в патентных заявках, относящихся к ингибиторам СОХ-2, например в патентных документах, на которые имеются ссылки в настоящем описании. В этих патентных документах также проиллюстрированы и перечислены конкретные соединения, которые также являются наиболее предпочтительными ингибиторами СОХ-2 настоящего изобретения.
Однако особенно предпочтительными соединениями являются диизопропилфторфосфат, L-745337, рофекоксиб, NS398, SС58125, этодолак, мелоксикам, целекоксиб, нимезулид.
Способы получения ингибиторов СОХ-2, используемых в настоящем изобретении, хорошо известны специалистам, и в частности, описаны в работах, упомянутых выше.
Ингибитор СОХ-2, предназначенный для лечения и предупреждения описанных здесь заболеваний, например, иммунодефицита и вирусных инфекций, а в частности, ВИЧ-инфекций/СПИДа в соответствии с настоящим изобретением, может иметь один или несколько асимметрических центров и/или одну или несколько двойных связей, то есть настоящее изобретение относится к использованию изомеров и рацематов описанных здесь соединений. Все такие возможные изомеры входят в объем настоящего изобретения. Ингибитор СОХ-2 может иметь форму изомерной смеси соединений или, более предпочтительно, форму очищенного изомера или его фармацевтически приемлемой соли.
Фармацевтическая композиция ингибитора(ов) СОХ-2 для лечения состояний в соответствии с настоящим изобретением, например иммунодефицита и вирусных инфекций, может быть получена в виде фармацевтически приемлемых солей и может также содержать фармацевтически приемлемые носители, хорошо известные специалистам.
Таким образом, настоящее изобретение также относится к фармацевтическим композициям, содержащим ингибитор СОХ-2 или его производное или фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель, носитель или наполнитель. Термин "фармацевтически приемлемый" означает, что данный ингредиент должен быть совместимым с другими ингредиентами в указанной композиции, а также он должен быть физиологически приемлемым для реципиента.
В других вариантах своего осуществления, настоящее изобретение также относится к использованию таких композиций и к способам предупреждения/лечения с использованием указанных композиций, как описано выше.
Если ингибитор СОХ-2 является основным, то соли могут быть получены из фармацевтически приемлемых нетоксичных кислот, включая неорганические и органические кислоты. Особенно предпочтительными солями являются соли соляной, бромистоводородной, фосфорной, серной, лимонной, малеиновой и винной кислот.
Если ингибитор СОХ-2 является кислотным, то соли могут быть получены из фармацевтически приемлемых нетоксичных оснований, включая неорганические и органические основания. Особенно предпочтительными солями являются соли натрия, калия и меглумина.
Для лечения или предупреждения описанных здесь заболеваний, например, иммунодефицита или вирусных заболеваний, включая ВИЧ-инфекции/СПИД, ингибиторы СОХ-2 могут быть введены перорально, ректально, местно, буккально, путем ингаляции или парентерально (например, внутримышечно, подкожно, внутрибрюшинно или внутривенно) в форме инъекции или вливания. Предпочтительными способами введения являются пероральное введение, ректальное введение или введени