Лечение инфекции, вызываемой микроорганизмами
Иллюстрации
Показать всеИзобретение относится к медицине и касается антитела, лекарства на его основе для лечения или диагностики инфекции, вызываемой микроорганизмом, экспрессирующим гомолог белка GrfA. Изобретение также раскрывает способ получения указанного лекарства, а также фармацевтическую упаковку для лечения указанного заболевания. Описанное антитело имеет установленную аминокислотную последовательность, представленную как последовательность SEQ ID NO:2, приведенную в описании, и антитело или его антигенсвязывающий фрагмент специфически связывается с эпитопом, предоставляемым пептидом с аминокислотной последовательностью, приведенной в SEQ ID NO:3, раскрытой в описании. Использование изобретения позволяет повысить терапевтическую эффективность гликопептидного антибиотика по сравнению с использованием одного антибиотика. 4 н. и 18 з.п. ф-лы, 1 ил., 10 табл.
Реферат
Настоящее изобретение касается лечения инфекций организма человека или животных, вызываемых микроорганизмами, такими как S. aureus, особенно устойчивыми к антибиотикам штаммами микроорганизмов, такими как MRSA. Предлагаются лекарства для лечения инфекции, вызываемой микроорганизмами, такими как S. aureus, способы получения лекарств для лечения инфекции, фармацевтические упаковки, содержащие лекарства для лечения инфекции, и способы лечения инфекции организма человека или животных, вызываемых указанными микроорганизмами.
Множественная устойчивость к лекарствам (MDR) представляет собой растущую проблему в отношении грамположительных бактерий (Banergee, S.N. et al. 1991, Am. J. Med. 91: 865-895; Shaberg, D.R. et al., 1991, Am. J. Med. suppl., 88: 72-75; Gaynes, R.P. et al., 1994, Infect. Dis. Clin. Pract., 6: 452-455), особенно в больницах. В частности, метициллин-устойчивые Staphylococcus aureus (MRSA) и негативные в отношении коагулазы стафилококки (CNS), особенно метициллин-устойчивые CNS, создают проблемы, будучи устойчивыми ко всем пенициллинам и цефалоспоринам. Широко распространена устойчивость к другим агентам, таким как хинолоны (Malabarta, A. et al., 1997, Eur. J. Med. Chem., 32: 459-478; Lewis, K., 1994, TIBS, 19: 119-123; Traub, W.H. et al., 1996, Chemotherapy, 42: 118-132). Лечение обычно осуществляется с использованием ванкомицина или тейкопланина. Однако распространяется устойчивость к данным агентам, и, следовательно, необходимы новые способы терапии. Например, Hubert SK et al. (J. Clin Microbiol. 1999 Nov;37(11):3590-3; PMID: 10523558) описывает изоляты S. aureus со сниженной чувствительностью к ванкомицину и тейкопланину. Было обнаружено, что определенные эпидемические штаммы MRSA, включая EMRSA-15 (www.phls.org.uk, Public Health Laboratories, Colindale, UK), могут давать рост субклонов с увеличенной устойчивостью к ванкомицину (Burnie J et al., Clin Infect Dis. 2000 Sep;31(3):684-9; PMID: 11017816). Надеялись, что линезолид должен обеспечить весьма необходимую альтернативу имеющейся в настоящее время терапии, но Tsiodras S. et al. (Lancet. 2001 Jul 21;358(9277):207-8; PMID: 11476839) сообщили о клиническом изоляте MRSA, устойчивом к линезолиду у больного, которого лечили данным антибиотиком при перитоните, связанном с диализом.
Кроме того, введение больших количеств таких антибиотиков больным для эффективного лечения инфекций, особенно инфекций, которые проявляют устойчивость к вводимым антибиотику(кам), может быть токсичным и нефротоксичным и, хотя и помогает спасти жизнь больного, может приводить к тяжелым побочным эффектам.
Лечение и диагностика стафилококковых инфекций широко обсуждались в предшествующем уровне техники, и связанные публикации включают патенты WO 98/01154, WO 99/50418 и EP 0786519. Причины устойчивости к антибиотикам обсуждаются также в таких публикациях, как Allignet J. (Gene 1997 Nov 20; 202(1-2):133-8; PMID: 9427556).
Таким образом, существует очевидная потребность в новой и усиленной терапии инфекции, вызываемой микроорганизмами, особенно S. aureus.
Авторы настоящего изобретения в настоящее время обнаружили, что конкретное сочетание агентов, а именно антител (подробнее ниже), имеющих новую антигенсвязывающую часть, и гликопептидного антибиотика (такого как ванкомицин или тейкопланин), обладает очень неожиданным синергическим терапевтическим эффектом - терапевтическая эффективность гликопептидного антибиотика существенно увеличивается по сравнению с его терапевтической эффективностью при использовании в одиночку. Это, в частности, возникает в случае, когда микроорганизм, подвергаемый воздействию, устойчив к гликопептидному антибиотику. Важно, что настоящее изобретение способно воздействовать на штаммы S. aureus, полностью устойчивые к ванкомицину, и на штаммы с промежуточной устойчивостью к ванкомицину, применяя ванкомицин совместно с антителом SEQ ID NO: 2. Нигде на предшествующем уровне техники не предполагалось, что это может быть достигнуто. Гликопептидные антибиотики действуют путем влияния на стенку бактериальной клетки. Другие антибиотики, такие как пенициллины, также действуют на стенку бактериальной клетки. Однако авторы настоящего изобретения обнаружили, что их эффективность не улучшается при применении их с антителом SEQ ID NO: 2. В частности, эксперименты показали, что эффективность флуклоксациллина не улучшается при применении его с антителом SEQ ID NO: 2. Бактерии, устойчивые к флуклоксациллину, не проявляют сниженной устойчивости при применении антитела SEQ ID NO: 2.
В соответствии с настоящим изобретением предлагается антитело SEQ ID NO: 2 или его антигенсвязывающий фрагмент. Антитело кодируется нуклеотидной последовательностью SEQ ID NO: 1, хотя, конечно, нуклеотидная последовательность может быть легко модифицирована для, например, оптимизации кодонов для конкретных микроорганизмов, применяемых для их синтеза или для других причин, как это желательно.
Антитело SEQ ID NO: 2 (обозначаемое также как зарегистрированное торговое название "Aurograb") представляет собой генетическое рекомбинантное антитело человека. Оно связывает иммунодоминантный антиген клеточной поверхности, GrfA, стафилококковый белок-транспортер ABC (патент WO 99/50418; Burnie JP et al., Infect Immun. 2000 Jun;68(6):3200-9; PMID: 10816464). Исходно оно произошло от больных, которые выздоравливали после септицемии S. aureus и продуцировали антитела GrfA. Оно имеет существенную антистафилококковую активность и проявляет синергизм с ванкомицином и другими гликопептидными антибиотиками, как in vitro, так и in vivo, против широкого спектра штаммов S. aureus, включая MRSA и ванкомицин-устойчивые MRSA. Антибактериальная активность антитела SEQ ID NO: 2, как одного, так и в сочетании с гликопептидными антибиотиками, дает существенные преимущества при лечении инфекций S. aureus.
Как иммуноглобулин из плазмы человека (Ramisse F et al., J Infect Dis. 1993 Oct; 168(4):1030-3; PMID: 837815), так и гипериммунная антисыворотка кролика, действующая против GrfA, являются защитными в моделях стафилококковых инфекций (см. раздел «Эксперименты» ниже). Рекомбинантные антитела человека, специфичные для GrfA, являются защитными в мышиных моделях MRSA инфекции. Особенно аминокислотная последовательность GrfA, эпитоп SEQ ID NO: 3, как обнаружено, часто является мишенью для гуморального иммунного ответа больных, выздоравливающих от септицемии S. aureus (Burnie JP et al., 2000, выше).
Однако нигде на предшествующем уровне техники не предполагалось, что усовершенствованное лечение инфекций, вызываемых микроорганизмами, такими как S. aureus, может быть достигнуто при применении сочетания гликопептидного антибиотика, такого как ванкомицин, тейкопланин и даптомицин, и против антитела GrfA, в частности, антитела, специфичного в отношении эпитопа SEQ ID NO: 3, и более конкретно антитела, имеющего последовательность SEQ ID NO: 2.
Таким образом, в соответствии с настоящим изобретением предлагается лекарство, включающее терапевтически эффективное количество гликопептидного антибиотика и антитела, специфичного в отношении GrfA, в частности, антитела, специфичного в отношении эпитопа SEQ ID NO: 3. Предлагаются также способы получения лекарств, фармацевтические упаковки и способы лечения, все включающие или использующие вышеуказанное. Лекарство может применяться для лечения инфекции S. aureus. Применяемый здесь термин «лечение» обозначает любое лечение, которое предназначено для вылечивания, облегчения, исчезновения или уменьшения симптомов, или для предотвращения или снижения возможности заражения такой инфекцией, и включает профилактику.
Белок GrfA, который представляет собой белок-транспортер ABC, выделен из S. aureus и очищен, но существуют гомологи, которые выполняют ту же самую функцию в других организмах, и они могут быть использованы в качестве мишеней для терапии. Таким образом, может быть получено антитело против гомолога GrfA, продуцируемого микроорганизмом, отличным от S. aureus, и оно может быть применено совместно с гликопептидным антибиотиком для эффективного лечения инфекции, вызываемой микроорганизмом, у больного. Примерами других микроорганизмов, на которые может быть направлено лечение, являются другие стафилококки, особенно негативные в отношении коагулазы стафилококки, такие как S. haemolyticus, S. epidermidis и S. saprophyticus. Инфекцию, вызываемую энтерококками, особенно E. faecalis и E. faecium, также можно лечить, так же как и инфекцию, вызываемую Corynebacteria, такими как C. jeikeium и C. xerosis.
Гомолог GrfA может иметь гомологию последовательности с GrfA, по меньшей мере, 60%, например, по меньшей мере, 70, 80, 85, 90, 95, 96, 97, 98, 99 или 99,5%. Гомологии последовательностей определяют с применением программ NCBI BLASTN (сравнения нуклеотидных последовательностей) или BLASTP (сравнения полипептидов), версия 2.1.2, с параметрами по умолчанию. Программы NCBI BLAST могут быть найдены на www.ncbi.nlm.nih.gov/blast/. Применяемый здесь термин «идентичность последовательностей» относится к аминокислотным остаткам в оптимально выравненных последовательностях, которые попарно выровнены в соответствующих относительных положениях.
В организмах, отличных от S. aureus, особенно в других стафилококках, эпитоп (SEQ ID NO: 3), против которого выработаны антитела и который применяют как основу для лечения, может оставаться одним и тем же.
Таким образом, в соответствии с настоящим изобретением предлагается лекарство для лечения инфекции, особенно инфекции, вызываемой S. aureus, причем указанное лекарство включает терапевтически эффективное количество гликопептидного антибиотика и антитело SEQ ID NO: 2 или его антигенсвязывающий фрагмент.
Предлагается также гликопептидный антибиотик и антитело SEQ ID NO: 2 или его антигенсвязывающий фрагмент для применения в способе получения лекарства для лечения инфекции.
При осуществлении терапии инфекции, особенно инфекции, вызываемой S. aureus, гликопептидный антибиотик и антитело или антигенсвязывающий фрагмент можно вводить больному отдельно или последовательно. В соответствии с настоящим изобретением предлагается также фармацевтическая упаковка, включающая терапевтически эффективные количества гликопептидного антибиотика и антитела SEQ ID NO: 2 или его антигенсвязывающего фрагмента.
В соответствии с настоящим изобретением предлагается также применение гликопептидного антибиотика и антитела SEQ ID NO: 2 или его антигенсвязывающего фрагмента для изготовления лекарства для лечения инфекции, особенно инфекции, вызываемой S. aureus.
В соответствии с настоящим изобретением предлагается также способ лечения инфекции, особенно инфекции, вызываемой S. aureus, у больного, включающий стадию введения указанному больному терапевтически эффективного количества гликопептидного антибиотика и антитела SEQ ID NO: 2 или его антигенсвязывающего фрагмента.
Гликопептидными антибиотиками, особенно пригодными для настоящего изобретения, являются ванкомицин, тейкопланин и даптомицин, хотя, конечно, настоящее изобретение распространяется на другие члены семейства гликопептидных антибиотиков.
Применяемый здесь термин «антитело» в различных его грамматических формах относится к молекулам иммуноглобулинов и к иммунологически активным частям молекул иммуноглобулинов, т.е. к молекулам, которые содержат связывающий центр антитела или паратоп. Такие молекулы также обозначаются как «антигенсвязывающие фрагменты» молекул иммуноглобулинов.
Примерами молекул антител являются молекулы интактных иммуноглобулинов, молекулы по существу интактных иммуноглобулинов и те части молекулы иммуноглобулина, которые содержат паратоп, включающий те части, которые известны в данной области техники как Fab, Fab', F(ab')2, scFv и F(v).
Термин «связывающий сайт антитела» относится к структурной части молекулы антитела, включающей вариабельную и гипервариабельную области тяжелой и легкой цепей, которые специфически связывают антиген (иммунологически взаимодействуют с антигеном).
Что касается антитела SEQ ID NO: 2, оно может быть легко модифицировано для изменения своей аминокислотной последовательности, до тех пор пока присутствует тот же самый паратоп и сохраняется его антигенсвязывающая специфичность. Вообще говоря, его структура организована (от амино- к карбокситерминальной последовательности) как вариабельный домен тяжелой цепи иммуноглобулина человека (VH) и вариабельный домен легкой цепи (VK), ковалентно связанные друг с другом с помощью линкера и имеющие карбокситерминальную последовательность His.
Каждая из вариабельных областей включает комплемент-определяющие области CDR1, CDR2 и CDR3, и они являются основополагающими для определения антигенсвязывающей специфичности антитела, т.е. паратопа. Авторы настоящего изобретения обнаружили, что из данных областей часть CDR3 области VH является наиболее важной для определения антигенной специфичности. Дополнительные указания в отношении антител широко доступны в данной области техники, например, Harlow, E. and Lane, D., "Using Antibodies: A Laboratory Manual", Cold Spring Harbor Laboratory Press, New York, 1998. Используя обычные общие знания о частях, определяющих паратопы, и связывающем сайте антитела и представленные выше указания, специалист в данной области техники легко способен модифицировать последовательность SEQ ID NO: 2 для получения альтернативных антител с тем же паратопом, которые дают возможность достигнуть того же или сходного терапевтического эффекта.
Например, антигенсвязывающий фрагмент антитела SEQ ID NO: 2 может быть легко получен с помощью простого удаления одного или более карбокситерминальных остатков His. Другие примеры модификаций включают пересадку гипервариабельных частей (комплемент-определяющих областей) антитела SEQ ID NO: 2 в каркас вариабельных областей, отличных от таковых SEQ ID NO: 2, так, чтобы результирующее антитело также имело тот же самый паратоп (см., например, патент EP 239400 и тому подобное).
Под «усовершенствованным лечением» подразумевается, что данное количество гликопептидного антибиотика обладает более сильным терапевтическим эффектом при введении больному совместно с антителом настоящего изобретения, чем при введении в одиночку. Сходно, желаемый терапевтический эффект может быть достигнут у больного с помощью меньшей дозировки гликопептидного антибиотика, когда он вводится больному совместно с антителом настоящего изобретения по сравнению с введением одного гликопептидного антибиотика. Это особо важно, когда микроорганизм, такой как S. aureus, является устойчивым к гликопептидному антибиотику. Это может быть крайне полезно для снижения любых побочных эффектов лечения.
Обеспечивая существующие гликопептидные антибиотики «вторым дыханием» и давая возможность им быть терапевтически эффективными против инфекции, вызываемой S. aureus, даже когда S. aureus является устойчивым к ним, настоящее изобретение предлагает лекарства и способы лечения, безопасность и эффективность которых могут быть легко оценены и которые не включают новые классы веществ - параметры безопасности для гликопептидных антибиотиков уже хорошо известны и могут быть применены в настоящем изобретении. Применение антител в качестве другого активного ингредиента в настоящем изобретении аналогично является относительно простым в отношении безопасности. В частности, когда антитело находится в форме рекомбинантного фрагмента антитела, происходящего от последовательностей антител человека, его иммуногенность должна быть предельно низкой. Кроме того, применение режимов лечения, в которых антитело вводят в течение очень короткого периода времени (например, нескольких дней), означает, что существует небольшая вероятность для иммунной системы больного развить иммунный ответ против него. Таким образом, побочные реакции типа гиперчувствительности, вызываемые продукцией антитела против антитела настоящего изобретения и образованием/отложением иммунных комплексов, очень малы.
Антитело SEQ ID NO: 2 имеет также ряд конкретных преимуществ - оно не имеет части FC, которая может служить триггером отложения комплемента и связывания макрофагами и, следовательно, маловероятно, чтобы оно вызывало нежелательную активацию каскада комплемента, который может вызвать воспаление и повреждение ткани.
Получая антитела настоящего изобретения без применения продуктов животного происхождения, можно избежать возможности введения больным агентов, вызывающих инфекционные болезни животных и человека, или онкогенов.
Режимы лечения и дозировки лекарств настоящего изобретения описываются ниже, и их модификации должны быть вполне очевидны специалисту в данной области техники, который, в частности, должен быть осведомлен о режимах лечения, применяемых с гликопептидным антибиотиком, и должен быть способен модифицировать их подходящим образом. Например, могут быть легко применены простые тесты доза-ответ, а результаты лечения на моделях млекопитающих, таких как мышиные модели, могут быть легко экстраполированы к человеку.
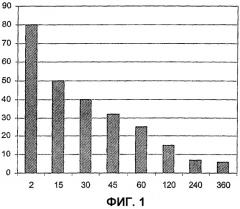
Настоящее изобретение будет далее ясно из последующего описания со ссылкой на прилагаемый чертеж, которое показывает с помощью примера только формы лечения инфекции, вызываемой S. aureus.
Чертеж представляет собой фармакокинетику высоких доз Aurograb. На оси Х отложено время в минутах. На оси Y представлена концентрация Aurograb в мкг/мл в образцах крови.
Эксперименты
Эксперименты, подробно описанные ниже, показывают, что Aurograb (т.е. SEQ ID NO: 1 и SEQ ID NO: 2), приближенный к человеческому фрагмент рекомбинантного антитела настоящего изобретения, специфичный в отношении GrfA, обладает внутренней антистафилококковой активностью in vitro и стафилококковой инфекции мыши, и что он проявляет синергическое действие с гликопептидными антибиотиками, в особенности с гликопептидным антибиотиком широкого спектра действия - ванкомицином.
Синергичная с гликопептидными антибиотиками активность проявляется:
(1) в снижении минимальной ингибирующей концентрации ванкомицина в присутствии Aurograb in vitro и
(2) в снижении количества колоний в органах на моделях инфекции мыши S. aureus, когда после заражения S. aureus вводится однократная доза Aurograb (2 мг/кг) в сочетании с однократной дозой ванкомицина (6 мг/кг).
Если это не указано иначе, все подробно описанные здесь процедуры проводили с применением стандартных протоколов и в соответствии с инструкциями производителей, где это было применимо. Стандартные протоколы для различных способов, включая ПЦР, молекулярное клонирование, обработку, секвенирование, получение антител, эпитопное картирование и конструирование мимотопов, культивирование клеток и проявление фагов, описаны в руководствах, таких как McPherson, M.J. et al. (1991, PCR: A practical approach, Oxford University Press, Oxford), Sambrook, J. et al. (1989, Molecular cloning: a laboratory manual, Cold Spring Harbour Laboratory, New York), Huynh and Davies (1985, "DNA Cloning Vol I - A Practical Approach", IRL Press, Oxford, Ed. D.M. Glover), Sanger, F. et al. (1977, PNAS USA 74(12): 5463-5467), Harlow, E. and Lane, D. ("Using Antibodies: A Laboratory Manual", Cold Spring Harbor Laboratory Press, New York, 1998), Jung, G. and Beck-Sickinger, A.G. (1992, Angew. Chem. Int. Ed. Eng., 31:367-486), Harris, M.A. and Rae, I.F. ("General Techniques of Cell Culture", 1997, Cambridge University Press, ISBN 0521 573645), "Phage Display of Peptides and Proteins: A Laboratory Manual" (Eds. Kay, B.K., Winter, J., and McCafferty, J., Academic Press Inc., 1996, ISBN 0-12-402380-0).
Применимые для этого в подробно описанных здесь способах реактивы и оборудование среди прочих могут быть получены в равной мере от Amersham (www.amersham.co.uk), Boehrmger Mannheim (www.boehringer-ingeltheim.com), Clontech (www.clontech.com), Genosys (www.genosys.com), Millipore (www.millipore.com), Novagen (www.novagen.com), Perkin Elmer (www.perkinelmer.com), Pharmacia (www.pharmacia.com), Promega (www.promega.com), Qiagen (www.qiagen.com), Sigma (www.sigma-aldrich.com) and Stratagene (www.stratagene.com).
Когда для публикаций даются номера ссылок "PMID", эти номера обозначают идентификационные номера, присвоенные им Национальной медицинской библиотекой США, из которой полная библиографическая информация и реферат каждой публикации доступны по адресу www.ncbi.nlm.nih.gov. Может быть также обеспечен прямой доступ к электронным копиям полных публикаций, в особенности в случае публикаций, например, PNAS, JBC и MBC.
Содержание каждой из обсуждаемых здесь ссылок, включая цитированные здесь ссылки, включено здесь в качестве ссылки во всей своей полноте.
1. Исследование на человеке
Для данного исследования Aurograb вводили в сочетании с ванкомицином для снижения летальности и/или показателей заболеваемости больных с подтвержденным культивированием укоренившейся инфекции MRSA. Данное исследование проводили в трех частях:
i) Исследование переносимости и варьирования дозы, в котором группы из трех больных с инфекцией MRSA получают ступенчато возрастающие дозы Aurograb, начиная с суб-терапевтической дозы (0,1 мг/кг), и возрастающей до 1 мг/кг массы тела, во время которого каждого больного тщательно обследуют на предмет любых неблагоприятных побочных эффектов.
ii) Внутреннее, открытое, маркированное исследование, в котором 5 больных с инфекцией MRSA получают предполагаемый курс терапии Aurograb, а именно 1 мг/кг массы тела в течение 7 дней, с тщательным контролем в отношении устойчивости и фармакокинетики. Предварительная оценка эффективности может быть осуществлена на основании истории болезни.
iii) Проспективное, дважды слепое, рандомизированное испытание фазы II.
2. Физические, химические и фармацевтические свойства
| Таблица 1 | |
| Физическая форма: | Aurograb представляет собой аморфный лиофилизированный порошок, который при растворении в воде при концентрации 2 мг/мл дает прозрачный, бесцветный раствор |
| Структурная формула: | Рекомбинантный белок с аминокислотной последовательностью SEQ ID NO: 1 - scFv человека, совместно с гистидиновой меткой карбоксильного конца из 6 аминокислотных остатков гистидина |
| Молекулярная масса: | Мономер - 28,1 кДа - приблизительно 18% молекул находятся в виде гомодимера |
| Свойства: | Белый порошок рыхлого твердого вещества. Гигроскопичный |
| Кислотность/щелочность | Aurograb осаждается при pH 9,5±0,2. |
3. Состав, композиция, обработка и хранение
3.1 Состав и композиция
Полный состав для Aurograb показан ниже в таблице 2. Он состоит из лиофилизированного (замороженного-высушенного) порошка, предлагаемого в количестве 10 мг на сосуд. Лекарство вводят ресуспендированием порошка в 5 мл стерильной воды для инъекций незадолго до инъекции. Воду не следует заменять никаким другим растворителем, поскольку Aurograb чувствителен к изменениям pH и был специально приготовлен для ресуспендирования в воде.
| Таблица 2 | |||
| Наименования ингредиентов | Количество на сосуд Aurograb | Количество на мл после разбавления 5 мл воды | Функция |
| Aurograb | 10 мг | 2 мг | Активный ингредиент |
| Мочевина Ph Eur, BP, USP, JP | 150 мг | 30 мг | Наполнитель |
| Аргинин Ph Eur | 174 мг | 34,8 мг | Наполнитель |
L-Аргинин и мочевина присутствуют для поддержания баланса pH состава и обеспечения растворимости Aurograb. Они оба находятся в дозах, которые рассматриваются как безопасные при клиническом внутривенном введении. Например, однократная доза Aurograb (37,5 мл для больного массой 75 кг) содержит 7,5 ммоль аргинина. Это в 26 раз меньше максимально допустимой ежедневной дозы L-аргинина при введении во время измерения уровня гормона роста у детей (руководство ABPI, 1998-99). В случае мочевины однократная доза Aurograb 35 мл содержит 1,125 г мочевины. И вновь это значительно меньше максимально допустимой ежедневной дозы 150 г мочевины (данная максимальная доза показана для лечения острого внутричерепного давления посредством внутривенной доставки - руководство ABPI, 1998-99).
3.2 Хранение
Лиофилизированное лекарство хранится в стеклянных сосудах при 4°С в темноте. Приемлема транспортировка в течение ночи при температуре окружающей среды. Следует избегать экспозиции при ярком свете или избыточной влажности. Не наблюдалось изменения активности Aurograb после хранения при 4°С (3 месяца).
После восстановления водой Aurograb должен храниться при 4°С, и его следует использовать в течение 14 часов. Активность будет медленно снижаться при комнатной температуре.
3.3 Получение и введение
Aurograb, предлагаемый в количестве 10 мг на сосуд, вводят путем ресуспендирования порошка в 5 мл стерильной воды для инъекций незадолго до внутривенной (в/в) инъекции. Примерной дозой для человека является 1 мг/кг массы тела. Стерильную вводу вносят непосредственно в сосуды посредством инъекции через резиновую пробку с помощью шприца/иглы подкожных инъекций.
Для разбавления:
добавить половину конечного объема воды (2,5 мл на сосуд) и вращать для растворения;
отфильтровать (если это необходимо) для удаления всего нерастворенного вещества;
добавить остальную воду.
Внимание. Если введение откладывается, хранить при 4°С (до 14 часов).
Не следует заменять воду никаким другим растворителем, поскольку Aurograb чувствителен к изменениям pH и был приготовлен специально для ресуспендирования в воде.
Aurograb следует вводить путем медленной в/в болюсной инъекцией, например с использованием комплекта для в/в введения, который следует сначала сполоснуть физиологическим раствором для удаления любых других в/в жидкостей с повторением процедуры после введения лекарства.
Не требуется особых предосторожностей для удаления пролитого или удаления отходов.
Физиологический раствор для в/в применения совместим с разбавленным Aurograb (при разведении 50:50). Он менее совместим с 20% глюкозой и буфером на основе бикарбоната натрия, как это показано снижением активности при ELISA, и поэтому при в/в введении посредством того же комплекта для в/в введения этих или других жидкостей инъекционный порт должен быть промыт струей физиологического раствора до и после введения Aurograb.
4. Неклинические исследования
Aurograb проявляет антибактериальную активность, как in vitro, так и in vivo, в отношении широкого спектра штаммов S. aureus. Кроме того, было показано, что Aurograb оказывает синергичное антибактериальное действие при применении в сочетании с ванкомицином.
4.1 Неклинические исследования эффективности: данные in vitro
Aurograb проявляет синергетическую активность в сочетании с ванкомицином в отношении широкого спектра штаммов MRSA, включая штаммы EMRSA с промежуточной устойчивостью к ванкомицину ("VISA" - нечувствительный к ванкомицину MRSA)
Эти данные были получены при применении методологии MIC, которую обычно используют в отношении антибиотиков.
Цели: Показать синергизм при применении в сочетании с ванкомицином в отношении широкого спектра эпидемических штаммов MRSA.
Задача: Демонстрация синергизма снижением MIC ванкомицина при применении Aurograb в сочетании.
Введение
Эпидемические штаммы MRSA легко вырастают в субпопуляции с промежуточной устойчивостью к ванкомицину (т.е., MIC 4 или 8 мкг/мл) при последовательных пассажах в питательном бульоне с возрастающими концентрациями ванкомицина (Burnie J et al., Clin Infect Dis. 2000 Sep; 31(3):684-9; PMID: 11017816). Это, возможно, служит причиной многих неудач в лечении, связанном с терапией ванкомицином. В данном исследовании активность Aurograb оценивали в отношении как данных VISA, так и полностью чувствительного к ванкомицину исходного штамма EMRSA-15.
Способ
Штаммы MRSA выращивали в течение ночи в питательном бульоне и разбавляли для получения прививочного материала в концентрации 1·103 клеток на мл. 100 мкл аликвоты культуры помещали в планшеты для микротитрования с плоским дном и добавляли ванкомицин в диапазоне 0,125-250 мкг/мл. Культуры инкубировали еще в течение 2 дней. Минимальную ингибирующую рост концентрацию (MIC) определяют как наибольшую концентрацию антибиотика, при которой происходит рост бактерий, и ее определяют путем спектрофотометрической оценки мутности (роста) культуры. MIC определяли в присутствии экзогенного Aurograb или в присутствии буфера для состава Aurograb (отрицательный контроль).
Результаты:
| Таблица 3 | ||||
| Штамм MRSA | MIC ванкомицина в присутствии Aurograb в следующих концентрациях | |||
| VISA:- | 0 мкг/мл | 60 мкг/мл | 80 мкг/мл | 125 мкг/мл |
| EMRSA-1 | 8 мкг/мл | 4 мкг/мл | 2 мкг/мл | <0,125 мкг/мл |
| EMRSA-2 | 4 мкг/мл | 0,5 мкг/мл | 1 мкг/мл | <0,125 мкг/мл |
| EMRSA-8 | 8 мкг/мл | 2 мкг/мл | 1 мкг/мл | <0,125 мкг/мл |
| EMRSA-11 | 4 мкг/мл | 4 мкг/мл | 1 мкг/мл | <0,125 мкг/мл |
| EMRSA-12 | 8 мкг/мл | 4 мкг/мл | 2 мкг/мл | <0,125 мкг/мл |
| EMRSA-15 | 8 мкг/мл | 4 мкг/мл | 2 мкг/мл | <0,125 мкг/мл |
| Исходный EMRSA-15 | 1 мкг/мл | - | 0,25 мкг/мл | <0,125 мкг/мл |
Спектр активности: Повышенная антибактериальная активность наблюдается в отношении всех тестированных штаммов, что показывает широкий спектр активности против штаммов MRSA.
Синергизм: Aurograb обладает способностью повышать чувствительность MRSA к ванкомицину, включая MRSA со сниженной чувствительностью к ванкомицину.
Были предприняты дополнительные эксперименты для определения MIC ванкомицина в отношении ряда штаммов MRSA и действия антитела Aurograb на MIC. Были также проведены эксперименты с применением флуклоксациллина вместо ванкомицина для исследования эффективности антител пенициллинового типа с использованием Aurograb. Результаты приведены в таблице 3a:
| Таблица 3А | ||
| Штамм EMRSA | MIC для ванкомицина | MIC для ванкомицина + 100 мкг/мл Aurograb |
| 1 | 0,5 мкг/мл | 0,03 мкг/мл |
| 2 | 0,5 мкг/мл | 0,03 мкг/мл |
| 3 | 0,5 мкг/мл | 0,03 мкг/мл |
| 4 | 0,5 мкг/мл | 0,03 мкг/мл |
| 5 | 0,5 мкг/мл | 0,03 мкг/мл |
| 6 | 0,5 мкг/мл | 0,0125 мкг/мл |
| 7 | 0,5 мкг/мл | 0,03 мкг/мл |
| 8 | 0,5 мкг/мл | 0,0125 мкг/мл |
| 9 | 0,5 мкг/мл | 0,0125 мкг/мл |
| 10 | 0,5 мкг/мл | 0,03 мкг/мл |
| 11 | 0,5 мкг/мл | 0,03 мкг/мл |
| 12 | 0,5 мкг/мл | 0,03 мкг/мл |
| 13 | 0,5 мкг/мл | 0,03 мкг/мл |
| 14 | 0,25 мкг/мл | 0,03 мкг/мл |
| 15 | 0,5 мкг/мл | 0,03 мкг/мл |
| 16 | 0,5 мкг/мл | 0,03 мкг/мл |
Результаты, полученные с флуклоксациллином, показали, что полученная MIC была > 256 мкг/мл в отношении всех штаммов EMRSA. Флуклоксациллин + Aurograb дали те же результаты и показали отсутствие снижения MIC флуклоксациллина.
Заключение: Применение Aurograb в сочетании с ванкомицином должно повышать терапевтическую эффективность ванкомицина и препятствовать появлению устойчивых к ванкомицину штаммов. Благодаря структуре и функции антитела в отношении молекулы-мишени, можно ожидать, что сходные результаты будут получены при применении других гликопептидных антибиотиков, таких как тейкопланин, поскольку используемые S. aureus механизмы устойчивости к ним являются такими же, что и в отношении ванкомицина, и, следовательно, они также служат мишенью для антитела и поддаются терапии с его применением.
4.2 Неклинические исследования эффективности: данные in vivo
Мышиная модель стафилококковой инфекции широко и рутинно применяется при оценке противомикробных лекарств. Она служит хорошим предсказателем эффективности у инфицированных людей, поскольку S. aureus вводят внутривенно для создания бактериемии, в случае которой патоген распространяется в другие органы, включая почки, печень и селезенку. Следовательно, природа инфекции (септицемия) является аналогичной ситуации у инфицированных больных. Кроме того, внутривенный путь введения Aurograb, применяемый на животных моделях (данные приведены ниже), является тем же путем, который обычно следует применять у больных, что улучшает шансы на сопоставимость фармакокинетики, биологической доступности лекарства и эффективности.
Данные цикла 1: Aurograb - внутренняя антибактериальная активность против EMRSA-15
Цели: Демонстрация того, что Aurograb представляет собой терапевтическое средство при введении его одного мышам, инфицированным чувствительным к ванкомицину штаммом MRSA, EMRSA-15.
Задача: Демонстрация антистафилококковой активности по снижению летальности или бактериальной нагрузки (колониеобразующих единиц) в почках, печени или селезенке в присутствии Aurograb.
Способ: 20 самок мыши CD-1 получали сублетальное контрольное заражение (1,3·107 КОЕ) устойчивым к метициллину, чувствительным к ванкомицину штаммом S. aureus (EMRSA-15, типированный госпитальный изолят, Central Manchester Healthcare Trust) в 100 мкл в/в болюса (все в/в инъекции производят через латеральную хвостовую вену). Через 1 час две группы из 10 мышей получали в виде 100 мкл в/в болюса:
1. буфер для состава (аргинин-мочевина) в качестве отрицательного контроля или
2. Aurograb (2,0 мг/кг) в буфере для состава.
Всех животных забивали через 48 часов и определяли жизнеспособные клетки как КОЕ на грамм органа.
Результаты:
| Таблица 4 | ||||
| Группа (n=10) | Aurograb | Почки | Печень | Селезенка |
| Log КОЕ/г ткани | ||||
| 1. Буфер состава | - | 8,58±2,59 | 4,79±0,53 | 5,04±0,24 |
| 2. Aurograb | 2 мг/кг | 7,20±1,15 | 3,63±0,68 | 3,79±0,82 |
Заключение: Антибактериальная активность - Жизнеспособные стафилококки были обнаружены в почках, печени и селезенке с предпочтительной локализацией в почках. Введение Aurograb приводило к логарифмическому (10-кратному) снижению жизнеспособных микроорганизмов, обнаруживаемых во всех трех органах. Это позволяет предполагать, что Aurograb снижает жизнеспособность S. aureus при экспериментальных инфекциях мышей в отсутствие любого другого экзогенного противомикробного агента при применении мышиной модели глубоко укоренившейся инфекции.
Данные цикла 2: Исследование варьирования дозы Aurograb
Цели: Исследование варьирования дозы для применения Aurograb против штамма EMRSA-15 S. aureus.
Задача: Показать антибактериальную активность как большее снижение бактериальной нагрузки (КОЕ в органе) в почках, печени или селезенке при введении Aurograb в виде единственного агента по сравнению с контролем - плацебо. Диапазон доз определяют путем сравнения КОЕ (выраженных в виде log КОЕ на грамм ткани) для разных органов при различных дозах.
Способ: 40 самок мышей CD-1 (24-26 г) получали контрольное заражение путем в/в болюса S. aureus с последующим через 2 часа в/в введением однократной дозы плацебо или Aurograb (2 мг/кг, 1 мг/кг или 20 мг/кг). Всех мышей забивали через 48 часов для культивирования почек, печени и селезенки для определения показателей жизнеспособных микроорганизмов в органах.
Результаты: выражены в виде log КОЕ на грамм ткани
Эксперимент 1: S. aureus (1,5·107 КОЕ): EMRSA-15
| Таблица 5 | |||
| Доза Aurograb | Почки | Печень | Селезенка |
| 0 | 8,40±2,256 | 7,22±2,52 | 6,98±2,39 |
| 2 мг/кг | 7,62±1,16 | 5,22±1,39 | 5,10±1,29 |
| 1 мг/кг | 8,7±2,6 | 5,40±1,38 | 5,33±1,21 |
| 0,2 мг/кг | 8,5±2,55 | 6,61±3,03 | 5,69±1,16 |
Эксперимент 2: S. aureus (9·106 КОЕ): клинический изолят EMRSA-15 - низкая доза Aurograb
| Таблица 6 | |||
| Доза Aurograb | Почки | Печень | Селезенка |
| 0,2 мг/кгAurograb | 7,14±1,28 | 3,13±0,44 | 3,40±0,64 |
| Плацебо1 | 7,36±1,05 | 4,14±1,27 | 4,01±1,26 |
| 1Антитело отрицательного контроля (WC7), специфичное в отношении незащищающего эпитопа GrfA. |
Эксперимент 1: Было достигнуто от 10- до 100-кратного снижения жизнеспособных бактерий в печени и селезенке в диапазоне от 1,0 до 2,0 мг/кг Aurograb. При дозе Aurograb 0,2 мг/кг освобождение селезенки от микроорганизмов остается еще хорошим, но снижено в печени. Полученная наибольшая доза обеспечивала снижение бактериального заражения на 0,8 log в почках, но при меньших дозах снижение не происходило.
Эксперимент 2: При низких дозах, таких как 0,2 мг, снижение жизнеспособных стафилококков не обнаружено в почках, но очевидна гибель бактерий в печени и селезенке.
Заключение: Введение Aurograb в дозе 2 мг/кг приводит к снижению жизнеспособных микроорганизмов во всех трех органах, и в особенности в селезенке и печени. Aurograb в дозе 2 мг/кг также проявлял значительную антибактериальную активность в селезенке и печени, но терял активность в почках. Низкие дозы, такие как 0,2 мг/кг, все еще проявляют антибактериальную активность в селезенке и, в меньшей степени, в печени.
Экстраполяция на человека: Однократная доза 2,0 мг/кг у мышей обеспечивает приблизительно 2,0 log снижение в печени и селезенке и 0,8 log снижение в почках. На основе массы тела это соответствует дозе 1 мг/кг, вводимой дважды в день человеку.
Данные цикла 3: Антибактериальная активность Aurograb и синергизм с ванкомицином: сублетальная модель.
Цели: Демонстрация того, что Aurograb является антибактериальным агентом при введении его одного и синергичным при введении в сочетании с ванкомицином у мышей, инфицированных сублетальной дозой S. aureus.
Задачи: Демон