Термостабильные мутанты ферментов биосинтеза крахмала
Иллюстрации
Показать всеИзобретение относится к генной инженерии. Введение в растение полинуклеотидов, кодирующих мутантные полипептиды АДФ-глюкозопирофосфорилазы эндоспермы кукурузы и растворимой синтазы крахмала обеспечивает высокую урожайность за счет их повышенной термостабильности в условиях теплового стресса. 8 н. и 78 з.п. ф-лы, 3 ил., 4 табл.
Реферат
Перекрестная ссылка на родственную заявку
Данная заявка претендует на преимущества приоритета предварительной заявки на выдачу патента США с регистрационным No.60/275768, поданной 14 марта 2001.
Предпосылка изобретения
Неподвижная природа жизни растений порождает постоянное воздействие факторов окружающей среды, которые оказывают положительное и отрицательное влияние на их рост и развитие. Одним из основных препятствий, с которым сталкивается современное сельское хозяйство, являются неблагоприятные условия окружающей среды. Одним из важных факторов, который вызывает значительную потерю урожая, является тепловой стресс. Температурный стресс в значительной степени снижает урожай зерна многих зерновых культур, таких как кукуруза, пшеница и ячмень. Вследствие теплового стресса урожайность значимых во всем мире зерновых культур уменьшается на 7-35%.
В ряде исследований идентифицированы возможные физиологические последствия теплового стресса. В ранней работе Hunter et al. (Hunter, R.B., Tollenaar, M. and Breuer, C.M. [1977] Can. J. Plant Sci. 57: 1127-1133) с использованием условий в ростовой камере показано, что температура уменьшала продолжительность наливания зерна у кукурузы. Сходные результаты, в которых продолжительность наливания зерна неблагоприятно изменяли повышенными температурами, установлены Tollenaar and Bruulsema (Tollenaar, M. and Bruulsema, T.W. [1988] Can. J. Plant Sci. 68: 935-940). Badu-Apraku et al. (Badu-Apraku, B., Hunter, R.B., and Tollenaar, M. [1983] Can. J.Plant. Sci. 63: 357-363) измеряли заметное снижение урожайности растений кукурузы, выросших в температурном режиме день/ночь 35/15°C, по сравнению с ростом в температурном режиме 25/15°C. Пониженные урожайности вследствие повышенных температур также подтверждаются историческими, а также климатологическими исследованиями (Thompson, L.M. [1986] Agron. J. 78: 649-653; Thompson, L.M. [1975] Science 188: 535-541; Chang, J. [1981] Agricul. Metero. 24: 253-262; и Conroy, J.P., Seneweera, S., Basra, A.S., Rogers, G., and Nissen-Wooller, B. [1994] Aust. J. Plant Physiol. 21: 741-758).
То, что тепловой стресс неблагоприятно влияет на физиологические процессы развития семян, является очевидным на основе исследований с использованием системы культивирования зерен in vitro (Jones, R. J., Gengenbach, B.G., and Cardwell, V.B. [1981] Crop Science 21: 761-766; Jones, R.J., Ouattar, S., and Crookston, R.K. [1984] Crop Science 24: 133-137; и Cheikh, N., and Jones, R.J. [995] Physiol. Plant. 95: 59-66). Наблюдали значительное снижение массы зерен кукурузы, культивируемых при температуре выше оптимальной, при 35°C.
В работе с использованием пшеницы потеря активности растворимой синтазы крахмала (SSS) идентифицирована в качестве критерия реакции эндосперма пшеницы на тепловой стресс (Hawker, J.S. and Jenner, C.F. [1993] Aust. J. Plant Physiol. 20: 197-209; Denyer, K., Hylton, C.M., and Smith, A.M. [1994] Aust. J.Plant Physiol. 21: 783-789; Jenner, C. F. [1994] Aust. J. PlantPhysiol. 21: 791-806). Дополнительные исследования SSS эндосперма пшеницы показывают, что она является термолабильной (Rijven, A.H.G.C. [1986] Plant Physiol. 81: 48-453; Keeling, P. L., Bacon, P.J., Holt, D.C. [1993] Planta. 191: 342-348; Jenner, C.F., Denyer, K., and Guerin, J. [1995] Aust. J. Plant Physiol. 22: 703-709).
Роли SSS и АДФ-глюкозопирофосфорилазы (AGP) в условиях теплового стресса у кукурузы менее выяснены. AGP катализирует превращение АТФ и α-глюкозо-1-фосфата в АДФ-глюкозу и пирофосфат. АДФ-глюкоза используется в качестве донора гликозила в биосинтезе крахмала растениями и в биосинтезе гликогена бактериями. Значение АДФ-глюкозопирофосфорилазы в качестве ключевого фермента в регуляции биосинтеза крахмала отмечено в исследовании мутантов кукурузы (Zea mays) с дефицитом крахмала в эндосперме (Tsai, C.Y., and Nelson, Jr., O.E. [1966] Science 151: 341-343; Dickinson, D.B., J. Preiss [1969] Plant Physiol. 44: 1058-1062).
Ou-Lee и Setter (Ou-Lee, T. and Setter, T.L. [1985] PlantPhysiol. 79: 852-855) исследовали влияние температуры на апикальные или верхушечные области початков кукурузы. При повышенных температурах активность AGP была ниже в апикальных зернах по сравнению с базальными зернами во время интенсивного отложения крахмала. Напротив, в течение указанного периода в зернах, развившихся при нормальных температурах, активность AGP была сходной в апикальных и базальных зернах. Однако активность синтазы крахмала в течение указанного периода в апикальных и базальных зернах не подвергалась дифференцированному воздействию. Кроме того, в подвергнутых тепловой обработке апикальных зернах наблюдали увеличение активности синтазы крахмала по сравнению с контролем. Этого не наблюдали в случае активности AGP. Singletary et al. (Singletary, G.W., Banisadr, R., and Keeling, P.L. [1993] Plant Physiol. 102: 6 (suppl).; Singletary, G.W., Banisadra, R., Keeling, P.L. [1994] Aust. J.Plant Physiol. 21: 829-841), используя систему культивирования in vitro, количественно оценили влияние различных температур в течение периода наливания зерна. Масса семян постоянно снижалась по мере того, как температура увеличивалась от 22 до 36°C. Роль AGP в потере урожайности также подтверждается работой Duke и Doehlert (Duke, E.R. And Doehlert, D.C. [1996] Environ. Exp.Botany. 36: 199-208).
В работе Keeling et al. (1994, выше) количественно оценивали активность SSS в кукурузе и пшенице, используя анализ Q10, и показали, что SSS является важной контрольной точкой в потоке углерода в крахмал.
Биохимические исследования in vitro AGP и SSS ясно свидетельствуют, что оба фермента являются термолабильными. AGP эндосперма кукурузы теряет 96% своей активности при нагревании при 57°C в течение пяти минут (Hannah, L.C., Tuschall, D.M., and Mans, R.J. [1980] Genetics 95: 961-970). От нее отличается AGP картофеля, которая полностью стабильна при 70°C (Sowokinos, J.R. and Preiss, J. [1982] Plant Physiol. 69: 1459-1466; Okita, T.W., Nakata, P.A., Anderson, J.M., Sowokinos, J., Morell, J., and Preiss, J. [1990] Plant Physiol. 93: 785-90). Исследования по инактивации при нагревании в случае SSS показали, что она также лабильна при более высоких температурах, и кинетические исследования выявили, что значение Km для амилопектина экспоненциально возрастает в том случае, когда температура увеличивается от 25 до 45°C (Jenner et al., 1995, выше).
На основе биохимических и генетических данных AGP идентифицирована как ключевой фермент биосинтеза крахмала у высших растений и биосинтеза гликогена у E. coli (Preiss, J. and Romeo, T. [1994] Progress in Nuc. Acid Res. and Mol. Biol. 47: 299-329; Preiss, J. and Sivak, M. [1996] "Starch synthesis in sinks and sources," в Photoassimilate distribution in plants and crops: source-sink relationships. Zamski, E., ed., Marcil Dekker Inc. pp. 139-168). AGP катализирует стадию, которая рассматривается как начальная стадия пути биосинтеза крахмала, при этом продукт реакции является активированным донором гликозила, АДФ-глюкозой. Она используется синтазой крахмала для удлинения полисахаридного полимера (обзор в Hannah, L. Curtis [1996] "Starch synthesis in the maize endosperm," в Advances inCellular and Molecular Biology of Plants, Vol. 4. B.A. Larkins and I.K. Vasil (eds.). Cellular and Molecular Biology of Plant Seed Development. Kluwer Academic Publishers, Dordrecht, The Netherlands).
Первоначальные исследования AGP картофеля показали, что экспрессия в E. coli давала фермент с аллостерическими и кинетическими свойствами, очень сходными со свойствами нативного фермента клубней. (Iglesias, A., Barry, G.F., Meyer, C., Bloksberg, L., Nakata, P., Greene, T., Laughlin, M.J., Okita, T.W., Kishore, G.M., and Preiss, J. [1993] J. Biol Chem. 268: 1081-86; Ballicora, M.A., Laughlin, M.J., Fu, Y., Okita, T.W., Barry, G.F., and Preiss, J. [1995] Plan Physiol. 109: 245-251). Greene et al. (Greene, T.W., Chantler, S.E., Kahn, M.L., Barry, G.F., Preiss, J., and Okita, T.W. [1996] Proc. Natl. Acad. Sci. 93: 1509-1513; Greene, T.W., Woodbury, R.L., and Okita, T.W. [1996] Plant Physiol. (112: 1315-1320) в своих структурно-функциональных исследованиях AGP картофеля показали пригодность бактериальной экспрессирующей системы. Идентифицированы множественные мутации, важные для картирования аллостерических и связывающих субстрат сайтов (Okita, T.W., Greene, T.W., Laughlin, M.J., Salamone, P., Woodbury, R., Choi, S., Ito, H., Kavakli, H., and Stephens, K. [1996] "Engineering Plant Starches by the Generation of Modified Plant Biosynthetic Enzymes," в Engineering Crops for Industrial End Uses, Shewry, P.R., Napier, J.A., and Davis, P., eds., Portland Press Ltd., London).
Ферменты AGP выделены как из бактерий, так и из растений. Бактериальная AGP состоит из гомотетрамера, тогда как растительная AGP из фотосинтетических и нефотосинтетических тканей является гетеротетрамером, состоящим из двух разных субъединиц. Фермент растений кодируется двумя разными генами, при этом одна субъединица больше другой. Эта особенность отмечена у ряда растений. Субъединицы AGP в листьях шпината имеют молекулярные массы 54 кД и 51 кД, определенные с помощью SDS-PAGE. Обе субъединицы вступают в реакцию с антителом, вырабатываемым против очищенной AGP из листьев шпината (Copeland, L., J. Preiss [1981] Plant Physiol. 68: 996-1001; Morell, M., M. Bloon, V. Knowles, J. Preiss [1988] J. Bio. Chem. 263: 633). Иммунологические анализы с использованием антисыворотки, полученной против малой и большой субъединиц фермента из листьев шпината, показали, что AGP клубней картофеля также кодируется двумя генами (Okita et al., 1990, выше). Выделены и секвенированы клоны кДНК двух субъединиц из клубня картофеля (50 и 51 кД) (Muller-Rober, B.T., J. Kossmann, L.C. Hannah, L. Willmitzer, U. Sounewald [1990] Mol. Gen. Genet. 224: 136-146; Nakata, P.A., T.W. Greene, J.M. Anderson, B.J. Smith-White, T.W. Okita,J. Preiss [1991] Plant Mol. Biol. 17: 1089-1093). Большая субъединица AGP клубней картофеля является термостабильной (Nakata et al. [1991], выше).
Как предположили Hannah и Nelson (Hannah, L.C., O.E. Nelson [1975] Plant Physiol. 55: 297302.; Hannah, L.C., and Nelson, Jr., O.E. [1976] Biochem. Genet. 14: 547-560) и Shrunken-2 (Sh2) (Bhave, M.R., S. Lawrence, C. Barton, L.C. Hannah [1990] Plant Cell 2: 581-588) и Brittle-2 (Bt2) (Bae, J.M., M. Giroux, L.C. Hannah [1990] Maydica 35: 317-322) являются структурными генами АДФ-глюкозопирофосфорилазы эндосперма кукурузы. Sh2 и Bt2 кодируют большую субъединицу и малую субъединицу фермента соответственно. На основе секвенирования кДНК рассчитана молекулярная масса белков Sh2 и Bt2 57179 Д (Shaw, J.R., L.C.Hannah [1992] Plant Physiol. 98: 1214-1216) и 52224 Д соответственно. Эндосперм является местом наибольшего отложения крахмала во время развития зерна у кукурузы. Мутанты Sh2 и Bt2 эндосперма кукурузы имели в значительной степени сниженные уровни крахмала в соответствии с недостаточными уровнями активности AGP. Показано, что мутации любого из генов снижают активность AGP примерно на 95% (Tsai and Nelson, 1966, выше; Dickinson and Preiss, 1969, выше). Более того, выявлено, что ферментативные активности увеличиваются с увеличением дозы функциональных аллелей Sh2 и Bt2 дикого типа, тогда как мутантные ферменты обладают измененными кинетическими свойствами. AGP является лимитирующей скорость стадией в биосинтезе крахмала у растений. Stark et al. поместили мутантную форму AGP E. coli в клубень картофеля и получили 35% увеличение содержания крахмала (Stark et al. [1992] Science 258: 287).
Сообщалось о клонировании и характеристике генов, кодирующих субъединицы фермента AGP для различных растений. Гены включают в себя кДНК Sh2 (Bhave et al., 1990, выше), геномную ДНК Sh2 (Shaw and Hannah, 1992, выше) и кДНК Bt2 (Bae et al., 1990, выше) из кукурузы; кДНК малой субъединицы (Anderson, J.M., J. Hnilo, R. Larson, T.W. Okita, M. Morell, J Preiss [1989] J. Biol. Chem. 264: 12238-12242) и геномную ДНК (Anderson, J.M., R. Larson, D. Landencia, W.T. Kim, D. Morrow, T.W. Okita, J. Preiss [1991] Gene 97: 199-205) риса; и кДНК малой и большой субъединиц из листа шпината (Morell et al., 1988, выше) и клубня картофеля (Muller-Rober et al., 1990, выше; Nakata, P.A., Greene, T.W., Anderson, J.W., Smith-White, B.J., Okita, T.W., and Preiss, J. [1991] Plant Mol. Biol. 17: 1089-1093). Кроме того, выделены клоны кДНК из эндосперма и листовой ткани пшеницы (Olive, M.R., R.J. Ellis, W.W. Schuch [1989] Plant Physiol. Mol. Biol. 12: 525-538) и листа Arabidopsis thaliana (Lin, T., Caspar, T., Sommerville, C.R., and Preiss, J. [1988] Plant Physiol. 88: 1175-1181). Последовательности AGP ячменя также описаны у Ainsworth et al. (Ainsworth, C., Hosein, F., Tarvis, M., Weir, F., Burrell, M., Devos, K.M., Gale, M.D. [1995] Planta 197: 1-10).
До настоящего времени исследованы функции AGP в качестве аллостерического фермента во всех тканях и организмах. Впервые было показано, что аллостерические свойства имеют важное значение у E. coli. Выделили мутант E. coli, сверхпродуцирующий гликоген, и мутация, картированная в структурном гене AGP, названа glyC. Показано, что мутант E. coli, известный как glyC-16, более чувствителен к активатору, фруктозо-1,6-бифосфату, и менее чувствителен к ингибитору, цАМФ (Preiss, J. [1984] Ann.Rev. Microbiol. 419-458). Хотя AGP растений также являются аллостерическими, они отвечают на другие эффекторные молекулы, отличные от молекул для AGP бактерий. У растений 3-фосфоглицериновая кислота (3-PGA) функционирует как активатор, тогда как фосфат (PO4) служит в качестве ингибитора (Dickinson and Preiss, 1969, выше).
Используя систему мутагенеза in vivo, созданную благодаря опосредованной Ac эксцизии транспозируемого элемента Ds, случайно локализованного вблизи известного сайта связывания активатора, Giroux et al. (Giroux, M.J., Shaw, J., Barry, G., Cobb, G.B., Greene, T., Okita, T.W., and Hannah, L.C. [1996] Proc. Natl. Acad. Sci. 93: 5824-5829) смогли создать сайт-специфичные мутанты в функционально важной области AGP эндосперма кукурузы. Один мутант, Rev6, содержал инсерцию тирозин-серин в большой субъединице и обусловливал 11-18% увеличение массы семян. Кроме того, в опубликованной международной заявке WO 01/64928 показано, что различные признаки, такие как количество семян, биомасса растений, индекс урожайности и т.д., могут быть увеличены у растений, трансформированных полинуклеотидом, кодирующим большую субъединицу AGP кукурузы, содержащую мутацию Rev6.
В опубликованных международных заявках на выдачу патента WO 99/58698 и WO 98/22601 и заявленном патенте США No.6069300 описаны мутации в большой субъединице фермента AGP кукурузы, которые при экспрессии придают повышенную термостабильность по сравнению с термостабильностью, наблюдаемой в случае фермента AGP дикого типа. Несколько термостабильных мутантов описано в 300 публикациях патентов и заявок WO, включая мутанты, обозначенные HS 13 (имеющий замену Ala на Pro в положении 177); HS 14 (имеющий замену Asp на His в положении 400 и замену Val на Ile в положении 454); HS 16 (имеющий замену Arg на Thr в положении 104); HS 33 (имеющий замену His на Tyr в положении 333); HS 39 (имеющий замену His на Tyr в положении 333); HS 40 (имеющий замену His на Tyr в положении 333 и замену Thr на Ile в положении 460); HS 47 (имеющий замену Arg на Pro в положении 216 и замену His на Tyr в положении 333); RTS 48-2 (имеющий замену Ala на Val в положении 177); и RTS 60-1 (имеющий замену Ala на Val в положении 396).
Сущность изобретения
Данное изобретение относится к веществам и способам, применимым для повышения урожайности у растений, таких как растения, которые относятся к зерновым культурам. В одном варианте данное изобретение относится к термостабильным ферментам AGP и нуклеотидным последовательностям, которые кодируют указанные ферменты. В предпочтительном варианте термостабильные ферменты согласно изобретению можно использовать для получения растений, обладающих более высокой толерантностью к высоким температурам, повышая таким образом урожайность указанных растений. В конкретном предпочтительном варианте улучшенным растением является злаковое растение. Злаковые растения, по отношению к которым применимо данное изобретение, включают в себя, например, кукурузу, пшеницу, рис и ячмень.
Краткое описание чертежей
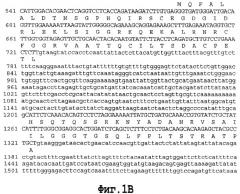
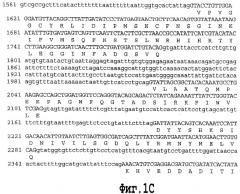
На фигуре 1 показана геномная нуклеотидная последовательность аллеля Shrunken-2 дикого типа Zea mays. Интроны показаны строчными буквами. Основание номер 1 является стартовым сайтом транскрипции.
На фигуре 2 показано сравнение активности фермента дикого типа и различных мутантов большой субъединицы AGP кукурузы. Все реакции выполняли в повторах. Приведенные цифры являются средними из двух повторов после вычитания фона. Проценты относятся к активности после тепловой обработки по сравнению с активностью до тепловой обработки. Надпись к фигуре означает следующее:
"sh2" = белок sh2 дикого типа;
"sh2ht" = белок sh2 дикого типа после тепловой обработки;
"33" = белок sh2, содержащий мутацию HS 33 (т.е. аминокислотную замену гистидина на тирозин в положении 333 в большой субъединице AGP кукурузы);
"33ht" = белок sh2, содержащий мутацию HS 33, после тепловой обработки;
"177" = белок sh2, содержащий мутацию rts48-2 (т.е. аминокислотную замену аланина на валин в положении 177 в большой субъединице AGP кукурузы);
"177ht" = белок sh2, содержащий мутацию rts48-2 (т.е. аминокислотную замену аланина на валин в положении 177 в большой субъединице AGP кукурузы), после тепловой обработки;
"396" = белок sh2, содержащий мутацию rts60-1 (т.е. аминокислотную замену аланина на валин в положении 396 в большой субъединице AGP кукурузы);
"396ht" = белок sh2, содержащий мутацию rts60-1 (т.е. аминокислотную замену аланина на валин в положении 396 в большой субъединице AGP кукурузы), после тепловой обработки;
"7+6" = белок sh2, содержащий комбинацию мутаций "177" и "396";
"7+6ht" = белок sh2, содержащий комбинацию мутаций "177" и "396", после тепловой обработки;
"7+3" = белок sh2, содержащий комбинацию мутаций "177" и "HS 33";
"7+3ht" = белок sh2, содержащий комбинацию мутаций "177" и "HS 33", после тепловой обработки;
"6+3" = белок sh2, содержащий комбинацию мутаций "396" и "HS 33";
"6+3ht" = белок sh2, содержащий комбинацию мутаций "396" и "HS 33", после тепловой обработки.
На фигуре 3 показана карта рестрикции кодирующей области Sh2. Указанные ферменты рестрикции являются ферментами, используемыми для выделения полной кодирующей области и создания двойных и тройных мутантов. Мутации указаны звездочками (*).
Краткое описание последовательностей
SEQ ID NO. 1 является аминокислотной последовательностью области, соответствующей аминокислотам с 318 по 350 большой субъединицы AGP кукурузы, содержащей мутацию HS 33.
SEQ ID NO. 2 является аминокислотной последовательностью области, соответствующей аминокислотам с 170 по 189 большой субъединицы AGP кукурузы, содержащей мутацию RTS48-2.
SEQ ID NO. 3 является аминокислотной последовательностью области, соответствующей аминокислотам с 389 по 406 большой субъединицы AGP кукурузы, содержащей мутацию RTS60-1.
SEQ ID NO. 4 является геномной нуклеотидной последовательностью аллеля Shrunken-2 дикого типа Zea mays.
SEQ ID NO. 5 является синтетическими олигонуклеотидным праймером, который можно использовать согласно данному изобретению.
SEQ ID NO. 6 является синтетическим олигонуклеотидным праймером, который можно использовать согласно данному изобретению.
SEQ ID NO. 7 является синтетическим олигонуклеотидным праймером, который можно использовать согласно данному изобретению.
SEQ ID NO. 8 является синтетическим олигонуклеотидным праймером, который можно использовать согласно данному изобретению.
SEQ ID NO. 9 является синтетическим олигонуклеотидным праймером, который можно использовать согласно данному изобретению.
SEQ ID NO. 10 является синтетическим олигонуклеотидным праймером, который можно использовать согласно данному изобретению.
Подробное описание изобретения
Данное изобретение относится к новым мутантным полинуклеотидным молекулам и кодируемым ими полипептидам, которые придают повышенную теплоустойчивость и повышенную урожайность растениям, выращиваемым в условиях теплового стресса, по сравнению с растениями, экспрессирующими генотип дикого типа. В конкретных вариантах молекулы полинуклеотидов согласно данному изобретению кодируют активности ферментов АДФ-глюкозопирофосфорилазы (AGP) эндосперма кукурузы и растворимой синтазы крахмала (SSS). Мутантные ферменты во время развития семян и растений придают повышенную устойчивость к условиям теплового шока семенам и тканям растения, экспрессирующим ферменты, по сравнению с активностями ферментов дикого типа.
Один аспект данного изобретения относится к полинуклеотидам, которые кодируют два или более аминокислотных изменений в большой субъединице AGP по сравнению с последовательностью дикого типа полипептида большой субъединицы AGP, при этом экспрессированный мутантный белок проявляет повышенную стабильность. Предпочтительно полипептид, кодируемый данными полинуклеотидами, при экспрессии с малой субъединицей проявляет повышенную ферментативную активность по сравнению с белком дикого типа, и предпочтительно на уровне примерно таком же или более высоком, чем уровень, проявляемый в случае мутации одной аминокислоты, которая придает повышенную термостабильность, такой как HS 33. Полинуклеотиды согласно изобретению могут кодировать два, три или более аминокислотных изменений по сравнению с последовательностью дикого типа. Предпочтительно полинуклеотид согласно изобретению кодирует полипептид, имеющий аминокислотную замену в одном или нескольких из следующих положений, соответствующих положениям в большой субъединице AGP кукурузы: в положении 177, 333 и 396.
В одном варианте полинуклеотид согласно данному изобретению кодирует мутантную большую субъединицу AGP растения, содержащую двойную мутацию: аминокислотную замену гистидина на тирозин и аминокислотную замену аланина на валин в последовательности полипептида. В приведенном в качестве примера варианте замена гистидина на тирозин имеет место в аминокислоте, соответствующей остатку номер 333 в последовательности большой субъединицы AGP кукурузы. В одном варианте замена аланина на валин происходит в аминокислоте, соответствующей остатку номер 177 в последовательности большой субъединицы AGP кукурузы. В другом варианте замена аланина на валин происходит в аминокислоте, соответствующей остатку 396 в последовательности большой субъединицы AGP кукурузы.
В следующем варианте полинуклеотид согласно данному изобретению кодирует мутантную большую субъединицу AGP растения, содержащую две аминокислотные замены аланина на валин в последовательности полипептида. В приведенном в качестве примера варианте первая замена аланина на валин имеет место в аминокислоте, соответствующей остатку номер 177, а вторая замена аланина на валин имеет место в аминокислоте, соответствующей остатку номер 396 в последовательности большой субъединицы AGP кукурузы. Ферментативная активность, связанная с мутантными белками согласно данному изобретению, имеющими две мутации, показана на фигуре 2.
Другой вариант относится к тройному мутанту, содержащему замену гистидина на тирозин в аминокислоте, соответствующей остатку номер 333, замену аланина на валин в аминокислоте, соответствующей остатку номер 177, и замену аланина на валин в аминокислоте, соответствующей остатку 396 в последовательности большой субъединицы AGP кукурузы.
Номера остатков аминокислот, указанные выше, основаны на общепринятой нумерации аминокислот в данном белке (Shaw and Hannah, 1992, выше). Положение указанных замен легко может идентифицировать специалист в данной области. Ниже в таблице 1 показаны мутанты с двойными и тройными заменами аминокислот, приведенные в данном описании в качестве примеров.
| Таблица 1. | |
| Мутант полипептида Sh2 | Изменение аминокислоты |
| HS 7+3 | Ala на Val в положении 177 и His на Tyr в положении 333 |
| HS 6+3 | Ala на Val в положении 396 и His на Tyr в положении 333 |
| HS 7+6 | Ala на Val в положении 177 и Ala на Val в положении 396 |
| HS 7+6+3 | Ala на Val в положении 177 и Ala на Val в положении 396 и His на Tyr в положении 333 |
Вследствие гомологии между полипептидами AGP разных видов растений (Smith-White and Preiss [1992] J. Mol. Evol. 34: 449-464) специалист в данной области легко определит положение мутаций в AGP из других растений, отличных от кукурузы, которые соответствуют положению мутаций в AGP кукурузы, которые приведены в данном описании. Таким образом, данное изобретение охватывает полинуклеотиды, которые кодируют мутантную AGP других растений, отличных от кукурузы, включая, но не ограничиваясь указанным, пшеницу, ячмень, овес и рис, которая придает повышенную термостабильность при экспрессии в растении.
Одиночные мутации аминокислот в AGP, которые придают термостабильность, и способы получения и селекции таких мутаций заявлены в патенте США No.6069300 и опубликованных международных заявках WO 99/58698 и WO 98/22601. Обычно плазмиду, содержащую полинуклеотид, кодирующий субъединицу SH2 AGP кукурузы, подвергали мутагенезу, помещали в мутантные клетки E. coli glg C-, экспрессирующие субъединицу BT2, и клетки выращивали при 42°C, чтобы отобрать мутанты, которые могут продуцировать гликоген при данной температуре. Выделили несколько мутантов, названных термостабильными (HS) мутантами. Готовили неочищенные экстракты указанных мутантов и проверяли термостабильность полученной в результате AGP. Мутанты с единственной аминокислотной заменой сохраняли 8-59% своей активности после инкубации при 60°C в течение пяти минут. Кроме того, общая ферментативная активность мутантной AGP эндосперма кукурузы перед тепловой обработкой была повышена примерно в два-три раза у нескольких мутантов.
В пределах одной субъединицы легко можно комбинировать множественные мутации, придающие термостабильность. Например, можно использовать различные уникальные сайты рестрикции, которые делят кодирующие области Sh2 на три отдельных фрагмента. В том случае, когда это целесообразно, комбинации мутаций можно создать путем субклонирования соответствующего фрагмента, содержащего добавленную мутацию. Если две мутации находятся в тесной близости, то можно использовать сайт-специфичный мутагенез, чтобы сконструировать такие комбинации. Один из способов получения сайт-специфичных мутаций заключается в ПЦР, использовании мутагенного праймера и использовании эндонуклеазы рестрикции DpnI. Можно сконструировать праймеры так, чтобы они содержали мутацию на 5'-конце, и использовать их для ПЦР-амплификации с применением корректирующей полимеразы Vent. Затем амплифицированную ДНК можно расщепить DpnI. Родительская ДНК, выделенная из E. coli, метилирована и поэтому чувствительна к DpnI. Расщепленную ДНК фракционируют по размеру с помощью гель-электрофореза, лигируют и клонируют в экспрессирующих векторах. Мутации подтверждают анализом последовательности и трансформируют штамм AC70R1-504, несущий малую субъединицу дикого типа. Затем можно провести анализ комбинированных мутантов.
Данное изобретение также относится к мутантным полипептидам, кодируемым данными полинуклеотидами, имеющим аминокислотные замены, указанные в данном описании. В предпочтительном варианте мутантные полипептиды являются полипептидами кукурузы.
Данное изобретение также относится к термостабильным мутантам AGP согласно данному изобретению в комбинации с термостабильными мутациями в малой субъединице фермента. Мутации в малой субъединице AGP, которые придают термостабильность ферменту, также легко можно получить и идентифицировать с использованием способов, описанных в патенте США No.6069300 и опубликованных международных заявках WO 99/58698 и WO 98/22601. Термостабильные мутанты малой субъединицы можно экспрессировать совместно с мутантами согласно данному изобретению, чтобы дополнительно повысить стабильность фермента AGP.
Растения и ткани растений, полученные при селекции так, чтобы они содержали мутантные полинуклеотиды согласно изобретению, или трансформированные указанными полинуклеотидами и экспрессирующие полипептиды, кодируемые полинуклеотидами, также являются целью данного изобретения. Растения и ткани растений, экспрессирующие мутантные полинуклеотиды, дают ткани, в которых, например, происходит меньшая индуцированная нагреванием потеря массы или урожайности в том случае, когда они подвергаются тепловому стрессу во время развития. В рамках данного изобретения растения включают в себя однодольные растения, такие как рис, пшеница, ячмень, овес, сорго, кукуруза, лилейные и просо, и двудольные растения, такие как горох, люцерна, нут, цикорий, клевер, кормовая капуста, чечевица, луговые травы, соя, табак, картофель, батат, редис, капуста, рапс, яблоня и салат-латук. В особенно предпочтительном варианте растение является злаковой культурой. Злаковые культуры, к которым применимо данное изобретение, включают в себя, например, кукурузу, пшеницу, рис, ячмень, овес, рожь и просо.
Данное изобретение также относится к способам получения и идентификации полинуклеотидов и полипептидов, рассматриваемых в объеме данного изобретения. В одном варианте для выделения молекул полинуклеотидов, которые кодируют субъединицы AGP растений, обладающие мутациями, которые могут ослаблять индуцированную теплом потерю при синтезе крахмала у растений, можно использовать мутирование генов с последующей селекцией с использованием бактериальной экспрессирующей системы. Отдельные аминокислотные замены можно комбинировать в одной субъединице, как указано в данном описании.
Данное изобретение, кроме того, относится к растениям и тканям растений, которые содержат полинуклеотид согласно данному изобретению, который кодирует мутантный полипептид согласно изобретению. В предпочтительном варианте растение или растительная ткань имеет мутантный ген AGP согласно изобретению, включенный в их геном. В геном растений также могут быть включены другие аллели, которые придают полезный фенотип. В предпочтительном варианте растение является злаковым растением. Более предпочтительно растение является Zea mays. Растения, имеющие мутантный ген AGP, можно выращивать из семян, которые содержат мутантный ген в своем геноме. Кроме того, в данной области известны способы трансформации растений геном, такие как инфекция Agrobacterium, высокоскоростные баллистические способы (biolistic methods) и т.д.
Вследствие вырожденности генетического кода множество разных полинуклеотидных последовательностей может кодировать каждый из приведенных в данном описании вариантов полипептида AGP. Кроме того, специалист в данной области легко может создать альтернативные полинуклеотидные последовательности, кодирующие такие же или по существу такие же полипептиды согласно данному изобретению. Указанные вариантные или альтернативные полинуклеотидные последовательности входят в объем данного изобретения. В используемом в данном описании смысле указание "по существу такая же" последовательность относится к последовательностям, которые кодируют аминокислотные замены, делеции, присоединения или инсерции, которые по существу не изменяют функциональную активность полипептида, кодируемого мутантным полинуклеотидом AGP, приведенным в данном описании.
В используемом в данном описании смысле термины "нуклеиновая кислота" и "полинуклеотидная последовательность" относятся к дезоксирибонуклеотидному или рибонуклеотидному полимеру либо в однонитевой, либо в двунитевой форме, и если не оговорено особо, может охватывать известные аналоги природных нуклеотидов, которые могут функционировать подобно нуклеотидам природного происхождения. Полинуклеотидные последовательности включают в себя как последовательность нити ДНК, которая транскрибируется в РНК, так и последовательность РНК, которая транслируется в белок. Полинуклеотидные последовательности включают в себя как полноразмерные последовательности, так и более короткие последовательности, полученные из полноразмерных последовательностей. Понятно, что конкретная полинуклеотидная последовательность включает в себя вырожденные кодоны нативной последовательности или последовательности, которые могут быть введены для того, чтобы обеспечить предпочтительное использование кодонов в конкретной клетке-хозяине. Аллельные варианты приведенных в качестве примеров последовательностей также входят в объем данного изобретения. Полинуклеотидные последовательности, попадающие в объем данного изобретения, кроме того, включают в себя последовательности, которые специфично гибридизуются с приведенными в качестве примера последовательностями. Полинуклеотид включает в себя как смысловые, так и антисмысловые нити либо в виде отдельных нитей, либо в виде дуплекса.
В рамках данного изобретения также рассматриваются замены аминокислот, отличные от замен, которые приведены в качестве конкретных примеров у мутантов, описанных в данной заявке. Аминокислоты можно отнести к следующим классам: неполярные, незаряженные полярные, основные и кислые. Консервативные замены, при которых в мутантном полипептиде AGP, имеющем аминокислоту одного класса, проводят замену другой аминокислотой того же класса, входят в объем данного изобретения при условии, что мутантный полипептид AGP, имеющий замену, еще сохраняет повышенную термостабильность по сравнению с полипептидом дикого типа. В таблице 2 ниже представлен список примеров аминокислот, относящихся к каждому классу.
| Таблица 2 | |
| Класс аминокислот | Примеры аминокислот |
| Неполярные | Ala, Val, Leu, Ile, Pro, Met, Phe, Trp |
| Незаряженные полярные | Gly, Ser, Thr, Cys, Tyr, Asn, Gln |
| Кислые | Asp, Glu |
| Основные | Lys, Arg, His |
Например, замена тирозина в положении 333 в мутантах HS33, HS 7+3, HS 6+3 и HS 7+6+3 другой аминокислотой, такой как глицин, серин, треонин, цистеин, аспарагин и глутамин, входит в объем изобретения. В частности, в объем данного изобретения также включена замена либо фенилаланином, либо метионином в положении 333 в большой субъединице AGP. Таким образом, комбинация фенилаланина или метионина в положении 333 либо с валином в положении 177, либо с валином в положении 396, либо с обоими специально включена в данное изобретение. Подобным образом, замена валина в положениях 177 и 396 в мутантах RTS48-2, RTS 60-1, HS 7+3, HS 6+3, HS 7+6 и HS 7+6+3 другой аминокислотой, такой как лейцин, изолейцин, пролин, метионин, фенилаланин и триптофан, входит в объем данного изобретения. Аминокислотные замены в других положениях, отличных от сайта термостабильной мутации, также входят в объем изобретения при условии, что полипептид сохраняет или приобретает повышенную термостабильность по сравнению с полипептидом дикого типа.
Полинуклеотиды и белки согласно данному изобретению также можно описать в отношении более конкретных пределов идентичности и/или сходства с полинуклеотидами и белками, приведенными в данном описании в качестве примеров. Идентичность последовательностей обычно будет составлять более 60%, предпочтительно более 75%, более предпочтительно более 80%, еще более предпочтительно более 90% и может быть более 95%. Идентичность и/или сходство последовательности может составлять 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% при сравнении с последовательностью, приведенной в данном описании в качестве примера. Если не оговорено особо, в используемом в данном описании смысле процент идентичности и/или сходства двух последовательностей можно определить с использованием алгоритма Karlin и Altschul (Karlin and Altschul [1990] Proc. Natl. Acad. Sci. USA 87: 2264-2268), модифицированного, как в работе Karlin и Altschul (Karlin и Altschul [1993] Proc. Natl. Acad. Sci. USA 90: 5873-5877). Такой алгоритм включен в программы NBLAST и XBLAST Altschul et al. (Altschul et al. [1990] J. Mol. Biol. 215: 402-410). Поиски на основе BLAST можно осуществить с помощью программы NBLAST, балльная оценка = 100, длина слова = 12, чтобы получить последовательности с требуемой идентичностью последовательностей в процентах. Чтобы получить выравнивания с пробелами в целях сравнения можно использовать BLAST для последовательностей с пробелами, как описано у Altschul et al. (Altschul et al. [1997] Nucl. Acids Res. 25: 3389-3402). При использовании программ BLAST и BLAST для последовательностей с пробелами можно использовать параметры по умолчанию для соответствующих программ (NBLAST и XBLAST). Смотри веб-сайт NCBI/NIH.
Данное изобретение также относится к полинуклеотидам, которые кодируют фрагменты полноразмерного мутантного полипептида, при условии, что указанные фрагменты сохраняют по существу такую же функциональную активность, как и полноразмерный полипептид. Фрагменты мутантного полипептида AGP, кодируемые указанными полинуклеотидами, также входят в объем данного изобретения. Фрагменты полноразмерной последовательности можно получить с использованием стандартных способов, известных в данной области.
Данное изобретение также охватывает полинуклеотидные молекулы, кодирующие ферменты биосинтеза крахмала, имеющие последовательности, которые в достаточной степени гомологичны последовательности дикого типа, с тем чтобы обеспечить гибридизацию с данной последовательностью в условиях стандартной жесткости и стандартными способами (Maniatis, T., E.F.Fritsch, J.Sambrook [1982] Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY). В используемом в данном описании смысле, условия "жесткости" для гибридизации относятся к условиям, при которых обычно осуществляют гибридизацию в течение ночи при температуре на 20-25°C ниже температуры плавления (Tпл.) гибрида ДНК в 6х SSPE, 5x растворе Денхардта, 0,1% SDS, 0,1 мг/мл денатурированной ДНК. Температура плавления описывается следующей формулой (Beltz, G.A., K.A.Jacobs, T.H.Eickbush, P.T.Cherbas, and F.C.Kafatos [1983] Methods of Enzymology, R. Wu, L.Grossman and K.Moldave [eds.] Academic Press, New York 100: 266-285):
Tпл. = 81,5°C + 16,6 log[Na+] + 0,41 (% G+C) - 0,61 (% формамида)-600/длина дуплекса в парах оснований.
Промывки обычно выполняют следующим образом:
(1) Дважды при комнатной температуре в течение 15 минут в 1x SSPE, 0,1% SDS (промывка при низкой жесткости).
(2) Один раз при Tпл. -20°C в течение 15 минут в 0,2x SSPE, 0,1% SDS (промывка при умеренной жесткости).
Молекулы полинуклеотидов согласно данному изобретению можно использовать для трансформации растений, что