Гидроксаматная композиция и способ пенной флотации
Иллюстрации
Показать всеИзобретение относится к гидроксаматной композиции для сбора минералов путем пенной флотации, при этом композиция включает водную смесь гидроксамата, где рН композиции составляет, по меньшей мере, 11, и к способу сбора ценных менералов из водной суспензии руды путем пенной флотации. Позволяет улучшить активность реагента для пенной флотации. Способ включает стадию добавления водной композиции жирного гидроксамата к водной суспензии руды, где рН указанной водной композиции жирного гидроксамата составляет, по меньшей мере, 11, и указанная водная композиция жирного гидроксамата по существу свободна от нерастворимых в воде растворителей, получение пены в присутствии пенообразующего вещества, удаление пены и флотированных ценных минералов. 3 н. и 24 з.п. ф-лы, 6 табл.
Реферат
Настоящее изобретение относится к гидроксаматной композиции и к способу сбора минералов путем пенной флотации с применением гидроксамата.
Предпосылки изобретения
Гидроксамовые кислоты и их соли (здесь далее называемые гидроксаматы) используют для сбора минералов, таких как пирохлор, мусковит, фосфорит, гематит, пиролюзит, родонит, радохрозит, хризоколла, малахит, борнит, кальцит, золото и другие благородные металлы. Гидроксаматы в основном используют для пенной флотации содержащих медь минералов, в частности оксидированных медных минералов.
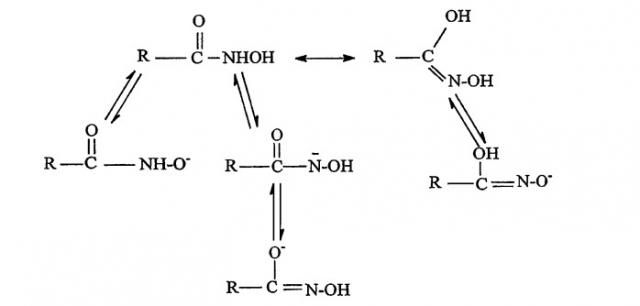
Гидроксаматы, используемые для сбора минералов, обычно содержат гидрокарбильную группу, такую как арильная, алкиларильная или жирная алифатическая группа. Гидроксаматы могут существовать в виде сложного многообразия форм, обусловленных резонансным сопряжением, таких как следующие:
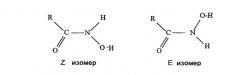
Наличие таких форм и относительные концентрации могут зависеть от растворителя, рН и присутствия других соединений, таких как противо-ионы. Кроме того, при возникновении ограниченного вращения относительно связи C-N возможно также существование дискретных изомеров Z и E
Структура гидроксамовых кислот в растворе и влияние изомерии на осуществление пенной флотации не изучены.
Описаны способы получения гидроксаматов в кислотной форме. Например, Rothenberg в патенте США 6145667 описывает получение гидроксамовых кислот в виде раствора в масле или жирном спирте. Находящаяся одновременно на рассмотрении международная патентная заявка авторов настоящего изобретения РСТ/AU01/00920 описывает получение жирных гидроксаматов в форме твердой соли, такой как соль калия или натрия. Было обнаружено, что использование гидроксамата в органическом растворителе или в кислотной, или в сухой форме значительно снижает активность гидроксамата при пенной флотации. Можно предположить, что такое явление возникает потому, что существенная часть кислоты или соли присутствует в неактивной форме.
Краткое описание изобретения
Было обнаружено, что гидроксамат представлен в форме, при которой существенно улучшена активность для пенной флотации, когда гидроксамат существует в форме водной смеси с рН, по меньшей мере, 11. Таким образом, предлагается гидроксаматная композиция для сбора минералов путем пенной флотации, содержащая водную смесь гидроксамата, где рН композиции составляет, по меньшей мере, 11, предпочтительно находится в пределах от 11 до 13, более предпочтительно от 11,5 до 13, и наиболее предпочтительно от 12,0 до 12,5.
Еще один аспект настоящего изобретения обеспечивает способ сбора ценных минералов из водной руды путем пенной флотации, способ включает стадию смешивания водной суспензии руды с водной гидроксаматной композицией, где рН водной гидроксаматной композиции составляет, по меньшей мере, 11.
Было обнаружено, что гидроксаматная композиция может содержать свободный гидроксиламин, предпочтительно не более 1%, который способен оказывать действие, стабилизирующее флотационный реагент, и сохранять свою эффективность, по меньшей мере, в течение шести месяцев. Согласно предпочтительным вариантам осуществления изобретения обеспечивается гидроксаматная композиция и вышеуказанный способ, где гидроксаматная композиция содержит свободный гидроксиламин, предпочтительно в количестве не более 1 мас.%.
Описание предпочтительных вариантов осуществления
Гидроксаматная композиция по изобретению существует в форме водной щелочной смеси и может представлять собой водный раствор, вязкую суспензию или пасту. Предпочтительно, концентрация гидроксамата находится в пределах от 1 до 60 мас.% от водной смеси, желательно от 5 до 50 мас.%, и, наиболее предпочтительно, от 5 до 30 мас.%.
Предпочтительно гидроксаматная композиция по существу свободна от нерастворимых в воде растворителей, таких как жирные спирты. Композиции могут содержать незначительное количество жирной кислоты в качестве примеси, но предпочтительно их количество составляет менее 5 мас.% гидроксамата и предпочтительно не более 2 мас.%.
Гидроксаматная композиция может содержать незначительное количество, предпочтительно не более 3 мас.%, противопенного средства, такого как метанол или этанол. Такое противопенное средство может быть использовано для снижения пенообразования в ходе получения гидроксамата, как описано в международной патентной заявке РСТ/AU01/00920.
Гидроксамат в композиции по изобретению предпочтительно представляет собой жирный гидроксамат, и характерная жирная часть имеет длину углеродной цепи в пределах от 6 до 14 атомов углерода, предпочтительно от 8 до 12 атомов углерода, и, наиболее предпочтительно, означает С8, С10 или их смесь.
Было обнаружено, что С8-жирная углеродная цепь обеспечивает лучшую флотационную характеристику композиции по изобретению. Реагент, основанный на С6, обладает хорошей водорастворимостью, но меньшей эффективностью. Реагент, основанный на С12, также обладает меньшей эффективностью при пенной флотации, но может быть применен в некоторых случаях.
Подходящие С8/С10-жирные кислоты или их производные для использования в целях получения предпочтительной жирной алкильной части гидроксамата могут быть получены путем фракционирования кокосового и пальмового масла.
Алифатические монокарбоновые кислоты с короткими цепями также могут поставляться нефтеперерабатывающей промышленностью, например 3,5,5-триметилгексановая кислота.
Композиция из жирных гидроксаматов по изобретению имеет рН от 11 до 13, предпочтительно от 11,5 до 13 и, наиболее предпочтительно, от 12,0 до 12,5. При таком рН гидроксамат присутствует в виде соли. Предпочтительно присутствующий в соли противоион выбирают из щелочных металлов, в особенности из натрия, калия или смеси натрия и калия. Калий является наиболее предпочтительным противоионом.
Предпочтительно противоион присутствует в избытке. Указанный противоион может быть, например, обеспечен путем добавления основания щелочного металла, такого как гидроксид калия, гидроксид натрия или их смесь.
Предполагается, что высокое значение рН (в особенности, когда гидроксамат представляет собой калиевую соль (с6-С12-жирного алкилгидроксамата) способствует образованию более активной формы гидроксамата. Предполагается, что более активной формой является цис-енольная форма гидроксаматаниона, которая может быть представлена формулой:
где М является ионом металла, такого как натрий или калий, и R представляет собой гидрокарбил, в частности С6-С14-жирный алкил. Водная суспензия жирного гидроксамата щелочного металла с рН от 11,5 до 13 более активна, чем твердый жирный гидроксамат. По-видимому, когда гидроксамат щелочного металла упаривают почти досуха, указанный гидроксамат образует агрегат с гидроксамовой кислотой, что приводит к содержанию щелочного металла, составляющему почти половину от ожидаемого значения. Возможно, что высушенный или концентрированный до пасты продукт образует агрегат формулы
Активность в пенной флотации такой твердой соли может обычно быть восстановлена путем добавления гидроксида щелочного металла, обеспечивающего рН 11,5 и, предпочтительно, 12-12,5.
Композиция по изобретению может быть использована для пенной флотации оксидов или карбонатов металлов, таких как касситерит, куприт, хризоколла, церуссит, смитсонит, атакамит, малахит, вольфрамит и шеелит.
Композиция по изобретению может быть использована с другими собирателями минералов, такими как ксантогенат, органотиофосфаты или тионокарбаматы. Композиция по изобретению может также быть использована для извлечения металлических меди, серебра, золота и металлов платиновой группы путем пенной флотации. При использовании во флотации совместно с сульфидным собирателем синергическое взаимодействие выражается в повышенной скорости извлечения, обусловленной сбором как сульфидных, так и оксидных минералов одновременно.
Композиция по изобретению может также содержать диалкилдитиокарабамат или быть использована вместе с ним. Как описано в находящейся одновременно на рассмотрении австралийской предварительной патентной заявке от 27 мая 2002, было обнаружено, что диалкилдитиокарбаматы повышают эффективность восстановления минералов в высокооксидированной руде.
Композиция по изобретению может быть сформулирована в виде концентрированной суспензии, такой как паста для транспортировки. Указанная паста может содержать от 30 до 50 мас.% гидроксамата щелочного металла и от 50 до 70 мас.% воды и, необязательно, другие компоненты. Такой концентрат может быть использован в пенной флотации, но указанный концентрат может также быть разбавлен пред применением путем добавления, например, разбавленной щелочи, такой как гидроксид щелочного металла (например, 0,5% KOH). Предпочтительно, чтобы гидроксаматная суспензия была разбавлена до по существу растворенного гидроксамата, необязательно, при слабом нагревании (например, от 30 до 50°С). Разбавленная композиция для добавления во флотационную камеру может содержать от 1 до 30 мас.%, предпочтительно от 1 до 15 мас.%, гидроксамата щелочного металла. Предпочтительно, гидроксамат перед добавлением во флотационную камеру разбавляют гидроксидами щелочных металлов и перемешивают, желательно в течение 15-30 минут. Предпочтительно получать свежий раствор гидроксамата в соединениях щелочного металла каждый день, если гидроксамат транспортируется в виде водной пасты или в твердой форме.
В предпочтительном варианте осуществления изобретение обеспечивает способ пенной флотации минералов из руды, включающий:
(i) получение водной суспензии руды;
(ii) необязательное доведение рН суспензии до требуемой величины;
(iii) добавление к суспензии вышеуказанной водной композиции жирного гидроксамата с рН, по меньшей мере, 11;
(iv) предпочтительное перемешивание суспензии с целью смешивания и доведения до кондиции жирного гидроксамата и суспензии руды (может быть добавлен сульфидный флотационный реагент, если сульфиды должны быть удалены вместе с оксидированными минералами);
(v) добавление к суспензии пенообразующего вещества;
(vi) перемешивание суспензии с целью получения пены, содержащей флотированные минералы;
(vii) удаление пены и сбор флотированных минералов в присутствии гидроксамата.
Концентрация гидроксамата, по оценке методом анализа в УФ-видимой области, находится обычно в пределах 10-1000 мг на литр, в зависимости от качества и количества руды и представляющих интерес металлов. По отношению к количеству руды количество гидроксаматного реагента обычно находится в пределах от 0,1 до 500 г/т.
Было обнаружено, что эффективность гидроксаматного реагента в извлечении конкретных металлов способом флотации зависит от рН. Извлечение меди и многих других металлов возрастает, когда величина рН флотационного раствора близка или приблизительно равна рКа кислоты Бренстеда, являющейся жирной гидроксамовой кислотой. Рабочие значения рН могут быть выше рКа (са. 9). Извлечение меди с применением гидроксамата значительно возрастает, когда рН суспензии руды составляет, по меньшей мере, около 8,5 и, более предпочтительно, от 8,5 до 13, наиболее предпочтительно от 10 до 13.
Обнаружено также, что гидроксаматная композиция по изобретению является эффективным собирателем при значительно меньшем рН, чем рКа указанной композиции. Например, рассматриваемая композиция извлекает содержащий олово касситерит (SnO2) при оптимальных рН от 4 до 5. В таком случае реагент должен обладать сравнительно низкой растворимостью, однако, согласно структурному анализу, функциональность реагента должна все же быть доступной в реакционноспособной хелатирующей форме. Возможно, что дзета-потенциал содержащего олово минерала (˜4,5) индуцирует большую скорость процесса адсорбции гидроксамата при более низких значениях рН. Поскольку гидроксаматный реагент имеет ограниченную растворимость при рН 4-5, указанный реагент не способен образовывать реакционноспособный агрегат, как происходит при больших рН в случае извлечения меди. Обнаружено, что повышение температуры от 20 до 30°С приводит к значительному усилению процесса извлечения олова, которое может быть отчасти компенсировано путем увеличения С6-содержания гидроксамата. Обычно при повышении температуры повышаются качество и извлекаемость, характеризующие процесс флотации.
Гидроксаматный реагент по изобретению адсорбируется на оксидированной поверхности минерала во флотационной камере очень быстро (за миллисекунды), и композиции по изобретению обеспечивают превосходные характеристики флотации, по-видимому, потому, что реагент присутствует в активной цис-енольной форме.
Наличие непрореагировавшего сложного метилового эфира или гидролизованных продуктов жирных кислот вредят эффективности флотации в части специфичности флотации и выхода. Отмечено, что озон и перекись водорода служат идеальными добавками во флотационную камеру перед добавлением раствора гидроксамата. На практике O3 является наиболее полезным в качестве агента быстрого и сильнодействующего оксиданта, дающего гарантию того, что отдельные фазы минералов будут селективно окислены без утраты каких-либо добавленных к суспензии катионов или анионов.
Гидроксаматная композиция по изобретению может быть получена путем повышения рН гидроксаматов, полученных известным из уровня техники способом. Например, по одному из вариантов осуществления производное жирной кислоты, такое как низший алкиловый (например, метиловый или этиловый) гидроксамат С6-С14-жирной кислоты подвергают взаимодействию с гидроксиламином в водном растворе. Гидроксиламин может быть получен на месте из солей гидроксиламина в присутствии щелочного водного раствора, которым обычно является водный раствор гидроксида щелочного металла.
В предпочтительном варианте осуществления гидроксиламин получают с концентрацией 10-30% мас./об. путем взаимодействия между гидроксидом щелочного металла и сульфатом гидроксиламмония.
Предпочтительно осуществлять взаимодействие в водном растворе и регулировать количество воды таким образом, чтобы обеспечивать концентрацию продукта в пределах от 30 до 50% мас./об. Предпочтительно, чтобы реакционная смесь была по существу свободна от нерастворимых в воде растворителей и поверхностно-активных веществ. Сложный эфир жирной кислоты, реагент, используемый для получения гидроксамата, является несмешиваемым с водой, однако было обнаружено, что указанный реагент взаимодействует с гидроксиламином в водном растворе и в ходе взаимодействия водная фаза и фаза эфира жирной кислоты сливаются, возможно, благодаря эмульгирующим свойствам первоначально образуемого гидроксамата. pH композиции доводят до требуемого значения путем добавления щелочи, такой как гидроксид щелочного металла, обеспечивая рН, предпочтительно, по меньшей мере, 11 и, желательно, 12-12,5.
Было обнаружено, как указано выше, что если жирнокислотный гидроксамат щелочного металла получают в виде сухого твердого вещества, то активность теряется, вероятно, по причине образования неактивной формы. Согласно настоящему изобретению активность может быть обеспечена путем добавления водной щелочи, в частности гидроксида калия или натрия, что обеспечивает водную смесь твердого вещества с рН, по меньшей мере, 11.
Далее настоящее изобретение раскрывается с помощью следующих примеров. Следует понимать, что примеры служат способом иллюстрации изобретения и никоим образом не ограничивают объема изобретения.
Пример
Когда в примерах ссылаются на значение рН, измерение осуществляют, используя комбинированный стеклянный электрод. Используют систему для измерения рН особой марки, ORION, модель 42, с комбинированным стеклянным электродом типа 9107. Также для определения рН могут быть использованы комбинированные стеклянные электроды других марок.
Пример 1
Часть (а)
Данные примеры демонстрируют получение композиции по изобретению, содержащей калийную соль (С8/С10-жирный алкил)гидроксамата, без выделения твердой соли.
Сульфат гидроксиламина подвергают взаимодействию с гидроксидом калия, получая гидроксиламин в виде свободного основания при концентрации 15-16 мас.%. Сульфат калия, образующийся в качестве побочного продукта, удаляют фильтрацией.
Гидроксиламин в виде свободного основания затем добавляют, при непрерывном перемешивании, к метиловому эфиру С8/С10-фракционированных жирных кислот, полученных из кокосового или пальмового масла при поддержании температуры ниже 40-45°С. Используют избыток гидроксиламина в виде свободного основания (приблизительно 1,25 молярный избыток) для доведения взаимодействия до завершения.
Небольшой стехиометрический избыток гидроксида калия добавляют, чтобы получить (С8/С10-жирный) гидроксамат калия в виде 45% мас./об. пасты с рН около 12-12,5.
Часть (b)
Данный раздел демонстрирует получение твердой калиевой соли С8/С10-производных гидроксамата из кокосового масла и применение указанной соли для получения гидроксаматных композиций по изобретению.
Реагент, 7-8% свободный гидроксиламин, получают по методике, аналогичной методике примера 1. Затем указанный реагент сразу же подвергают взаимодействию с триглицеридом кокосового масла (22,5 г, число омыления 279, 0,112 мольный эквивалент глицерида) при 45°С, при перемешивании. После перемешивания в течение 12 часов белую, густую кремообразную массу переносят в резервуар из пирексного стекла и оставляют на воздухе, давая возможность растворителю постепенно испариться досуха. Полученный белый продукт в виде пасты промывают охлажденным метанолом для удаления глицерина и других органических веществ. FTIR-спектр сухого белого порошка (18 г) дает полосу поглощения, аналогичную полосе поглощения калиевой соли С8/С10-производного гидроксамата, полученного по примеру 1 согласно РСТ AU01/00920.
Композиция жирного гидроксамата по изобретению может быть получена путем диспергирования твердого гидроксамата в теплом 1% растворе гидроксида калия и, предпочтительно, при перемешивании в течение, по меньшей мере, 15 минут.
Пример 2
Получение состава
Партию гидроксамата в две (2) тонны получают, используя реактор емкостью 1000 л и следующие стадии:
150 кг воды помещают в стеклянный реактор на 1000 л.
Добавляют 175 кг (NH3OH)2SO4 и начинают перемешивание.
245 кг 49% KOH добавляют в реактор вручную при такой скорости, что температура реакции не превышает 35°С.
Добавление вышеуказанного каустика продолжают в течение периода 6-8 часов.
Суспензию гидроксиламина выгружают из реактора через расположенный на дне клапан.
Раствор гидроксиламина отделяют от суспензии K2SO4, используя рукав фильтра при отсасывании.
Путем фильтрования извлекают раствор NH2OH массой 317,6 кг, в котором измеренное содержание NH2OH составляет 15,75%.
Полученный раствор NH2OH в виде свободного основания, упомянутый выше, возвращают в реактор емкостью 1000 л для начала взаимодействия по получению гидроксамата.
К раствору гидроксиламина добавляют 203 кг сложного метилового эфира.
74 кг 92% KOH в виде хлопьев постепенно вводят в реактор с целью регулирования температуры реактора.
При введении 50% едкого кали в реакторе начинает накапливаться белый пенистый продукт.
Температура реактора после добавления 50% каустика повышается приблизительно до 42°С.
После завершения добавления 2/3 KOH температура еще повышается до 48°С.
После добавления оставшегося KOH за период 7 часов устанавливается температура реактора 50°С.
Гидроксамат в виде ярко-белого пенистого продукта почти полностью занимает пространство реактора.
Пример 2а
Данный пример демонстрирует влияние (а) рН водного раствора жирноалкильного гидроксамата калия и (b) рН флотационной камеры при извлечении меди.
Медная руда
Медную руду для флотационной камеры получают из рудного состава, приведенного в следующей таблице 1:
| Таблица 1 | |
| Исходное сырье и содержание металла | |
| Оксидированная Cu-руда | Cu 0,8% |
| (North Parkes, NSW) | Au 0,9 ч/млн. |
Образцы исходного минерального сырья массой в 1 кг измельчают на 80% до размера менее 75 мкм и осуществляют стандартные способы флотации в лабораторной флотационной камере на 2 литра.
Жирный гидроксамат
Жирный гидроксамат получают по способу примера 2 после доведения рН до величины, указанной в таблице 2.
Пять образцов гидроксамата получают и растворяют в теплой воде, и, если необходимо, рН доводят до требуемой величины путем добавления водного KOH.
Флотационную камеру подготавливают, суспендируя измельченную руду и доводя рН флотационной камеры до требуемой величины с помощью водного KOH.
Приведенные ниже в таблице испытания проводят, используя метилизобутилкарбинол в качестве флотационного средства (до 10 г/тонна). Состав пенного концентрата в зависимости от условий рН и дозировка гидроксамата также приведены в таблице.
| Таблица 2 - Результаты флотации с применением жирной оксидированной медной руды от North Parkes Mine, NSW. | |||||||
| Испытание № | рН флотационной камеры | рН композиции гидроксамата | Общее количество гидроксамата (г соли гидроксамата на тонну руды) | Содержание Cu в продукте флотации | Извлечение Cu из продукта флотации | Содержание Au в продукте флотации(ч/млн.) | Извлечение Au из продукта флотации(ч/млн.) |
| 1 | 7,5 | 8,5 | 230 | 9,8% | 39,1% | 5,5 | 27,5 |
| 2 | 8,5 | 8,5 | 230 | 12,5% | 49,2% | 7,5 | 33,5 |
| 3 | 9,5 | 10,2 | 150 | 17,4% | 61,0% | 8,5 | 42,5 |
| 4 | 10,1 | 11,1 | 100 | 29,2% | 64,2% | 10,5 | 55,5 |
| 5 | 11,5 | 11,1 | 80 | 37,5% | 65,3% | 12,0 | 60,0 |
Значительное улучшение уровней извлечения и флотации наблюдается, когда гидроксамат добавляют во флотационную камеру в виде водного раствора с рН свыше 11.
Пример 3
Данный пример изучает стабильность при хранении жирного гидроксамата по примеру 1. Обнаружено, что стабильность при хранении композиции гидроксамата по примеру 1 за период свыше четырех месяцев значительно улучшается за счет присутствия приблизительно от 0,3 до 0,6 мас.% гидроксиламина в расчете на массу водной композиции.
Пример 4
Считается, что в композиции на основе жирного алкильного гидроксамата калия по изобретению гидроксамат существует преимущественно в цис-енольном типе геометрической изомерной формы, стабилизированной показанным ниже резонансом.
Исследования методом 13С-ЯМР показывают, что при протонировании реагента, жирного гидроксамата калия, происходит сдвиг углерода карбонильной группы гидроксамата на 2 м.д. в нижнюю область поля (от 172 м.д. до 174 м.д.). Хотя это свидетельствует об отрицательном заряде, локализованном на функциональности гидроксамата, указанный результат не дает доказательств в отношении существующих в смеси структурных изомеров.
Для изучения изомерного структурного равновесия в качестве модельного соединения выбрана суберогидроксамовая кислота. Указанное соединение имеет молекулу дигидроксамовой кислоты, содержащую 8 атомов углерода, и по причине симметрии спектр ЯМР является упрощенным и в то же время усиленным в отношении гидроксаматной группы. Протонный ЯМР соединения, полученный в растворителе ДМСО-d6, четко показывает две изомерных структуры в смеси. Протоны группы -NHOH гидроксамовой кислоты дают строгое доказательство существования двух изомерных форм. При сравнении с литературными данными по протонному ЯМР для ацетогидроксамовой (CH3CONHOH) кислоты очевидно, что сигналы в чрезвычайно низких областях, 10,93 и 10,31 м.д. соответственно, обусловлены протонами N-H цис- и транс-изомера.
| Соотнесение спектральных данных | |
| Протоны | Химический сдвиг (δ м.д.) |
| αα1 | 2,5 (т, JH,H=8 Гц) |
| ββ1 | 2,02 (м) |
| γγ1 | 1,78 (м) |
| цис- N-H | 10,93 (с) |
| транс- N-H | 10,31 (с) |
| цис- О-Н | 9,25 (с) |
| транс- О-Н | 9,60 (с) |
Существуют два сигнала, соответствующие сигналам протонов N-H, при 9,60 и 9,25 м.д., которые, очевидно, относятся к протону -ОН, находящемуся в транс- и цис-геометрической форме. Измерение интенсивности протонов показывает, что соотношение цис:транс равно 9:1.
Пример 5
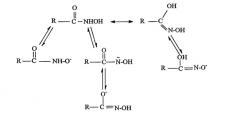
Соли жирного гидроксамата часто представляют как соли гидроксамовой кислоты, получаемые депротонированием под действием сильного основания. Структура соли жирного гидроксамата никогда не была полностью охарактеризована иными современными аналитическими средствами, чем некоторое предполагаемое резонансное представление, приведенное на схеме 1.
Схема 1
Депротонирование участка -ОН ведет к структуре II, которая не может быть резонансно стабилизированной, однако процесс может осуществляться через депротонирование участка NH, которое ведет к структуре IIIa и IIIb. Структура II может быть названа гидроксаматом, тогда как структура IIIb имеет значительную степень сходства со структурой оксима и поэтому может быть определена как гидроксимат. Являются ли структуры II и III взаимообратимыми и оказывают ли какое-нибудь действие на способ связывания с металлом, неизвестно, однако резонансная стабилизация, которая может существовать для IIIa и IIIb, ведущая к образованию гидроксамат-иона, соответствует обычной димерной (доля К 50%) модели, тогда как структура II - нет.
Структуры жирного гидроксамата в композиции по изобретению изучены с помощью инфракрасной спектроскопии с Фурье-преобразованием (FTIR), масс-спектрометрии с электрораспылением (ESMS), термогравиметрического анализа (TGA), метода ядерного магнитного резонанса (ЯМР) и элементного анализа и соотнесены с активностью указанного соединения по результатам поведения в процессе флотации.
Продукт по примеру 1 анализируют с помощью ATR-FTIR, чтобы увидеть наличие функциональных групп в продукте. Важной характеристикой полученного спектра является то, что сигнал карбонильной группы метилового эфира при 1740 см-1 полностью заменен очень интенсивным сигналом при 1626 см-1, сопровождающимся двумя другими характерными сигналами, появляющимися в области 1550 и 3212 см-1. В сравнении со спектром калийной соли гексил-, октил-, децил- и додецилгидроксамата, полученной синтетическим способом с использованием гидроксиламингидрохлорида, гидроксида калия и сложного метилового эфира в безводном метаноле, гидроксаматный продукт дает очень схожие FTIR-данные, суммированные в таблице 3.
| Таблица 3 - Отобранные FTIR-данные для различных алкилгидроксаматов и их сравнение с гидроксаматным реагентом | ||
| Соль гидроксамата в калийной форме | Способ подготовки образца | FTIR-сигналы (см-1) |
| Гексилгидроксамат | в KBr | 3213, 1631, 1552 |
| Октилгидроксамат | в KBr | 3213, 1626, 1555 |
| Децилгидроксамат | в KBr | 3214, 1626, 1555 |
| Додецилгидроксамат | в KBr | 3212, 1626, 1563 |
| Гидроксаматный реагент (в форме пасты) | Испытание в ATR-FTIR | 3213, 1627, 1554 |
| Гидроксаматный реагент (в форме твердого вещества) | в KBr | 3215, 1623, 1557 |
За счет регулирования кислотности продукт гидроксамовой кислоты становится менее растворимым в воде, но хорошо растворимым в органической среде, такой как спирт и углеводороды. Продукту соответствуют FTIR-сигнальные характеристики (в твердом состоянии), в которых обнаружен интенсивный дополнительный сигнал при 1660 см-1. Сигнал, первоначально проявляющийся при 3213 см-1, теперь сдвинут более чем на 40 см-1 в область более высоких частот. Сопоставление FTIR-данных для соли гидроксамата и соответствующего подкисленного продукта приводится в таблице 4.
| Таблица 4 - Сопоставление FTIR-данных для соли гидроксамата и ее подкисленного продукта | |||||
| Соль гидроксамата и ее подкисленный продукт | Способ подготовки образца | FTIR-сигналы (см-1) | |||
| Гексилгидроксамат | в KBr | 3213, | -, | 1631, | 1552 |
| Подкисленный продукт | в KBr | 3258, | 1665, | 1629, | 1565 |
| Октилгидроксамат | в KBr | 3213, | -, | 1626, | 1555 |
| Подкисленный продукт | в KBr | 3260, | 1665, | 1626, | 1566 |
| Децилгидроксамат | в KBr | 3214, | -, | 1626, | 1555 |
| Подкисленный продукт | в KBr | 3258, | 1664, | 1623, | 1567 |
| Додецилгидроксамат | в KBr | 3215, | -, | 1623, | 1557 |
| Подкисленный продукт | в KBr | 3257, | 1664, | 1623, | 1567 |
| Гидроксаматный реагент | Испытание в ATR-FTIR | 3213, | -, | 1627, | 1554 |
| Подкисленный продукт | ATR-FTIR | 3258, | 1662, | 1620, | 1567 |
FTIR-спектральные характеристики показывают, что продукт фактически распределен между двумя изомерными формами, а именно кето- и енольной формами, и их соотношение в значительной степени зависит от длины углеродной цепи, рН среды, а также дзета-потенциала частиц минералов. Кетоформа в основном представлена несопряженной жирной гидроксамовой кислотой, в которой карбонильная группа поглощает при более высокой частоте (1660 см-1), чем в енольном изомере, как представлено на схеме 2.
Схема 2
Жирная гидроксамовая кислота может также принимать сопряженную енольную форму за счет делокализации электрона неподеленной пары азота благодаря карбонильной π-связи, что вызывает сдвиг поглощения карбонила в более низкую энергетическую область (1626 см-1). Кроме того, в енольной форме указанная кислота может существовать как в цис-, так и в транс-геометрических изомерах. В кетоформе гидроксамовой кислоты связь группы -ОН с азотом проявляется в более высокочастотной области (3258 см-1). Повышение сопряженности системы приводит к сдвигу частоты колебания -ОН в сторону меньшей энергии, как это обнаружено в спектре соли гидроксамата или гидроксамата (3215 см-1), в связи с вероятностью образования внутримолекулярной Н-связи по причине преимущественного образования цис-изомера. Подобное электронное распределение может вызывать расширение пика N-H на область в пределах 1550-1565 см-1.
В композиции по примеру 1 енольная форма доминирует, потому что отщепление протона под действием KOH уже присутствует в композиции. Следовательно, FTIR служит доказательством обоснованности представления относительно преимущественного существования соли гидроксамата в енольной форме в композиции по изобретению. Другими словами, соль гидроксамата структурно более схожа с гидроксиматом, чем гидроксаматом, как предположительно представлено на схеме 1.
Анализ ЯМР продукта по примеру 1 дает структурную информацию, которая большей частью подтверждает FTIR-исследования. FTIR дает информацию об основной функциональной группе, тогда как ЯМР исследует структуру молекулы в целом, включая углеродный каркас. Спектр ЯМР снимают в жидкой фазе, предпочтительно в среде протонного растворителя, моделируя практическое использование растворителя применительно к флотации. Обнаружено, что система растворителей, состоящая из смеси D2O/CD3OD, является удачно подобранной комбинацией для получения данных в отношении протонного и углеродного ЯМР жирнокислотного гидроксамата калия.
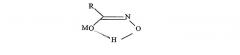
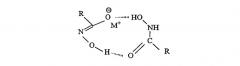
Сравнение протонного и углеродного ЯМР-спектра со спектром модельного октилгидроксамата выявляет очень сходные характеристики, представленные протонным и углеродным химическими сдвигами. В протонном ЯМР отчетливо просматриваются 4 группы сигналов, проявляющихся в области 2,79, 2,33, 2,0 и 1,63 м.д. как триплет, квинтет, уширенный мультиплет с последующим вторым триплетом, принадлежащих протонам линейной жирной углеродной цепи. Сигнал триплета, центрированный при 2,79 м.д., относится к сигналу α-протона, смежного с карбонильной группой. Когда рН ЯМР-раствора понижают, переводя из щелочной области к кислотную, протонный сигнал при 2,79 м.д. сдвигается до 0,2 м.д. в область слабого поля. В углеродном спектре такая кислотная обработка вызывает сдвиг углеродного сигнала карбонила от 172 к 174 м.д., что соответствует сдвигу на 2 м.д. в сторону слабого поля. Такая особенность спектра ЯМР указывает на гидроксамат, имеющий отрицательно заряженную форму, возможно, гидроксаматную форму. Хотя спектр ЯМР снимают в протонной среде либо в кислотных, либо в щелочных условиях, в смеси, по-видимому, всегда существует один доминирующий изомер. В свете литературных данных по ЯМР, анализу рентгеновской кристаллической структуры и молекулярных орбитальных расчетов в отношении анализа молекулы низшей гидроксамовой кислоты, можно предположить, что гидроксамат в протонном растворителе имеет гидроксаматный тип структуры с преобладанием цис-изомера, который является энергетически устойчивым за счет образования водородной связи с молекулой воды, как показано на фигуре 1.
Фигура 1: Гидроксамат в гидратированной форме
Анализ методом масс-спектроскопии с электрораспылением гидроксамата и родственной алкилгидроксаматной соли, осуществляемый в отрицательной моде, дает интенсивный пик отрицательного иона, который соответствует пику масс-спектра (m/z) иона [RCONOH]-.
В таблице 5 приведен характерный пик масс-спектра, четко свидетельствующий о том, что гидроксамат в виде соли энергетически устойчив и характеризуется двумя интенсивными сигналами масс-спектра при 158 и 186, что хорошо соответствует композициям, составленным из структур С8- и С10-гидроксаматов. Пики масс-спектра образца гидроксамата дополнительно проверяют, исследуя чистые соли С8- и С10- гидроксаматов тем же самым способом.
| Таблица 5 - Получаемая в условиях электрораспыления масс-спектральная характеристика солей гидроксамата и гидроксаматного реагента, снятая для моды отрицательного иона. | ||
| Гидроксамат/соль гидроксамата | Преобладающий пик(m/z) | Соответствие массе |
| С8/С10-гидроксамат | 158 | [C7H15CONOH]- (C8) |
| 186 | [C9H19CONOH]- (C10) | |
| Октилгидроксамат | 158 | [C7H15CONOH]- |
| Децилгидроксамат | 186 | [C9H19CONOH]- |
Согласно приведенным спектроскопическим данным гидроксамат в композиции частично существует в форме енолята или гидроксаматной структуры и, как таковой, имеет сходство с промежуточным соединением, постулированным для перегруппировки Гофмана. По перегруппировке Гофмана происходит превращение амида в амин с числом углерода, меньшим на единицу, через образование изоцианата и последующего гидролиза указанного изоцианата. При нагревании свыше 120°С гидроксаматный продукт подвергается быстрому разложению. Это показано с помощью методов термогравиметрического анализа (TGA) и дифференциальной сканирующей калориметрии (DSC). Анализ продукта разложения посредством масс-спектроскопии показывает, что указанный продукт является смесью аминов, в основном, композицией гептила и нонила. Подобную термическую фрагментацию также демонстрирует соль октил- и децил- гидроксамата, и полученные результаты служат строгим доказательством того, что гидроксамат обладает в некоторой степени структурным сходством с промежуточным продуктом Гофмана, как иллюстрируется схемой 3.
Когда гидроксаматный продукт затвердевает при медленном выпаривании влаги, указанный продукт обладает значительным сродством к образованию агре