Термоплавкая ттс для применения ротиготина
Иллюстрации
Показать всеТрансдермальная терапевтическая система включает клеевую матрицу, содержащую биологически активное вещество - ротиготин. Клеевая матрица содержит термоплавкий контактный клей. Термоплавкий контактный клей состоит из контактного клея, смеси разных контактных клеев или контактного клея с пластификатором и при 160°С обладает динамической вязкостью не более 100 Па·с. ТТС получена способом горячего плавления, при котором перед наслаиванием клеевой матрицы ее компоненты плавят и гомогенизируют без использования растворителей при температуре от 70 до 200°С. ТТС по изобретению имеет высокую степень наполнения ротиготином, который высвобождается из термоплавких матриц постоянно и с терапевтически желательной скоростью. Ротиготин при реализации способа горячего плавления сохраняет свою стабильность при нагревании до 160°С. Отсутствует необходимость в использовании, удалении, регенерации или дожигании органических растворителей и обеспечении соответствующих мер безопасности при производстве ТТС. 4 н. и 20 з.п. ф-лы, 10 ил., 5 табл.
Реферат
Изобретение касается трансдермальной терапевтической системы (ТТС), включающей содержащую ротиготин клеевую матрицу, отличающейся тем, что клеевая матрица содержит термоплавкий контактный клей, в котором диспергировано, частично или полностью растворено биологически активное вещество ротиготин [(-)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил)амино]-1-нафтол].
Кроме того, изобретение касается способа получения ТТС с клеевой матрицей, содержащей в качестве биологически активного вещества ротиготин, отличающегося тем, что перед нанесением или наслаиванием компоненты клеевой матрицы подвергают плавлению и гомогенизации без использования растворителей при температуре от 70 до 200°С, предпочтительно от 120 до 160°С.
Наконец, изобретение касается применения ротиготина для получения клеевой матрицы ТТС способом горячего плавления.
Из уровня техники известны различные ТТС для применения ротиготина.
В WO 94-07468 описана система, двухфазная матрица которой содержит соль биологически активного вещества. Двухфазная матрица состоит из гидрофобного полимера с диспергированным в нем силикатом для поглощения гидрофильной соли лекарственного вещества, причем дополнительно используют органические растворители. Матрицу получают путем сушки дисперсии при 70°С. Содержание ротиготина в матрице составляет 2-5 мас.%.
Однако описанная система страдает рядом недостатков.
(1) Ее получение многостадийно и трудоемко. Соль биологически активного вещества должна быть растворена в воде или содержащей воду смеси растворителей, затем смешана с силикатом, после чего смешана с эмульгатором, чтобы на заключительной стадии эмульгировать водный раствор и растворенный в органическом растворителе (обычно, гептане, этилацетате или толуоле) полимер, например, в силиконовом клее. Обращение с полученной эмульсией затруднительно.
(2) Используются органические растворители, которые при получении ТТС подлежат полному удалению, чтобы обеспечить достаточную стабильность системы при хранении и воспроизводимость высвобождения биологически активного вещества, а также предотвратить раздражение кожи. Это приводит к увеличению издержек производства. До стадии получения содержащей биологически активное вещество клеевой массы процесс осуществляют периодическим способом.
(3) При обращении с органическими растворителями следует соблюдать особые меры предосторожности, чтобы предотвратить вредное воздействие растворителей на окружающую среду и занятый в производстве ТТС персонал. Приобретение оборудования для регенерации и выделения растворителей и реализация мероприятий по защите персонала и устранению отходов растворителей требуют значительных расходов.
(4) Стерень наполнения клеевой матрицы биологически активным веществом ограничена растворимостью ротиготина в используемой системе растворителей. Кроме того, при удалении растворителей в процессе получения матрицы происходит концентрирование биологически активного вещества, что может сопровождаться пересыщением матрицы и нежелательной кристаллизацией биологически активного вещества. Таким образом, максимальное количество биологически активного вещества, которое может быть введено в клеевую матрицу, ограничено. Низкое наполнение матрицы, в свою очередь, служит причиной снижения количества высвобождаемого в единицу времени биологически активного вещества и/или уменьшения жизнеспособности матрицы, обусловленного преждевременным высвобождением биологически активного вещества.
(5) Чтобы в процессе сушки клеевой матрицы обеспечить полное удаление используемых для ее получения растворителей, максимальная толщина матрицы на стадии ее получения ограничена 100 мкм (что примерно соответствует ее массе 100 г/м2). Клеевую матрицу толщиной более 100 мкм можно получить лишь в несколько технологических ступеней. А это связано с увеличением трудоемкости и производственных затрат.
(6) Остающийся в пластыре силикат или диоксид кремния играет роль барьера, препятствующего диффузии биологически активного вещества и способного отрицательно повлиять на его высвобождение. Кроме того, указанные компоненты оказывают воздействие на влагопоглощение пластыря. Порообразование на граничащей с кожей поверхности клеевой матрицы, обусловленное вымыванием водорастворимых компонентов, может привести к плохо контролируемому высвобождению биологически активного вещества.
В WO 99/49852 описана ТТС с ротиготином в виде свободного основания, содержащая контактный клей на акрилатной или силиконовой основе. Для создания клеев того и другого типа тоже используют растворители, подлежащие удалению в процессе изготовления ТТС, что также связано с указанными в пунктах (2)-(5) недостатками и ограничениями.
Кроме того, обе описанные в WO 99/49852 клеевые матрицы обладают следующими недостатками, касающимися их наполнения ротиготином и его высвобождения.
Силиконовые матрицы. Степень наполнения силиконовой клеевой матрицы ротиготином, которая может быть достигнута при использовании содержащей это биологически активное вещество эмульсии или раствора, не превышает 15 мас.%. Таким образом, наполнение силиконовых матриц биологически активным веществом ограничено определенным пределом. Повысить наполнение матрицы ротиготином, например, с целью получения пластырей многодневного действия можно только путем нанесения дополнительных клеевых слоев, однако, это требует выполнения нескольких технологических операций, что обусловливает повышение трудоемкости и удорожание производства ТТС.
Акрилатные матрицы. Степень наполнения акрилатной клеевой матрицы ротиготином при его нанесении из растворителя может достигать 40 мас.%. Хотя акрилатная матрица и способна поглотить большее количество ротиготина, чем силиконовая, однако применение акрилатных матриц с более высоким наполнением ограничено уменьшением их способности транспортировать ротиготин к коже по сравнению с силиконовыми системами, что обусловлено неблагоприятными значениями коэффициента распределения биологически активного вещества в акрилатной матрице. С одной стороны, чтобы обеспечить достаточно высокий уровень высвобождаемого из акрилатных систем ротиготина в плазме, требуются очень высокие степени наполнения клеевой матрицы. Но, с другой стороны, после применения такого пластыря в нем сохранятся относительно большие количества невостребованного биологически активного вещества, что приводит к увеличению производственной себестоимости таких систем и нежелательно с точки зрения надежности применения лекарственных средств.
Цель настоящего изобретения состояла в создании содержащей ротиготин ТТС, позволяющей исключить недостатки и ограничения, обусловленные использованием растворителей. В частности, должна быть обеспечена возможность получения ТТС с содержанием ротиготина, варьируемым в максимально широких пределах, включая ТТС с высокими степенями наполнения, а также возможность высвобождения ротиготина в терапевтически эффективных количествах.
Указанные выше проблемы решены благодаря впервые созданной ТТС, включающей содержащую ротиготин клеевую матрицу, отличающейся тем, что клеевая матрица получена способом горячего плавления и, соответственно, содержит термоплавкий контактный клей, в котором диспергировано, частично или полностью растворено биологически активное вещество ротиготин [(-)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил)амино]-1-нафтол].
Чертежи
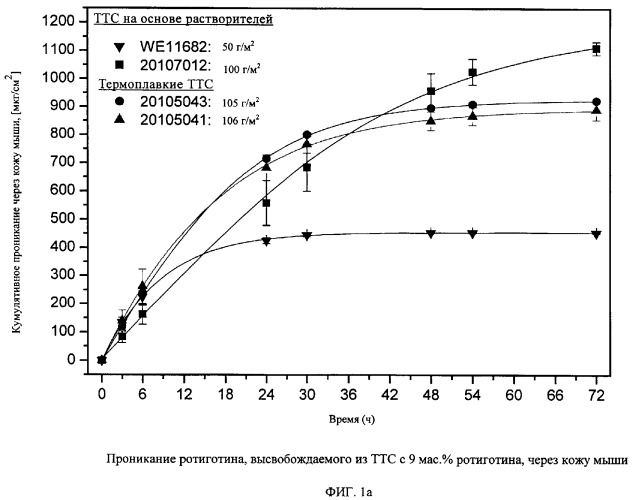
На фиг.1а и 1б сравнивается проникание ротиготина через кожу мыши из термоплавкой силиконовой ТТС и силиконовой ТТС на основе растворителей. На фиг.1а показано высвобождение ротиготина из ТТС с содержанием ротиготина 9 мас.%. На фиг.1б показано влияние повышения степени наполнения термоплавкой ТТС ротиготином на его проникание через кожу мыши.
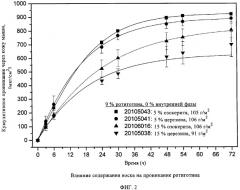
На фиг.2 показано влияние содержания воска на проникание ротиготина через кожу мыши из термоплавкой ТТС на силиконовой основе при постоянном наполнении ротиготином, составляющим 9 мас.%.
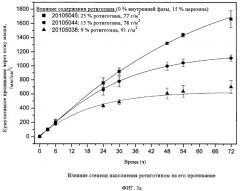
На фиг.3а и 3б показано влияние степени наполнения ротиготином на его проникание через кожу мыши из термоплавкой ТТС на силиконовой основе, содержащей 15% (фиг.3а) и 5% (фиг.3б) воска.
На фиг.4 показано влияние массы клеевой матрицы на проникание ротиготина через кожу мыши из термоплавкой ТТС на силиконовой основе.
На фиг.5а и 5б показано влияние содержания поливинилпирролидона (ПВП) в качестве внутрифазного компонента на кумулятивное (фиг.5а) и линейное (фиг.5б) проникание ротиготина через кожу мыши из термоплавкой ТТС. На фиг 5в показано влияние содержания полиэтиленоксида (ПЭО) на кумулятивное проникание ротиготина через кожу человека из термоплавкой ТТС на силиконовой основе.
На фиг.6а показано наблюдаемое в течение 72 часов кумулятивное проникание ротиготина через кожу человека из термоплавкой ТТС на силиконовой основе по сравнению с силиконовой ТТС на основе растворителей. На фиг.6б показано наблюдаемое в течение 7 дней кумулятивное проникание ротиготина через кожу человека из термоплавкой ТТС на силиконовой основе. На фиг.6в показано наблюдаемое в течение 7 дней кумулятивное проникание ротиготина через кожу человека из термоплавких ТТС на силиконовой основе, содержащих, соответственно, 5% озокерита и 5% церезина.
На фиг.7 показано кумулятивное проникание ротиготина через кожу мыши из термоплавких ТТС с варьируемыми контактными клеями.
На фиг.8 показано кумулятивное проникание ротиготина через кожу мыши из полученных в экструдере термоплавких ТТС на силиконовой основе с разными внутрифазными компонентами и содержанием ротиготина 9%.
На фиг.9 показано кумулятивное проникание ротиготина через кожу мыши из полученных в экструдере термоплавких ТТС на основе сополимера этилена с винилацетатом (ЭВА) с разным содержанием ротиготина. На фиг.9а показано кумулятивное проникание ротиготина через кожу человека из термоплавкой ТТС на основе ЭВА по сравнению с силиконовой ТТС на основе растворителей.
На фиг.10 показан пример структуры ТТС с содержащей биологически активное вещество клеевой матрицей (1), инертным по отношению к компонентам клеевой матрицы обратным слоем (2) и удаляемой перед применением ТТС защитной пленкой (3).
Описание изобретения
Неожиданно было обнаружено, что ротиготин отлично пригоден для переработки способом горячего плавления, стабилен при кратковременном нагревании до температур, по меньшей мере, не превышающих 160°С, может быть гомогенно распределен в получаемых способом горячего плавления клеевых матрицах и высвобождается из термоплавких матриц постоянно и с терапевтически желательной скоростью.
В частности, авторы изобретения неожиданно обнаружили, что чувствительный к окислению ротиготин при реализации способа горячего плавления сохранял свою стабильность при нагревании даже до 160°С. Несмотря на то, что ротиготин при повышенных температурах в кислородсодержащей атмосфере склонен к окислительной деструкции, пребывая в горячем расплаве клея он проявлял поразительную стабильность, и степень чистоты находящегося в клеевой матрице ротиготина систематически превышала 98%, в общем случае составляя более 99% (измерение методом ВЭЖХ, длины волн 220 и 272 нм; см. таблицы 2, 3 и 4).
Ротиготин вводят в гомогенизированную расплавленную клеевую матрицу предпочтительно в твердом состоянии, и, таким образом, он плавится лишь оказавшись в горячей матрице. После кратковременной гомогенизации содержащую ротиготин матрицу охлаждают, поэтому в общем случае ротиготин подвергается тепловому воздействию в течение периода, составляющего менее 5 минут, предпочтительно менее 4, 3 минут или даже менее 1 минуты. В дальнейшем ротиготин пребывает в составе затвердевшего расплава клеевой матрицы. Во время осуществления этих процессов ротиготин в значительной мере защищен от критических воздействий окружающей среды (света, кислорода).
Способом горячего плавления можно получать ТТС со степенью наполнения ротиготином, превышающей 40 мас.% (в расчете на массу клеевой матрицы).
Итак, ТТС согласно изобретению, получаемые способом горячего плавления, обладают рядом следующих преимуществ по сравнению с известными из уровня техники ТТС, получаемыми с использованием растворителей.
- Поскольку ротиготин можно вводить непосредственно в клеевой расплав, отпадают обусловленные присутствием растворителей проблемы переработки высококонцентрированного биологически активного вещества. Результатом этого является возможность простым способом вводить в состав ТТС значительно большие количества ротиготина (до концентраций, превышающих 40 мас.%) по сравнению с предусматривающим использование растворителей способом получения ТТС на силиконовой основе, который не позволяет ввести более 15 мас.% ротиготина. Благодаря осуществлению единственной технологической операции способом горячего плавления удается ввести поразительно большие количества ротиготина и в состав относительно тонких клеевых матриц.
- Толщину клеевой матрицы можно варьировать в широком диапазоне. Таким образом, путем осуществления единственной технологической операции можно без всяких проблем изготовить клеевые матрицы массой более 100 г/м2 и даже более 200 г/м2. Отсюда следует, что одновременно с более высокими концентрациями ротиготина в ТТС его содержание в клеевой матрице может достигать 8 мг/см2 или даже выше. В отличие от этого способ получения ТТС на силиконовой основе, предусматривающий использование растворителей, не позволяет обеспечить наполнение матрицы ротиготином более 1,5 мг/см.
- Отпадает необходимость в использовании, удалении, регенерации или дожигании органических растворителей и обеспечении соответствующих мер безопасности при производстве ТТС.
- Технология горячего плавления позволят получать клеевую матрицу ТТС непрерывным способом, от взвешивания индивидуальных компонентов до непосредственного наслаивания клея. Такая технология обеспечивает следующие основные преимущества:
- значительное сокращение длительности технологического процесса,
- объем выпускаемых партий ТТС можно устанавливать в соответствии с длительностью эксплуатации производственной установки, что позволяет избежать замены оборудования на более крупное, обычно сопровождаемой проблемами увеличения масштаба производства (scale-up) и/или дополнительными затратами на аттестацию.
- Продукцию в соответствии с гарантированной минимальной ценой (GMP) можно выпускать на компактных установках, которые можно разместить на небольших площадях.
- Благодаря использованию надлежащих пластификаторов, например, восков и/или, при необходимости, осуществляемому введению внутренней фазы может быть обеспечено пролонгированное высвобождение ротиготина из клеевой матрицы. При соответствующем исполнении ТТС это позволяет получать системы, высвобождающие терапевтически эффективные количества ротиготина в течение нескольких, например, 5, 6 или 7 дней.
Таким образом, предметом изобретения является ТТС, включающая содержащую ротиготин клеевую матрицу, отличающаяся тем, что клеевая матрица содержит термоплавкий контактный клей.
Другим предметом изобретения является ТТС, включающая содержащую ротиготин клеевую матрицу, отличающаяся тем, что клеевая матрица содержит термоплавкий контактный клей, в котором диспергировано, частично или полностью растворено биологически активное вещество ротиготин [(-)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил)амино]-1-нафтол].
В одном другом варианте выполнения изобретения термоплавкая клеевая матрица вместо ротиготина содержит предшественника ротиготина, то есть соединение, например, сложный эфир, которое расщепляется или метаболирует в организме пациентов, например, в крови или коже под лиянием эстеразы с образованием терапевтически эффективного количества ротиготина. При этом предшественник предпочтительно должен высвобождать столько ротиготина, чтобы в плазме была создана стационарная терапевтически эффективная концентрация этого вещества. Такой концентрации предпочтительно соответствует интервал от 0,05 до 20 нг, особенно предпочтительно от 0,1 до 10 нг и еще более предпочтительно от 0,2 до 5 нг ротиготина в мл плазмы.
Другим предметом изобретения является ТТС, включающая полученную способом горячего плавления, содержащую ротиготин клеевую матрицу, причем клеевая матрица получена путем введения расплавленного или предпочтительно твердого ротиготина в не содержащий растворителей, нагретый до 70-200°С расплав клеевой матрицы. Ротиготин предпочтительно вводят в не содержащий растворителей, нагретый до 100-170°С, особенно предпочтительно до 120-160°С и еще более предпочтительно до 130-150°С расплав, который подвергают переработке и охлаждению не более чем через 5 минут, предпочтительно не более чем через 3, 2 минуты или особенно предпочтительно не более чем через 1 минуту после введения ротиготина.
При этом под трансдермальной терапевтической системой подразумевается фармацевтический препарат или приспособление, пригодное для трансдермального применения биологически активного вещества в терапевтически эффективном количестве через кожу млекопитающего, в частности, кожу человека.
При этом под способом горячего плавления подразумевается способ, предусматривающий использование тепловой энергии для плавления составных частей клеевой матрицы, в частности, для плавления термоплавкого контактного клея и, при необходимости, вводимой в его состав внутренней фазы, благодаря чему при получении клеевой матрицы можно отказаться от использования растворителей. В настоящей заявке термин "способ горячего плавления" используют и для описания варианта способа, предусматривающего работу при температуре ниже точки плавления ротиготина, то есть когда в расплавленный клей вводят твердый ротиготин.
В настоящей заявке под выражением "без использования растворителей" подразумевают, что для получения клеевой матрицы не используют никаких растворителей, подлежащих последующему удалению во время реализации способа получения ТТС.
Под термоплавким контактным клеем подразумевается контактный клей, обладающий чувствительностью к прижиму при накладывании на кожу и пригодный для переработки способом горячего плавления при температуре от 70 до 200°С, предпочтительно от 100 до 170°С, особенно предпочтительно от 120 до 160°С и еще более предпочтительно от 130 до 150°С. При этом термоплавкий контактный клей может состоять из единственного контактного клея или смеси разных контактных клеев, каждый из которых сам по себе обладает термоплавкостью. В качестве альтернативы термоплавкий контактный клей может также являться смесью контактного клея с надлежащим пластификатором.
Такой термоплавкий контактный клей при 160°С и, в частности, при температуре от 130 до 150°С обладает динамической вязкостью, не превышающей 150 Па·с, предпочтительно не превышающей 120 Па·с, особенно предпочтительно менее 100 Па·с, еще более предпочтительно менее 80 Па·с или даже менее 60 Па·с.
Контактными клеями, которые сами по себе не обладают термоплавкостью, являются, например, рыночные силиконовые клеи. При указанных выше температурах переработки такие силиконовые клеи обладают слишком высокой вязкостью, то есть их динамическая вязкость составляет более 150 Па·с.
В патентной литературе описаны разные способы изменения вязкости силиконовых клеев путем их смешивания с надлежащими добавками (пластификаторами) с целью придания клеям термоплавкости. Примерами таких пластификаторов для силиконовых клеев являются монолаурат глицерина или лаурилацетат (ЕР 835136), воска формулы R-C(O)-OR' (EP 360467), алкилметилсилоксановые воска (ЕР 524775), силоксированные полиэфирные воска (ЕР 663431) или органические воска (US RE36754).
В общем случае пластификаторы вводят в состав силиконового клея в количестве 1-30 мас.% в расчете на общую термоплавкую клеевую смесь. Предпочтительными пластификаторами являются органические воска, например, описанные в US RE 36754, в частности, озокерит, церезин, парафин, канделильский воск, карнаубский воск, пчелиный воск или смеси указанных восков, причем особенно предпочтительными являются озокерит и церезин.
Термоплавкие силиконовые клеи заводского изготовления, в частности, смеси силиконовых контактных клеев с церезином или озокеритом могут быть предоставлены фирмой Dow Corning (Мичиган). Например, благодаря добавлению к силиконовому контактному клею 10 мас.% церезина удается снизить измеренную при температуре переработки 160°C динамическую вязкость с величины, превышающей 150 Па·с (исходный клей), до величины, составляющей менее 50 Па·с (смесь силиконового контактного клея с церезином). Такая смесь хорошо перерабатывается способом горячего плавления в температурном интервале от 100 до 200°С, в частности, от 120 до 160°С.
Неожиданно было обнаружено, что термоплавкий силиконовый контактный клей отлично пригоден для трансдермального применения ротиготина.
Таким образом, предметом настоящего изобретения является ТТС, включающая содержащую ротиготин клеевую матрицу, отличающаяся тем, что клеевая матрица содержит термоплавкий контактный клей, в котором диспергировано биологически активное вещество ротиготин [(-)-5,6,7,8-тетрагидро-6-[пропил[2-(2-тиенил)этил)амино]-1-нафтол], причем термоплавкий контактный клей содержит надлежащую смесь силиконового контактного клея, по меньшей мере, с одним пластификатором.
Другим предметом изобретения является ТТС, включающая клеевую матрицу, которая содержит
(а) 50-99 мас.% смеси контактного клея, состоящей из
(I) 70-99 мас.% стойкого по отношению к аминам силиконового клея,
(II) 1-30 мас.% надлежащего пластификатора,
(б) 1-40 мас.% ротиготина или предшественника ротиготина.
В одном предпочтительном варианте выполнения изобретения указанный термоплавкий контактный клей на силиконовой основе состоит из
(а) 70-99 мас.% стойкого по отношению к аминам силиконового клея и
(б) 1-30 мас.%, предпочтительно 3-15 мас.% и еще более предпочтительно 4-10 мас.% органического воска, который особенно предпочтительно выбран из группы, включающей озокерит, церезин, парафин, канделильский воск, карнаубский воск, пчелиный воск или смеси указанных восков, причем еще более предпочтительными восками являются озокерит и, в частности, церезин.
Как показано на фиг.1а, такая обладающая несложной конструкцией термоплавкая ТТС на силиконовой основе обеспечивает скорости проникания ротиготина in-vitro, сравнимые с известной из уровня техники терапевтически эффективной силиконовой ТТС на основе растворителей.
Как показано на фиг.1б, благодаря более высокому наполнению ротиготином термоплавкой силиконовой ТТС согласно изобретению достигаются гораздо более высокие скорости его проникания in-vitro по сравнению с известными из уровня техники клинически эффективными силиконовыми пластырями на основе растворителей.
В настоящей заявке под термоплавкой ТТС подразумевается система, клеевая матрица которой получена способом горячего плавления, то есть путем плавления термоплавкого контактного клея, а также, при необходимости, дополнительных компонентов в отсутствие растворителей.
Неожиданно было обнаружено, что добавление восков, в частности, органических восков, в частности озокерита или церезина, оказывает влияние и на проникание ротиготина через кожу мыши in-vitro из термоплавкой силиконовой ТТС. Как показано на фиг.2, скорость проникания ротиготина с повышением содержания воска снижается. Этот экспериментальный факт можно объяснить частичным распределением ротиготина в воске и обусловленным этим эффектом замедления его высвобождения.
Указанное свойство воска имеет особое значение при создании ТТС, предназначенных для применения в течение нескольких дней, например, в течение 7 дней. Такой пластырь многодневного действия необходимо сильно наполнить ротиготином, однако при этом возникает опасность так называемого эффекта dose-dumping, то есть преждевременного высвобождения избыточного ротиготина в начальной фазе применения ТТС. В связи с этим в состав ТТС целесообразно вводить компонент, регулирующий высвобождение биологически активного вещества. Таким компонентом может быть мембрана, расположенная с обратной стороны клеевой матрицы и регулирующая высвобождение биологически активного вещества. Однако создание подобной мембраны связано с увеличением расходов на материалы и повышением трудоемкости изготовления ТТС. Поэтому вместо использования дополнительной мембраны желательно введение в состав матрицы надлежащих компонентов, способных замедлять высвобождение ротиготина.
Поскольку неожиданно обнаружилось, что присутствие воска в клеевом слое замедляет высвобождение биологически активного вещества, варьирование содержания воска не только позволяет регулировать динамическую вязкость контактного клея, но и предоставляет неожиданную дополнительную возможность регулирования высвобождения биологически активного вещества.
При увеличении содержания воска динамическая вязкость силиконового контактного клея сначала резко падает (до содержания воска около 5 мас.%), однако в дальнейшем лишь плавно снижается. Содержание воска в силиконовом контактном клее в интервале 4-10 мас.% соответствует пригодной для переработки расплава динамической вязкости, при этом воск оказывает незначительное влияние на высвобождение ротиготина. Дальнейшее повышение концентрации пластификатора обеспечивает дополнительный эффект замедления высвобождения ротиготина.
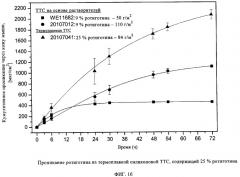
Как показано на фиг.6а и 6в, благодаря добавлению 5 мас.% органического воска к ТТС с относительно высокой степенью наполнения ротиготином (около 25 мас.%) скорость проникания ротиготина через кожу человека становится сравнима со скоростью, характерной для ТТС на основе растворителей с меньшим наполнением (9 мас.%). Это предоставляет возможность получения ТТС с пролонгированным высвобождением биологически активного вещества, происходящим, например, в течение периода, превышающего 7 дней (см. фиг.6б и 6в).
Неожиданным оказалось также влияние воска на реологические свойства ТТС. Использование органического воска в качестве пластификатора силиконового контактного клея обеспечивает снижение динамической вязкости соответствующей смеси при повышенных температурах, благодаря чему клеевая смесь на силиконовой основе отлично пригодна для переработки способом горячего плавления. При этом реологические характеристики силикона при комнатной температуре, в частности, его когезионная прочность, неожиданно сохраняются практически на неизменном уровне, и типичные проблемы, связанные с использованием термоплавких контактных клеев, например хладотекучесть на коже пациентов, отсутствуют.
В качестве силиконов в принципе пригодны известные из технологии получения пластырей силиконовые контактные клеи. Предпочтительными силиконовыми контактными клеями являются стойкие по отношению к аминам, чувствительные к прижиму полиорганосилоксановые клеи. Силиконовые контактные клеи чаще всего представляют собой полиметилсилоксаны, которые вместо метильных групп в принципе, разумеется, могут содержать и другие органические заместители, например, этильные или пропильные группы. Стойкие по отношению к аминам силиконовые контактные клеи в общем случае отличаются тем, что они не содержат свободных силанольных групп или содержат лишь незначительное количество таких групп, поскольку по Si-OH-группам ранее было выполнено алкилирование. Подобные клеи описаны в ЕР 180377. Особенно предпочтительными силиконовыми клеями являются конденсата или смеси силиконовых полимеров с полиорганосилоксанами, описанные, например, в US RE 35474.
Такие силиконовые контактные клеи являются коммерчески доступными продуктами, поставляемыми, например, фирмой Dow Coming под торговым наименованием Bio-PSA Q7-4300 или Bio-PSA Q7-4200. Кроме того, фирма Dow Coming выпускает термоплавкие силиконовые клеи, представляющие собой смеси PSA 7-4300 с органическими восками, в частности, озокеритом или церезином.
Содержание используемого в качестве биологически активного вещества ротиготина в расчете на общую массу клеевой матрицы может составлять от 1 до более 40 мас.%, причем ротиготин может присутствовать в ней в виде соли или свободного основания. Предпочтительным является присутствие ротиготина в клеевой матрице в виде свободного основания. Как альтернатива возможно присутствие ротиготина в клеевой матрице в виде соответствующего предшественника, например, сложного эфира или карбамата.
В отличие от силиконовых контактных клеев на основе растворителей, содержащих максимум 15 мас.% биологически активного вещества, в состав клеевой матрицы термоплавкого ТТС без дополнительных технических издержек могут быть введены гораздо большие количества ротиготина. Благодаря этому предоставляются гораздо более широкие возможности для регулирования скорости проникания ротиготина и длительности его высвобождения из термоплавкой ТТС.
Как показано на фиг.3а и 3б на примере термоплавких силиконовых ТТС, благодаря повышению степени наполнения ротиготином можно увеличить как скорость проникания ротиготина через кожу млекопитающего, так и длительность его высвобождения. При фиксировании ТТС на коже человека повышение степени наполнения клеевой матрицы ротиготином приводит, в частности, к увеличению длительности его высвобождения, в то время как скорость проникания ротиготина через кожу, начиная с его содержания 8-9%, возрастает весьма незначительно.
Предпочтительное содержание ротиготина или предшественника ротиготина в клеевой матрице составляет 4-40 мас.%, в частности, 9-30 мас.%, наиболее предпочтительно 9-25 или 15-25 мас.%, а для пластыря с семидневным сроком применения 20-40 мас.%, в частности, 25-35 мас.% в расчете на общую массу клеевой матрицы.
Используя в качестве модели вымя коровы, осуществляли экспериментальную проверку совместимости термоплавкой ТТС на силиконовой основе с высоким наполнением ротиготином (свыше 15 мас.%) с кожей. С этой целью измеряли жизнеспособность клеток, а также синтез PGE2 после наложения соответствующей содержащей ротиготин термоплавкой ТТС (5% церезина, 2% РЕО, 25-30% ротиготина).
Активность клеток после наложения ТТС согласно изобретению по сравнению с неподвергнутой подобной обработке кожей изменялась несущественно, в то время как синтез PGE2 в начальный период несколько усиливался, а через 5 часов после наложения ТТС прекращался вовсе. По сравнению с этим результатами после обработки кожи раствором додецилсульфата натрия концентрацией 10% было обнаружено существенное повышение активности клеток (более 50% через 5 часов) и значительное усиление синтеза PGE2 (более 60% через 5 часов), что свидетельствовало о протекании воспалительной реакции. Отсюда может быть сделан вывод, что термоплавкие ТТС согласно изобретению, пригодные для применения ротиготина в течение нескольких дней, несмотря на высокое содержание ротиготина не вызывают существенного раздражения кожи.
Дополнительную возможность регулирования скорости и длительности высвобождения ротиготина предоставляет варьирование толщины клеевой матрицы. На фиг.4 на примере термоплавкой силиконовой ТТС показано установленное in vitro влияние массы клеевой матрицы на проникание ротиготина через кожу мыши.
Толщину клеевой матрицы можно гибко регулировать в широком интервале, осуществляя единственную технологическую операцию нанесения клея, поскольку отсутствуют ограничения по толщине, присущие способу, предусматривающему использование растворителей. Толщина клеевой матрицы может составлять от 30 до 300 мкм, предпочтительно от 50 до 150 мкм и особенно предпочтительно от 50 до 120 мкм.
Масса клеевой матрицы ТТС согласно изобретению предпочтительно составляет от 30 до 300 г/м2, особенно предпочтительно от 50 до 150 г/м2 и еще более предпочтительно от 50 до 120 г/м2, а для пластырей с семидневным сроком применения предпочтительно от 70 до 200 г/м2, особенно предпочтительно от 80 до 180 г/м2 и от 100 до 160 г/м2.
Предпочтительное содержание ротиготина в клеевой матрице в зависимости от предусматриваемой длительности применения ТТС колеблется от 0,4 до 8 мг/см2.
Предпочтительное наполнение ТТС с однодневным сроком действия составляет от 0,4 до 1,5 мг/см2, особенно предпочтительно от 0,4 до 0,8 мг/см2.
Терапевтическая дозировка ротиготина для взрослых в среднем составляет около 6 мг/день. Следовательно, ТТС с семидневным сроком действия должна содержать в среднем около 42 мг биологически активного вещества. Учитывая необходимость надежного обеспечения терапевтического эффекта, при применении клинических трансдермальных систем исходят из того, что исчерпанию подлежит в среднем лишь 50-60% биологически активного вещества от общего ресурса ТТС. Таким образом, ТТС с семидневным сроком действия предпочтительно содержит, по меньшей мере, от 70 до 84 мг биологически активного вещества.
Таким образом, предпочтительное наполнение ТТС с семидневным сроком действия предпочтительной площадью 10-30 см и особенно предпочтительной площадью 15-25 см2 составляет:
| Площадь пластыря, см2 | Минимальное содержание ротиготина, мг/см2 |
| 10 | 7,0-8,4 |
| 15 | 4,7-5,6 |
| 20 | 3,5-4,2 |
| 25 | 2,8-3,4 |
| 30 | 2,3-2,8 |
Следовательно, содержание ротиготина или предшественника ротиготина в пластыре с семидневным сроком действия предпочтительно составляет от 2 до 8 мг/см2, особенно предпочтительно от 2,8 до 5,6 мг/см2 и еще более предпочтительно от 3,1 до 5,6 мг/см2.
ТТС согласно уровню техники, предназначенные для применения ротиготина в терапевтически эффективной дозировке и обладающие столь высоким содержанием ротиготина, до последнего времени известны не были, и получение подобных ТТС стало возможным лишь благодаря варьируемому наполнению и варьируемой толщине наносимого клеевого слоя термоплавкого ТТС. Причем высокая степень наполнения ротиготином (более 40 мас.%), необходимая для ТТС с семидневным сроком действия, может быть обеспечена и для относительно тонких клеевых матриц, толщина которых составляет 80-200 мкм, предпочтительно 80-180 мкм, особенно предпочтительно 80-160 мкм.
Таким образом, предметом настоящего изобретения являются ТТС для применения ротиготина в терапевтически эффективном количестве, отличающиеся тем, что содержание ротиготина в клеевой матрице составляет, по меньшей мере, 2,0 мг/см2, предпочтительно, по меньшей мере, 2,8 мг/см2, особенно предпочтительно, по меньщей мере, 3,1 мг/см2 или, по меньшей мере, 3,4 мг/см2. При этом предпочтительными являются ТТС, содержащие клеевые матрицы со степенью наполнения ротиготином более 20 мас.% и массой менее 200 г/м2, например, от 80 до 180 г/м2 и особенно предпочтительно от 80 до 160 г/м2 (что соответствует толщине матрицы 80-200 мкм).
В клеевой слой (называемый также клеевой матрицей) наряду с ротиготином и смесью контактного клея, при необходимости, может быть введен компонент, выполняющий функцию внутренней фазы.
Такой внутрифазный компонент служит, в частности, в качестве гидротропного солюбилизатора и ингибитора кристаллизации и способствует равномерному распределению биологически активного вещества в клеевой матрице. Кроме того, внутрифазный компонент предназначен для повышения влагопоглощения зафиксированного на коже пластыря.
Для использования в способе горячего плавления особенно пригодны такие внутрифазные компоненты, расплав которых при температуре ниже 170°С обладает динамической вязкостью не более 150 Па·с, предпочтительно менее 120 Па·с и 100 Па·с и особенно предпочтительно менее 80 Па·с.
Если динамическая вязкость внутрифазного компонента при желательной температуре переработки слишком низка, то, при необходимости, к нему сначала нужно добавить надлежащий пластификатор, например, глицерин. В некоторых случаях пластифицирующими свойствами может обладать и используемый в качестве биологиче