Способ управления окислением молибденита под давлением в автоклаве
Иллюстрации
Показать всеИзобретение может быть использовано для извлечения молибдена из концентрата молибденита. Способ окисления концентрата молибденита включает: формирование водной суспензии концентрата молибденита; нагревание этой суспензии до температуры около 200°С; перемешивание суспензии при контакте с атмосферой, содержащей свободный кислород; окисление суспензии в этой атмосфере при избыточном давлении кислорода, как минимум, 3,4 бар (50 фунт/дюйм); определение количества растворимого молибдена при окислении под давлением концентрата молибденита; регулирование концентрации ионов трехвалетного железа и концентрации избыточной серной кислоты путем рециркулирования порции выщелоченной суспензии и/или путем добавления дополнительного количества серной кислоты к водной суспензии; получение выщелоченной суспензии, в которой более 99% молибдена концентрата молибденита окислено. Определение количества растворимого молибдена при окислении под давлением концентрата молибденита включает предварительный расчет концентрации избыточной серной кислоты и предварительный расчет концентрации растворимого железа. Изобретение позволяет определить количество растворимого молибдена, образующегося в процессе окисления под давлением концентрата молибденита, и оптимизировать этот процесс, 11 з.п. ф-лы, 5 ил., 2 табл.
Реферат
Данное изобретение относится к области химии процессов окисления концентратов молибденита под давлением и, в частности, к способу управления и оптимизации окисления концентратов молибденита под давлением.
Предпосылки изобретения
Экстракция молибдена из материалов, содержащих молибден, при водном процессе является предметом исследования в течение 50 лет. В 1952 г. опубликована работа Е.С.Усатой. "Окисление молибденита в водном растворе". Записки Всесоюзного минерального общества, т.81, 298-303 (1952). Было установлено, что в нейтральных, кислых и слабо основных растворах продукты разложения осаждаются на поверхности молибденита и препятствуют дальнейшему окислению молибденита. Было обнаружено, что сильные основания и сильные окисляющие агенты препятствуют образованию защитного слоя. Повышение температуры ускоряет скорость окисления в щелочных растворах, но в кислотных растворах повышение температуры до 60°С не сказывается на скорости.
В японском патенте (Sada, Koji, "Extraction of molybdenum", Japanese patent 15.207 ('62), assigned to Awamura Mining Co., Ltd) в 1962 г. сообщается об окислении кислородом под давлением (ОКД) молибденита. Из образца в этом процессе выщелачивают при 200°С и давлении кислорода 200 атмосфер концентрат, содержащий 55,5% Мо, 36,4% S и 4,4% Cu при 9% твердого вещества. Осадок молибденовой кислоты, образующейся при выщелачивании, растворяют, используя аммоний для превращения в молибдат аммония. Формула реакции:
В 1971 г. АМАХ запатентована аналогичная реакция (Barry, Henry F. et al., Aqueous phase oxidation of molybdenum disulfide," German patent 2,043,874 (1971)), однако температура выбрана выше 80°С и давление более 3,5 атмосфер. Во втором патенте АМАХ (Hallada, Callvin J., et al., "Conversion of molybdenum disulfide to molybdenum oxide," German patent 2,045,308 (1971)) непрерывно добавляют гидроокись щелочного металла или гидроокись аммония для нейтрализации образующейся кислоты и поддержания рН (в пределах 7-12).
Шапиро в 1970 г. (Шапиро К.Я. и др. "Использование серной кислоты для окисления молибденового сырья", Научн. Труды Всесоюзного Научно-исслед. Проектн. Института тугоплавких металлов и твердых сплавов, 1970) и Мельников в 1973 г. (Мельников Б.С. и др. "Окислительное водное выщелачивание в автоклаве молибденовых концентратов", Научн. Труды Всесоюзного научно-исслед. Проектн. Института тугоплавких металлов и твердых сплавов, 1973, 14, 151-157) сообщают об окислении под давлением в присутствии серной кислоты. Шапиро утверждает, что растворимой молибденовой частицей является MoO2SO4. Мельников использует окисленный концентрат, содержащий 17% Мо и 15% Fe при 16% твердого вещества, при 100°С. Условия у Шапиро для 47% Мо концентрата составляют 9% твердого вещества, температура 225°С, давление кислорода меньше 10 атмосфер, в течение трех часов.
В 1970 г. в статье Иркова (Ирков Ф.Я., Палант А.А., Резниченко В.А. "Растворимость безводной окиси молибдена (VI) в водных растворах серной кислоты". Журнал неорганической химии, т.15, 5, 695-697 (1970)) сообщается о растворимости окиси молибдена в серной кислоте при температуре 22, 50, 71 и 89°С. В статье показано, что растворимость молибдена падает с ростом температуры и показано влияние концентрации серной кислоты выше 20%.
В статье Шапиро и Мельникова (Мельников Б.С. и Шапиро К.А. "Водное растворение в автоклаве молибденитного сырья", Научн. Труды Всесоюзного научно-исслед. Проектн. Института тугоплавких металлов и твердых сплавов, 1975, 113-120, 253-260) в 1975 г. сообщается о ОКД разложении 1) чистых молибденитов, 99/5% MoS2, 2) высококачественных концентратов, 47% Мо и 3) низкосортных промышленных продуктов, содержащих 16% Мо и 15% Fe. Условия выщелачивания 9% твердого вещества, температура от менее чем 160 до 225°С, избыточное давление кислорода от 5 до 20 атмосфер и время от 15 до 195 минут.
В статье показано влияние температуры на скорость окисления при избыточном давлении кислорода 15 атмосфер. Скорость окисления становится высокой при температуре выше 190°С. В статье также показано влияние избыточного давления кислорода на скорость окисления при 225°С. Скорость окисления прямо пропорциональна избыточному давлению кислорода. Авторы утверждают, что скорость окисления, зависящая от температуры и избыточного давления кислорода, контролирует количество растворимого молибдена.
В статье также изучено влияние добавления железа к молибдениту высокой чистоты. Добавление железа сильно ускоряет окисление молибденита. Влияние температуры на скорость уменьшается при добавлении железа. В присутствии железа содержание молибдена в растворе достигает пика вблизи 60% окисления молибденита, а затем понижается до уровня примерно удвоенного по сравнению с тем, когда не добавляют железо. Авторы предполагают, что образуется гетерополикомплекс молибден-железо, который разлагается при увеличении концентрации кислоты. Это может быть также комплекс с двухвалентным железом, который разлагается, как только растворимое железо окислится до трехвалентного железа.
Также изучено окисление низкосортных промышленных концентратов и показано влияние температуры (150-225°С) на скорость окисления, растворимость молибдена и концентрацию железа и серной кислоты при избыточном давлении кислорода менее чем 15 атмосфер. Полученные данные четко показывают, что существует инкубационный период, во время которого окисляется достаточное количество пирит/халькопирита, образующего серную кислоту в количестве, которого достаточно для того, чтобы началось окисление молибденита. Быстрое окисление молибденита не происходит до тех пор, пока концентрация растворимого железа не составит около 8 г/л, а концентрация серной кислоты не составит около 40 г/л. Полученные данные показывают, что испытания порциями с использованием воды в качестве выщелачивающего средства не позволяет получить сведения, которые можно перенести на реактор с непрерывным действием.
Ротманом (Rothmann, Hans W. and Bauer, Guenter, "Method for recovering molybdenum oxide", German patent DE 2,830,394 (1980)) в 1980 г. и Бауэром (Bauer, Guenter and Eckert, Joachim, "Recovery of molybdenum oxide", German patent DE 3,128,921 (1983)) в 1983 г. запатентован способ выщелачивания под давлением кислорода, при котором молибденит добавляют к реакционной смеси, содержащей до 100 г/л серной кислоты. Выщелачивание проводят при температуре от 250 до 300°С и избыточном давлении кислорода от 10 до 20 атмосфер.
В 1986 г. Гоком (Gock, Eberhard "Pure molybdenum trioxide produced by way of extraction of molybdenum from sulfate solutions", German patent DE 84.3,443,806 (1986)) запатентован способ окисления молибденита (97,5%), неполное окисление связано с содержащимися флотационными реагентами. Молибден поддерживался в виде растворимых частиц с пониженной валентностью, а не шестивалентных частиц, которые выпадают в осадок. Условия реакции (кислотное выщелачивающее средство при рН-значении от 0,2 до 0,6, температура 160-220°С и избыточное давление кислорода) не указывают на то, как управление реакцией может предотвратить полное окисление флотационных реагентов.
В 1998 г. Cyprus Amax (Sweetser, W.H. and Hill, L.N., "Process for autoclaving molybdenum sulfide", US 5,804,151 (1998)) запатентован способ, в котором молибденит добавляют к фильтрату предыдущей реакции и доводят окисление до 70-95%. Непрореагировавший молибденит извлекают в виде твердых частиц при пенной флотации. Непрореагировавший молибденит и часть остаточной жидкости возвращают в выщелачивающий реактор. Условия окисления: температура 175-225°С и избыточное давление кислорода от 3,5 до 21 кг/см2 (от 50 до 300 фунт/дюйм2). Флотационные хвосты содержат, наряду с окисью молибдена и/или молибденовой кислотой, небольшое количество молибденита и их следует кальцинировать до того, как получить окись молибдена. Остаточную жидкости из автоклава обрабатывают для извлечения рения и меди.
В канадском патенте Брассиер и Паскаля (Brassier, Cecile and Baron, Pascal: Canadian Patent 2,154,133 (1994), а также French Patent 2,272,701, "Process for the recovery of molybdenum from impure calcium molybdate resulting from treatment of uraniferous ores") описано образование гетерополисоединений при выщелачивании осадков сырьевых молибдатов кальция серной кислотой. Результаты, приведенные в этом патенте, указывают на образование в значительном количестве гетерополифосфатов и -силикатов в том случае, если выщелачивание осуществляют не менее чем 0,5 молярной серной кислотой (49 г/л). При выщелачивании 1 молярной серной кислотой количество гетерополисоединений уменьшается более чем на порядок. Из этих результатов следует вывод, что первоначальное вещество, добавляемое для выщелачивания, должно содержать достаточное количество свободной кислоты, чтобы избежать области с низким содержанием кислоты, где образуются гетерополисоединения.
Исходя из разных использованных в течение многих лет способов, условий и теорий, становится ясным, что для фундаментального понимания химии процесса, вовлеченного в окисление концентратов молибденита, необходим разумный контроль химических реакций при выщелачивании под давлением кислорода, а также предсказание концентрации растворимого молибдена, присутствующего в суспензии, полученной в автоклаве после окисления под давлением.
Поэтому задача данного изобретения состоит в создании модели выщелачивания, которая предсказывает количество растворимого молибдена, присутствующего в суспензии, полученной в автоклаве после окисления под давлением концентратов молибденита.
Другая задача данного изобретения состоит в создании способа оптимизации и управления химическим процессом окисления концентратов молибденита кислородом под давлением.
Резюме
Задачи, указанные выше, а также другие задачи и преимущества данного изобретения осуществлены благодаря воплощению изобретения, описанного ниже.
Данное изобретение предлагает модель выщелачивания, с помощью которой можно предсказать количество растворимого молибдена, образующегося в ходе окисления под давлением концентратов молибденита, и предлагает способ оптимизации и управления химическим процессом окисления под давлением в автоклаве.
Химический процесс окисления под давлением концентратов молибденита управляется согласно данному изобретению для увеличения извлечения путем регулирования количества трехвалентного железа и избыточной серной кислоты в конечной выщелоченной суспензии. Кинетика окисления управляется температурой и избыточным давлением кислорода в автоклаве. Модель позволяет предсказать количество растворимого молибдена, опираясь на анализ концентрата, анализ рециркулируемого раствора и плотность использованной пульпы. Найдено, что для хорошей кинетики окисления необходимы температура выше 200°С и избыточное давление кислорода выше 3,5 кг/см2 (50 фунт/дюйм2).
Модель позволяет определить условия растворимости молибдена независимо от окисления молибдена. Используя компьютерную модель, удалось достигнуть степени окисления более 99% молибденита с получение конечной суспензии, в которой растворены менее 20% или более 80% молибдена. Количество растворенной меди составляет более 99%, а количество растворенного железа от содержащегося в концентрате пирита и халькопирита составляет от 60 до 90%. Существенная часть этого железа затем выпадает в осадок в виде молибдатов железа. Выщелачивание при условии большого избытка кислоты позволяет удерживать количество растворенного кремния ниже 100 мг/л. Большая часть рения, мышьяка и фосфора растворяется независимо от условий выщелачивания.
Другие задачи, особенности и преимущества изобретения показаны в последующем описании предпочтительных воплощений изобретения, включая иллюстративные, не ограничивающие изобретение, примеры модельных способов (процессов) и составы (композиции) полученных продуктов.
Краткое описание чертежей
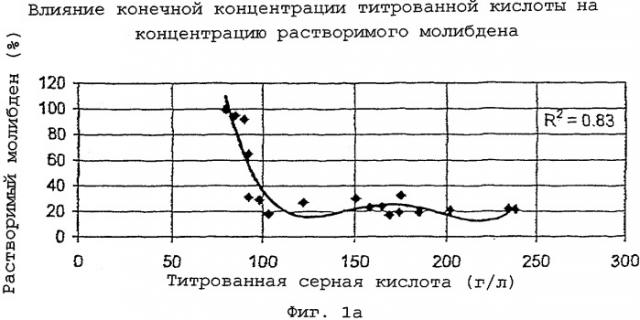
На фиг.1а представлена кривая зависимости концентрации растворимого молибдена от концентрации титрованной серной кислоты.
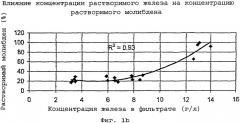
На фиг.1b представлена кривая зависимости концентрации растворимого молибдена от концентрации трехвалентного железа.
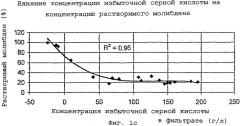
На фиг.1с представлен кривая зависимости концентрации растворимого молибдена от концентрации трехвалентного железа плюс концентрации избыточной серной кислоты.
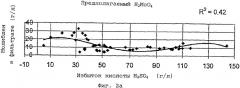
На фиг.2а - 2с представлены кривые зависимости концентрации растворимого молибдена для трех различных частиц молибдена от концентрации избыточной серной кислоты.
На фиг.3 представлена кривая зависимости рассчитанной концентрации избыточной серной кислоты от концентрации титрованной серной кислоты для проб фильтратов, отбираемых при условия непрерывного процесса.
На фиг.4 представлена модель выщелачивания, созданная для предсказания количества (концентрации) растворимого молибдена после окисления кислородом под давлением (ОКД) концентрата молибденита.
На фиг.5 представлена кривая зависимости количества фактического ОКД-растворимого молибдена от количества ОКД-растворимого молибдена, предсказываемого предлагаемой моделью.
Детальное описание предпочтительных воплощений изобретения
Модель выщелачивания, способная предсказать концентрацию растворимого молибдена, была создана после серии лабораторных испытаний выщелачивания под давлением и сбора достачного количества статистических данных. Результаты показывают, что температура выщелачивания, время и избыточное давление кислорода незначительно влияют на растворение молибдена. Самыми важными переменными являются конечные концентрации кислоты и железа. На фиг.1а-1с показано влияние этих переменных на растворимость молибдена. Из фиг.1а видно, что понижение растворимости молибдена хорошо коррелирует с увеличением количества титрованной серной кислоты. Из фиг.1b видно, что повышение растворимости молибдена хорошо коррелирует с увеличением концентрации железа. Из фиг.1с видно, что растворимость молибдена, определенная согласно модели (железо плюс избыточная серная кислота), обнаруживает очень хорошую корреляцию (R2=0,96).
Первая стадия по созданию модели состоит в установлении того, какие частицы присутствуют в выщелачивающем растворе и какова концентрация кислоты. Высокая концентрация серной кислоты в выщелачивающем растворе благоприятствует образованию бисульфатных анионов, находящихся в равновесии с катионами металлов. Поэтому моделируемый процесс предполагает, что железо и медь растворимы в виде Fe(HSO4)3 и Cu(HSO4)2. В российском исследовании (Шапиро и Мельников) предположено, что растворимой молибденовой частицей является MoO2SO4. На фиг.2а - 2с приведены концентрации растворимого молибдена для случая трех различных частиц (Н2MoO4, MoO2SO4 и МоО2(HSO4)2) по отношению к избытку серной кислоты. На этих графиках приведены только испытания с хорошим окислением сульфидов и хорошим балансом металлов. Если предположить, что этими частицами являются МоО2(HSO4), то графическое нанесение концентрации молибдена по отношению к избытку серной кислоты дает лучшую корреляцию при величине R2=0,81.
Модель управления основывается на предсказании конечной (избыточной) концентрации серной кислоты и концентрации растворимого железа. Количество избыточной кислоты определяют как количество титрованной кислоты, исправленной на бисульфат, который титруется вместе с частицами кислоты, плюс любая кислота, генерируемая в ходе титрования. Процедура титрования, использованная во время лабораторной программы, начинается с растворения аликвоты всего, что подлежит измерению, в растворе оксалата калия. В этом случае катионы дают комплекс с оксалатом, освобождая бисульфат для титрования гидроокисью калия. По существу химию титрования можно описать следующим образом:
Если приведенные выше ионы титровать с помощью КОН, то реакции описываются следующим образом:
Поэтому количество титранта, реагирующего с двумя ионами бисульфата, соответствует одному иону меди, реагирующего с тремя ионами бисульфата, соответствует одному иону трехвалентного железа, а реагирующего с двумя ионами бисульфата и с двумя ионами водорода соответствует одному иону молибдена. После внесения поправок в результаты титрования кислоты на ионы бисульфата и водорода, связанные с медью, железом и молибденом, оставшуюся кислоту относят к "избыточной кислоте". На фиг.3 видна хорошая корреляция значений титрованной серной кислоты с рассчитанным значением "избыточной кислоты".
Затем составляют уравнение для предсказания количества избыточной кислоты исходя из веса концентрата и его анализа плюс объема рециркулируемого раствора и его анализа. Предположенные реакции таковы:
Другие сульфидные минералы также реагируют и образуют растворимые бисульфаты. В связи с этим свинец, вероятно, будет осаждаться в виде сульфата.
Следует заметить, что ни в одной из приведенных выше реакций не образуется избыточная серная кислота. Источниками для образования кислоты являются халькопирит и пирит. Медь и железо быстро растворяются в условиях автоклава и позднее часть железа от 15 до 25% осаждается в виде Fe2О3. Напротив, часть молибдена гидролизуется, генерируя кислоту. Ниже приведены первичные реакции с образованием осадка.
Как только железо и/или молибден начинают осаждаться, уровень избыточной кислоты быстро возрастает, что приводит к росту осаждения молибдена. Установление количества осажденного железа очень важно для предсказания количества молибдена, который выпадет в осадок.
На фиг.4 приведена модель, созданная для предсказания количества растворимого молибдена после окисления под давлением концентратов молибденита. Суть модели основывается на предварительном расчете для установления количества избыточной кислоты, за которым следует второй расчет, использующий установленное количество избыточной кислоты. Первый расчет, устанавливающий количество избыточной кислоты, предполагает: 1) полное растворение меди, железа и молибдена поступающего концентрата; 2) выпадение в осадок 30% железа, включая как рециркулируемое, так и растворенное из концентрата; и 3) выпадение в осадок всего рецирклируемого молибдена плюс 20% растворенного из концентрата. Количество осажденного железа, равное 30%, является средним в том случае, когда испытания выщелачивания проводят при 200 - 220°С. При более высоких температурах будет осаждаться больше железа. 20% молибдена выбрано, чтобы избежать больших отрицательных значений в том случае, когда модель предсказывает высокую растворимость молибдена. Величина количества избыточной кислоты плюс коррекция для установленного растворимого железа использованы для расчета первоначального предсказания количества растворимого молибдена. Затем вносится поправка в величину избытка кислоты для компенсации количества молибдена, выпавшего в осадок, и делается окончательное предсказание. На фиг.5 сравнены предсказанное с помощью модели количество растворимого молибдена и количество фактически растворимого молибдена. Заметим, что если бы модель была совершенной, то все точки лежали бы на прямой. Вероятно, экспериментальные и аналитические ошибки способствуют отклонению точек от линии, предсказанной моделью.
Принципиальные преимущества в связи с пониманием химии процесса состоят в возможности управления вовлеченными в процесс химическими реакциями и в предсказании количества растворимого молибдена в смеси, выгружаемой из автоклава. Это понимание процесса позволяет также влиять на другие усовершенствования процесса, например на достижение более низких уровней содержания растворимого кремния в случае, если количество свободной кислоты в автоклаве поддерживается на относительно высоком уровне. Другое усовершенствование состоит в рециркулировании выщелоченной суспензии при добавлении к ней свободной кислоты и трехвалентного железа, что повышает начальную скорость реакции таким образом, что требуется меньшее время задержки при выщелачивании, уменьшение размеров используемого оборудования.
ПРИМЕРЫ
Ниже изобретение поясняется следующими примерами, не ограничивающими изобретение. Исследование выщелачивания проводят для процессов с непрерывной или периодической подачей реагентов. Процесс с непрерывной подачей более близко имитирует непрерывный процесс в автоклаве и создает возможность для больших скоростей реакции. Идентичные результаты достигаются в случае периодической подачи при условии, что продолжительность времени задержки достаточна.
Пример 1. Процесс выщелачивания с непрерывной загрузкой
1. Загружают 2-литровый реактор Парра заданным объемом суспензии (номинально 1 литр), нагревают до заданной температуры под давлением кислорода и выщелачивают 30 минут. Вспенивание создает проблемы при использовании непрерывного потока кислорода. Поэтому была разработана процедура, при которой каждые 15 минут осуществляют понижение избыточного давления кислорода до половинного значения, а затем добавляют кислород пока не достигается заданного повышенного давления кислорода. Это приводит к тому, что любую образовавшуюся пену возвращают в суспензию. При использовании мешалки с отсасывающей трубкой возможно непрерывное добавление кислорода и удаление пара из верхней части устройства.
2. Отбирают половину объема суспензии (суспензия А) и заменяют ее свежей суспензией.
3. Выщелачивают 30 минут.
4. Отбирают половину объема суспензии (суспензия В) и заменяют ее свежей суспензией.
5. Выщелачивают 30 минут.
6. Отбирают половину объема суспензии (суспензия С) и заменяют ее свежей суспензией.
7. Выщелачивают 30 минут, затем берут небольшую аликвоту суспензии для анализа (суспензия D).
8. Выщелачивают дополнительно 30 минут, затем берут небольшую аликвоту суспензии для анализа (суспензия Е).
9. Выщелачивают дополнительно 30 минут, затем берут небольшую аликвоту суспензии для анализа (суспензия F) и охлаждают реактор. Фильтруют и промывают твердое вещество (суспензия G).
10. Выдерживают все промежуточные и конечный выгружаемый образец при перемешивании, по крайней мере, в течение 120 минут на водяной бане при 35°С. Это позволяет образцам прийти в равновесие при условиях, совпадающих с условиями на заводе. После выдерживания до достижения равновесия все образцы фильтруют и промывают водой. Фильтраты и смывы объединяют для анализа. Большинство образцов, полученных в конце, фильтруют, промывают, репульпируют, снова фильтруют и промывают для минимизации переноса растворимого сульфата в отфильтрованный остаток.
11. Для конечных фильтратов из автоклава делают анализ главных компонентов и некоторых следовых элементов. Промытые кислотные остатки разделяют пополам или на меньшие порции. Одну половину сушат и анализируют, а другую половину выщелачивают раствором карбоната натрия.
12. Промытые остатки выщелачивают 18% раствором карбоната натрия при 50°С для определения баланса окисленного молибдена и выпавших в осадок сульфатов. Остаток карбоната натрия анализируют на остаточный сульфид и нерастворимый молибден.
Пример 2. Процесс выщелачивания с периодической загрузкой
Тесты по выщелачиванию с периодической загрузкой осуществляют в 2-литровом и 2-галонном реакторе Парра. Концентрат подают в реактор в виде пульпы с использованием рециркулируемого раствора плюс вода. Реактор закрывают и поднимают температуру при наличии давления кислорода. Реактор выдерживают при заданной температуре 150 минут. В случае использования 2-литрового реактора парциальное давление кислорода регулируют при выщелачивании каждые 15 минут в результате сбрасывания наполовину избыточного давления и последующего добавления кислорода до тех пор, пока не будет достигнуто требуемое давление. Если используют мешалку с отсасывающей трубкой в верхней части реактора, то появляется возможность непрерывного добавления кислорода и удаления паровой фазы. В случае использования 2-галонного реактора образование пены не создает проблем, кислород добавляют непрерывно и удаление паровой фазы происходит непрерывно.
В таблице 1 сравнены величины предсказанных и фактических концентраций растворимого молибдена при испытаниях, проведенных для четырех образцов.
Пример 3. Влияние условий низкой растворимости Мо на содержание растворимого кремния
Количество растворимого кремния в выщелачиваемых растворах при испытании проб, содержащих молибден с низкой растворимостью, оказывается значительно ниже, чем наблюдается в предшествующих испытаниях, где не контролируют количество кислоты. В таблице 2 сравнены результаты анализа количества растворимого кремния для случая испытания проб, содержащих молибден с низкой растворимостью, с анализом кремния, наблюдаемого при всех испытаниях. Низкие значения для содержания кремния могут быть связаны с высоким содержанием кислоты и с низким содержанием кремния в рециркулируемых выщелачиваемых растворах, добавляемых в автоклав, то есть с равновесной подпиткой выщелачиваемым раствором.
| Таблица 1 | ||||||||
| Примеры применения модели выщелачивания для получения в автоклаве продуктов с высокой или низкой растворимостью молибдена | ||||||||
| Концентрат 1 | Концентрат 2 | Концентрат 3 | Концентрат 4 | |||||
| Анализ концентрата | ||||||||
| Медь, % | 3,8 | 2,1 | 2,0 | 7,2 | ||||
| Молибден, % | 12,8 | 22,3 | 22,8 | 26,9 | ||||
| Железо, % | 4,0 | 2,3 | 2,2 | 6,9 | ||||
| Сера, % | 12,4 | 17,2 | 18,1 | 25,8 | ||||
| Растворимость целевого молибдена | высок. | низкая | высок. | низкая | высок. | низкая | высок. | низкая |
| Тест № | 134 | 102 | 43 | 109 | 137 | 70 | 47 | 67 |
| Смесь, загружаемая для выщелачивания | ||||||||
| Концентрат, г | 184 | 230 | 119 | 140 | 141 | 179 | 96 | 96 |
| Cu рециркул., моль/моль Мо | 0,00 | 0,2 | 0,00 | 0,12 | 0,42 | 0,04 | 0,00 | 0,23 |
| Fe рециркул., моль/моль Мо | 0,39 | 0,22 | 0,79 | 0,13 | 0,5 | 0,17 | 0,57 | 0,56 |
| H2SO4 рециркул. или добавлен. при титровании, моль/моль Мо | 0,43 | 1,94 | 0,46 | 1,48 | 2,72 | 0,71 | 0,47 | 5,2 |
| H2SO4 избыток, моль/моль Мо | -0,04 | 0,52 | -0,31 | 0,41 | 0,41 | 0,21 | -0,23 | 1,34 |
| Смесь, выгружаемая из автоклава | - | |||||||
| Mo предсказанный, г/л | 23,8 | 10,3 | 25,4 | 7,3 | 13,4 | 8,4 | 25,2 | 9,6 |
| Mo фактический, г/л | 27,3 | 10,1 | 28,5 | 6,3 | 19,1 | 10,1 | 25,6 | 14,1 |
| Cu фактический, г/л | 7,1 | 16,6 | 2,6 | 5,6 | 10,8 | 5,1 | 6,8 | 13,2 |
| Fe фактический, г/л | 11,6 | 11,7 | 14 | 5.1 | 12,5 | 7,6 | 13 | 17,1 |
| Свободн. H2SO4 титрован., г/л | 77 | 144 | 90 | 117 | 89 | 93 | 85 | 158 |
| H2SO4 избыток, г/л | -20 | 67 | -9 | 82 | 1 | 45 | -12 | 64 |
| Анализ осадка | ||||||||
| Сера, % после выщелачивания Na2CO3 | 0,61 | 0,02 | 0,41 | 0,27 | 0,36 | 0,1 | 0,49 | 0,1 |
| Молибден, % | 0,3 | 16 | 2,2 | 28,6 | 5,9 | 25 | 1,7 | 41,4 |
| Молибден, % после выщелачивания Na2CO3 | 0,15 | 0,04 | 0,1 | 0,43 | 0,6 | 0,17 | 0,5 | 0,3 |
| Эффективность выщелачивания | ||||||||
| Окисление серы, % | 99 | 96,8 | 96,5 | 98,6 | 97,5 | 99,5 | 98,3 | 99,9 |
| Молибден, растворимый в щелоке, % | 98,8 | 9 | 92 | 10 | 75 | 21 | 95 | 10 |
| Молибден, полностью окисленный, % | 99,9 | 99 | 99,8 | 99 | 98 | 99,7 | 98,5 | 99,4 |
| Таблица 2 | ||||||||
| Концентрат | Концентрат 2 | Концентрат 4 | ||||||
| Молибден (г/л) | 9,9 | 9,3 | ||||||
| Растворимый молибден (%) | 11 | 16 | ||||||
| Кремний (мг/л) | 64 | 96 |
1. Способ окисления концентрата молибденита, включающий
а. формирование водной суспензии концентрата молибденита;
b. нагревание этой суспензии до температуры, как минимум, 200°С;
с. перемешивание этой суспензии при контакте с атмосферой, содержащей свободный кислород; и
d. окисление этой суспензии в указанной атмосфере при избыточном давлении кислорода, как минимум, 3,4 бар (50 фунт/дюйм2);
е. определение количества растворимого молибдена при окислении под давлением концентрата молибденита, который включает
е1. предварительный расчет концентрации избыточной серной кислоты, и
е2. предварительный расчет концентрации растворимого железа;
f. регулирование концентрации ионов трехвалетного железа и концентрации избыточной серной кислоты путем рециркулирования порции выщелоченной суспензии, полученной на стадии (g), обратно на стадию формирования (а) и/или путем добавления дополнительного количества серной кислоты к водной суспензии на стадии (а); и
g. получение выщелоченной суспензии, в которой более 99% молибдена указанного концентрата молибденита окислено.
2. Способ по п.1, отличающийся тем, что менее чем 20% или более чем 80% окисленного молибдена является растворимым.
3. Способ по п.1, отличающийся тем, что концентрат молибденита содержит медь, и растворение меди в указанной выщелоченной суспензии составляет более чем 99%.
4. Способ по п.1, отличающийся тем, что концентрат молибденита содержит железо, и растворение железа в указанной выщелоченной суспензии составляет около 60-90 вес.%.
5. Способ по п.1, отличающийся тем, что на регулирующей стадии в суспензии поддерживают уровень серной кислоты от 100 до 240 г/л для достижения уровня растворимого кремния ниже 100 мг/л.
6. Способ по п.1, отличающийся тем, что на регулирующей стадии в суспензии поддерживают уровень трехвалентного железа выше 3 г/л для увеличения скорости окисления.
7. Способ по п.1, отличающийся тем, что дополнительно включает предварительный расчет количества растворимого молибдена.
8. Способ по п.7, отличающийся тем, что стадия предварительного расчета сопровождается мониторингом анализа концентрата, анализа рециркулируемого раствора и плотности пульпы.
9. Способ по п.1, отличающийся тем, что избыточное давление кислорода на стадии окисления составляет 5,5-8,27 бар (80-120 фунт/дюйм2).
10. Способ по п.1, отличающийся тем, что температура на стадии нагревания составляет от 210 до 220°С.
11. Способ по п.1, отличающийся тем, что на стадии е1 определяют вес концентрата и объем рециркулируемого раствора и анализируют их составы.
12. Способ по п.1, в котором стадия предварительного расчета е2 дополнительно включает
а. учет концентрации избыточной серной кислоты, определенной при предварительном расчете, и
b. усовершенствование этого предварительного расчета с помощью одного или нескольких последующих расчетов, при которых в величину концентрации избыточной серной кислоты вносится поправка для компенсации дополнительного осаждения молибдена.