Соединение, способ его получения
Иллюстрации
Показать всеОписаны макроциклические комплексы металлов и их получение, а также их применение для получения конъюгатов с биомолекулами. Подобные конъюгаты пригодны для применения в качестве контрастных веществ при ЯМР-диагностике и рентгенодиагностике, а также для радиотерапии. За счет присоединения к макроциклам особых лигандов достигается высокая релаксационность и обеспечивается возможность точного ее регулирования. 2 н. и 10 з.п. ф-лы, 2 табл.
Реферат
Настоящее изобретение относится к объектам, охарактеризованным в формуле изобретения, а именно к макроциклическим комплексам металлов, а также к их применению для получения конъюгатов с биомолекулами. Подобные конъюгаты пригодны для получения контрастных веществ, предназначенных для использования при ЯМР-диагностике и рентгенодиагностике, а также средств, предназначенных для радиотерапии.
Предпосылкой целенаправленной и эффективной терапии является, как очевидно, точность постановки диагноза. За прошедшие годы именно в области диагностики был достигнут значительный прогресс, о чем свидетельствуют, например, современные методы ЯМР-диагностики, которая позволяет с высокой точностью избирательно визуализировать практически любую анатомическую деталь. Однако во многих случаях соответствующие структуры становятся визуально различимы только при применении контрастных веществ. Помимо этого существует также возможность придания контрастным веществам таких свойств, благодаря которым они приобретают способность избирательно накапливаться в требуемых структурах-мишенях. Благодаря этому удается повысить точность визуализации определенных структур организма при одновременном снижении дозы контрастного вещества, в которой его требуется вводить в организм пациента для достижения необходимого эффекта.
Для применения в качестве контрастных веществ при ЯМР-диагностике пригодны хелатные комплексы парамагнитных металлов. Теоретические и практические аспекты применения хелатных соединений гадолиния(III) в качестве контрастных веществ при ЯМР-диагностике подробно рассматриваются в обзорной статье Р.Caravan и др., опубликованной в Chem. Rev.99, 1999, cc.2293-2352.
Интенсивность изображения при исследованиях методом протонного ЯМР определяется в основном протонами воды. Она зависит от времени ядерной релаксации. Комплексы парамагнитных переходных металлов и лантаноидов сокращают время релаксации соседних протонов за счет диполярных взаимодействий. Получение изображений при диагностике методом протонного ЯМР обеспечивается не за счет непосредственного, а за счет косвенного детектирования парамагнитных контрастных веществ на основе того факта, что они способны изменять время релаксации соседних протонов, таких как протоны воды. Предпочтительными для применения при ЯМР-диагностике парамагнитными катионами металлов являются благодаря их высокому магнитному моменту и высокой релаксационной эффективности катионы Gd3+, Fe3+, Mn2+.
Важной физической величиной, описывающей релаксационные свойства протонов, является время их продольной релаксации T1. Ткани, для которых характерно короткое время релаксации T1, в целом дают изображения более высокой интенсивности по сравнению с тканями, для которых характерно более длительное время релаксации. Если для определенного парамагнитного иона построить график зависимости величины, обратной его измеренному времени релаксации T1, от его концентрации с, то такой график будет иметь вид прямой с наклоном R. Подобный наклон называют также релаксационностью, которая является мерой, характеризующей способность соответствующего парамагнитного иона сокращать время релаксации соседних протонов.
Равным образом в области биологических и медицинских исследований уже достаточно давно известно применение радиофармацевтических препаратов в диагностических и терапевтических целях. Подобные радиофармацевтические препараты используются главным образом для визуализации определенных структур организма, таких, например, как скелет, различные органы или ткани. Радиоактивные средства для возможности их применения в диагностических целях должны обладать способностью после их введения в организм пациента специфически накапливаться непосредственно в тех структурах организма, которые требуется исследовать. Такие локально накапливающиеся в организме радиоактивные средства можно после их введения обнаруживать, регистрировать с помощью графопостроителя или сцинтиграфировать с использованием соответствующих детекторов, таких, например, как сцинтилляционные камеры или иные пригодные для этой цели средства и методы регистрации. По распределению и относительной интенсивности детектированного излучения, испускаемого радиоактивным средством, можно определить место его нахождения в исследуемой структуре и таким путем визуализировать наличие аномалий в структурах организма и в выполняемых ими функциях, патологические изменения и т.д.
Аналогичным образом радиофармацевтические препараты можно использовать и в качестве терапевтических средств для облучения определенных больных тканей или областей организма. Для подобного лечения требуется получение радиоактивных терапевтических средств, способных накапливаться в определенных структурах, органах или тканях.
Требуемые ионы по причине их отчасти сравнительно высокой токсичности обычно вводят в организм не в виде их водорастворимых солей, а в виде хелатных комплексов. Такие хелатные комплексы могут практически в неизменном виде выводиться из организма. Чем меньше размеры присутствующих в растворе комплексов, тем меньше их момент инерции и тем выше скорость их вращения в растворе (Tumbling Motion Time). Соответственно чем выше скорость вращения комплекса, тем ниже его релаксационность. Тем самым релаксационность возрастает с увеличением молекулярной массы всего комплекса. Высокую молекулярную массу комплексов можно обеспечить за счет их связывания с макромолекулами. Эффективное контрастное вещество для ЯМР-диагностики должно помимо прочего обладать высоким показателем релаксационности.
Конъюгаты из Gd-ДТПУ (диэтилентриаминопентауксусная кислота) с альбумином описаны, например, у M.D.Ogan и др. в Invest. Radiol. 22, 1987, cc.665-671, а также у U.Schmiedl и др. в Radiology 162, 1987, cc.205-210. В WO 95/31444 описаны конъюгаты из макроциклических комплексов металлов и биомолекул. Для повышения избирательности контрастных веществ в WO 01/08712 было предложено контрастное вещество, которое содержит по меньшей мере два представляющих собой хелатные соединения металлов фрагмента в качестве улучшающих качество изображения групп и по меньшей мере два "связывающихся с мишенью фрагмента", обеспечивающих в организме присоединение молекулы контрастного вещества к требуемой молекуле-мишени или органу-мишени.
Согласно WO 97/02051 крупные молекулы контрастных веществ с высокой молекулярной массой получают путем встраивания макроциклических комплексов металлов в каскадные полимеры.
В ЕР-А 0565930 описаны производные тетраазациклододекантетрауксусной кислоты, которые обладают высокой стабильностью и хорошей растворимостью из-за отсутствия у них заряда и которые пригодны для присоединения к биомолекулам.
Описанное выше присоединение макроциклических комплексов металлов к биомолекулам позволяет повысить не только релаксационность контрастного вещества, но и его избирательность. Чем выше релаксационность контрастного вещества, тем в меньшем количестве его требуется вводить в организм пациента и тем выше контрастность получаемого изображения. По этой причине желательно далее получение контрастных веществ для ЯМР-диагностики с максимально высокой релаксационностью.
В соответствии с этим в основу настоящего изобретения была положена задача предложить более эффективные контрастные вещества для ЯМР-диагностики и рентгенодиагностики, а также средства для радиотерапии. Такие контрастные вещества для ЯМР-диагностики должны обладать прежде всего максимально высокой релаксационностью и способностью с максимально высокой избирательностью накапливаться в требуемом месте в организме.
Согласно изобретению неожиданно было установлено, что указанную задачу можно решить за счет присоединения к 1,4,7,10-тетраазациклододекановому макроциклу особых лигандов. Новые качественные свойства предлагаемых в изобретении соединений проявляются при их присоединении к биомолекулам. За счет присоединения к макроциклу особых лигандов достигается высокая релаксационность получаемого в результате контрастного вещества и помимо этого обеспечивается возможность точного ее регулирования с учетом цели применения предлагаемых в изобретении соединений.
В соответствии с этим настоящее изобретение относится к соединениям формулы I
в которой
Z обозначает атом водорода или по меньшей мере два Z представляют собой эквивалент иона металла,
В обозначает атом водорода или С1-С4алкильный остаток,
R обозначает атом водорода или прямой, разветвленный либо циклический насыщенный либо ненасыщенный C1-С10алкильный или арильный остаток, который необязательно замещен карбоксильной группой, группой -SO3Н или группой -РО3Н2, при этом алкильная цепь C1-С10алкильного остатка необязательно содержит арильную группу и/или 1-2 атома кислорода,
при условии, что остатки В и R оба одновременно не обозначают атомы водорода,
А обозначает прямую либо разветвленную, насыщенную либо ненасыщенную C1-С30углеводородную цепь, которая необязательно содержит 1-5 атомов кислорода, 1-5 атомов азота и/или 1-5 -NR'-остатков, где R' имеет указанные для R, но выбираемые независимо от него значения, и необязательно замещена 1-3 карбоксильными группами, 1-3 группами -SO3Н, 1-3 группами -РО3Н2 и/или 1-3 атомами галогена и в которой 1-3 атома углерода необязательно присутствуют в виде карбонильных групп, при этом такая цепь или ее часть может быть замкнута в кольцо, и которая далее имеет такую структуру, что Х по меньшей мере через 3 атома связан с атомом азота, к которому присоединен остаток А, и
Х представляет собой группу, способную вступать в реакцию с биомолекулой, включая соли этого соединения, и к его применению для получения конъюгата с биомолекулой.
Соответствующее макроциклическое соединение, у которого каждый из четырех атомов азота макроциклической структуры замещен группой -СН(CO2Н)СН2СН2CO2Н, описано у Р.Caravan и др., Chem. Rev.99, 1999, cc.2293-2352. Однако возможное применение этого соединения для получения конъюгатов с биомолекулами в этой публикации не рассматривается. В WO 97/02051 описаны макроциклические соединения, в которых А представляет собой остаток -CH(R4)-CO-NR2-U6- и которые используются в качестве промежуточных соединений для получения каскадных полимеров. В ЕР-А-0565930 описаны макроциклические соединения, в которых А представляет собой остаток -CH(R3)-C(O)-NH-(CH2)1-6-NH-D-. При этом о повышении релаксационности таких соединений за счет использования определенных заместителей в этой публикации ничего не говорится. В соответствии с этим подобные соединения не подпадают под определение соединения формулы I, указанное в п.1 формулы изобретения, и исключены из объема настоящего изобретения.
Под "алкильным остатком" в контексте настоящего изобретения подразумевается, если не указано иное, насыщенный или ненасыщенный, неразветвленный или разветвленный либо циклический алкильный остаток с указанным числом атомов углерода. Если такой остаток может содержать другие группы или атомы, то в этом случае в контексте настоящего изобретения подразумевается, что подобные другие группы или атомы могут присутствовать в дополнение к уже имеющимся у остатка атомам и могут находиться в любом его положении, включая концевые положения.
Под "арилом" в контексте настоящего изобретения предпочтительно подразумеваются фенил, бисфенил, пиридил, фуранил, пирролил и имидазолил. Особо предпочтительным при этом является фенил.
Под "углеводородной цепью", которая полностью или частично может быть замкнута в кольцо, в контексте настоящего изобретения предпочтительно подразумевается углеводородная цепь, такая как алкильная цепь, которая, например, может содержать алифатическое или ароматическое, необязательно гетероциклическое, 5- или 6-членное кольцо (например, фенил(ен), пиридил(ен) или циклогексил(ен)) либо состоять из него.
В предлагаемом в изобретении соединении формулы I три из четырех атомов азота макроциклического кольца замещены необязательно замещенными уксуснокислыми, соответственно метилкарбоксилатными остатками. Эти остатки способствуют координации, соответственно компенсации заряда координированного иона металла. Поэтому Z обозначает либо атом водорода, либо эквивалент иона металла.
Уксуснокислые, соответственно метилкарбоксилатные остатки у трех из атомов азота макроциклического кольца дополнительно могут быть замещены заместителем R. Помимо этого макроциклическое кольцо может быть замещено по четырем его атомам углерода дополнительным заместителем В. Характерная особенность предлагаемых в изобретении соединений заключается в том, что оба заместителя В и R одновременно не могут обозначать атомы водорода, т.е. макроциклическое кольцо должно быть замещено такими дополнительными заместителями непосредственно по его кольцевым атомам и/или по уксуснокислым, соответственно метилкарбоксилатным заместителям его атомов азота. За счет соответствующего выбора подобных дополнительных заместителей обеспечивается целенаправленное точное регулирование релаксационности полученного с применением предлагаемого в изобретении соединения контрастного вещества.
Заместитель В может представлять собой атом водорода или С1-С4алкильный остаток. Предпочтительными С1-С4алкильными остатками являются метил, этил и изопропил.
Если в предлагаемых в изобретении соединениях формулы I В представляет собой атом водорода, то R обозначает прямой, разветвленный и/или циклический, насыщенный либо ненасыщенный C1-С10алкильный (предпочтительно С5-С10алкильный) или арильный остаток, который необязательно замещен карбоксильной группой, группой -SO3Н или группой -РО3Н2, при этом алкильная цепь C1-С10алкильного остатка необязательно содержит арильную группу и/или 1-2 атома кислорода. В качестве алкильных остатков предпочтительны неразветвленные или разветвленные, предпочтительно насыщенные C1-С10- и прежде всего С1-С4алкильные остатки, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил, а также циклогексил. В другом варианте предпочтительны неразветвленные, разветвленные или циклические, предпочтительно насыщенные С5-С10алкильные остатки, такие как пентил, гексил, циклогексил, гептил, октил, нонил и децил. C1-С10алкильный остаток, значение которого может иметь заместитель R, необязательно может быть замещен карбоксильной группой, группой -SO3Н или группой -РО3Н2. В качестве предпочтительных примеров подобных замещенных алкильных групп можно назвать -СН2-СООН и -С(СН3)2-СООН. Помимо этого алкильная цепь C1-С10алкильного остатка может содержать арильную группу и/или 1-2 атома кислорода. Эти арильная группа и атомы кислорода могут находиться в любом положении в алкильной цепи. Арильная группа может, кроме того, находиться также в концевом положении в алкильной цепи и образовывать совместно с атомом кислорода арилоксигруппу. Наиболее предпочтительной арильной группой является прежде всего фенильная группа.
Предпочтительной алкильной цепью в качестве значения заместителя R, которая необязательно содержит арильную группу и 1-2 атома кислорода, является остаток формулы -(СН2)m-(O)n-(фенилен)р-Y, где m обозначает целое число от 1 до 5, n обозначает 0 или 1, p обозначает 0 или 1, a Y обозначает атом водорода, метоксиостаток, карбоксильную группу, -SO3Н или -РО3Н2. Заместитель Y находится при этом предпочтительно в пора-положении.
Арильный остаток в качестве значения заместителя R предпочтительно представляет собой фенильный остаток, который необязательно замещен карбоксильной группой, группой -SO3Н или группой -РО3Н2.
В том случае, когда В обозначает атом водорода, R предпочтительно представляет собой изопропил, изобутил, трет-бутил, неразветвленный либо разветвленный С5-С10алкильный остаток, циклогексил, -СН2-СООН, -С(СН3)2-СООН, фенильный остаток или остаток формулы -(CH2)m-(O)n-(фенилен)р-Y, где m обозначает целое число от 1 до 5, n обозначает 0 или 1, p обозначает 0 или 1, a Y обозначает атом водорода, метоксиостаток, карбоксильную группу, -SO3Н или -РО3Н2, наиболее предпочтительно R представляет собой изопропил, циклогексил или фенил.
Замещенное макроциклическое кольцо соединения формулы I может быть присоединено к биомолекуле посредством группы X, способной вступать в реакцию с биомолекулой, через спейсер А.
При этом такой спейсер А представляет собой прямую либо разветвленную, насыщенную либо ненасыщенную C1-С30углеводородную цепь, которая необязательно содержит 1-5 атомов кислорода, 1-5 атомов азота и/или 1-5 -NR'-остатков, где R' имеет указанные выше для R, но выбираемые независимо от него значения, и необязательно замещена 1-3 карбоксильными группами, 1-3 группами -SO3Н, 1-3 группами -РО3Н2 и/или 1-3 атомами галогена и в которой 1-3 атома углерода необязательно присутствуют в виде карбонильных групп, при этом такая цепь или ее часть может быть замкнута в кольцо, и которая далее имеет такую структуру, что Х по меньшей мере через 3 атома связан с атомом азота, к которому присоединен остаток А.
Подобный спейсер должен иметь по меньшей мере три, предпочтительно по меньшей мере четыре, атома, расположенных в цепь между атомом азота макроциклического кольца и заместителем X. Под такой цепью атомов при этом подразумевается также кратчайшее соединение между атомом азота макроциклического кольца и заместителем Х в том числе и через кольцо. При подобном трактовании в качестве спейсера с цепью из четырех атомов могла бы рассматриваться, например, пара-фениленовая группа, а в качестве спейсера с цепью из трех атомов - мета-фениленовая группа. При определении длины такой цепи атомов подсчитывается общее количество атомов вне зависимости от того, является ли каждый из них атомом углерода, азота или кислорода. Заместители у этих атомов или боковые цепи не относятся к числу образующих эту цепь атомов.
Для -А-Х предпочтительно выбирать отличное от заместителей -CH(R)-CO2Z значение.
Спейсер А предпочтительно представлять в виде остатка A'-U, где А' присоединен к атому азота макроциклического кольца, a U присоединен к X. При этом А' предпочтительно обозначает
а)связь,
б) группу -CH(СО2Н)-,
в) группу формулы
в которой Q обозначает атом водорода, C1-С10алкильный остаток, который необязательно замещен карбоксильной группой, или арильный остаток, который необязательно замещен карбоксильной группой, С1-С15алкоксигруппой, арилоксигруппой или атомом галогена, a R' имеет указанные для R, но выбираемые независимо от него значения, или
г) группу формулы
в которой о обозначает 0 или 1, а кольцо необязательно аннелировано с бензольным кольцом, которое при его наличии может быть замещено метоксигруппой, карбоксильной группой, группой -SO3Н или группой -РО3Н2.
В представленных выше в п.п. в) и г) группах их обозначенные символом положения присоединены к смежным группам, при этом α-положение связано с атомом азота макроциклического кольца, а β-положение связано с U.
В группе формулы
Q предпочтительно обозначает линейный либо разветвленный C1-С10-, прежде всего С1-С4алкильный остаток, такой как метил, этил или изопропил, или циклогексильный остаток. Эти остатки необязательно могут быть замещены карбоксильной группой, при этом предпочтителен карбоксиметильный остаток. Предпочтительным арильным остатком в качестве значения заместителя Q является фенил. Такой арильный остаток может быть замещен карбоксильной группой, С1-С15алкоксигруппой, арилоксигруппой, прежде всего феноксигруппой, или атомом галогена, например фтором, хлором, бромом или иодом, но прежде всего фтором или хлором. Если арильным остатком является фенильный остаток, то он предпочтительно замещен в пара-положении одной из указанных групп. Наиболее предпочтительными группами в качестве значений заместителя Q являются метил, фенил и n-додеканоксифенил.
R' имеет указанные выше для заместителя R значения, которые, однако, могут выбираться независимо от значений этого заместителя R. Наиболее предпочтительно R' обозначает атом водорода.
Предпочтительно А' обозначает связь, -СН(CO2Н)-, -С(СН3)Н-СО-NH-, -С(фенил)Н-СО-NH-, -С(n-додеканоксифенил)Н-СО-NH-,
где R1 обозначает -ОСН3, -CO2H, -SO3H или -РО3Н2.
Если спейсер А представить в виде остатка A'-U, где А' имеет указанное выше значение, то U предпочтительно обозначает прямую либо разветвленную, насыщенную либо ненасыщенную C1-С30углеводородную цепь, которая необязательно содержит 1-3 атома кислорода, 1-3 атома азота и/или 1-3 -NR''-остатка, где R'' имеет указанные выше для R, но выбираемые независимо от него значения, и в которой 1-3 атома углерода необязательно присутствуют в виде карбонильных групп, при этом такая цепь или ее часть может быть замкнута в кольцо. Наиболее предпочтительно U обозначает арильный остаток или С1-С20алкильный остаток (предпочтительно линейный или по меньшей мере частично циклический и насыщенный), который необязательно содержит 1-3 атома кислорода, 1-3 -NR''-остатка, 1-2 фениленовых остатка и/или пиридиленовый остаток и в котором 1-3 атома углерода необязательно присутствуют в виде карбонильных групп и который далее необязательно замещен арильным остатком (например, фенилом). А' и U совместно должны образовывать такую структуру, чтобы Х по меньшей мере через три атома был связан с атомом азота, к которому присоединен А'. Такая цепь из по меньшей мере трех атомов рассмотрена выше при раскрытии значений заместителя А.
Предпочтительным арильным остатком в качестве значения заместителя U является фенильный остаток. Предпочтительным С1-С20алкильным остатком в качестве значения заместителя U является линейный, насыщенный C1-С10алкильный остаток, циклогексильный остаток или циклогексил-С1-С5алкильный остаток. Алкильные фрагменты в этих остатках необязательно могут быть прерваны 1 атомом кислорода, 1 фениленовым остатком и/или 1 пиридиленовым остатком или могут содержать -СО-NR''-остаток либо могут быть замещены фенилом. К предпочтительным значениям заместителя U относятся -СН2-, -(СН2)5-, -(СН2)10-, -фенилен-О-СН2-, -фенилен-O-(СН2)3, -фенилен-O-(СН2)10-, -СН2-фенилен-, -циклогексилен-О-СН2-, -фенилен-, -С(фенил)Н-, -СН2-пиридилен-О-СН2-, -СН2-пиридилен- и -СН2-СО-NH-СН2-СН2-. В указанных выше в качестве предпочтительных значений заместителя U группах фениленовые группы предпочтительно замещены в пара-положении, а пиридиленовые группы предпочтительно представляют собой пирид-2,5-иленовые или пирид-2,4-иленовые группы.
Предпочтительными группами в качестве значений спейсера А являются следующие:
Через спейсер А в соединениях формулы I группа Х присоединена к макроциклическому кольцу. Под такой группой Х подразумевается группа, способная вступать в реакцию с биомолекулой. В качестве примеров подобной группы можно назвать карбоксил (-СООН), активированный карбоксил, аминогруппу (-NH2), изоцианат (-NCO), изотиоцианат (-NCS), гидразин (-NHNH2), семикарбазид (-NHCONHNH2), тиосемикарбазид (-NHCSNHNH2), хлорацетамид (-NHCOCH2Cl), бромацетамид (-NHCOCH2Br), иодацетамид (-NHCOCH2I), ациламиногруппу, такую как ацетиламиногруппа (-NHCOCH3), смешанные ангидриды, азид, гидроксид, сульфонилхлорид, карбодиимид или группу формулы
где Hal обозначает атом галогена.
Под активированной карбоксильной группой выше подразумеваются такие карбоксильные группы, которые дериватизированы таким образом, что они облегчают реакцию с биомолекулой. Конкретные группы, которые могут использоваться для подобного активирования, хорошо известны в данной области, и в этом отношении можно сослаться на публикацию М. и А.Bodanszky, "The Practice of Peptide Synthesis", изд-во Springer Verlag, 1984. В качестве примеров при этом можно назвать аддукты карбоновой кислоты с карбодиимидами или активированных сложных эфиров, таких как гидроксибензотриазоловый эфир. Наиболее предпочтительно активированную карбоксильную группу в качестве значения заместителя Х выбирать из
и
Z в формуле I обозначает атом водорода или эквивалент иона металла. Ион какого именно металла должен присутствовать в предлагаемом в изобретении соединении в образующем комплекс виде, зависит от предусматриваемого применения полученных с использованием предлагаемых в изобретении соединений конъюгатов с биомолекулой. Соответствующие конъюгаты могут использоваться, например, при ЯМР-диагностике, рентгенодиагностике и радиотерапии, а также при нейтронозахватной терапии. Наиболее предпочтительно использовать такие конъюгаты в качестве контрастных веществ при ЯМР-диагностике.
Комплексные соединения для ЯМР-диагностики можно получать методом, описанным в ЕР 71564, ЕР 130934 и DE-OS 3401052. С этой целью оксид или соль (например, хлорид, нитрат, ацетат, карбонат или сульфат) соответствующего металла растворяют или суспендируют в воде и/или низшем спирте (таком как метанол, этанол или изопропанол) и подвергают взаимодействию с раствором или суспензией эквивалентного количества предлагаемого в изобретении комплексообразователя.
Если такие комплексообразователи предусматривается использовать для получения рентгенодиагностических или радиотерапевтических средств, то комплексные соединения можно получать из комплексообразователей по методам, описанным в "Radiotracers for Medical Applications", т.I, изд-во CRC-Press, Boca Raton, Florida.
Предлагаемые в изобретении соединения могут использоваться в следующих целях:
1. для ЯМР-диагностики в виде их комплексов с ионами парамагнитных элементов с порядковыми номерами 21-29, 42, 44 и 58-70, при этом в качестве примера приемлемых ионов можно назвать ионы хрома(III), железа(II), кобальта(II), никеля(II), меди(II), празеодима(III), неодима(III), самария(III) и иттербия(III), а наиболее предпочтительны для ЯМР-диагностики благодаря их высокому магнитному моменту ионы гадолиния(III), тербия(III), диспрозия(III), гольмия(III), эрбия(III), марганца(II) и железа(III);
2. для рентгенодиагностики и радиотерапии в виде их комплексов с радиоизотопами элементов с порядковыми номерами 26, 27, 29, 31, 32, 37-39, 43, 46, 47, 49, 61, 62, 64, 67, 70, 71, 75, 77, 82 и 83.
Предлагаемые в изобретении соединения и прежде всего их конъюгаты с биомолекулами отвечают самым различным требованиям, которыми определяется их пригодность для применения в качестве контрастных веществ в ЯМР-томографии. Так, в частности, эти соединения, соответственно их конъюгаты с биомолекулами позволяют за счет увеличения интенсивности сигнала после их перорального или парентерального введения повысить информативность изображения, полученного с помощью ЯМР-томографа.
Помимо этого такие соединения, соответственно их конъюгаты с биомолекулами обладают высокой эффективностью, которая необходима для снижения концентрации вводимых в организм чужеродных веществ до минимально возможного уровня, и вместе с тем обладают хорошей переносимостью, которая необходима для сохранения неинвазивного характера исследований.
Благодаря хорошей растворимости предлагаемых в изобретении соединений и их конъюгатов с биомолекулами в воде и их малой осмомолярности появляется возможность получать на их основе высококонцентрированные растворы, что позволяет поддерживать объемную перегрузку системы кровообращения в допустимых пределах и компенсировать разбавление таких растворов жидкостями организма, т.е. водорастворимость средств для ЯМР-диагностики должна в 100-1000 раз превышать водорастворимость средств для ЯМР-спектроскопии. Предлагаемые в изобретении соединения обладают далее не только высокой стабильностью in vitro, но и проявляют неожиданно высокую стабильность in vivo, благодаря чему высвобождение или обмен не ковалентно связанных в комплексах ионов, которые по своей природе являются токсичными, происходит лишь крайне медленно в течение промежутка времени, за который новые контрастные вещества полностью выводятся из организма.
Предлагаемые в изобретении комплексные соединения могут, кроме того, эффективно применяться в качестве реагентов с магнитной восприимчивостью и в качестве реагентов сдвига в ЯМР-спектроскопии in vivo.
Предлагаемые в изобретении соединения и их конъюгаты с биомолекулами благодаря их оптимальным радиоактивным свойствам и высокой стабильности содержащихся в них комплексных соединений пригодны также для применения в качестве рентгенодиагностических и радиотерапевтических средств. Более подробно применение таких средств и их дозировка описаны, например, в публикации "Radiotracers for Medical Applications", изд-во CRC-Press, Boca Raton, Florida, 1983, а также в Eur. J. Nucl. Med. 17, 1990, cc.346-364, и в Chem. Rev.93, 1993, cc.1137-1156.
Для применения при однофотонной эмиссионной компьютерной томографии (ОФЭКТ) пригодны комплексы с изотопами 111In и 99mTc.
В качестве примера другого метода визуализации, основанного на применении радиоизотопов, можно назвать позитронно-эмиссионную томографию, где используются испускающие протоны изотопы, такие, например, как 43Sc, 44Sc, 52Fe, 55Co, 68Ga, 64Cu, 86Y и 94mTc (W.D.Heiss и М.Е.Phelps, Positron Emission Tomography of Brain, изд-во Springer Verlag, Berlin, Heidelberg, New York, 1983).
Предлагаемые в изобретении соединения и их конъюгаты с биомолекулами могут, как неожиданно было установлено, применяться также для дифференциации злокачественных и доброкачественных опухолей в областях без гематоэнцефалического барьера.
Предлагаемые в изобретении соединения и их конъюгаты с биомолекулами отличаются также тем, что они полностью выводятся из организма, проявляя тем самым хорошую переносимость.
Поскольку предлагаемые в изобретении соединения и прежде всего их конъюгаты с биомолекулами накапливаются в злокачественных опухолях (отсутствие диффузии в здоровые ткани, но высокая проницаемость через опухолевые сосуды), их можно также применять в качестве вспомогательных средств при лучевой терапии злокачественных опухолей. Отличие лучевой терапии от соответствующей диагностики состоит лишь в количестве и типе используемого изотопа. Целью при этом является разрушение опухолевых клеток под воздействием высокоэнергетического (мощного) коротковолнового излучения с предельно малым радиусом действия. При этом используется взаимодействие содержащихся в комплексных соединениях металлов (таких, например, как железо или гадолиний) с ионизирующим излучением (например, с рентгеновскими лучами) или с нейтронным излучением. Благодаря этому эффекту удается значительно повысить локальную дозу облучения в том месте, где находится комплекс металла (например, в опухолях). Для обеспечения такой же дозы облучения в злокачественной ткани применение подобных комплексов металлов позволяет существенно снизить дозу облучения здоровых тканей и предотвратить тем самым нежелательные для пациентов побочные действия. Поэтому предлагаемые в изобретении конъюгаты с комплексами металлов пригодны также для применения в качестве радиосенсибилизирующих веществ при лучевой терапии злокачественных опухолей (например, за счет использования эффектов Мессбауэра или при нейтронозахватной терапии). В качестве примера приемлемых испускающих β-излучение ионов можно назвать 46Sc, 47Sc, 48Sc, 72Ga, 73Ga, 90Y, 67Cu, 109Pd, 111Ag, 149Pm, 153Sm, 166Ho, 177Lu, 186Re и 188Re. Предпочтительны при этом ионы 90Y, 177Lu, 72Ga, 153Sm и 67Cu. В качестве приемлемых испускающих α-излучение ионов с малым периодом полураспада можно назвать, например, 211At, 211Bi, 212Bi, 213Bi и 214Bi, предпочтителен из которых 212Bi. Приемлемым испускающим фотоны и электроны ионом является 158Gd, который можно получить из 157Gd путем захвата нейтронов.
Если предлагаемое в изобретении соединение или его конъюгат с биомолекулой предназначены для применения при лучевой терапии в соответствии с методикой, предложенной R.L.Mills и др. (Nature, т.336, 1988, с.787), то центральный ион должен быть производным мессбауэровского изотопа, такого, например, как 57Fe или 151Eu.
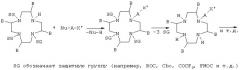
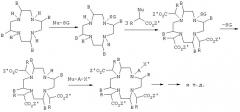
Возможно еще присутствующие свободные карбоксигруппы нейтрализуют с помощью неорганических оснований, например гидроксидов, карбонатов или бикарбонатов натрия, калия, лития, магния или кальция, и/или органических оснований, таких, в частности, как первичные, вторичные и третичные амины, например этаноламин, морфолин, глюкамин, N-метил- и N,N-диметилглюкамин, а также основных аминокислот, таких, например, как лизин, аргинин и орнитин, либо амидов исходно нейтральных или кислых аминокислот.
Для получения нейтральных комплексных соединений требуемое основание можно, например, добавлять к кислым солям комплексов в водном растворе или суспензии в таком количестве, при котором достигается точка нейтральности. Полученный раствор можно затем досуха концентрировать в вакууме. Образовавшиеся нормальные соли часто предпочтительно осаждать добавлением смешивающихся с водой растворителей, таких, например, как низшие спирты (метанол, этанол, изопропанол и другие), низшие кетоны (ацетон и другие), полярные простые эфиры (тетрагидрофуран, диоксан, 1,2-диметоксиэтан и другие), с получением таким путем легко выделяемых и хорошо поддающихся очистке кристаллизатов. Было установлено, что соответствующее основание предпочтительно добавлять к реакционной смеси уже в процессе комплексообразования, что позволяет на одну сократить количество стадий в способе получения предлагаемых в изобретении соединений.
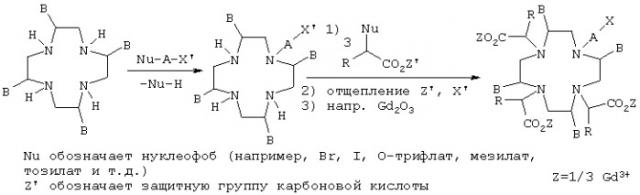
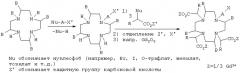
Предлагаемые в изобретении соединения формулы I можно получать известными методами. Так, например, соединения формулы I можно получать способом, в соответствии с которым соединение формулы II
в которой В имеет указанные выше значения, необязательно после введения защитных групп для атомов азота, подвергают взаимодействию с молекулами Nu-A-X' и Nu-CH(R)-CO2Z', где А и R имеют указанные выше значения, Nu обозначает нуклеофоб, X' соответствует заместителю Х или защищенной форме заместителя X, который имеет указанные выше значения, a Z' обозначает атом водорода, эквива