Меченный тритием ацилкоензим а
Иллюстрации
Показать всеИзобретение относится к новому меченому аналогу физиологически активного соединения - меченному тритием ацил-коензиму А общей формулы I:
где: Acyl - [5,6-3Н](5,6-дигидро)арахидоноил или [6,7-3Н]линолеил. 2 ил.
Реферат
Изобретение относится к области органической химии и может найти применение в аналитической химии, биоорганической химии, биохимии и прикладной медицине.
При изучении физиологически активных соединений необходимы их меченые аналоги.
Известно, что замена атомов соединений на их меченые аналоги не приводит к изменению каких-либо свойств исходного соединения (Evans Е.А. - Tritium and its compounds. London, Butterworths, 1974, p.48).
Известен ацилкоензим А формулы I:
Данное соединение необходимо для изучения низкоактивных ферментативных систем в мозге (J.E.Bishop, A.K.Hajra // Analytical Biochem. 1980. Vol.106. 344-350. The Merck Index 1999 N2531).
Однако меченный тритием ацилкоензим А не описан.
Техническим результатом, достигаемым настоящим изобретением, является расширение ассортимента меченых аналогов физиологически активных соединений.
Достигается указанный технический результат получением высокомеченного тритием ацилкоензима А: [5,6-3Н](5,6-дигидро)арахидоноили [6,7-3Н]линолеил-коэнзима А формулы I:
где: Acyl - [5,6-3H](5,6-дигидро)арахидоноил - CH3(CH2)4(CH=CHCH2)3-CH3H-CH3H-(CH2)3-CO- или [6,7-3H]линолеил - CH3(CH2)4(CH=CHCH2)2-CH3H-CH3H-(CH2)4-CO-.
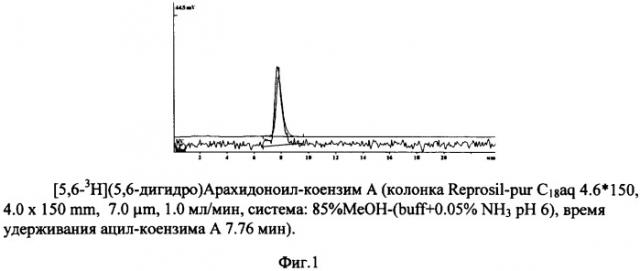
На фиг.1 представлен результат ВЭЖХ [5,6-3Н](5,6-дигидро)Арахидоноил-коензима А (колонка Reprosil-pur C18aq 4.6·×150, 4.0×150 мкм, 7.0 мкм, 1.0 мл/мин, система: 85% MeOH-(buff+0.05% NH3 pH 6), время удерживания ацилкоензима А 7.76 мин).
На фиг.2 представлен результат ВЭЖХ [6,7-3Н]Линолеил-коензим А. (колонка Reprosil-pur C18aq 4.6·150, 4.0×150 мм, 7.0 мкм, 1.0 мл/мин, система: 85% МеОН-(buff+0.05% NH3 pH 6), время удерживания ацилкоензима А 6.01 мин).
Ниже приведены примеры реализации изобретения.
Пример I. Синтез [5,6-3Н](5,6-дигидро)арахидоновой кислоты
а) Раствор 10 мг арахидоновой кислоты в 0.4 мл диоксана помещали в реакционную ампулу, в которой находилось 20 мг катализатора Линдлара на основе 5% Pd/BaSO4. Ампулу замораживали жидким азотом, вакуумировали и заполняли газообразным тритием до давления 333 ГПа. Селективное гидрированием проводили в течение 1 ч при перемешивании. Предварительную очистку проводили твердофазной экстракцией на патроне Diasorb C16, основная часть метки вышла в системе 90% метанола, содержащей 0.1% трифторуксусной кислоты. После двух хроматографий (Silasorb 13 C18, 10×250 мм, система: метанол-уксусная кислота-трифторуксусная кислота, 100:0.1:0.01 и Kromasil 100 C18, 8×150 мм, система: метанол-вода-уксусная кислота-трифторуксусная кислота, 95:5:0.1:0.01) получали [5,6-3Н](5,6-дигидро)арахидоновую кислоту с выходом - 12%, молярной радиоактивностью - 27 Ки/ммоль, радиохимической чистотой - 99%.
б) При использовании катализатора Линдлара на основе 5% Pd/СаСО3 фирмы Merck выход достигал 3%.
Пример 2. Синтез [6,7-3Н]линолевой кислоты
а) Раствор 10 мг γ-линоленовой кислоты в 0.4 мл диоксана помещали в реакционную ампулу, в которой находилось 20 мг катализатора Линдлара на основе 5% Pd/BaSO4.
Ампулу замораживали жидким азотом, вакуумировали и заполняли газообразным тритием до давления 333 гПа. Селективное гидрированием проводили в течение 1 ч при перемешивании. Предварительную очистку проводили твердофазной экстракцией на патроне Diasorb С16, основная часть метки вышла в системе 90% метанола, содержащей 0.1% трифторуксусной кислоты. После двух хроматографий (Silasorb 13 C18, 10×250 мм, система: метанол-уксусная кислота-трифторуксусная кислота, 100:0.1:0.01 и Kromasil 100 C18, 8×150 мм, система: метанол-вода-уксусная кислота-трифторуксусная кислота, 95:5:0.1:0.01) получали [6,7-3Н]линолевую кислоту с выходом - 22%, молярной радиоактивностью - 22 Ки/ммоль, радиохимической чистотой - 99%.
б) При использовании катализатора Линдлара на основе 5% Pd/СаСО3 фирмы Merck выход достигал 10%.
Пример 3. Синтез меченного тритием [5,6-3Н](5,6-дигидро)арахидоноил-коензима А.
[5,6-3Н](5,6-дигидро)Арахидоновую кислоту (100 мКи) в 0.2 мл бензола переносили в ампулу и упаривали в токе аргона. Затем упаривание с бензолом повторяли еще дважды. К остатку прибавляли 0.4 мл смеси оксалилхлорида и бензола (1:2). Ампулу герметизировали и перемешивали на роторе 1 ч при 35°С. Содержимое ампулы тщательно упаривали в токе аргон. Остаток растворяли в 0.2 мл тетрагидрофурана (тетрагидрофуран непосредственно перед опытом необходимо профильтровать через прокаленную окись алюминия) и быстро, как только возможно, в токе аргона прибавляли 1.6 мл смеси тетрагидрофурана (1 мл) с раствором 6 мг коензима А в 0.15 М водной NaHCO3 (pH 9.0) при интенсивном перемешивании. Ампулу герметизировали и перемешивали на роторе 1 ч при 35°С. Затем тетрагидрофуран из реакционной смеси упаривали в токе аргона, Водный раствор подкисляли 2 н. соляной кислотой до pH 6, добавляли метанол (конечная концентрация 5%) и выделяли искомый продукт методом ВЭЖХ (фиг.1).
Выход меченого препарата 76%, молярная радиоактивность 27 Ки/ммоль, радиохимическая чистота 97-98%.
Пример 4. Синтез [6,7-3Н]линолеил-коензима А.
[6,7-3Н]линолевую кислоту (100 мКи) в 0.2 мл бензола переносили в ампулу и упаривали в токе аргона. Затем упаривание с бензолом повторяли еще дважды. К остатку прибавляли 0.4 мл смеси оксалилхлорида и бензола (1:2). Ампулу герметизировали и перемешивали на роторе 1 ч при 35°С. Содержимое ампулы тщательно упаривали в токе аргон. Остаток растворяли в 0.2 мл тетрагидрофурана (тетрагидрофуран непосредственно перед опытом необходимо профильтровать через прокаленную окись алюминия) и быстро, как только возможно, в токе аргона прибавляли 1.6 мл смеси тетрагидрофурана (1 мл) с раствором 6 мг коензима А в 0.15 М водной NaHCO3 (pH 9.0) при интенсивном перемешивании. Ампулу герметизировали и перемешивали на роторе 1 ч при 35°С. Затем тетрагидрофуран из реакционной смеси упаривали в токе аргона. Водный раствор подкисляли 2 н. соляной кислотой до pH 6, добавляли метанол (конечная концентрация 5%) и выделяли искомый продукт методом ВЭЖХ.
Выход меченого препарата 80%, молярная радиоактивность 22 Ки/ммоль, радиохимическая чистота 97-98% (фиг.2).
Таким образом, получено новое высокомеченное тритием физиологически активное соединение.
Меченный тритием ацилкоензим А общей формулы I:
где
Acyl - [5,6-3H](5,6-дигидро)арахидоноил
или [6,7-3H]линолеил.