Новые ингибиторы дипептидилпептидазы iv и их применение для понижения кровяного давления
Иллюстрации
Показать всеПредложено применение ингибиторов дипептидилпептидазы (DPIV-ингибиторов) и, в частности, изолейцил-тиазолидина в качестве активного компонента фармацевтической композиции для понижения уровней кровяного давления у млекопитающих с диабетом. Показана стабилизация систолического давления у диабетических крыс и снижение его уровней со 170 (контрольные животные без изолейцил-тиазолидина) до 150 мм рт. ст. 8 з.п. ф-лы, 9 ил., 11 табл.
Реферат
Область техники
Настоящее изобретение относится к ингибиторам активности дипептидилпептидазы IV и дипептидилпептидаза IV-подобных ферментов и, в частности, к фармацевтическим композициям, содержащим вышеуказанные соединения, и применению указанных соединений для понижения уровней кровяного давления у млекопитающих и (лечения) связанных с этим расстройств.
Предшествующий уровень техники
Дипептидилпептидаза IV (DPIV) - сериновая протеаза, которая отщепляет N-концевые дипептиды от пептидной цепи, содержащей предпочтительно остаток пролина в предпоследнем положении. Хотя биологическая роль DPIV в системах млекопитающих полностью не установлена, полагают, что она играет важную роль в метаболизме нейропептидов, активации Т-клеток и проникновении ВИЧ (HIV) в лимфоидные клетки.
Настоящее изобретение обеспечивает новое использование DPIV-ингибиторов для профилактики и лечения состояний, опосредованных ингибированием DPIV и DPIV-подобных ферментов, в частности для понижения уровней кровяного давления и лечения родственных нарушений, и фармацевтических композиций, например, полезных для ингибирования DPIV и DPIV-подобных ферментов, и способ ингибирования активности вышеуказанных ферментов.
Данное изобретение относится к способу лечения, в частности к способу снижения уровней кровяного давления у млекопитающих и к соединениям и композициям для использования в вышеупомянутом способе. Дипептидилпептидаза IV (DPIV; EC 3.4.14.5; CD26) представляет сериновую протеиназу, расщепляющую пептидные связи, следующие после пролина (в меньшей степени после аланина, после серина или после глицина), которая экспрессируется в ряде тканей, включая эпителиальные клетки и подгруппу лейкоцитов. Кроме того, она представляет ассоциированную с мембраной эктопептидазу, которая демонстрирует свою активность во внеклеточном домене.
Примерами низкомолекулярных ингибиторов дипептидилпептидазы IV являются такие средства, как: производные тетрагидроизохинолин-3-карбоксамида, N-замещенные 2-цианопиролы и -пирролидины, N-(N'-замещенный глицил)-2-цианопирролидины, N-(замещенный глицил)тиазолидины, N-(замещенный глицил)-4-цианотиазолидины, амино-ацил-бороно-пролилингибиторы, циклопропил-конденсированные пирролидины и гетероциклические соединения. Ингибиторы дипептидилпептидазы IV описаны в патенте США 6380398, патенте США 6011155; патенте США 6107317; патенте США 6110949; патенте США 6124305; патенте США 6172081; международной публикации WO 95/15309, международной публикации WO 99/61431, WO 99/67278, международной публикации WO 99/67279, патенте DE 19834591, международной публикации WO 97/40832, патенте DE 196 16 486 C 2, международных публикациях WO 98/19998, WO 00/07617, WO 99/38501, WO 99/46272, WO 99/38501, WO 01/68603, WO 01/40180, WO 01/81337, WO 01/81304, WO 01/55105, WO 02/02560 и WO 02/14271, на описания которых здесь ссылаются во всей их полноте, особенно относительно вышеуказанных ингибиторов, их определения, применений и их получения.
Термин DPIV-подобные ферменты относится к структурно и/или функционально DPIV/СD26-родственным ферментным белкам (Sedo & Malik, Dipeptidyl peptidase IV-like molecules: homologous proteins or homologous activities? Biochimica et Biophysica Acta 2001 36506: 1-10). По существу, эта небольшая группа, как было выявлено, высвобождает H-Xaa-Pro-Дипептиды и H-Xaa-Ala-Дипептиды от N-конца олиго- или полипептидов. Они демонстрируют общую особенность, заключающуюся в том, что они действуют в Pro-положении, а также Ala, Ser, Thr и других аминокислот с небольшими гидрофобными боковыми цепями, таким как Gly или Val. Гидролитическая активность располагается в следующий ряд Pro > Ala " Ser, Thr " Gly, Val. Те же самые белки были доступны в таких небольших количествах, что можно было установить только пост-Pro и пост-Ala расщепление. В то время как белки DPIV, DP II, FAPa (Seprase), DP 6, DP 8 и DP 9 структурно родственны и демонстрируют высокую гомологию последовательностей, аттрактин является экстраординарно функциональным DPIV-подобным ферментом, характеризующимся аналогичной активностью и схожей картиной ингибирования.
Другие DPIV-подобные ферменты раскрываются в международных патентных публикациях WO 01/19866, WO 02/04610, WO 02/34900 и W0 02/31134. WO 01/19866 раскрывает новую человеческую дипептидиламинопептидазу (DPP8) со структурным и функциональным сходствами с DPIV и фибробласт-активирующий белок (FAP). В международной публикации WO 02/34900 раскрывается новая дипептидилпептидаза 9 (DPP9), структура аминокислотной последовательности которой в значительной степени схожа с аминопоследовательностями DPIV и DPP8. В международной публикации WO 02/31134 раскрываются три DPIV-подобных фермента, DPRP1, DPRP2 и DPRP3. Секвенирование показало, что DPRPI идентичен DPP8, как раскрывается в международной публикации WO 01/19866, что DPRP2 идентичен DPP9, а DPRP3 идентичен K1AA1492, как раскрывается в международной публикации WO 02/04610.
Высокое кровяное давление (гипертензия) является бессимптомным состоянием, и это аномально высокое давление в артериях увеличивает риск возникновения таких проблем, как: удар, аневризма, сердечная недостаточность, сердечный приступ и поражение почек. Для многих людей слово "гипертензия" означает чрезмерное напряжение, нервозность или стресс. В медицинских терминах, однако, гипертензия относится к состоянию повышенного кровяного давления независимо от причины его проявления. Ее называют "бесшумный киллер", так как гипертензия обычно не вызывает симптомов, непосредственно связанных с заболеванием, на протяжении многих лет, до тех пор, пока не повреждается жизненно важный орган. Высокое кровяное давление определяют как систолическое давление в состоянии покоя, которое в среднем составляет 140 мм Hg или больше, диастолическое давление в состоянии покоя, которое в среднем равняется 90 мм Hg или больше, или и то и другое. При высоком кровяном давлении обычно оба и систолическое и диастолическое давления являются повышенными.
В качестве вторичного действия сахарного диабета происходит поражение нервов, которые регулируют кровяное давление и процессы пищеварения. Это приводит к колебаниям кровяного давления; к осложнениям, связанным с глотанием, и изменению функции желудочно-кишечного тракта с приступами диареи. Кроме того, как вторичное действие сахарного диабета в отдельных участках тканей артериальной стенки происходит образование атеросклеротических бляшек, которые могут блокировать артерии больших и средних размеров в сердце, головном мозге, ногах и пенисе. Стенки небольших кровеносных сосудов повреждаются до такой степени, что сосуды не транспортируют кислород нормальным образом и могут допускать утечку.
Другие определения и классификация высокого кровяного давления представлены в Merck Manual of Medical Information-Home Edition, Merck & Co., 2000. В тех случаях, когда систолическое и диастолическое давления человека соответствуют различным категориям, для классифицирования кровяного давления используют более высокую категорию. Например, 160/92 классифицируют как гипертензию 2 стадии, и 180/120 классифицируют как гипертензию 4 стадии. Оптимальное кровяное давление, которое сводит к минимуму риск возникновения проблем, связанных с сердечно-сосудистыми заболеваниями, ниже 120/80 мм Hg. Однако необычно низкие значения давлениядолжны учитываться.
| Категория | Систолическое кровяное давление | Диастолическое кровяное давление |
| Нормальное кровяное давление | Ниже 130 мм Hg | Ниже 85 мм Hg |
| Высокое кровяное давление | 130-139 | 85-89 |
| Гипертензия 1 стадии (легкая) | 140-159 | 90-99 |
| Гипертензия 2 стадии (умеренная) | 160-179 | 100-109 |
| Гипертензия 3 стадии (тяжелая) | 180-209 | 110-119 |
| Гипертензия 4 стадии (очень тяжелая) | 210 или выше | 120 или выше |
Если человек имеет высокое кровяное давление, соответствующее 3 стадии (тяжелая), или оно носит устойчивый характер и не лечится, то возникают такие симптомы, как: головная боль, утомление, тошнота, рвота, одышка, возбужденное состояние и размытое зрение из-за поражения головного мозга, глаз, сердца и почек. Иногда у людей с высоким кровяным давлением наступает состояние дремоты и даже развивается кома, вызванные отеком мозга. Это состояние, называемое гипертонической энцефалопатией, требует экстренного лечения.
Отсутствие систематического лечения высокого кровяного давления у людей увеличивает риск развития болезни сердца (таких как сердечная недостаточность или сердечный приступ), почечной недостаточности и удара в раннем возрасте. Высокое кровяное давление - наиболее важный фактор риска удара. Кроме того, оно является одним из трех основных факторов риска для развития сердечного приступа (инфаркта миокарда), которые человек может регулировать; другими двумя факторами являются курение и высокий уровень холестерина.
Раскрытие изобретения
Настоящее изобретение обеспечивает новые применения DPIV-ингибиторов формул 1-12 и их соответствующих фармацевтически приемлемых аддитивных солей кислот для снижения кровяного давления или лечения связанных с этим расстройств у млекопитающих.
Пониженная экспрессия эктопептидазы DPIV и недостаток DPIV-подобной активности у мутантных крыс F344, испытывающих недостаток в ферментативной активности и экспрессии DPIV, приводит к снижению кровяного давления. Были испытаны мутантные сублинии F344, испытывающие недостаток в ферментативной активности DPIV, и дикие линии типаF344. Хроническая внутрижелудочная инфузия изолейцил-цианопирролидин ТФК и изолейцил-тиазолидин фумарата при помощи осмотических мининасосов на протяжении двух недель снижала кровяное давление у крыс доза-зависимым образом. Таким образом, кровяное давление снижается при хроническом лечении с использованием различных ингибиторов DPIV (изолейцил-тиазолидин фумарат; изолейцил-цианопирролидин ТФК), что дает основание предположить проявление сходных защитных действий со стороны двух различных DPIV-ингибиторов/лигандов. Возможно, изолейцил-тиазолидин фумарат и изолейцил-цианопирролидин ТФК защищают от высокого кровяного давления посредством увеличения уровней субстратов DPIV, которые косвенно опосредуют соответствующие действия.
Настоящее изобретение относится к новому способу, в котором уменьшение активности фермента дипептидилпептидазы (DPIV или СD26) или активности DPIV-подобных ферментов в крови млекопитающих специфическими эффекторами фермента приводит к снижению деградации эндогенных или экзогенно вводимых инсулинотропных пептидов (инкретинов), пептидного гормона, секретируемого желудком/глюкоза-зависимого инсулинотропного полипептида 1-42 (GIP1-42) и глюкагон-подобного Пептида-1 7-36 амида(GLP-17-36)(или аналогов этих пептидов). Уменьшение концентрации этих пептидов или их аналогов, являющееся результатом их деградации DPIV и DPIV-подобными ферментами, будет в соответствии с этим снижено или замедлено.
В результате повышения стабильности эндогенных или экзогенно вводимых инкретинов или их аналогов, вызванной уменьшением DPIV-активности, их инсулинотропные действия повышаются, что приводит к ярко выраженному стимулированию секреции инсулина из панкреатических островков Лангерганса и более быстрому удалению глюкозы из крови. В результате толерантность к глюкозе повышается.
Как следствие, метаболические аномалии, ассоциированные с сахарным диабетом, включая аномалии углеводного и липидного обмена, глюкозурию и диабетический кетоацидоз, и хронические изменения, такие как: микроваскулярная и макроваскулярная болезнь, полиневропатия и диабетическая ретинопатия, которые являются следствием длительных повышенных концентраций циркулирующей глюкозы, предотвращаются или облегчаются и, в частности, снижаются высокие уровни кровяного давления.
Настоящее изобретение представляет новый подход к снижению повышенных концентраций глюкозы в крови и повышенных уровней кровяного давления. Это простой, коммерчески выгодный и пригодный к использованию для лечения, особенно болезней человека, которые вызваны повышенными или экстраординарными уровнями глюкозы в крови и/или кровяного давления.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Более глубокое понимание настоящего изобретения можно получить, ссылаясь на сопроводительные чертежи, где:
Фиг.1 демонстрирует MALDI-TOF-анализ DPIV-катализируемого гидролиза GIP1-42 (a) и GLP7˜36 (b) и ингибирование их гидролиза изолейцил-тиазолидином.
Фиг.2демонстрирует ВЭЖХ-анализ присутствия в сыворотке метаболитов GLP-1 в присутствии ингибитора DPIV, изолейцил-тиазолидина, in vivo.
Фиг.3демонстрируетвлияниеDPIV-ингибитора, изолейцил-тиазолидина на различные параметры в крови вн.дуод. (i.d.)-глюкозостимулированной крысы.
Фиг.4демонстрирует влияние хронического перорального лечения тучных (fa/fa) VDF крыс линии Zucker DPIV-ингибитором, изолейцил-тиазолидином на уровни глюкозы в крови натощак в течение 12-недельного приема лекарственного средства.
Фиг.5 демонстрирует влияние хронического лечения тучных (fa/fa) VDF крыс линии Zucker DPIV-ингибитором, изолейцил-тиазолидином на систолическое кровяное давление в пределах 8-недельного применения лекарственного средства (систолическое кровяное давление измеряют, используя способ наложения манжеты на хвост).
Фиг.6демонстрирует дозозависимое снижение уровней глюкозы в крови у диабетических крыс линии Zucker после перорального введения 5 мг/кг, 15 мг/кг, 50 мг/кг м.т. глутаминилпирролидина и плацебо соответственно;
Фиг.7 демонстрирует дозозависимое снижение уровней глюкозы в крови у диабетических крыс линии Zucker после перорального введения 5 мг/кг, 15 мг/кг, 50 мг/кг м.т. глутаминилтиазолидина и плацебо соответственно;
Фиг.8 демонстрирует химическую структуру пироглутаминил-тиазолидина, продукта деградации, обнаруженного после перорального введения глутаминилтиазолидина крысам линии Wistar; и
Фиг.9демонстрирует хроматограмму экстракта плазмы крысы, полученного после перорального введения глутаминилтиазолидина тучным крысам линии Zucker. Пик при 2,95 мин представляет глутаминилтиазолидин и пик при 6,57 мин представляет пироглутаминилтиазолидин.
Детальное описание изобретение
Целью настоящего изобретения является разработка простого и нового способа снижения уровня глюкозы в крови и/или кровяного давления, в котором уменьшение активности фермента дипептидилпептидазы (DPIV или СD26) или активности DPIV-подобных ферментов в крови млекопитающих, индуцируемое эффекторами фермента, приводит к снижению деградации эндогенных (или экзогенно вводимых) инсулинотропных пептидов (инкретинов), пептидного гормона, секретируемого желудком/глюкозозависимого инсулинотропного полипептида 1-42 (GIP1-42) и глюкагон-подобного пептида-1 амида (7-36) (GLP-17-36) (или аналогов этих пептидов). В соответствии с этим уменьшение концентрации этих пептидов или их аналогов, являющееся результатом их деградации DPIV и DPIV-подобными ферментами, будет снижаться или замедляться.
Настоящее изобретение основано на неожиданном установлении того факта, что уменьшение ферментативной активности дипептидилпептидазы IV (DPIV или СD26) или активности DPIV-подобных ферментов в теле млекопитающих in vivo приводит к повышению толерантности к глюкозе и к снижению высокого кровяного давления.
Авторами было обнаружено, что:
1. Снижение активности дипептидилпептидазы IV (DPIV или СD26) или DPIV-подобных ферментов ведет к повышению стабильности глюкозостимулированных эндогенно выделяемых или экзогенно вводимых инкретинов (или их аналогов) с вытекающим отсюда следствием, что введение эффекторов DPIV или DPIV-подобных белков может быть использовано для регулирования деградации инкретинов, участвующих в циркуляции.
2. Повышенная биологическая стабильность инкретинов (или их аналогов) приводит к изменению реакции инсулина.
3. Повышенная стабильность циркулирующих инкретинов, вызванная уменьшением дипептидилпептидазы IV (DPIV или СD26) или DPIV-подобных ферментов, приводит к последующему изменению инсулинзависимой утилизации (удалению) глюкозы, указывая на то, что толерантность к глюкозе может быть повышена применением DPIV-эффекторов.
4. Высокое кровяное давление снижается.
Соответственно данное изобретение относится к использованию эффекторов активности дипептидилпептидазы IV (DPIV) или DPIV-подобных ферментов для снижения повышенных уровней глюкозы в крови и/или кровяного давления, таких как: уровни, обнаруживаемые у млекопитающих, демонстрирующих клинически несоответствующие базальную и пост-обеденную гипергликемию. Применение в соответствии с изобретением, в частности, характеризуется введением эффекторов активности DPIV или DPIV-подобных ферментов для предотвращения или облегчения патологических аномалий метаболизма млекопитающих, таких как: глюкозурия, гиперлипидемия, диабетический кетоацидоз, диабетическая ретинопатия и сахарный диабет. В другом предпочтительном варианте осуществления изобретение относится к способу снижения повышенных уровней глюкозы в крови у млекопитающих, таких как уровни, обнаруживаемые у млекопитающего, демонстрирующего клинически несоответствующие базальную и пост-обеденную гипергликемию, включающему введение млекопитающему, при необходимости такого лечения, терапевтически эффективного количества эффектора активности дипептидилпептидазы IV (DPIV) или DPIV-подобных ферментов.
В другом предпочтительном варианте осуществления изобретение касается эффекторов активности дипептидилпептидазы IV (DPIV) или DPIV-подобных ферментов, применяемых в способе снижения повышенных уровней глюкозы в крови и/или кровяного давления у млекопитающих, таких как уровни, обнаруживаемые у млекопитающих, демонстрирующих клинически несоответствующие базальную и пост-обеденную гипергликемию.
Предлагаемые эффекторы DPIV и DPIV-подобных ферментов согласно настоящему изобретению могут быть использованы в фармацевтических составах как ингибиторы ферментов, субстраты, псевдосубстраты, ингибиторы экспрессии гена DPIV, связывающие белки или антитела белков ферментов-мишеней или в виде комбинации таких различных соединений, которые снижают концентрацию DPIV белка и DPIV-подобного белка или активность ферментов у млекопитающих. Эффекторами согласно изобретению являются, например, ингибиторы DPIV, такие как производные дипептидов или дипептидные миметики, как например аланилпиролидид, изолейцилтиазолидин, а также псевдосубстрат N-валил-пролил, O-бензоил-гидроксиламин. Такие соединения известны из литературы [DEMUTH, H-U., Recent developments in the irreversible inhibition of serine and cysteine proteases. J. Enzyme Inhibition 3, 249 (1990)] или они могут быть синтезированы согласно способам, описанным в литературе.
Способ согласно изобретению представляет новый подход к снижению повышенной концентрации глюкозы, циркулирующей в крови млекопитающих, и к снижению высоких уровней кровяного давления.
Настоящее изобретение относится к области ингибирования дипептидилпептидазы IV (DPIV) и, в частности к новому использованию ингибиторов активности DPIV и DPIV-подобных ферментов для снижения высоких уровней кровяного давления или (лечения) связанных с этим расстройств у млекопитающих, и фармацевтических композиций, содержащих вышеуказанные соединения.
В отличие от других предложенных способов в данной области настоящее изобретение обеспечивает перорально доступную терапию низкомолекулярными ингибиторами дипептидилпептидазы IV. Настоящее изобретение представляет новый подход к снижению уровней кровяного давления и лечению связанных с этим нарушений у млекопитающих. Этот подход удобен для пользователя, коммерчески выгоден и пригоден для использования в лечебной схеме, особенно касающейся болезней человека.
Исходя из полученных данных, исследование роли экспрессии DPIV и ферментативной активности DPIV в регулировании кровяного давления согласно изобретению позволило установить, что пероральное введение ингибиторов DPIV приводит к уменьшению уровней кровяного давления.
Цель настоящего изобретения состоит в разработке ингибиторов дипептидилпептидазы IV и/или лигандов, которые обладали бы высокой биодоступностью. В другом предпочтительном варианте осуществления настоящее изобретение обеспечивает ингибиторы DPIV, которые обладают точно предсказуемым временем активности в ткани-мишени.
Примерами перорально доступных средств с низкой молекулярной массой являются пролекарства стабильных и нестабильных ингибиторов дипептидилпептидазы IV общей формулы A-B-C, где A представляет аминокислоту, B представляет химическую связь между A и C или аминокислоту и С представляет нестабильный или стабильный ингибитор дипептидилпептидазы IV соответственно. Такие соединения описаны в международных патентных публикациях WO 99/67278 и WO 99/67279, на раскрытия которых относительно обеспечения, определения, использования и получения пролекарств здесь ссылаются во всей их полноте. Особенно это касается детального описания определений А, В и С.
Настоящее изобретение относится к новому способу, в котором уменьшение активности фермента, дипептидилпептидазы (DPIV или CD26) или активности DPIV-подобных ферментов, или где связывание специфического лиганда DPIV оказывают благотворные действия в организмах млекопитающих, индуцированные эффекторами фермента, и ведет как причинное следствие к снижению кровяного давления у млекопитающего. В результате млекопитающие, имеющие повышенное кровяное давление, будут получать пользу от лечения ингибиторами активности DPIV и DPIV-подобных ферментов.
Способ и применение согласно настоящему изобретению включает профилактику повышения кровяного давления или снижение кровяного давления и родственных расстройств у животного, включая человека, путем ингибирования DPIV, или активностей родственных ферментов, используя ингибитор или лиганд вышеуказанных ферментов. В большинстве обстоятельств пероральное введение ингибитора DPIV может быть предпочтительным.
В дальнейшем настоящее изобретение иллюстрируется, ссылаясь на нижеследующие примеры, сфокусированные на действии в направлении снижения кровяного давления и уровней глюкозы в крови, вызванном уменьшением DPIV-подобной активности и/или связыванием.
В одном иллюстративном варианте воплощения настоящее изобретение относится к применению дипептид-подобных соединений и соединений, подобных дипептидным соединениям, которые образованы из аминокислоты и тиазолидиновой или пирролидиновой группы, и их солей, упоминаемых в дальнейшем как дипептид-подобные соединения. Предпочтительно аминокислота и группа тиазолидина или пирролидина связаны амидной связью.
Особенно подходящими для этой цели согласно изобретению являются дипептидные соединения, в которых аминокислота предпочтительно выбрана из природной аминокислоты, такой как, например, лейцин, валин, глутамин, глутаминовая кислота, пролин, изолейцин, аспарагины и аспарагиновая кислота.
Дипептид-подобные соединения, используемые согласно изобретению, демонстрируют при концентрации (дипептидных соединений) 10 мкМ уменьшение активности дипептидилпептидазы IV или активностей DPIV-подобных ферментов, по крайней мере, на 10%, особенно, по крайней мере, на 40%. Зачастую требуется уменьшение активности, по крайней мере, на 60% или, по крайней мере, на 70%. Предпочтительные эффекторы могут также демонстрировать уменьшение активности максимально на 20% или 30%.
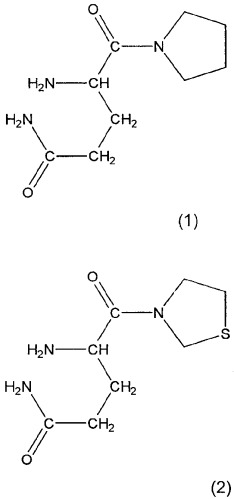
Предпочтительными соединениями являются N-валил-пролил, O-бензоил-гидроксиламин, аланил-пирролидин, изолейцил-тиазолидин так же как и их оптические изомеры L-алло-изолейцил-тиазолидин, L-трео-изолейцил-пирролидин и их соли, особенно соли фумаровой кислоты, и L-алло-изолейцил-пирролидин и его соли. Особенно предпочтительными соединениями являются глутаминилпирролидин и глутаминилтиазолидин формул 1 и 2:
Другие предпочтительные соединения представлены в Таблице 1.
Соли дипептид-подобных соединений могут быть в молярном отношении дипептид(-аналог) компонент к компоненту соли 1:1 или 2:1.
Такой солью является, например, (Ile-Thia)2 фумаровая кислота.
Таблица 1: Структуры дополнительных дипептидных соединений
| Эффектор |
| H-Asn-пирролидин |
| H-Asn-тиазолидин |
| H-Asp-пирролидин |
| H-Asp-тиазолидин |
| H-Asp(NHOH)-пирролидин |
| H-Asp(NHOH)-тиазолидин |
| H-Glu-пирролидин |
| H-Glu-тиазолидин |
| H-Glu(NHOH)-пирролидин |
| H-Glu(NHOH)-тиазолидин |
| H-His-пирролидин |
| H-His-тиазолидин |
| H-Pro-пирролидин |
| H-Pro-тиазолидин |
| H-Ile-азидидин |
| H-Ile-пирролидин |
| H-L-алло-Ile-тиазолидин |
| H-Val-пирролидин |
| H-Val-тиазолидин |
В другом предпочтительном варианте воплощения настоящее изобретение представляет применение пептидных соединений формулы 3, полезных для конкурентной модуляции катализа дипептидилпептидазой IV:
где A, B, C, Dи E представляют независимо любые аминокислотные части, включая протеиногенные аминокислоты, не-протеиногенные аминокислоты, L-аминокислоты и D-аминокислоты, и где E и/или D могут отсутствовать.
Дополнительные условия в отношении формулы (3):
A представляет аминокислоту, исключая D-аминокислоту,
B представляет аминокислоту, выбранную из Pro, Ala, Ser, Gly, Hyp, азетидин-(2)-карбоновой кислоты и пипеколиновой кислоты,
C представляет любую аминокислоту, исключая Pro, Hyp, азетидин-(2)-карбоновую кислоту, пипеколиновую кислоту и исключая N-алкилированные аминокислоты, например N-метилвалин и саркозин,
D представляет любую аминокислоту или отсутствует, и
E представляет любую аминокислоту или отсутствует,
или:
C представляет любую аминокислоту, кроме Pro, Hyp, азетидин-(2)-карбоновой кислоты, пипеколиновой кислоты, кроме N-алкилированных аминокислот, например, N-метилвалина и саркозина, и кроме D-аминокислоты;
D представляетлюбую аминокислоту, выбранную изPro, Ala, Ser, Gly, Hyp, азетидин-(2)-карбоновой кислоты и пипеколиновой кислоты, и
E представляет любую аминокислоту, кроме Pro, Hyp, азетидин-(2)-карбоновой кислоты, пипеколиновой кислоты и, исключая N-алкилированные аминокислоты, например, N-метилвалин и саркозин.
Примерами аминокислот, которые могут быть использованы в настоящем изобретении, являются L и D-аминокислоты, N-метил-аминокислоты; алло- и трео-формы Ile и Thr, которые могут, например, быть a-, Я- и ω-аминокислотами, среди которых a-аминокислоты являются предпочтительными.
Примерами аминокислот для формулы изобретения и описания являются:
аспарагиновая кислота (Asp), глутаминовая кислота (Glu), аргинин (Arg), лизин (Lys), гистидин (His), глицин (Gly), серин (Ser) и цистеин (Cys), треонин (Thr), аспарагин (Asn), глутамин (Gln), тирозин (Tyr), аланин (Ala), пролин (Pro), валин (Val), изолейцин (Ile), лейцин (Leu), метионин (Met), фенилаланин (Phe), триптофан (Trp), гидроксипролин (Hyp), бета-аланин (бета-Ala), 2-аминооктановая кислота (Aoa), азетидин-(2)-карбоновая кислота (Ace), пипеколиновая кислота (Pip), 3-аминопропионовая кислота, 4-аминомасляная кислота и т.д., альфа-аминоизомасляная кислота (Aib), саркозин (Sar), орнитин (Orn), цитруллин (Cit), гомоаргинин (Har), т-бутилаланин (т-бутил-Ala), т-бутилглицин (т-бутил-Gly), N-метилизолейцин (N-MeIle), фенилглицин (Phg), циклогексилаланин (Cha), норлейцин (Nle), цистеиновая кислота (Cya) и метионин сульфоксид (MSO), Ацетил-Lys, модифицированные аминокислоты, такие как: фосфорил-серин (Ser(P)), бензил-серин (Ser(Bzl)) и фосфорил-тирозин (Tyr(P)), 2-аминомасляная кислота (Abu), аминоэтилцистеин (AECys), карбоксиметилцистеин (Cmc), дегидроаланин (Dha), дегидроамино-2-масляная кислота (Dhb), карбоксиглутаминовая кислота (Gla), гомосерин (Hse), гидроксилизин (Hyl), цис-гидроксипролин (цисHyp), транс-гидроксипролин (трансHyp), изовалин (Iva), пироглутаминовая кислота (Pyr), норвалин (Nva), 2-аминобензойная кислота (2-Abz), 3-аминобензойная кислота (3-Abz), 4-аминобензойная кислота (4-Abz), 4-(аминометил)бензойная кислота (Amb), 4-(аминометил)циклогексанкарбоновая кислота (4-Amc), Пеницилламин (Pen), 2-амино-4-цианомасляная кислота (Cba), циклоалкан-карбоновые кислоты.
Примерами ω-аминокислот являются, например: 5-Ara (аминовалериановая кислота), 6-Ahx (аминогексановая кислота), 8-Aoc (аминооктановая кислота), 9-Anc (аминованоевая кислота), 10-Adc (аминодекановая кислота), 11-Aun (аминоундекановая кислота), 12-Ado (аминододекановая кислота).
Дополнительными аминокислотами являются: инданилглицин (Igl), индолин-2-карбоновая кислота (Idc), октагидроиндол-2-карбоновая кислота (Oic), диаминопропионовая кислота (Dpr), диаминомасляная кислота (Dbu), нафтилаланин (1-Nal), (2-Nal), 4-аминофенилаланин (Phe(4-NH2)), 4-бензоилфенилаланин (Bpa), дифенилаланин (Dip), 4-бромфенилаланин (Phe(4-Br)), 2-хлорфенилаланин (Phe(2-Cl)), 3-хлорфенилаланин (Phe(3-Cl)), 4-хлорфенилаланин (Phe(4-Cl)), 3,4-хлорфенилаланин (Phe(3,4-Cl2)), 3-фторфенилаланин (Phe(3-F)), 4-фторфенилаланин (Phe(4-F)), 3,4-фторфенилаланин (Phe(3,4-F2)), пентафторфенилаланин (Phe(F5)), 4-гуанидинофенилаланин (Phe(4-гуанидино)), гомофенилаланин (hPhe), 3-иодфенилаланин (Phe(3-J)), 4-иодфенилаланин (Phe(4-J)), 4-метилфенилаланин (Phe(4-Me)), 4-нитрофенилаланин (Phe-4-N02)), бифенилаланин (Bip), 4-фосфонометилфенилаланин (Pmp), циклогексилглицин (Ghg), 3-пиридинилаланин (3-Pal), 4-пиридинилаланин (4-Pal), 3,4-дегидропролин (A-Pro), 4-кетопролин (Pro(4-кето)), тиопролин (Thz), изонипекотиновая кислота (Inp), 1,2,3,4,-тетрагидроизохинолин-3-карбоновая кислота (Tic), пропаргилглицин (Pra), 6-гидроксинорлейцин (NU(6-OH)), гомотирозин (hTyr), 3-иодотирозин (Tyr(3-J)), 3,5-дииодотирозин (Tyr(3,5-J2)), d-метил-тирозин (Tyr(Me)), 3-N02-тирозин (Tyr(3-N02)), фосфотирозин (Tyr(PO3H2)), алкилглицин, 1-аминоиндан-1-карбокси кислота, 2-аминоиндан-2-карбокси кислота (Aic), 4-амино-метилпиррол-2-карбоновая кислота (Py), 4-амино-пирролидин-2-карбоновая кислота (Abpc), 2-аминотетралин-2-карбоновая кислота (Atc), диаминоуксусная кислота (Gly(NH2)), диаминомасляная кислота (Dab), 1,3-дигидро-2H-изоинол-карбоновая кислота (Disc), гомоциклогексилаланин (hCha), гомофенилаланин (hPhe oder Hof), транс-3-фенил-азетидин-2-карбоновая кислота, 4-фенил-пирролидин-2-карбоновая кислота, 5-фенил-пирролидин-2-карбоновая кислота, 3-пиридилаланин (3-Pya), 4-пиридилаланин (4-Pya), стирилаланин, тетрагидроизохинолин-1-карбоновая кислота (Tiq), 1,2,3,4-тетрагидроноргарман-3-карбоновая кислота (Tpi), Я-(2-тиенил)аланин (Tha).
Другие замены аминокислот для аминокислот, кодированных в генетическом коде, могут быть также включены в пептидные соединения в пределах объема изобретения и могут быть классифицированы внутри этой общей схемы.
Термин протеиногенные аминокислоты означает a-аминокислоты, являющиеся производными природных белков. Термин не-протеиногенные аминокислоты означает все другие аминокислоты, которые не являются строительными блоками обычных природных белков.
Результирующие пептиды могут быть синтезированы как в форме со свободной С-концевой кислотой, так и форме С-концевого амида. Пептиды со свободной кислотой или амиды могут варьироваться путем модификаций их боковых цепей. Такие модификации боковой цепи включают, например, но ими не ограничиваются, образование гомосерина, образование пироглутаминовой кислоты, образование дисульфидной связи, деамидирование остатков аспарагина или глутамина, метилирование, т-бутилирование, т-бутилоксикарбонилирование, 4-метилбензилирование, тиоанизилирование, тиокрезилирование, бензилоксиметилирование, 4-нитрофенилирование, бензилоксикарбонилирование, 2-нитробензоилирование, 2-нитросульфенилирование, 4-толуолсульфонилирование, пентафторфенилирование, дифенилметилирование, 2-хлорбензилоксикарбонилирование, 2,4,5-трихлорфенилирование, 2-бромбензилоксикарбонилирование, 9-флуоренилметилоксикарбонилирование, трифенилметилирование, 2,2,5,7,8-пентаметилхроман-6-сульфонилирование, гидроксилирование, окисление метионина, формилирование, ацетилирование, анизилирование, бензилирование, бензоилирование, трифтороацетилирование, карбоксилирование аспарагиновой кислоты или глутаминовой кислоты, фосфорилирование, сульфатирование, цистеинилирование, гликолизация пентозами, дезоксигексозами, гексозаминами, гексозами или N-ацетилгексозаминами, фарнезилирование, муристолизирование, биотинилирование, пальмитоилирование, стеароилирование, геранилгеранилирование, глутатионилирование, 5'-аденозилирование, ADP-рибозилирование, модификация N-гликолилнейраминовой кислотой, N-ацетилнейраминовой кислотой, пиридоксаль-фосфатом, липоевой кислотой, 4'-фосфопантетином, или N-гидроксисукцинимидом.
В соединениях формулы (3) аминокислотные части A, B, C, D, и E соответственно присоединены к соседней части амидными связями обычным способом согласно стандартной номенклатуре так, что амино-конец (N-конец) аминокислот (пептида) изображается слева (N-конец) и карбоксил-конец аминокислот изображается справа (С-конец).
До настоящего изобретения как пептидные субстраты пролин-специфичной сериновой протеазы дипептидилпептидазы IV in vitro были известнытрипептиды Diprotin A (Ile-Pro-Ile), Diprotin B (Val-Pro-Leu) и Diprotin C (Val-Pro-Ile). Авторами неожиданно было обнаружено, что соединения, раскрываемые здесь выше и ниже, действуют как субстраты дипептидилпептидазы IV in vivo у млекопитающего и в фармакологических дозах снижают кровяное давление и облегчают патологические аномалии метаболизма у млекопитающих, такие, как: глюкозурия, гиперлипидемия, метаболический ацидоз и сахарный диабет, посредством конкурентного катализа.
Особенно предпочтительные соединения настоящего изобретения, которые используют в качестве модуляторов дипептидилпептидазы IV и DPIV-подобных ферментов, включают такие соединения, которые демонстрируют Ki-значения для связывания DPIV, эффективны в ингибировании DPIV in vivo после внутривенного (i.v.) и/или перорального (p.o.) введения крысам линии Wistar.
Другими предпочтительными соединениями являются пептидилкетоны формулы 4:
где A выбран из
X1 представляет H или ацильную или оксикарбонильную группу, включая все аминокислотны или пептидные остатки,
X2 представляет H, -(CH)n-NH-C5H3N-Y с n=2-4 или C5H3N-Y (дивалентный остаток пиридила) и Y выбран из H, Br, Cl, I, NO2 или CN,
Х3 представляет H или фенил или пиридил, незамещенный или замещенный одной, двумя или несколькими алкил, алкокси, галоген, нитро, циано или карбокси группами,
X4 представляет H или фенил или пиридил, незамещенный или замещенный одной, двумя или несколькими алкил, алкокси, галоген, нитро, циано или карбокси группами,
X5 представляет H или алкил, алкокси или фенил,
X6 представляет H или алкил;
для n=1
X выбран из H, OR2, SR2, NR2R3, N+R2R3R4, где
R2 означает ацильные остатки, которые являются незамещенными или замещенными одним, двумя или несколькими алкилом, циклоалкилом, арилом или гетероарилом, или обозначает все аминокислоты и пептидные остатки, или алкильные остатки, которые незамещены или замещены одним, двумя или несколькими алкилами, циклоалкилами, арилами и гетероарильными остатками,
R3 обозначает алкильные и ацильные функции, где R2 и R3 могут быть частью одной или нескольких кольцевых структур ненасыщенных и насыщенных карбоциклических или гетероциклических структур,
R4 означает алкильные остатки, где R2 и R4 или R3 и R4 могут быть частью одной или нескольких кольцевых структур насыщенных и ненасыщенных карбоциклических или гетероциклических структур;
для n=0
X выбран из:
где B означает О, S, NR5, где R5 представляет H, алкилиден или ацил,
C, D, E, F, G, H независимо выбраны из незамещенных и замещенных алкильных, оксиалкильных, тиоалкильных, аминоалкильных, карбонилалкильных, ацильных, карбамоильных, арильных и гетероарильных остатков; и
для n=0 и n=1
Z выбран из H, или С1-С9 алкила с разветвленной или одинарной цепью или С2-С9 алкенила с разветвленной или одинарной цепью, С3-С8 циклоалкила, С5-С7 циклоалкенила, арил- или гетероарильного остатка, или боковой цепи, выбранной из всех боковых цепей всех природных аминокислот или их производных.
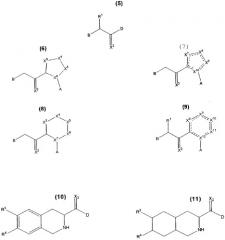
Кроме того, согласно настоящему изобретению раскрываются соединения формул 5, 6, 7, 8, 9, 10 и 11, включая все стереомеры и их фармацевтически приемлемые соли, и все они могут быть использованы: