Вакцина свиней против респираторных патологий и патологий репродукции свиней
Иллюстрации
Показать всеИзобретение относится к области вирусологии. Вакцина свиней включает плазмиду, включающую ген вируса PRRS. Ген PRRS выбран из группы генов Е, ORF3 и М. Вакцина вызывает иммунный ответ против вируса PRRS. Изобретение может быть использовано в свиноводстве. 9 з.п. ф-лы, 25 ил.
Реферат
Настоящее изобретение относится к формуле вакцины, позволяющей, в частности, проводить вакцинацию свиней против респираторных патологий и патологий репродукции. Оно также относится к соответствующей методике вакцинации.
В ходе последних десятилетий произошло фундаментальное изменение методов разведения свиней. Всеобщее распространение получило интенсивное разведение в закрытом пространстве и, как следствие, драматическое развитие респираторных патологий.
Симптомы респираторных патологий свиней обычно объединяют под комплексным названием респираторного заболевания свиней, из чего следует большое разнообразие патогенных агентов, включающих как вирусы, так и бактерии и микоплазмы. Главными агентами, вызывающими респираторные нарушения, являются Actinobacillus pleuropneumoniae, вирус бесплодия и респираторного синдрома (PRRS), также называемый вирусом таинственной болезни, вирус болезни Aujeszky (PRV) и вирус гриппа свиней.
Другие вирусы вызывают нарушения репродуктивной функции, проявляющиеся в виде выкидышей, мумификации зародышей и бесплодия. Основными из таких вирусов являются PRRS, парвовирус и вирус классической чумы свиней (HCV). ВО вторую очередь такие нарушения могут вызывать вирусы PRV, гриппа свиней и A.Pleuropneumoniae. Смертность возможна в случае A.Pleuropneumoniae, HCV и PRV.
Кроме этого, в респираторном комплексе свиней очень важное значение имеют взаимодействия между микроорганизмами. Действительно, большая часть патогенных бактерий составляют обычную микрофлору носоглоточных зон и миндалин молодого животного. Эти патогены выделяются свиноматкой и часто вдыхаются поросятами в первые часы жизни, когда колостральный иммунитет еще не эффективен. Организмы, живущие в верхних отделах дыхательных путей, могут распространяться в нижние отделы, если защитные механизмы дыхательной системы ослаблены воздействием предшествующего агента, такого как Actinobacillus pleuropneumoniae или вирусы. Инвазия в легкие может быть очень быстрой, в частности, если предшествующими патогенами являются такие, как Actinobacillus pleuropneumoniae, которые выделяют сильные цитотоксины, способные вызывать повреждение ресничек клеток дыхательного эпителия и альвеолярных макрофагов.
Важные вирусные инфекции, такие как грипп, респираторные коронавирусные инфекции и вирус Aujeszky, могут играть роль в патогенезе респираторного комплекса вместе с бактериями респираторного тропизма и микроплазмами.
Наконец, некоторые агенты влияют одновременно на дыхательную и на репродуктивную системы. Также могут произойти взаимодействия в плане патологии репродукции. Необходимо, следовательно, постараться наладить эффективные превентивные методы против главных патогенных агентов, вызывающих респираторные патологии репродукции свиней.
Сочетания, разработанные до настоящего времени, были получены на основе инактивированных вакцин или живых вакцин и, в некоторых случаях, смесей таких вакцин. При их применении встают проблемы совместимости валентностей и стабильности. Так, нужно обеспечить одновременно совместимость различных валентностей вакцины как в отношении различных используемых антигенов, так и в отношении самих составов, в частности, если используют вместе инактивированные вакцины и живые вакцины. Также возникает проблема хранения таких комбинированных вакцин и их безвредности, в частности, в присутствии добавок. Эти вакцины обычно довольно дороги. В заявках WO-A-9011092, WO-A-9319183, WO-A-9421997 и WO-A-9520660 описано использование недавно разработанной технологии полинуклеотидных вакцин. Известно, что в этих вакцинах используют плазмиду, обеспечивающую в клетках хозяина экспрессию встроенного антигена. Были предложены все пути введения (внутрибрюшинный, внутривенный, внутримышечный, чрескожный, внутрикожный, через слизистую и т.д.). Также могут быть использованы различные средства вакцинации, такие как ДНК, помещенная на поверхность частиц золота и распыляемая таким образом, что она проникает в кожу животного (Tang и др., Nature 356, 152-154, 1992), и жидкоструйные впрыскиватели, позволяющие осуществить трансфекцию одновременно в кожу, в мышцы, в жировые ткани и в ткани молочной железы (Furth и др., Analytical Biochemistry, 205, 365-368, 1992).
В полинуклеотидных вакцинах можно использовать как неодетые ДНК, так и ДНК, например, в составе липосом и катионных липидов. M-F Le Potier и др. (Second International Symposium on the Eradication of Aujeszky's Disease (pseudo rabies) Virus August 6th tu 8th 1995 Copenhagen, Denmark) и М.Monteil и др. (Научные дни Кафедры Патологии животных, INRA-ENV, Лионская Государственная Ветеренарная школа. 13-14 декабря 1994, Lyon, Франция) осуществили попытку вакцинации свиней против вируса болезни Aujeszky с помощью плазмиды, обеспечивающей экспрессию гена gD под контролем сильного промотора, позднего мажорного промотора аденовируса типа 2. Несмотря на хороший уровень антительного ответа, не было выявлено установление защиты. Однако, хорошие результаты в отношении защиты были зафиксированы после заражения свиней рекомбинантным аденовирусом, в который был встроен ген gD и тот же промотор, что доказывает, что наличие гликопротеина gD достаточно для установления защиты у свиней.
Практика прошлого не дала никаких результатов в отношении установления защиты у свиней методом полинуклеотидной вакцинации.
Задачей изобретения является разработка формулы поливалентной вакцины, позволяющей осуществить вакцинацию свиней против определенного числа патогенных агентов, вызывающих, в частности, респираторные патологии и/или патологии репродукции. Другой целью изобретения является разработка такой формулы вакцины, сочетающей различные валентности, при сохранении всех требуемых критериев совместимости и стабильности валентностей.
Другой целью изобретения является разработка такой формулы вакцины, позволяющей сочетать различные валентности в оном носителе. Другой целью изобретения является разработка такой формулы вакцины, которая была бы проста в применении и не являлась бы дорогостоящей.
Еще одной целью изобретения является разработка формулы вакцины и методики вакцинации свиней, которая позволяет добиться установления высокоэффективной долговременной защиты, в т.ч. поливалентной, при безвредности и отсутствии отходов. Таким образом, объектом изобретения является формула вакцины, в частности, против респираторных патологий и/или патологий репродукции свиней, включающая по меньшей мере три валентности полинуклеотидной вакцины, каждая из которых включает плазмиду, содержащую и (обеспечивающую его экспрессию in vivo в клетках хозяина) ген одной валентности патогена свиней, причем эти валентности выбирают из группы, представленной вирусом болезни Aujeszky (вирус PRV или псевдобешенства), вирусом гриппа свиней (SIV), вирусом таинственной болезни свиней (вирус PRRS), вирусом парвовироза (вирус PRV), вирусом классической чумы свиней (вирус HCV или Hog Cholera virus) и бактерией, вызывающей актинобакциллоз (A.pleuropneumoniae), а плазмиды содержат, для каждой валентности, один или несколько генов, выбранных из группы, представленной gB и gD для вируса болезни Aujeszky, НА, NP, N для вируса гриппа свиней, ORFS (Е), ORF3, ORF 6 (М) для вируса PRRS, VP2 для вируса парвовироза, E1, E2 для вируса классической чумы свиней и apxI, apxII и apxIII для A.pleuropneumoniae.
Под валентностью в рамках настоящего изобретения понимают по меньшей мере один антиген, обеспечивающий защиту против вируса рассматриваемого патогена, причем валентность может содержать в качестве подвалентности один или несколько измененных природных генов одного или нескольких штаммов рассматриваемого патогена. Под геном патогенного агента понимают не только полный ген, но и различные нуклеотидные последовательности, включая фрагменты, сохраняющие способность индуцировать защитный ответ.
В понятие гена входят нуклеотидные последовательности, эквивалентные в точности описанным в примерах, т.е. различные, но не кодирующие один и тот же протеин последовательности. В него также входят нуклеотидные последовательности других штаммов рассматриваемого патогена, обеспечивающие перекрестную защиту или специфическую защиту от штамма или группы штаммов. В него также входят нуклеотидные последовательности, которые были изменены для облегчения экспрессии in vivo в организме животного хозяина, но кодирующие тот же протеин.
Предпочтительно, формула вакцины по изобретению включает валентности Aujeszky и гриппа свиней, к которым могут быть добавлены другие валентности, выбранные, предпочтительно, из валентностей PRRS и A.pleuropneumoniae (актинобациллоз). Можно добавить другие валентности, выбранные из валентностей парвовироза и классической чумы свиней.
Возможны, разумеется, все комбинации валентностей. Однако, в рамках изобретения, предпочтение отдают валентностям Aujeszky и гриппа свиней, во вторую очередь PRRS и A.Pleuropheumoniae. Для вакцинации, направленной более конкретно против респираторных патологий у свиней, предпочтение при выборе валентностей отдают Aujeszky, гриппу свиней, PRRS и актинобациллозу.
Для вакцинации, направленной конкретно против патологий репродукции, валентности выбирают, предпочтительно, из PRRS, парвовироза, классической чумы свиней и Aujeszky. В отношении валентности Aujeszky можно использовать один из генов gB и gD. Предпочтительно, используют оба гена, которые, в этом случае, встраивают в разные плазмиды или в одну плазмиду.
В отношении валентности гриппа свиней используют, предпочтительно, гены НА и NP. Можно использовать один из этих двух генов или оба гена одновременно, встроенными в разные плазмиды или в одну плазмиду. Предпочтительно, в одной вакцине сочетают последовательности НА более одного штамма вируса гриппа, в частности штаммов, встречающихся в данной местности. В отличие от этого, NP обеспечивает перекрестную защиту и, следовательно, можно ограничиться использованием последовательности одного единственного штамма вируса.
В отношении валентности PRRS используют, предпочтительно, гены Е и ORF3 или также М. Можно использовать эти гены отдельно или в комбинации; в случае комбинации, гены можно встраивать в отдельные плазмиды или в плазмиды, комбинирующие две или три из этих генов. Выгодно использовать в одной вакцине гены, происходящие от по меньшей мере двух штаммов, в частности, от одного европейского штамма и от одного американского штамма.
В отношении валентности классической чумы свиней можно использовать один из генов Е1 и Е2 или гены Е1 и Е2 вместе. В двух разных плазмидах или, возможно, в одной плазмиде. В отношении валентности актинобациллоза можно использовать один из трех вышеназванных генов или комбинацию 2 или 3 из этих генов, в разных плазмидах или в составе смешанных плазмид, чтобы обеспечить защиту против различных серотипов A.Pleuropheumoniae. В антигенах арх I, II и III можно изменить кодирующие последовательности, чтобы получить нетоксичные антигены, в частности, как указано в примерах.
Объем дозы формулы вакцины по изобретению может составлять, в целом, от 0,1 до 10 мл, и в частности, от 1 до 5 мл для вакцинации при внутримышечном введении.
Доза составляет от 10 нг до 1 мг, предпочтительно, от 100 нг до 500 мкг, еще лучше - от 1 мкг до 250 мкг на каждый тип плазмиды.
Используют, предпочтительно, неодетые плазмиды, просто помещенные в вакцинирующий носитель, которым обычно является физиологический раствор (0,9% NaCl), ультрачистая вода, буфер ТЕ и т.п. Можно использовать, разумеется, любые формы полинуклеотидных вакцин, описанные в практике прошлого.
Каждая плазмида содержит промотор, способный обеспечить экспрессию зависящего от него гена в клетках хозяина. Таким промотором является сильный эукариотический промотор, и в частности ранний промотор цитомегаловируса CMV-IE, происходящий от человека или мыши, или, возможно, от другого животного, такого как крыса, свинья, морская свинка.
В общем, промотор может быть как вирусного, так и клеточного происхождения. В качестве вирусного промотора можно назвать ранний или поздний промотор вируса SV 40 или промотор LTR вируса Саркомы Руса. Это может быть также промотор вируса, от которого происходит ген, например собственный промотор гена.
В качестве клеточного промотора можно назвать промотор гена цитоскелета, например промотор десмина (Bolmont и др. Journal of Submicroscopic Cytology and Patholigy, 1990, 22, 117-122; и ZHENLIN и др., GENE, 1989, 78, 243-254) или промотор актина. Если одна плазмида содержит несколько генов, они могут находиться в одной единице транскрипции или в двух разных единицах. Комбинация различных валентностей вакцины по изобретению может быть получена, предпочтительно, смешиванием полинуклеотидных плазмид, обеспечивающих экспрессию одного или нескольких антигенов каждой валентности, но можно также осуществить экспрессию антигенов нескольких валентностей с помощью одной плазмиды.
Еще одним объектом изобретения являются формулы одновалентной вакцины, включающие одну или несколько плазмид, кодирующих один или несколько генов одного из вирусов, выбранных из группы, представленной PRV, PRRS, PPV, HCV и A.Pleuropneumoniae, причем гены такие, как описано выше. За исключением из одновалентного характера, эти формулы могут обладать вышеперечисленными характеристиками в том, что касается выбора генов, их комбинаций, композиций плазмид, объемов доз, доз и т.д. Формулы одновалентной вакцины могут быть использованы (i) для получения формулы поливалентной вакцины как она описана выше, (ii) в индивидуальном порядке, против конкретной патологии, (iii) в сочетании с вакциной другого типа (цельной живой или инактивированной, рекомбинантной, субъединичной), против другой патологии или (iv) в качестве вторичной вакцины после вакцины, описанной ниже. Действительно, еще одним объектом настоящего изобретения является использование одной или нескольких плазмид по изобретению для получения вакцины, предназначенной для вакцинации свиней, первичновакцинированных с помощью первой, обычной, вакцины из числа тех, которые использовались в практике прошлого, а именно, выбранной из группы, представленной цельной живой вакциной, цельной инактивированной вакциной, субъединичной вакциной, рекомбинантной вакциной, причем эта первая вакцина (одновалентная или поливалентная) несет (т.е. содержит или обеспечивает его экспрессию) один или несколько антигенов, кодируемых одной или несколькими используемыми плазмидами, или антигенов, обеспечивающих перекрестную защиту. Заслуживает внимания тот факт, что полинуклеотидная вакцина оказывает сильное действие в качестве вторичной вакцины, проявляющееся в усилении иммунного ответа и в установлении долговременного иммунитета.
В целом, вакцины для первичной вакцинации могут быть выбраны из числа вакцин, предлагаемых для продажи различными производителями ветеринарных вакцин. Еще одним объектом изобретения является набор для вакцинации, в который входят вакцина для первичной вакцинации, как она описана выше, и формула вакцины по изобретению для использования в качестве вторичной вакцины. Изобретение также относится к формуле вакцины по изобретению с приложенной к ней инструкцией, в которой указано использование этой формулы для вторичной вакцинации, после первичной вакцинации как она описана выше.
Также объектом настоящего изобретения является методика вакцинации свиней против респираторных патологий и/или репродукции свиней, включающая введение эффективной дозы формулы вакцины, как она описана выше. Эта методика вакцинации включает введение одной или нескольких доз формулы вакцины, причем эти дозы могут быть введены последовательно через короткие промежутки времени и/или последовательно через длительные промежутки времени.
Формулы вакцины по изобретению могут быть введены, в рамках данной методики вакцинации, различными путями введения, предложенными в практике прошлого для полинуклеотидной вакцинации, и с помощью любой известной техники введения. В частности, можно использовать вакцинацию внутрикожным путем с помощью жидкоструйного, предпочтительно, многоструйного впрыскивателя, и в частности, впрыскивателя с впрыскивающей насадкой, имеющей несколько отверстий, в частности, от 5 до 6 отверстий, как в аппарате Pigjet, выпускаемом компанией Endoscoptic, Laons, Франция. Объем дозы при использовании такого аппарата составляет, предпочтительно, от 0,1 до 0,9 мл, в частности, от 0,2 до 0,6 мл, лучше, от 0,4 до 0,5 мл, причем данный объем может быть введен за один или несколько раз, предпочтительно, за два раза.
Наконец, объектом изобретения является методика вакцинации, заключающаяся в том, что проводят первичную вакцинацию, как она описана выше и вторичную вакцинацию формулой вакцины по изобретению. Согласно предпочтительной форме осуществления способа по изобретению, сначала животному вводят эффективную дозу вакцины классического типа, в частности, инактивированную, живую, ослабленную или рекомбинантную, или субъединичной вакцины таким образом, чтобы обеспечить первичную вакцинацию, и, через, предпочтительно, 2-6 недель, вводят поливалентную или одновалентную вакцину по изобретению.
Изобретение также относится к методике получения формул вакцины, а именно к получению валентностей и их смесей, как следует из данного описания.
Далее следует более детальное описание изобретения с помощью способов осуществления изобретения с опорой на рисунки приложения.
| Список фигур | |
| Фигура №1: | Плазмида pVR1012 |
| Фигура №2а-2в: | Последовательность гена PRV gB (штамм NIA3) |
| Фигура №3: | Конструкция плазмиды рАВ090 |
| Фигура №4а-4в: | Последовательность гена PRV gD (штамм NIA3) |
| Фигура №5: | Конструкция плазмиды рРВ098 |
| Фигура №6а-6в: | Последовательность гена Грипп свиней НА (штамм HI N1) |
| Фигура №7: | Конструкция плазмиды рРВ143 |
| Фигура №8а-8в: | Последовательность гена Грипп свиней NP (штамм HI N1) |
| Фигура №9: | Конструкция плазмиды рРВ142 |
| Фигура №10а-10в: | Последовательность гена Грипп свиней НА (штамм Н3 N2) |
| Фигура №11: | Конструкция плазмиды рРВ144 |
| Фигура №12а-12в: | Последовательность гена Грипп свиней NP (штамм H3 N2) |
| Фигура №13: | Конструкция плазмиды рРВ132 |
| Фигура №14: | Плазмида рАВ025 |
| Фигура №15: | Плазмида рАВ001 |
| Фигура №16: | Плазмида рАВ091 |
| Фигура №17: | Плазмида рАВ092 |
| Фигура №18: | Плазмида рАВ004 |
| Фигура №19: | Плазмида рАВ069 |
| Фигура №20: | Плазмида рАВ061 |
| Фигура №21: | Плазмида рРВ162 |
| Фигура №22: | Плазмида рРВ163 |
| Фигура №23: | Плазмида рРВ174 |
| Фигура №24: | Плазмида рРВ189 |
| Фигура №25: | Плазмида рРВ190 |
| Список последовательностей SEQ ID № | |
| SEQ ID №1: | Последовательность гена PRV gB (штамм NIA3) |
| SEQ ID №2: | Олигонуклеотид АВ166 |
| SEQ ID №3: | Олигонуклеотид АВ167 |
| SEQ ID №4: | Олигонуклеотид АВ168 |
| SEQ ID №5: | Олигонуклеотид АВ169 |
| SEQ ID №6: | Последовательность гена PRV gD (штамм NIA3) |
| SEQ ID №7: | Олигонуклеотид РВ101 |
| SEQ ID №8: | Олигонуклеотид РВ102 |
| SEQ ID №9: | Олигонуклеотид РВ107 |
| SEQ ID №10: | Олигонуклеотид РВ108 |
| SEQ ID №11: | Последовательность гена Грипп свиней НА (штамм H1N1) |
| SEQ ID №12: | Олигонуклеотид РВ097 |
| SEQ ID №13: | Олигонуклеотид РВ098 |
| SEQ ID №14: | Последовательность гена Грипп свиней NP (штамм H1N1) |
| SEQ ID №15: | Олигонуклеотид РВ095 |
| SEQ ID №16: | Олигонуклеотид РВ096 |
| SEQ ID №17: | Последовательность гена Грипп свиней НА (штамм H3N2) |
| SEQ ID №18: | Последовательность гена Грипп свиней NP (штамм H3N2) |
| SEQ ID №19: | Олигонуклеотид АВ055 |
| SEQ ID №20: | Олигонуклеотид АВ056 |
| SEQ ID №21: | Олигонуклеотид АВ001 |
| SEQ ID №22: | Олигонуклеотид АВ002 |
| SEQ ID №23: | Олигонуклеотид АВ170 |
| SEQ ID №24: | Олигонуклеотид АВ171 |
| SEQ ID №25: | Олигонуклеотид АВ172 |
| SEQ ID №26: | Олигонуклеотид АВ173 |
| SEQ ID №27: | Олигонуклеотид АВ007 |
| SEQ ID №28: | Олигонуклеотид АВ010 |
| SEQ ID №29: | Олигонуклеотид АВ126 |
| SEQ ID №30: | Олигонуклеотид АВ127 |
| SEQ ID №31: | Олигонуклеотид АВ118 |
| SEQ ID №32: | Олигонуклеотид АВ119 |
| SEQ ID №33: | Олигонуклеотид РВ174 |
| SEQ ID №34: | Олигонуклеотид РВ189 |
| SEQ ID №35: | Олигонуклеотид РВ190 |
| SEQ ID №36: | Олигонуклеотид РВ175 |
| SEQ ID №37: | Олигонуклеотид РB176 |
| SEQ ID №38: | Олигонуклеотид РВ191 |
| SEQ ID №39: | Олигонуклеотид РВ192 |
| SEQ ID №40: | Олигонуклеотид РВ177 |
| SEQ ID №41: | Олигонуклеотид РВ278 |
| SEQ ID №42: | Олигонуклеотид РВ279 |
| SEQ ID №43: | Олигонуклеотид РВ280 |
| SEQ ID №44: | Олигонуклеотид РВ307 |
| SEQ ID №45: | Олигонуклеотид РВ303 |
| SEQ ID №46: | Олигонуклеотид РВ306 |
| SEQ ID №47: | Олигонуклеотид РВ304 |
| SEQ ID №48: | Олигонуклеотид РВ305 |
ПРИМЕРЫ
Пример 1: Культура вирусов
Вирусы культивируют на соответствующей системе клеток до проявления цитопатического эффекта. Системы клеток, используемые для каждого вируса, хорошо известны специалистам. Коротко говоря, клетки, чувствительные к используемому вирусу, культивируемые в минимальной необходимой среде Игла (среда «MEM») или в другой подходящей среде, заражают исследуемым вирусным штаммом, используя множественность заражения 1. Инфицированные клетки инкубируют при 37°С в течение времени, необходимого для проявления полного цитопатического эффекта (в среднем 36 часов).
Пример 2: Культура бактерий и экстракция бактериальной ДНК
Штаммы Actinobacillus pleuropneumoniae культивируют как описано A.Rycroft и др. (J. Gen. Microbiol. 1991, 137, 561-568). ДНК с большой молекулярной массой (хромосомная ДНК) была получена по стандартным технологиям, описанным J.Sambrook и др. (Molecular Cloning: A Laboratory Manual. 2 издание. Cold Spring Harbor Laboratory, Cold Spring Harbor New York. 1989).
Пример 3: Экстракция геномных вирусных ДНК
После культивирования собирают разрушенные клетки и их плавающие на поверхности обломки, вирусную суспензию центрифугируют при 1000 g и +4°С в течение 10 минут, чтобы удалить обломки клеток. Вирусные частицы осаждают ультрацентрифугированием при 400000 g и +4°С в течение 1 часа. Осадок собирают в минимальном объеме буфера (Tris 10 мМ, EDTA 1 мМ; рН 8,0). Эту концентрированную вирусную суспензию обрабатывают протеиназой К (100 мкг/мл конечн.) в присутствии натрийдодецилсульфата (SDS) (0,5% конечн.) в течение 2 часов при 37°С. Затем вирусную ДНК экстрагируют смесью фенол/хлороформ, потом преципитируют 2 объемами абсолютного этанола. По прошествии ночи при -20°С, ДНК центрифугируют при 10000 g и +4°С в течение 15 минут. Осажденную ДНК высушивают, затем собирают в минимальном объеме стерильной ультрачистой воды. После этого она может быть расщеплена рестрикционными ферментами.
Пример 4: Изолирование геномных вирусных РНК
РНК-содержащие вирусы очищали по хорошо известным специалистам технологиям. Затем изолировали РНК генома каждого вируса, используя технику экстракции «тиоционат гуанидия/фенолхлороформ», описанную P.Chomczynski и N.Sacchi (Anal. Biochem. 1987, 162, 156-159).
Пример 5: Технологии молекулярной биологии
Все плазмидные конструкции были получены с использованием стандартных технологий молекулярной биологии, описанных J. Sambrook и др. (Molecular Cloning: A Laboratory Manual. 2 издание. Cold Spring Harbor Laboratory. Cold Spring Harbor New York. 1989). Все рестрикционные фрагменты, используемые в настоящем изобретении, изолировали, используя набор Geneclean (BIO 101 Inc. La Jolla, CA).
Пример 6: Технология RT-PCR
Специфические олигонуклеотиды (содержащие на своих 5' концах сайты рестрикции для облегчения клонирования расширенных фрагментов) были синтезированы таким образом, что они полностью охватывают кодирующие участки генов, которые должны быть расширены (см. специфические примеры). Реакцию обратной транскрипции (RT) и расширение в цепи полимеразой (PCR) проводили по стандартным технологиям (J. Sambrook (Molecular Cloning: A Laboratory Manual. 2 издание. Cold Spring Harbor Laboratory. Cold Spring Harbor New York. 1989)). Каждую реакцию RT-PCR проводили с парой специфических амплимеров, используя в качестве матрицы экстрагированную геномную вирусную РНК. Расширенную комплементарную ДНК экстрагировали смесью фенол/хлороформ/изоамиловый спирт (25:24:1) перед расщеплением рестрикционными ферментами.
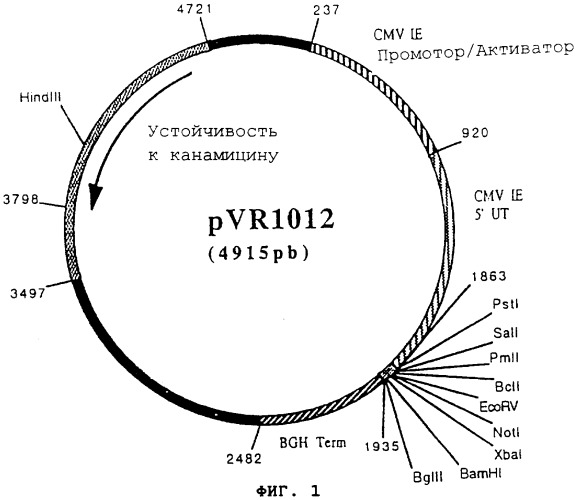
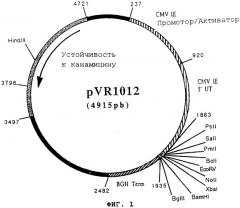
Пример 7: Плазмида pVR1012
Плазмида pVR1012 (Фигура №1) была получена при Vical Inc. San Diedo, CA, USA. Ее конструкция была описана в J.Hartikka и др. (Human Gene Therapy. 1996, 7, 1205-1217).
Пример 8: Конструирование плазмиды рАВ090 (ген PRV gB)
Плазмиду pPR 2.15 (M.Riviere и др. J. Virol. 1992. 66. 3424-3434) расщепили с помощью ApaI и NaeI, чтобы высвободить фрагмент ApaI-NaeI (2665 pb) (фрагмент А), содержащий ген, кодирующий гликопротеин gB вируса болезни Aujeszky (Штамм NIA3) (Фигура №2 и SEQ ID №1).
Гибридизацией следующих 2 олигонуклеотидов:
АВ166 (33 mer) (SEQ ID №2)
5'GATGCCCGCTGGTGGCGGTCTTTGGCGCGGGCC 3'
AB167 (33 mer) (SEQ ID №3)
5'ACGTCTACGGGCGACCACCGCCAGAAACCGCGC 3'
фрагмент (33 pb), содержащий последовательность гена gD, от инициального кодона ATG до сайта ApaI, был преобразован с образованием сайта PstI на 5' (фрагмент В).
Гибридизацией следующих 2 олигонуклеотидов:
АВ168 (45 mer) (SEQ ID №4)
5'GGCACTACCAGCGCCTCGAGAGCGAGGACCCCGACGCCCTGTAGG 3'
AB169 (49 mer) (SEQ ID №5)
5 'GATCCCTACAGGGCGTCGGGGTCCTCGCTCTCGAGGCGCTGGTAGTGCC 3'
фрагмент (45 pb), содержащий последовательность гена gD, от сайта Nael до стопирующего кодона TAG был преобразован с образованием сайта BamH1 на 3' (фрагмент С). Фрагменты А, В и С вместе сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ090 (7603 pb) (Фигура №3).
Пример 9: Конструирование плазмиды рРВ098 (ген PRV gD)
Плазмиду pPR29 (M.Riviere и др. J. Virol. 1992, 66, 3424-3434) расщепили с помощью SalI и BgIII, чтобы высвободить фрагмент SalI-BgIII (711 pb) (фрагмент А), содержащий 3'-конец гена, кодирующего гликопротеин gD вируса болезни Aujeszky (Штамм NIA3) (Фигура №4 и SEQ ID №6).
Плазмиду pPR29 расщепили с помощью Есо47III и SalI, чтобы высвободить фрагмент Eco47III-SalI (498 pb), содержащий 5'-конец гена, кодирующего гликопротеин gD вируса болезни Aujeszky (Штамм NIA3) (фрагмент В).
Гибридизацией следующих 2 олигонуклеотидов:
РВ101 (15 mer) (SEQ ID №7)
5'GATGCTGCTCGCAGC 3'
PB102 (19 mer) (SEQ ID №8)
5'GCTGCGAGCAGCATCTGCA 3'
фрагмент (55 pb), содержащий последовательность 5' гена gD, от инициального кодона ATG до сайта Eco47III, был преобразован с образованием сайта PstI на 5' (фрагмент С). После очистки фрагменты А, В и С вместе были сшиты с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и Bg1II, и получили плазмиду рРВ098 (6076 pb) (Фигура №5).
Пример 10: Конструирование плазмиды рРВ143 (ген Гриппа свиней НА штамм H1N1)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса гриппа свиней (штамм SIV HINI «SW»), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
РВ107 (32 mer) (SEQ ID №9)
5'GTTCTGCAGCACCCGGGAGCAAAAGCAGGGGA 3'
PB108 (33 mer) (SEQ ID №10)
5'ATTGCGGCCGCTAGTAGAAACAAGGGTGTTTTT 3'
чтобы точно изолировать ген, кодирующий протеин НА вируса SIV HINI (фигура №6 и SEQ ID №11), в форме фрагмента PCR (1803 pb). После очистки этот фрагмент сшили с вектором PCRII-прямой (Инвитроген №К2000-01), чтобы получить вектор рРВ137 (5755 pb); Вектор рРВ137 расщепили с помощью EcoRV и NotI, чтобы высвободить фрагмент EcoRV-NotI (1820 pb), содержащий ген НА. Затем этот фрагмент сшили с вектором PVR1012 (пример 7), предварительно расщепленным с помощью EcoRV и NotI, и получили плазмиду рРВ143 (6726 pb) (фигура №7).
Пример 11: Конструирование плазмиды рРВ142 (ген Гриппа свиней NP штамм H1N1)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса гриппа свиней (штамм SIV HINI «SW»), полученный по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
РВ097 (36 mer) (SEQ ID №12)
5'CCGGTCGACCGGGATAATCACTCACTGAGTGACATC 3'
PB098 (33 mer) (SEQ ID №13)
5'TTGCGGCCGCTGTAGAAACAAGGGTATTTTTCT 3'
чтобы точно изолировать ген, кодирующий протеин NP SIV HINI (фигура №8 SEQ ID №14), в форме фрагмента SalI-NotI. После очистки продукт RT-PCR (1566 pb) сшили с вектором PCRII-прямой (Инвитроген №К2000-01), чтобы получить вектор рРВ127 (5519 pb). Вектор рРВ127 расщепили с помощью SalI и NotI, чтобы высвободить фрагмент SalI-NotI (1560 pb), содержащий ген NP.
Затем этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью Satl и NotI, и получили плазмиду рРВ142 (6451 pb) (фигура №9).
Пример 12: Конструирование плазмиды рРВ144 (ген гриппа свиней НА штамм H3N2)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса гриппа свиней (штамм SIV H3N2 Cotes du Nord 1987), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
РВ095 (31 mer) (SEQ ID №15)
5'GTTCTGCAGGCAGGGGATAATTCTATCAACC 3'
PB096 (36 mer) (SEQ ID №16)
5'TTGCGGCCGCAAGGGTGTTTTTAATTACTAATATAC 3'
чтобы точно изолировать ген, кодирующий протеин НА вируса SIV H3N2 (Фигура №10 и SEQ ID №17), в форме фрагмента PstI-NotI. После очистки продукт RT-PCR(1765 pb) сшили с вектором PCRII-прямой (Инвитроген №К2000-01), чтобы получить вектор рРВ120 (5716 pb).
Вектор рРВ120 расщепили с помощью NotI, чтобы высвободить фрагмент NotI-NotT (1797 pb), содержащий ген НА. Затем этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью NotI, и получили плазмиду рРВ144 (6712pb), содержащую ген НА H3N2 в нормальной ориентации по сравнению с промотором (фиг. №11).
Пример 13: Конструирование плазмиды рРВ132 (ген гриппа свиней NP штамм H3N2)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса гриппа свиней (штамм SIV H3N2 Cotes du Nord 1987), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
РВ097 (36 mer) (SEQ ID №12)
5'CCGGTCGACCGGGATAATCACTCACTGAGTGACATC 3'
PB098 (33 mer) (SEQ ID №13)
5'TTGCGGCCGCTGTAGAAACAAGGGTATTTTTCT 3'
чтобы точно изолировать ген, кодирующий протеин NP вируса SIV H3N2 (Фигура №12 и SEQ ID №18), в форме фрагмента SalI-NotI. После очистки продукт RT-PCR (1564 pb) сшили с вектором PCRII-прямой (Инвитроген №К2000-01), чтобы получить вектор рРВ123 (5485 pb). Вектор рРВ123 расщепили с помощью SalI и NotI, чтобы высвободить фрагмент SalI и NotI (1558 pb), содержащий ген NP. Затем этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью SalI и NotI, и получили плазмиду рРВ132 (6449 pb) (фигура №13).
Пример 14: Конструирование плазмиды рАВ025 (ген PRRSV ORF5)штамм Lelystad
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса PRRSV (штамм Lelystad) (J.Meulenberg и др. Virology. 1993, 19, 62-72), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
AB055 (34 mer) (SEQ ID №19)
5'ACGCGTCGACAATATGAGATGTTCTCACAAATTG 3'
AB056 (33 mer) (SEQ ID №20)
5'CGCGGATCCCGTCTAGGCCTCCCATTGCTCAGC 3'
чтобы точно изолировать ген «ORF5», кодирующий гликопротеин оболочки Е (gp25) вируса PRRS штамма Lelystad. После очистки продукт RT-PCR (630 pb) расщепили с помощью SalI и BamHI, чтобы изолировать фрагмент SalI-BamHI (617 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рАВ025 (5486 pb) (фигура №14).
Пример 15: Конструирование плазмиды pAB001 PRRSV ORF5 штамм USA
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса PRRSV (Штамм ATCC-VR2332) (M.Murtaugh и др. Arch. Virol. 1995, 140, 1451-1460), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
АВ001 (30 mer) (SEQ ID №21)
5'AACTGCAGATGTTGGAGAAATGCTTGACCG 3'
AB002 (30 mer) (SEQ ID №22)
5'CGGGATCCCTAAGGACGACCCCATTGTTCC 3'
чтобы точно изолировать ген, кодирующий оболочечный гликопротеин Е (gp25) вируса PRRS штамма ATCC-VR2332. После очистки продукт RT-PCR (620 pb) расщепили с помощью PstI и BamHI, чтобы изолировать фрагмент PstI-BamHI (606 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ001 (5463 pb) (фигура №15).
Пример 16: Конструирование плазмиды рАВ091 (ген PRRSV ORF3 штамм Lelystad)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса PRRSV (Штамм Lelystad) (J.Meulenberg и др. Virology, 1993, 19, 62-72), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
АВ170 (32 mer) (SEQ ID №23)
5'AAACTGCAGCAATGGCTCATCAGTGTGCACGC 3'
AB171 (30 mer) (SEQ ID №24)
5'CGCGGATCCTTATCGTGATGTACTGGGGAG 3'
чтобы точно изолировать ген «ORF3», кодирующий оболочечный гликопротеин (gp45) вируса PRRS штамма Lelystad. После очистки продукт RT-PCR (818 pb) расщепили с помощью PstI и BamHI, чтобы изолировать фрагмент PstI-BamHI (802 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ091 (5660 pb) (фигура №16).
Пример 17: Конструирование плазмиды рАВ092 (ген PPRSV ORF3 штамм USA)
По технологии из примера 6 провели реакцию RT-PCP с РНК генома вируса PRRSV (Штамм ATCC-VR2332) (M.Murtaugh и др. Arch. Virol. 1995, 140, 1451-1460), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
АВ172 (32 mer) (SEQ ID №25)
5'AAACTGCAGCAATGGTTAATAGCTGTACATTC 3'
AB173 (32 mer) (SEQ ID №26)
5'CGCGGATCCCTATCGCCGTACGGCACTGAGGG 3'
чтобы точно изолировать ген ORF3, кодирующий оболочечный гликопротеин (gp45) вируса PRRS штамма ATCC-VR2332. После очистки продукт RT-PCR (785 pb) расщепили с помошью PstI и BamHI, чтобы изолировать фрагмент PstI-BamHI (769 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рАВ092 (5627 pb) (фигура №17).
Пример 18: Конструирование плазмиды рАВ004 (ген Парвовируса свиней VP2)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома парвовируса свиней (Штамм NADL2) (J.Vasudevacharya и др. Virology. 1995, 178, 611-616), полученной по технологии, описанной в примере 4, и ее следующими олигонуклеотидами:
АВ007 (33 mer) (SEQ ID №27)
5'AAAACTGCAGAATGAGTGAAAATGTGGAACAAC 3'
АВО10 (33 mer) (SEQ ID №28)
5'CGCGGATCCCTAGTATAATTTTCTTGGTATAAG 3'
чтобы расширить фрагмент (1757 pb), содержащий ген, кодирующий протеин VP2 парвовируса свиней. После очистки продукт RT-PCR расщепили с помощью PstI и Bam HI, чтобы изолировать фрагмент PstI-BamHI (1740 pb). Этот фрагмент сшили с вектором pVP 1012 (пример 7), предварительно расщепленным с помощью PstI и BamHI, и получили плазмиду рА3004 (6601 pb) (фигура №18).
Пример 19: Конструирование плазмиды рАВ069 (ген Чумы свиней HCVE1)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса чумы свиней (Hog Cholera Virus) (HCV) (Штамм Alfort) (G.Meyers и др. Virology. 1989, 171, 18-27), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
АВ126 (36 mer) (SEQ ID №29)
5'ACGCGTCGACATGAAACTAGAAAAAGCCCTGTTGGC 3'
AB127 (34 mer) (SEQ ID №30)
5'CGCGGATCCTCATAGCCGCCCTTGTGCCCCGGTC 3'
чтобы изолировать последовательность, кодирующую протеин Е1 вируса HCV, в форме фрагмента RT-PCR (1364 pb). После очистки этот фрагмент расщепили с помощью BamHI и SalI, чтобы получить фрагмент SalI-BamHI (1349 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно с помощью BamHI и SalI, и получили плазмиду рАВ069 (6218 pb) (фигура №19).
Пример 20: Конструирование плазмиды рАВ061 (ген Чумы свиней HCV E2)
По технологии из примера 6 провели реакцию RT-PCR с РНК генома вируса чумы свиней (Hog Cholera Virus) (HCV) (Штамм Alfort) (G.Meyers и др. Virology. 1989, 171, 18-27), полученной по технологии, описанной в примере 4, и со следующими олигонуклеотидами:
АВ118 (36 mer) (SEQ ID №31)
5'ACGCGTCGACATGTCAACTACTGCGTTTCTCATTTG 3'
АВ119 (33 mer) (SEQ ID №32)
5'CGCGGATCCTCACTGTAGACCAGCAGCGAGCTG 3'
чтобы изолировать последовательность, кодирующую протеин Е2 вируса HCV, в форме фрагмента RT-PCR (1246 pb). После очистки этот фрагмент расщепили с помощью BamHI и SalI, чтобы получить фрагмент SalI-BamHI (1232 pb). Этот фрагмент сшили с вектором pVR1012 (пример 7), предварительно расщепленным с помощью BamHI и SalI, и получили плазмиду рАВ061 (6101 pb) (фигура №20).
Пример 21: Конструирование плазмиды рРВ162 (ген Actinobacillus pleuropneumoniae apxI делецированный)
Ген apxl (Actinobacillus pleuropneumoniae) был клонирован таким образом, чтобы имела место делеция участка аминокислот с большим содержанием глицина (участвующего в фиксации иона кальция), находящегося между аминокислотами 719 и 846.
Провели реакцию PCR с ДНК генома Actinobacillus pleuropneumoniae (Серотип 1) (J.Frey и др. Infect. Immun. 1991, 59, 3026-3032), полученной по технологии, описанной в примерах 2 и 3, и со следующими олигонуклеотидами:
РВ174 (32 mer) (SEQ ID №33)
5'TTGTCGACGTAAATAGCTAAGGAGACAACATG 3'
PB189 (29 mer) (SEQ ID №34)
5'TTGAATTCTTCTTCAACAGAATGTAATTC 3'
чтобы расширить часть 5' гена apxI, кодирующего протеин гемолизин I (Actinobacillus pleuropneumoniae), в форме фрагмента SalI-EcoRI. После очистки продукт PCR (2193 pb) расщепили с помощью SalI и EcoRI, чтобы изолировать фрагмент SalI-EcoRI (2183 pb) (фрагмент А). Провели реакцию PCR с ДНК генома Actinobacillus pleuropneumoniae (Серотип 1) (J.Frey и др. Infect Immun. 1991, 59, 3026-3032) и со следующими олигонуклеотидами:
РВ190 (31 mer) (SEQ ID №35)
5'TTGAATTCTATCGCTACAGTAAGGAGTACGG 3'
PB175 (31 mer) (SEQ ID №36)
5'TTGGATCCGCTATTTATCATCTAAAAATAAC 3'
чтобы расширить часть 3' гена apxI, кодирующего протеин гемолизин I (Actinobacillus pleuropneumoniae), в форме фрагмента EcoRI-BamHI. После очистки продукт PCR (576 pb) расщепили с помощью EcoRI и BamHI, чтобы изолировать фрагмент EcoRI-BamHI (566 pb) (фрагмент В). Фрагменты А и В сшили вместе с вектором pVR1012 (пример 7), предварительно расщепленным с помощью SalI и BamHI, и получили плазмиду рРВ162 (7619 pb) (Фигура №21).
Пример 22: Конструирование плазмиды рРВ163 (ген Actinobacillus pleuropneumoniae apxII делецированный)
Ген apxII (Actinobacillus pleuropneumoniae) был клонирован таким образом, чтобы имела место делеция участка аминокислот с большим содержанием глицина (участвующего в фиксации иона кальция), находящегося между аминокислотами 716 и 813.
Провели реакцию PCR с ДНК генома Actinobacillus pleuropneumoniae (Серотип 9) (М.Smits и др., Infection and Immunity. 1991, 59, 4497-4504), полученной по технологии, описанной в примерах 2 и 3, и со следующими олигонук