Лечение в-клеточных злокачественных опухолей с использованием антител против cd40l в комбинации с антителами против cd20 и/или химиотерапией и лучевой терапией
Иллюстрации
Показать всеИзобретение относится к медицине, онкологии, и характеризует композиции, их применение и варианты способа лечения В-клеточных лимфом, лейкозов, а также других злокачественных опухолей CD40+. Основным активным терапевтическим агентом является анти-СD40L-антитело или другой антагонист CD40L, который ингибирует взаимодействие CD40-CD40L. В комбинации или композиции с указанным антагонистом CD40L могут дополнительно использоваться любой один или несколько из следующих компонентов: анти-СD20-антитело, химиотерапевтическое средство или их комбинация, лучевая терапия. Изобретение обеспечивает усиление механизмов апоптоза CD40+ клеток опухоли за счет сенсибилизации этих ранее резистентных клеток к гибели. 6 н. и 82 з.п. ф-лы, 4 ил., 6 табл.
Реферат
Область изобретения
Изобретение относится к способу терапии и комбинированной терапии для лечения В-клеточных лимфом и лейкозов, а также других злокачественных опухолей CD40+, путем регулирования взаимодействия между CD40 и его лигандом, CD40L, или регулирования передачи сигнала через CD40. В частности взаимодействие можно ингибировать с использованием антител против CD40L, чтобы предотвратить связывание CD40L с CD40. Указанные антитела или другие агенты, которые могут ингибировать взаимодействие CD40/CD40L, кроме того, можно комбинировать с химиотерапией, облучением и/или антителами против CD20 и антителами против CD40.
Предпосылки изобретения
Лимфомы представляют собой опухоли лимфоцитов. Девяносто процентов лимфом имеет В-клеточное происхождение, оставшиеся десять процентов лимфом Т-клеточного происхождения. У большинства пациентов диагностируют либо болезнь Ходжкина (БХ), либо лимфому неходжскинского типа (НХЛ).
В зависимости от диагностированной лимфомы варианты лечения включают в себя лучевую терапию, химиотерапию и применение моноклональных антител.
А. Антитела против CD20.
CD20 является антигеном клеточной поверхности, экспрессируемым более чем на 90% В-клеточных лимфом, который не исчезает и не модулируется в неопластических клетках (McLaughlin et al., J. Clin. Oncol. 16: 2825-2833 (1998b)). Антиген CD20 является негликозилированным мембранным белком В-клеток с молекулярной массой 35 кДа, вовлеченным во внутриклеточную передачу сигнала, дифференцировку В-клеток и мобилизацию кальциевых каналов (Clark et al., Adv. Cancer Res. 52: 81-149 (1989); Tedder et al., Immunology Today 15: 450-454 (1994)). Антиген появляется как ранний маркер дифференцировки В-клеточной линии и повсеместно экспрессируется с разной антигенной плотностью как на нормальных, так и на злокачественных популяциях В-клеток. Однако антиген отсутствует на полностью зрелых В-клетках (например, плазматических клетках), ранних популяциях В-клеток и стволовых клетках, что делает его подходящей мишенью для опосредованной антителами терапии.
Были получены антитела против CD20 для применения как в исследовательской работе, так и в терапии. Одно антитело против CD20 представляет собой моноклональное антитело В1 (патент США № 5843398). Антитела против CD20 также были получены в форме радионуклидов для лечения В-клеточной лимфомы (например, антитело против CD20, меченное 131I), а также в форме, меченной 89Sr, для облегчения болей в костях, вызываемых метастазами при раке простаты и молочной железы (Endo, Gan To Kagaku Ryoho 26: 744-748 (1999)).
Мышиное моноклональное антитело 1F5 (антитело против CD20), по имеющимся сообщениям, вводили путем непрерывной внутривенной инфузии пациентам с В-клеточной лимфомой. Однако, судя по сообщениям, требовались чрезвычайно высокие уровни (>2 грамм) 1F5, чтобы уменьшить количество циркулирующих опухолевых клеток, и результат был описан как «временный» (Press et al., Blood 69: 584-591 (1987)). Возможная проблема при использовании моноклональных антител в терапии заключается в том, что у моноклональных антител не человека, а животных (например, мышиных моноклональных антител), обычно отсутствуют эффекторные функции антитела человека, например, кроме прочего, они не способны опосредовать комлементзависимый лизис или лизировать клетки-мишени человека за счет антителозависимой клеточной токсичности или опосредованного Fc-рецепторами фагоцитоза. Кроме того, моноклональные антитела не человека, а животных, могут распознаваться хозяином-человеком как чужеродный белок; поэтому повторные инъекции таких чужеродных антител могут привести к индукции иммунных ответов, приводящих к опасным реакциям гиперчувствительности. Для моноклональных антител, полученных на основе мышей, это явление часто называют ответом на основе выработки антимышиных антител у человека или ответом «НАМА». Кроме того, указанные «чужеродные» антитела могут быть атакованы иммунной системой хозяина так, что в действительности они нейтрализуются до того, как достигнут места своей мишени.
RITUXAN®. RITUXAN® (также известный как Rituximab, MabThera®, IDEC-C2B8 и С2В8) было первым одобренным FDA моноклональным антителом и было разработано в IDEC Pharmaceuticals (см. патенты США № 5843439; 5776456 и 5736137) для лечения В-клеточной лимфомы человека (Reff et al., Blood 83: 435-445 (1994)). RITUXAN® является химерным моноклональным антителом (МАт) против CD20, которое ингибирует рост и, по имеющимся сообщениям, сенсибилизирует некоторые линии клеток лимфомы в отношении апоптоза под действием химиотерапевтических средств in vitro (Demidem et al., Cancer Biotherapy and Radiophannaceuticals 12: 177-(1997)). RITUXAN® также проявляет противоопухолевую активность при тестировании in vivo с использованием животных моделей ксенотрансплантатов мыши. RITUXAN® эффективно связывается с комплементом человека, обладает прочным связыванием с FcR и может эффективно убивать лимфоциты человека in vitro посредством как зависимого от комплимента (CDC), так и антителозависимого (ADCC) механизмов (Reff et al., Blood 83: 435-445 (1994)). У макак антитело избирательно истощает количество нормальных В-клеток в крови и лимфатических узлах.
RITUXAN® было рекомендовано для лечения пациентов с неходжкинской лимфомой низкой степени злокачественности или фолликулярной В-клеточной неходжкинской лимфомой (McLaughlin et al., Oncology (Huntingt) 12: 1763-1777 (1998a); Maloney et al., Oncology 12: 63-76 (1998); Leget et al., Curr. Opin. Oncol. 10: 548-551 (1998)). В Европе RITUXAN® было одобрено для терапии рецидивирующей фолликулярной лимфомы на стадии III/IV (White et al., Pharm. Sci. Technol. Today 2: 95-101 (1999)) и, по имеющимся сообщениям, эффективно против лимфомы клеток фолликулярных центров (FCC) (Nguyen et al., Eur. J. Haematol 62: 76-82 (1999)). Другие расстройства, которые лечат RITUXAN®, включают в себя лимфому клеток фолликулярных центров (FCC), лимфому из мантийных клеток (MCL), диффузную лимфому из крупных В-клеток (DLCL) и мелкоклеточную лимфоцитарную лимфому/хронический лимфоцитарный лейкоз (SSL/CLL) (Nguyen et al., 1999)). Пациенты с трудноизлечимой или неизлечимой НХЛ, по имеющимся сообщениям, реагировали на комбинированную терапию RITUXAN® и CHOP (например, циклофосфамид, винкристин, преднизон и доксорубицин) (Ohnishi et al., Gan To Kagaku Ryoho 25: 2223-8 (1998)). RITUXAN® проявило минимальную токсичность и значительную терапевтическую активность при неходжкинских лимфомах (НХЛ) низкой степени злокачественности в клинических исследованиях I и II фазы (Berinstein et al., Ann. Oncol. 9: 995-1001 (1998)).
RITUXAN®, которое использовали отдельно для лечения В-клеточных НХЛ обычно в еженедельной дозе 375 мг/м2 в течение четырех недель при рецидивирующей или трудноизлечимой НХЛ низкой степени злокачественности или фолликулярной НХЛ, хорошо переносилось и обладало значительной клинической активностью (Piro et al., Ann. Oncol. 10:655-61 (1999); Nguyen et al., (1999); и Coiffer et al., Blood 92: 1927-1932 (1998)). Однако в ходе испытаний с использованием антитела также вводили дозы до 500 мг/м2 в течение четырех недель (Maloney et al., Blood 90: 2188-2195 (1997)). RITUXAN® также комбинировали с химиотерапевтическими средствами, такими как CHOP (например, циклофосфамид, доксорубицин, винкристин и преднизон), для того, чтобы лечить пациентов с неходжкинской лимфомой низкой степени злокачественности или фолликулярной В-клеточной неходжкинской лимфомой (Czuczman et al., J. Clin. Oncol. 17: 268-76 (1999); и McLaughlin et al., (1998a)).
B. CD40 и CD40L.
CD40 экспрессируется на клеточной поверхности зрелых В-клеток, а также лейкозных и лимфоцитарных В-клетках и на клетках Ходжкина и Рид-Стернберга (PC) при болезни Ходжкина (БХ) (Valle et al., Eur. J. Immunol. 19: 1463-1467 (1989); и Gruss et al., Leuk. Lymphoma 24: 393-422 (1997)). CD40 является рецептором В-клеток, приводящим к активации и выживанию нормальных и злокачественных В-клеток, таких как клетки неходжкинской фолликулярной лимфомы (Johnson et al., Blood 82: 1848-1857 (1993); и Metkar et al., Cancer Immunol. Immunother. 47: 104 (1998)). Передача сигнала через рецептор CD40 защищает незрелые В-клетки и В-клеточные лимфомы от апоптоза, индуцированного IgM или Fas (Wang et al., J. Immunology 155: 3722-3725 (1995)). Сходным образом клетки лимфомы мантийных клеток имеют высокий уровень CD40, и добавление экзогенного CD40L повышало их выживаемость и спасало их от апоптоза, индуцированного флударабином (Clodi et al., Brit. J. Haematol. 103: 217-219 (1998)). Напротив, другие авторы сообщали, что стимуляция CD40 может ингибировать неопластический рост В-клеток как in vitro (Funakoshi et al., Blood 83: 2787-2794 (1994)), так и in vivo (Murphy et al., Blood 86: 1946-1953 (1995)).
Антитела против CD40 (см. патенты США № 5874082 и 5667165), вводимые мышам, увеличивали выживаемость мышей с В-клеточными лимфомами человека (Funakoshi et al. (1994); и Tutt et al., J. Immunol. 161: 3176-3185 (1998)). Способы лечения неоплазм, включая В-клеточные лимфомы и EBV-индуцированные лимфомы с использованием анти-CD40-антител, имитирующих эффект CD40L и, следовательно, доставляющих сигнал смерти, описаны в патенте США № 5674492 (1997), который включен в данное описание в качестве ссылки в полном объеме. Передача сигнала через CD40 также связана с синергическим взаимодействием с CD20 (Ledbetter et al., Circ. Shock 44: 67-72 (1994)). Дополнительные ссылки, описывающие получение и применение анти-CD40-антител, включают в себя патенты США № 5874085 (1999), 5874082 (1999), 5801227 (1998), 5674492 (1997) и 5667165 (1997), которые включены в данное описание в качестве ссылки в полном объеме.
Лиганд CD40, gp39 (также называемый лигандом CD40, CD40L или CD154), экспрессируется на активированных, но не на покоящихся Th-клетках CD4+ (Spriggs et al., J. Exp. Med. 176: 1543-1550 (1992); Lane et al., Eur. J. Immunol. 22: 2573-2578 (1992) и Roy et al., J. Immunol. 151: 1-14 (1993)). Как CD40, так и CD40L были клонированы и охарактеризованы (Stamenkovi et al., EMBO J. 8: 1403-1410 (1989); Armitage et al., Nature 357: 80-82 (1992); Lederman et al., J. Exp. Med. 175: 1091-1101 (1992); и Hollenbaugh et al., EMBO J. 11: 4313-4321 (1992)). CD40L человека также описан в патенте США № 5945513. Клетки, трансфицированные геном CD40L и экспрессирующие белок CD40L на своей поверхности, могут запускать пролиферацию В-клеток и вместе с другими стимулирующими сигналами могут индуцировать продукцию антител (Armitage et al. (1992); и патент США № 5945513). CD40L может играть важную роль в зависимом от клеточных контактов взаимодействии опухолевых В-клеток (CD40+) с неопластическими фолликулами или клетками Рид-Стернберга (CD40+) в областях поражения болезнью Ходжкина (Carbone et al., Am. J. Pathol. 147: 912-922 (1995)). Моноклональные антитела против CD40L, по имеющимся сообщениям, эффективно использовали для того, чтобы ингибировать индукцию мышиного СПИД (MAIDS) у мышей, инфицированных LP-BM5 (Green et al., Virology 241: 260-268 (1998)). Однако механизм передачи сигнала CD40L-CD40, приводящего к выживанию вместо ответов в виде клеточной гибели злокачественных В-клеток, неизвестен. Например, в клетках фолликулярной лимфомы понижающая регуляция индуцирующей апоптоз молекулы TRAIL (APO-2L) (Ribeiro et al., British J. Haematol. 103: 684-689 (1998)) и сверхэкспрессии BCL-2, и в случае B-CLL, понижающая регуляция CD95 (Fas/APO-1) (Laytragoon-Lewin et al., Eur. J. Haematol. 61: 266-271 (1998)), были предложены в качестве механизмов выживания. Напротив, относительно фолликулярной лимфомы существует доказательство того, что активация CD40 приводит к повышающей регуляции TNF (Worm et al., International Immunol. 6: 1883-1890 (1994)), молекул CD95 (Plumas et al., Blood 91: 2875-2885 (1998)).
Также были получены анти-CD40-антитела для того, чтобы предупреждать или лечить опосредованные антителами заболевания, такие как аллергии и аутоиммунные заболевания, как описано в патенте США № 5874082 (1999). Анти-CD40-антитела, по имеющимся сообщениям, эффективно комбинировали с анти-CD20-антителами, получая аддитивное действие в ингибировании роста неходжкинских В-клеточных лимфом в культуре клеток (Benoit et al., Immunopharmacology 35: 129-139 (1996)). Исследования in vivo на мышах, по сути, показали, что анти-CD20-антитела были более эффективными, чем анти-CD40-антитела, введенные отдельно, при стимуляции выживания мышей, несущих некоторые, но не все, линии лимфом (Funakoshi et al., J. Immunother. Emphasis Tumor Immunol. 19: 93-101 (1996)). Анти-СВ19-антитела, по имеющимся сообщениям, также эффективны in vivo при лечении двух В-клеточных лимфом сингенных мышей, BCL1 и А31 (Tutt et al. (1998)). Также описаны антитела к CD40L для применения при лечении расстройств, связанных с активацией В-клеток (Европейский патент № 555880 (1993)). Анти-CD40L-антитела включают в себя моноклональные антитела 3Е4, 2Н5, 2Н8, 4D9-8, 4D9-9, 24-31, 24-43, 89-76 и 89-79, которые описаны в патенте США № 57474037 (1998), и анти-CD40L-антитела, описанные в патенте США № 5876718 (1999), используемые для лечения болезни «трансплантат против хозяина».
Следовательно, не противореча тому, что сообщалось в литературе ранее, можно говорить о необходимости в улучшении способов лечения и комбинированной терапии для лечения В-клеточных лимфом и лейкозов. Применение композиций, содержащих анти-CD40L-антитела и другие агенты, которые противодействуют взаимодействиям CD40-CD40L, открывает новый путь лечения раковых пациентов, который может быть менее токсичным, чем существующая терапия. В частности, предложенные способы и композиции для ингибирования стимуляции CD40, чтобы предотвратить превращение раковых клеток в невосприимчивые к запрограммированной клеточной гибели, вызванной химиотерапией или другими способами терапии рака, открывает ранее неизвестный способ усиления терапии рака и снижения вероятности, что развивающиеся клетки будут резистентными к терапии.
Сущность изобретения
Объектом изобретения является способ лечения В-клеточных лимфом, В-клеточных лейкозов и других злокачественных опухолей CD40+, включающий в себя введение терапевтически эффективного количества антитела или фрагмента антитела, который связывается с CD40L. В-клеточные лимфомы включают в себя лимфому Ходжкина и неходжкинские лимфомы любой степени.
Другим объектом изобретения является комбинированная терапия для лечения В-клеточной лимфомы или В-клеточного лейкоза, включающая в себя анти-CD40L-антитело или фрагмент антитела или антагонист CD40L и по меньшей мере один из нижеперечисленных компонентов: (а) химиотерапевтическое средство или комбинацию химиотерапевтических средств, (b) лучевую терапию, (с) анти-CD20-антитело или его фрагмент и (d) анти-CD40-антитело или его фрагмент.
Краткое описание чертежей
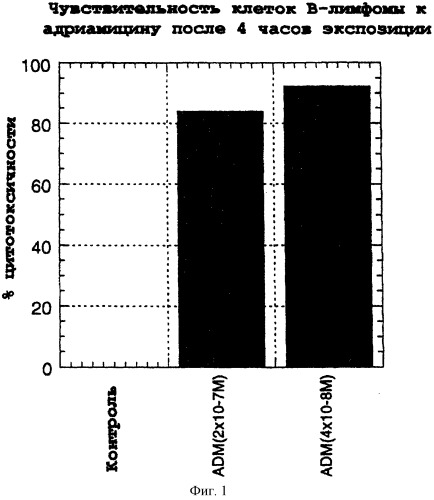
Фиг.1. Чувствительность клеток В-лимфомы к адриамицину после 4 часов экспозиции.
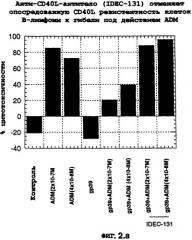
Фиг.2. (Панель А) Анти-CD40L (IDEC-131) отменяет опосредованную CD40L резистентность клеток В-лимфомы к гибели под действием ADM. (Панель В) Влияние RITUXAN® на нормальные и предварительно обработанные SCD40L клетки DHL-4.
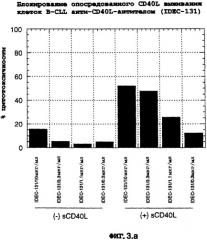
Фиг.3. (Панель А) Блокирование опосредованного CD40L выживания клеток B-CLL с помощью анти-CD40L-антитела (IDEC-131). (Панель В) Блокирование опосредованного CD40L выживания B-CLL с помощью С2В8 IDEC.
Фиг.4. FACS-анализ, сравнивающий экспрессию HLA-DR в клетках CD19+-CLL, культивируемых с sCD40L, и клетках, не культивируемых с sCD40L.
Подробное описание изобретения
В другом аспекте изобретение относится к композиции для лечения лейкозов и лимфом, а также других злокачественных опухолей, которые экспрессируют CD40. Предпочтительным вариантом изобретения являются композиции и способы их применения для лечения лимфом и лейкозов В-клеточной линии. Композиции могут содержать средства, которые антагонистическим образом действуют на передачу сигнала посредством CD40 или на взаимодействие между CD40 и CD40L. Средства необязательно могут содержать один активный агент, такой как анти-CD40L-антитело или его фрагмент, а также пептидные фрагменты, пептидные миметики или химические соединения. В альтернативном случае композиция может содержать несколько активных агентов, виды мишеней которых при злокачественных опухолях иные, чем передача сигнала через CD40 или взаимодействие CD40/CD40L, такие как химиотерапевтические средства, другие антитела, и/или композицию можно вводить в комбинации с лучевой терапией.
А. Определения.
В используемом здесь смысле подразумевается, что термин «CD40L-антитело» включает в себя иммуноглобулины и их фрагменты, которые специфично реагируют с белком CD40L или его пептидом, или слитым белком CD40L. Антитела к CD40L могут включать в себя антитела человека, приматизированные антитела, химерные антитела, биспецифичные антитела и гуманизированные антитела.
В используемом здесь смысле под термином «CD40-антитело» подразумевается, что он включает в себя иммуноглобулины и их фрагменты, которые специфично реагируют с белком CD40 или его пептидом, или слитым белком CD40. Антитела к CD40 могут включать в себя антитела человека, приматизированные антитела, химерные антитела, биспецифичные антитела и гуманизированные антитела.
В используемом здесь смысле под «CD20-антителом» подразумевается, что термин включает в себя иммуноглобулины и их фрагменты, которые специфично реагируют с белком CD20 или его пептидом, или слитым белком CD20. Антитела к CD20 могут включать в себя антитела человека, приматизированные антитела, химерные антитела, биспецифичные антитела и гуманизированные антитела. К анти-CD20-антителам относится моноклональное антитело В1 и RITUXAN®.
Под «гуманизированным антителом» подразумевается антитело, полученное из антитела не человека, а животного, обычно мышиного антитела, которое сохраняет или в значительной степени сохраняет антигенсвязывающие свойства исходного антитела, но которое менее иммуногенно у людей. Это может быть достигнуто разными способами, включая (а) пересадку полных вариабельных доменов антитела не человека на константные области антитела человека, чтобы создать химерные антитела; (b) пересадку только районов, определяющих комплементарность (CDR), антитела не человека к каркасным и константным участкам антитела человека с сохранением или без сохранения критических остатков каркаса и (с) трансплантацию полных вариабельных доменов антитела не человека, но при этом осуществляется их «маскировка» участками, подобными участкам антитела человека, путем замены поверхностных остатков. Такие способы раскрыты у Morrison et al., Proc. Natl. Acad. Sci. 81: 6851-5 (1984); Morrison et al., Adv. Immunol. 44: 65-92 (1988); Verhoeyen et al., Science 239: 1534-1536 (1988); Padlan, Molec. Immun. 28: 489-498 (1991); и Padlan, Molec. Immun. 31: 169-217 (1994), все работы включены в данное описание в качестве ссылки в полном объеме. Гуманизированные анти-CD40L-антитела можно получить, как описано в заявке на выдачу патента США № 08/554840, поданной 7 ноября 1995 г., также включенной в данное описание в качестве ссылки в полном объеме.
Под термином «антитело человека» подразумевается антитело, содержащее полностью человеческие легкую и тяжелую цепь, а также константные области, получаемое любым из известных стандартных способов.
Под «приматизированным антителом» понимается рекомбинантное антитело, которое было сконструировано так, чтобы оно содержало вариабельные домены тяжелой и легкой цепей антитела обезьяны (или другого примата), в частности антитела макаки крабоеда, и которое содержит последовательности константных доменов антитела человека, предпочтительно константного домена иммуноглобулина человека гамма 1 или гамма 4 (или вариант РЕ). Получение таких антител описано у Newman et al., Biotechnology, 10: 1458-1460 (1992); а также в совместно переуступленных заявках 08/379072, 08/487550 или 08/746361, которые все включены в данное описание в качестве ссылки в полном объеме. Сообщалось, что указанные антитела проявляют высокую степень гомологии с антителами человека, т.е. 85-98%, проявляют эффекторные функции антител человека, обладают пониженной иммуногенностью и могут проявлять высокую аффинность по отношению к антигенам человека.
Под «фрагментом антитела» понимается такой фрагмент антитела, как Fab, F(ab′)2, Fab′ и scFv.
Под «химерным антителом» подразумевается антитело, содержащее последовательности, полученные из двух разных антител, которые обычно являются антителами разных видов. Чаще всего химерные антитела содержат фрагменты антител человека и мыши и в большинстве случаев константные области человека и вариабельные области мыши.
Под «биспецифичным антителом» подразумевается молекула антитела с одним антигенсвязывающим сайтом, специфичным для одного антигена, и другим антигенсвязывающим сайтом, специфичным для другого антигена.
Под «иммуногенностыо» подразумевается способность направленного к мишени белка или терапевтического компонента вызывать иммунный ответ (например, гуморальный или клеточный) при введении субъекту.
Особенно предпочтительным является приготовление парентеральных композиций в виде дозированной лекарственной формы для простоты введения и единообразного дозирования. «Дозированная лекарственная форма» в используемом в данном описании смысле относится к физически дискретным единицам, подходящим для однократных доз для субъектов-млекопитающих, которых необходимо лечить; при этом рассчитывают каждую единицу, содержащую предварительно определенное количество активного соединения, чтобы получить требуемый терапевтический эффект, в ассоциации с требуемым фармацевтическим носителем. Конкретное определение дозированных лекарственных форм согласно изобретению продиктовано и непосредственно зависит от (А) уникальных характеристик активного соединения и конкретного терапевтического действия, которое необходимо достичь; и (В) ограничений, неизбежных в области составления рецептуры такого активного соединения для лечения, связанных с чувствительностью индивидуумов.
В. Антагонисты CD40L.
Согласно способам изобретения антагонист CD40L вводят субъекту для того, чтобы воспрепятствовать взаимодействию CD40L и его партнера при связывании, CD40. «Антагонист CD40L» определяют как молекулу, которая препятствует такому взаимодействию. Антагонистом CD40L может быть антитело, направленное против CD40L (например, моноклональное антитело против CD40L), фрагмент или производное антитела против CD40L (например, Fab или F(ab)′2-фрагменты), химерные антитела или гуманиэированные антитела, растворимые формы CD40, растворимые формы слитого белка, содержащего CD40, или фармацевтические средства, которые разрушают или препятствуют взаимодействию CD40L-CD40 или препятствуют передаче сигнала через CD40.
Антитела. Чтобы получить анти-CD40L-антитела млекопитающего (например, мышь, хомячок, кролик или копытное животное), можно иммунизировать иммуногенной формой белка или белкового фрагмента CD40L (например, пептидного фрагмента), которая вызывает гуморальный ответ у животного. В качестве иммуногена также можно использовать клетку, экспрессирующую CD40L на своей поверхности. Альтернативные иммуногены включают в себя очищенный белок CD40L или очищенные белковые фрагменты. CD40L можно очищать из клетки, экспрессирующей CD40L, стандартными способами очистки (Armitage et al. (1992); Lederman et al. (1992); и Hollenbaugh et al. (1992)). Альтернативно пептиды CD40L можно получить на основе аминокислотной последовательности CD40L, как показано у Armitage et al. (1992). Способы придания иммуногенности белку включают в себя конъюгацию с носителями или другие способы, хорошо известные в данной области. Например, белок можно вводить в присутствии адъюванта. Процесс иммунизации можно контролировать путем определения титра антител в плазме или сыворотке. Можно использовать стандартный метод ELISA или другой иммуноаналиэ с иммуногеном в качестве антигена, чтобы оценить уровни антител. После иммунизации можно получить антисыворотку и выделить поликлональные антитела. Чтобы получить моноклональные антитела, можно собрать антителопродуцирующие клетки и слить с клетками миеломы, используя стандартные способы слияния соматических клеток, как описано в патентах США № 5833987 (1998) и 5747037 (1997).
Антитела можно фрагментировать, используя стандартные способы, и можно провести скрининг фрагментов в отношении применимости таким же образом, который описан выше для целых антител. Например, F(ab')2-фрагменты можно создать при обработке антител пепсином. Полученный в результате F(ab')2-фрагмент можно обработать, чтобы восстановить дисульфидные мостики и получить Fab'-фрагменты. Другие рассматриваемые фрагменты антител включают в себя Fab и scFv.
Один из способов минимизации распознавания антител нечеловека при терапевтическом использовании на людях, отличный от общей иммуносупрессии, заключается в получении химерных производных антител, т.е. молекул антител, в которых объединены вариабельная область антитела не человека, а животного, и константная область антитела человека. Молекулы гуманизированных химерных антител, например, могут содержать антигенсвязывающий домен из антитела мыши, крысы или другого вида, и константные области антитела человека. Способы получения указанных гуманизированных химерных антител включают в себя способы, описанные в ссылках, цитируемых в патенте США № 5833987 (1998).
В целях терапии человека антитела, специфично реагирующие с белком или пептидом CD40L, можно далее гуманизировать благодаря получению химер вариабельных областей антитела человека, в которых части вариабельных областей, особенно консервативные каркасные районы антигенсвязывающего домена, имеют человеческое происхождение, и только гипервариабельные районы не имеют человеческого происхождения. Такие измененные молекулы иммуноглобулина можно получить любым из нескольких способов, известных в данной области (например, Teng et al., Proc. Natl. Acad. Sci. USA 80: 7308-7312 (1983); Kozbor et al., Immunology Today 4: 7279 (1983); Olsson et al., Meth. Enzymol. 92: 3-16 (1982)), и предпочтительно получают в соответствии со способами опубликованной заявки РСТ WO 92/06193 или ЕР 0239400. Гуманизированные антитела можно получить коммерческим способом, например, Scotgen Limited, 2 Holly Road, Twickenham, Middlesex, Great Britain. Предпочтительное гуманизированное gp 39(CD40L)-антитело, IDEC-131, описано в согласованной заявке на выдачу патента США 08/554840, включенной в данное описание в качестве ссылки в полном объеме.
Другим способом создания специфичных антител или фрагментов антител, реагирующих против белка или пептида CD40L (например, такого как слитый белок gp 39, описанный в патенте США № 5945513), является скрининг экспрессирующих библиотек, кодирующих гены иммуноглобулинов, или их части, экспрессируемые в бактериях, с помощью белка или полипептида CD40L. Например, полные Fab-фрагменты, VH-районы и Fv-районы можно экспрессировать в бактериях, используя экспрессирующие фаговые библиотеки. См., например. Ward et al., Nature 341: 544-546 (1989); Huse et al., Science 246: 1275-1281 (1989); и McCafferty et al., Nature 348: 552-554 (1990). Посредством скрининга таких библиотек, например с помощью пептида CD40L, можно идентифицировать фрагменты иммуноглобулинов, реагирующие с CD40L. Альтернативно можно использовать мышей SCID-hu (доступные из Genpharm), чтобы получить антитела или их фрагменты.
Методики получения моноклональных антител (МАт), направленных против CD40L, включая CD40L человека и CD40L мыши, и подходящие антитела для применения в способах согласно изобретению описаны в заявке на выдачу патента РСТ № WO 95/06666, озаглавленной «Anti-gp 39 Antibodies and Uses Therefor»; руководства которой включены в данное описание в качестве ссылки в полном объеме. Особенно предпочтительными антителами против CD40L человека согласно изобретению являются МАт 24-31 и 89-76, полученные соответственно с помощью гибридом 24-31 и 89-76. Гибридомы 89-76 и 24-31, продуцирующие соответственно антитела 89-76 и 24-31, были депонированы по условиям Будапештского договора в американской коллекции типов культур (АТСС), 10801 University Blvd., Manassas, VA 20110-2209, 2 сентября, 1994 г. Гибридоме 89-76 присвоили инвентарный номер АТСС НВ11713, и гибридоме 24-31 присвоили инвентарный номер АТСС НВ11712.
Рекомбинантные анти-CD40L-антитела, такие как химерные и гуманизированные антитела, можно получить посредством обработки нуклеиновой кислоты (например, ДНК или кДНК), кодирующей анти-CD40L-антитела, в соответствии со стандартными способами рекомбинантной ДНК. Таким образом, другой аспект данного изобретения относится к изолированным молекулам нуклеиновой кислоты, кодирующим тяжелые или легкие цепи иммуноглобулинов или их части, реагирующие с CD40L, в частности CD40L человека. Нуклеиновая кислота, кодирующая иммуноглобулин, может кодировать вариабельную область легкой (VL) или тяжелой (VН) цепи иммуноглобулина вместе или без связанной константной области тяжелой или легкой цепи (или ее части). Такие нуклеиновые кислоты можно выделить из клетки (например, гибридомы), продуцирующей МАт против CD40L человека, стандартными способами. Например, нуклеиновые кислоты, кодирующие МАт 24-31 или 89-76, можно выделить соответственно из гибридом 24-31 или 89-76, путем скрининга библиотеки кДНК, ПЦР-амплификации или другими стандартными способами. Кроме того, нуклеиновые кислоты, кодирующие МАт против CD40L человека, можно включить в экспрессирующий вектор и ввести в подходящую клетку-хозяина, чтобы обеспечить экспрессию и продукцию рекомбинантных форм антител против CD40L человека.
Приматизированные антитела. Другие высокоэффективные способы создания рекомбинантных антител представлены Newnan, Biotechnology, 10: 1455-1460 (1992). Более конкретно, результатом указанного способа является создание приматизированных антител, которые содержат вариабельные домены обезьян и константные последовательности человека. Данная публикация включена в данное описание в качестве ссылки в полном объеме. Кроме того, указанный способ также описан в совместно переуступленной заявке на выдачу патента США № 08/379072, поданной 25 января 1995 г., которая является продолжением заявки на выдачу патента США с регистрационным № 07/912292, поданной 10 июля 1992 г., которая является частичным продолжением заявки на выдачу патента США с регистрационным № 07/856281, поданной 23 марта 1992 г., которая, наконец, является частичным продолжением заявки на патент США с регистрационным № 07/735064, поданной 25 июля 1991. Заявка 08/379072 и все исходные заявки включены в данное описание в качестве ссылок в полном объеме.
Указанным способом модифицируют антитела так, что они не отторгаются из-за своих антигенных свойств при введении людям. Указанный способ основан на иммунизации макак-крабоедов антигенами или рецепторами человека. Данный способ был разработан для того, чтобы создать моноклональные антитела высокой аффинности, направленные к поверхностным антигенам клеток человека.
Идентификацию антител макак к CD40L человека путем скрининга библиотек на основе фагового дисплея или гетерогибридом обезьян, полученных с использованием В-лимфоцитов обезьян, иммунизированных CD40L, можно осуществить с использованием способов, описанных в совместно переуступленной заявке на патент США № 08/487550, поданной 7 июня 1995 г, включенной в данное описание в качестве ссылки в полном объеме.
Ранее сообщалось, что антитела, полученные с использованием способов, описанных в указанных заявках, проявляют эффекторную функцию антитела человека, обладают пониженной иммуногенностыо и продолжительным временем полужизни в сыворотке. Технология основана на том, что, несмотря на тот факт, что макаки-крабоеды филогенетически сходны с людьми, они все же распознают многие белки человека как чужеродные и поэтому вырабатывают иммунный ответ. Кроме того, поскольку макаки-крабоеды филогенетически близки людям, было обнаружено, что антитела, выработанные у этих обезьян, обладают высокой степенью аминокислотной гомологии с антителами, полученными у людей. Действительно, после секвенирования генов вариабельных областей легкой и тяжелой цепей иммуноглобулина макак было обнаружено, что последовательность каждого семейства генов на 85-98% гомологична последовательности эквивалента человека (Newman et al., 1992). Первое созданное таким образом антитело, анти-СВ4-антитело, было на 91-92% гомологично консенсусной последовательности каркасных районов иммуноглобулина человека (Newman et al., 1992).
Как описано выше, данное изобретение частично относится к идентификации моноклональных антител или их приматизированных форм, которые специфичны по отношению к антигену CD40L человека и способны ингибировать передачу сигнала через CD40 или ингибировать взаимодействие CD40/CD40L. Блокирование сайта первичной активации между CD40 и CD40L идентифицированным антителом (или его терапевтически эффективным фрагментом), обеспечивая возможность комбинированного антагонистического действия на позитивную костимуляцию с агностическим действием на негативную передачу сигнала, будет пригодным терапевтическим подходом воздействия на рецидивирующие формы злокачественной опухоли, особенно на В-клеточные лимфомы и лейкозы. Функциональную активность идентифицированных антител определяют по блокированию сигналов CD40, позволяющих клетке выживать и избегать апоптоза, индуцированного IgM или Fas.
Производство новых моноклональных антител обезьян, которые специфично связывают CD40L или CD40 человека, а также полученных из них приматизированных антител, можно осуществлять с использованием способов, описанных в заявке на выдачу патента США, поданной для совместного рассмотрения, с регистрационным № 08/487550, и как здесь указано. Данные антитела обладают высокой аффинностью к CD40L и поэтому их можно использовать в качестве иммуносупрессоров, которые ингибируют путь CD40L/CD40.
Получение моноклональных антител обезьян предпочтительно будет осуществлено путем скрининга библиотек на основе фагового дисплея или за счет получения гетерогибридом обезьян с использованием В-лимфоцитов, полученных от обезьян, иммунизированных CD40L (например, CD40 человека). CD40 человека также может быть из слитого белка, описанного в патенте США № 5945513.
Как указано, первый способ создания анти-CD40L-антител заключается в технологии рекомбинантного фагового дисплея. Данный способ в общих чертах описан выше.
По существу способ будет включать в себя синтез рекомбинантных библиотек иммуноглобулинов против антигена CD40L, экспонированных на поверхности нитчатого фага, и селекцию фагов, которые секретируют антитела, обладающие высоким сродством к антигену CD40L. Как отмечено выше, предпочтительно будут отбираться антитела, которые связываются как с CD40L, так и с CD40 человека. Для осуществления такой методологии авторы данного изобретения, чтобы получить библиотеки обезьян, создали уникальную библиотеку, в которой уменьшена возможность рекомбинации и повышена стабильность.
По существу, чтобы принять на вооружение фаговый дисплей для применения в случае библиотек обезьян, данный вектор содержит специфичные праймеры для ПЦР-амплификации генов иммуноглобулинов обезьян. Указанные праймеры основаны на последовательностях макак, полученных при разработке технологии приматизации, и баз данных, содержащих последовательности человека.
Подходящие праймеры представлены в совместно переуступленной заявке 08/379072, включенной в данное описание в качестве ссылки.
Второй способ заключается в иммунизации обезьян, например макак, направленной против антигена CD40L человека. Преимущества, присущие макакам, связанные с получением моноклональных антител, обсуждаются выше. В частности таких обезьян, например макак-крабоедов, можно иммунизировать против антигенов или рецепторов человека. Кроме того, полученные в результате антитела можно использовать для создания приматизированных антител согласно способу Newman et al. (1992) и Newman et al., совместно переуступленной заявке на выдачу патента США с регистрационным номером № 08/379072, поданной 25 января 1995 г., и указанные работы включены в данное описание в качестве ссылок в полном объеме.
Существенное преимущество антител, полученных от макак-крабоедов, состоит в том, что обезьяны распознают многие белки человека как чужеродные и поэтому обеспечивают образование антител, некоторые из которых обладают высоким сродством к требуемым антигенам человека, например поверхностным белкам и клеточным рецепторам человека. Кроме того, поскольку они филогенетически близки людям, полученные в результате антитела проявляют высокую степень аминокислотной гомологии с антителами, полученными у человека. Как отмечено выше, после секвенирования генов вариабельных областей легкой и тяжелой цепей иммуноглобулина макак было обнаружено, что каждое семейство генов было на 85-88% гомологично их аналогам у человека (Newman et al., 1992).
По существу, макакам-крабоедам вводят антиген CD40L человека, из них выделяют В-клетки, например у животных берут биопсии лимфатического узла, и затем В-лимфоциты сливают с клетками гетеромиеломы КН6/В5 (мышь × человек), используя полиэтиленгликоль (ПЭГ). Затем идентифицируют гетерогибридомы, секретирующие антитела, которые связывают антиген CD40L человека.
Желательны антитела, которые связываются с CD40L или CD40 таким образом, который прекращает или регулирует передачу сигнала через CD40, поскольку такие антитела потенциально можно использовать для того, чтобы ингибировать взаимодействие CD40L с CD40, с их встречными рецепторами. Если можно выработать антитела против более чем одного эпитопа на CD40L или CD40 и использовать антитела вместе, их комбинированная активность потенциально может давать синергическое действие.
Заявляемое изо