Протеин из растения pilocarpus heterophyllus - антагонист действия человеческого рилизинг-фактора гормона роста (ghrh), применение протеина для получения лекарственного средства (варианты), лекарственное средство (варианты), фармацевтическая композиция для противодействия эффектам ghrh, моноклональное антитело и способ выделения протеина (варианты)
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к выделению протеина, который фиксирует человеческий рилизинг-фактор гормона роста. Предложен новый протеин с молекулярной массой около 90,9 кДа, он включает фрагменты идентифицированных пептидных последовательностей 1, 2 и 3. Способ выделения протеина включает экстракцию водой клеток растения Pilocarpus heterophyllus, вакуумную фильтрацию, осаждение экстрагированных протеинов, центрифугирование и гель-фильтрацию полученного фильтрата. Получено также моноклональное антитело, которое специфически фиксирует выделенный протеин. Изобретение может быть использовано для получения эффективных лекарственных средств и фармацевтических композиций, предназначенных для противодействия эффектам GHRH, лечения пролиферативных заболеваний. 11 н. и 1 з.п. ф-лы, 5 ил.
Реферат
Настоящее изобретение относится к протеину, который фиксирует человеческий GHRH (человеческий рилизинг-фактор гормона роста или фактор, высвобождающий гормон роста человека).
Гормон роста («GH») представляет собой протеин из 191 аминокислоты, который стимулирует продуцирование многочисленных факторов роста как инсулиноподобный фактор роста I (IGF-1) и вызывает рост большого числа тканей (скелет, соединительные, мышечные и висцеральные ткани). Гормон роста также обладает физиологическими активностями, проявляемыми в увеличении синтеза нуклеиновых кислот, протеинов и липолиз и в значительном снижении мочевыделения (L.A. Frohman и R.D. Kineman, Handbook of Physiology, Hormonal Control of Growth, под ред. J.L. Kostyo и H.M. Goodman (Oxford Univ. Press., Нью-Йорк, 1999), с.189-221).
Синтез гормона роста регулируется факторами с положительным или отрицательным воздействием, секретируемыми гипоталамусом. Преобладающим фактором, контролирующим продуцирование гормона роста, является «рилизинг-фактор гормона роста» (GHRH), пептид из 44 аминокислот у человека.
GH и GHRH принимают участие в многочисленных заболеваниях. Из них можно назвать, в частности, рак (в особенности рак предстательной железы или рак легкого), акромегалию, ретинопатии и диабетические нефропатии; в случае этих патологий показано лечение антагонистами GHRH. В связи с числом потенциально имеющих отношение к этому заболеваний в промышленности продолжают заниматься поисками антагонистов GHRH.
Заявителю удалось выделить новый протеин растительного происхождения, обладающий свойством фиксировать человеческий GHRH.
Следовательно, во-первых, объектом изобретения является выделенный протеин, который может быть получен путем экстракции из растения Pilocarpus heterophyllus, отличающийся тем, что он имеет молекулярную массу около 90,9 кДа и включает фрагменты идентифицированных пептидных последовательностей 1, 2 и 3, причем вышеуказанный протеин может находиться в гликозилированной или негликозилированной форме. Для упрощения последующего описания этот протеин ниже называют как «гетерокарпин».
Вышеуказанными идентифицированными последовательностями 1, 2 и 3 являются следующие:
идентифицированная последовательность 1: SEQ ID No 1: KLIGARYFDK;
идентифицированная последовательность 2: SEQ ID No 2: YGEDIIVGVIDSGV;
идентифицированная последовательность 3: SEQ ID No 3: PESESY.
Используемая выше (как и в остальной части настоящей заявки) номенклатура для определения пептидов представляет собой таковую, указанную согласно «IUPAC-IUB Commissioner on Biochemical Nomenclature», по которой в соответствии с принятым представлением N-концевая (аминогруппа) аминокислота является левовращающей и С-концевая (карбоксильная группа) аминокислота является правовращающей. Термин "природная аминокислота" указывает одну из природных L-аминокислот, находящуюся в природных протеинах: Gly, Ala, Val, Leu, Ile, Ser, Thr, Lys, Arg, Asp, Asn, Glu, Gln, Cys, Met, Phe, Tyr, Pro, Trp и His.
Протеин является так называемым «выделенным», если его берут вне его первоначальной окружающей среды. В частности, природный протеин является выделенным, если он отделен от биологического материала, с которым он сосуществует в природной системе.
Изобретение предпочтительно относится к гетерокарпину в его негликозилированной форме.
Согласно предпочтительному варианту изобретения гетерокарпин получают из экстракта клеток растения Pilocarpus Heterophyllus, культивируемых in vitro.
Кроме того, объектом изобретения является также моноклональное антитело или его антигенсвязывающий фрагмент, которое (который) специфически фиксирует гетерокарпин.
Гетерокарпин обладает свойством фиксировать человеческий GHRH. In vitro, гетерокарпин фиксирует человеческий GHRH и таким образом ингибирует синтез циклического аденозинмонофосфата (АМФ), индуцируемый во время фиксации человеческого GHRH на его рецепторе. In vivo, в случае крысы, комплекс гетерокарпин/человеческий GHRH образуется в относящемся к крови компартменте и ингибирует зависимым от дозы образом синтез гормона роста, индуцируемый с помощью 10 мкг человеческого GHRH в соотношении моль на моль. Таким образом, гетерокарпин действительно обладает свойством фиксировать человеческий GHRH.
Эти свойства делают соединения согласно изобретению пригодными для фармацевтического использования. Следовательно, объектом изобретения является также в качестве лекарственного средства гетерокарпин в его гликозилированной или негликозилированной форме. Оно относится также к фармацевтическим композициям, включающим в качестве действующего начала гетерокарпин в гликозилированной или негликозилированной форме, причем вышеуказанная композиция включает также один или несколько фармацевтически приемлемых эксципиентов. Кроме того, объектом изобретения является применение гетерокарпина в гликозилированной или негликозилированной форме для получения лекарственных средств, предназначенных для противодействия эффектам GHRH, лечения пролиферативных заболеваний (и, в частности, рака), лечения акромегалии или лечения диабетических ретинопатий и нефропатий. В том, что касается рака, гетерокарпин особенно пригоден для получения лекарственного средства, предназначенного для лечения карциноидных и панкреатических опухолей, гипоталамогипофизарных ганглиоцитом, бронхиальных, интестинальных и гепатических карцином, симпатоадренергических опухолей, феохромоцитом, гипофизарных аденом и тиреоидных карцином.
Объектом изобретения является также в качестве лекарственного средства моноклональное антитело или его антигенсвязывающий фрагмент, которое (который) специфически фиксирует гетерокарпин. Кроме того, изобретение относится к фармацевтической композиции, включающей в качестве действующего начала моноклональное антитело или его антигенсвязывающий фрагмент, которое (который) специфически фиксирует гетерокарпин, причем вышеуказанная композиция также включает один или несколько фармацевтически приемлемых эксципиентов. Изобретение относится, кроме того, к применению моноклонального антитела или его антигенсвязывающего фрагмента, которое (который) специфически фиксирует гетерокарпин, для получения лекарственных средств, предназначенных для противодействия эффектам GHRH, лечения пролиферативных заболеваний (и, в частности, рака), лечения акромегалии или лечения диабетических ретинопатий и нефропатий. В том, что касается рака, вышеуказанное моноклональное антитело или его антигенсвязывающий фрагмент особенно пригодно(ен) для получения лекарственного средства, предназначенного для лечения карциноидных и панкреатических опухолей, гипоталамогипофизарных ганглиоцитом, бронхиальных, интестинальных и гепатических карцином, симпатоадренергических опухолей, феохромоцитом, гипофизарных аденом и тиреоидных карцином.
Изобретение относится к применению гетерокарпина в качестве эксципиента в фармацевтической композиции, предназначенной для пролонгированного высвобождения GHRH. Оно относится также к фармацевтической композиции, включающей GHRH, гетерокарпин и один или несколько фармацевтически приемлемых эксципиентов.
Наконец, другими объектами изобретения являются способы, позволяющие экстрагировать и выделять гетерокарпин из клеток растения Pilocarpus Heterophyllus, причем вышеуказанные клетки происходят предпочтительно из культур in vitro. Эти способы включают по существу стадию экстракции клеток растения Pilocarpus Heterophyllus с помощью воды при температуре 0-50°С, предпочтительно 4-25°С, причем за вышеуказанной стадией экстракции следуют стадия фильтрации в целях отделения обогащенного гетерокарпином фильтрата от клеток Pilocarpus Heterophyllus и одна или несколько стадий отделения гетерокарпина от других компонентов, экстрагированных из растения Pilocarpus Heterophyllus.
Согласно первому варианту эти способы экстракции и выделения включают по существу следующие последовательные стадии:
а) стадия экстракции клеток из растения Pilocarpus Heterophyllus с помощью воды при температуре 0-50°С, предпочтительно 4-25°С, причем за вышеуказанной стадией экстракции следует стадия фильтрации в целях отделения обогащенного гетерокарпином фильтрата от клеток Pilocarpus Heterophyllus;
б) стадия преципитации экстрагированных протеинов, например, путем добавления сульфата аммония, с последующей стадией отделения преципитата (путем фильтрации или предпочтительно путем центрифугирования);
в) растворение рекуперированного на стадии б) преципитата в воде; и
г) стадия хроматографии путем гель-фильтрации в целях отделения гетерокарпина от других компонентов раствора.
Согласно другому варианту эти способы экстракции и выделения включают по существу следующие последовательные стадии:
а) стадия экстракции клеток из растения Pilocarpus Heterophyllus с помощью воды при температуре 0-50°С, предпочтительно 4-25°С, причем за вышеуказанной стадией экстракции следует стадия фильтрации в целях отделения обогащенного гетерокарпином фильтрата от клеток Pilocarpus Heterophyllus;
б) стадия обезжиривания полученного на стадии а) раствора, подкисленного путем добавления не окисляющей кислоты (например, соляной кислоты, серной кислоты или фосфорной кислоты) до значения рН, составляющего предпочтительно 2-4, с помощью жидкофазной экстракции (предпочтительно используя органический растворитель, такой как дихлорметан, гептан, гексан или циклогексан);
в) стадия удаления таннинов путем введения в контакт полученного на стадии б) обезжиренного раствора с поливинилпирролидоном (или же с найлоном 66) с последующей фильтрацией через смолу с большими порами (предпочтительно такую смолу на основе полистиролов, как смола Diaion (HP-20);
г) установление значения рН в щелочной области (предпочтительно значение рН от 9 до 11) полученного после стадии в) фильтрата путем добавления основания, такого как гидроксид аммония, гидроксид натрия или гидроксид калия;
д) одна или более стадий фильтрации через анионообменную смолу, причем элюентом на этой или этих стадиях фильтрации является предпочтительно буферный раствор, имеющий значение рН 9-11 и содержащий, в случае необходимости, градиенты концентрации соли (как, например, хлорид натрия или сульфат аммония) в целях отделения гетерокарпина от других компонентов раствора; и
е) стадия обессоливания, заключающаяся в пропускании полученного на стадии д) раствора через смолу, разделяющую компоненты смеси в зависимости от их молекулярной массы (как смола Sephadex (G25 или Superdex (200 HR), и элюировании этой смеси из вышеуказанной смолы с помощью воды.
Фармацевтические композиции, включающие соединение согласно изобретению, могут находиться в твердой форме, как, например, порошки, пилюли, гранулы, таблетки, липосомы, желатиновые капсулы или суппозитории. Пилюли, таблетки или желатиновые капсулы могут быть покрыты веществом, способным защищать композицию от воздействия кислоты желудочного сока или ферментов в желудке субъекта в течение периода времени, достаточного для попадания этой композиции в нерестриктированном состоянии в тонкую кишку этого субъекта. Соединение также может быть введено локально, например, именно в местонахождение опухоли. Соединение можно также вводить методом, обеспечивающим пролонгированное высвобождение (например, используя композицию с пролонгированным высвобождением или перфузионный насос). Соответствующими твердыми носителями могут быть, например, фосфат кальция, стеарат магния, карбонат магния, тальк, сахара, лактоза, декстрин, крахмал, желатина, целлюлоза, метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, поливинилпирролидон и воск.
Фармацевтические композиции, включающие соединение согласно изобретению, могут также находиться в жидкой форме, как, например, растворы, эмульсии, суспензии или лекарственные формы с пролонгированным высвобождением. Соответствующими жидкими носителями могут быть, например, вода, органические растворители, такие как глицерин или гликоли, такие как полиэтиленгликоль, а также их смеси, в изменяемых пропорциях, с водой.
Введение лекарственного средства согласно изобретению можно осуществлять локально, перорально, парентерально, путем внутримышечной инъекции и т.д.
Доза соединения согласно настоящему изобретению, предусматриваемая для лечения вышеуказанных заболеваний или нарушений, изменяется в зависимости от способа введения, возраста и массы тела подвергаемого лечению субъекта, а также состояния этого последнего, и ее определяет лечащий врач или ветеринар. Такое количество, определенное лечащим врачом или ветеринаром, в настоящем контексте называют как «терапевтически эффективное количество».
Согласно изобретению гетерокарпин можно получать нижеописанным способом.
Получение гетерокарпина
Согласно предпочтительному варианту изобретения осуществляют культивирования in vitro каллусов или клеточных суспензий, происходящих из различных частей растения. Эти ткани, культивируемые на полутвердой или жидкой среде, способны биосинтезировать обладающие биологическими свойствами соединения.
Под термином «каллус» нужно понимать согласно настоящей заявке макроскопическое скопление недифференцированных клеток растений при культивировании на питательной полутвердой среде. Термином «недифференцированные клетки» называют согласно настоящей заявке клетки, которые в некоторых условиях обладают способностью размножаться в форме каллуса или в виде клеточной суспензии без явления морфогенеза. Наконец, под обозначением «клеточная суспензия» понимают недифференцированные клетки, которые могут образовывать макроскопические скопления при культивировании на жидкой питательной среде.
Выбор питательной среды, гормонов, условий культивирования, а также экстракция и анализ экстракта из этих культур in vitro составляют неотъемлемую часть изобретения.
Клетки семян Pilocarpus Heterophyllus могут быть культивированы в виде суспензии, например, согласно нижеприводимой методике.
Перед осуществлением культивирования части растения очищали обычными способами. Части проростков in vitro также служили исходным материалом для каллогенеза без необходимости предварительной дезинфекции. Предпочтительной основной питательной средой является одна из сред, обычно используемых для культивирования in vitro: речь идет о среде Гамборга (описывается Gamborg и др., Nutrient requirements of suspension cultures of Soybean root cells, Exp.Cell Res., 50 (1), 151-158 (1968)). Источником углерода является сахароза, но также может быть использована глюкоза в концентрации 1-120 г/л, предпочтительно около 30 г/л. Можно также снижать содержание макроэлементов с коэффициентом 2. К среде добавляли ауксин или ауксин и цитокинин, предпочтительно для ассоциации из 2 гормонов, как правило, 2,4-дихлорфеноксиуксусную кислоту и кинетин, однако, с кинетином или бензиламинопурином (ВАР) также могут быть комбинированы α-нафталинуксусная кислота (ANA), β-индолуксусная кислота (AIA), β-индолбутановая кислота (AIB) или пиклорам. Концентрация может изменяться в пределах 0,1-10 мг/л для ауксина (можно выбирать, например, 1 мг/л) и 0,01-2 мг/л для цитокинина (можно выбирать, например, 0,06 мг/л). Витаминами являются таковые, которые приемлемы в различных основных средах. Культивирования осуществляли на свету или в темноте. Температуру можно изменять от 10°С до 33°С, однако предпочтительно она составляет около 23°С.Значение рН среды составляло 4-6,5 и перед стерилизацией его предпочтительно доводили до 5,8. Кроме того, в среду может быть добавлен или нет агар.
Первичные каллусы появляются после нескольких дней культивирования и могут быть отделены от исходного имплантата, выделены и подвергнуты пересеву спустя примерно 1 месяц, затем культивированы на полутвердой агаровой среде (в пробирке или в чашке Петри) с пассажами 4-8 недель, предпочтительно 6 недель; таким образом, каллус можно сохранять годами за счет последовательных пассирований на новых средах. Каллус можно также пересевать на перемешиваемую жидкую культуральную среду (колба Эрленмейера или биореактор) с пассажами 2-6 недель, предпочтительно 3 недели.
Полученные штаммы отличаются генетическим происхождением, условиями культивирования, внешним видом и отсутствием морфогенеза.
Лиофилизированные клетки Pilocarpus Heterophyllus экстрагировали водой при температуре 0-50°С и предпочтительно при температуре 4-25°С. Таким образом полученный экстракт лиофилизировали перед повторным растворением в адекватной концентрации (например, примерно 30% сухого вещества). Протеины, подвергнутые преципитации путем добавления концентрированного раствора сульфата аммония (например, в концентрации, составляющей 70-90% от концентрации насыщения), растворяли в минимальном количестве воды, и нерастворимые вещества рекуперировали путем центрифугирования. Протеины затем отделяли путем колоночной хроматографии (причем элюирующим средством является предпочтительно вода) и тогда может быть рекуперирован гетерокарпин (идентифицируемый по его молекулярной массе примерно 90,9 кДа).
Получение антител, специфически фиксирующих гетерокарпин
Настоящее изобретение относится к фиксирующим агентам, таким как антитела, которые специфически фиксируют гетерокарпин. Такой агент называется как «специфически фиксирующий» протеин, если он взаимодействует на определяемом уровне (например, путем твердофазного иммуноферментного анализа EZISA) с вышеуказанным протеином и не взаимодействует определяемым образом с другими протеинами. Термин «фиксация» относится к не ковалентной ассоциации двух молекул, разделенных таким образом, что образуется комплекс. Фиксирующая способность может быть оценена, например, путем определения константы фиксации в случае образования комплекса. Константа фиксации представляет собой величину, получаемую путем деления величины концентрации комплекса на произведение величин концентраций незакомплексованных компонентов. Два продукта будут называться «фиксированными», если константа фиксации достигает 103 л/моль. Константа фиксации может быть определена при использовании хорошо известных специалисту методов.
Любой агент, способный отвечать вышеуказанным критериям, можно рассматривать как фиксирующий агент.
Согласно настоящему изобретению фиксирующим агентом является предпочтительно антитело или его фрагмент. Антитела могут быть получены любым, доступным специалисту способом (см. Harlow и Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988). Обычно антитела могут быть получены методами культивирования клеток, включающими генерацию моноклональных антител, или за счет трансфекций генов антител в клетки-хозяева бактерий или млекопитающих в целях продуцирования рекомбинантных антител.
Из других методов предпочтительно используют такие, как описанные ниже. Иммуноген, содержащий гетерокарпин, инъецируют группе млекопитающих (например, мыши, крысы, кролики, овцы или козы). На этой стадии гетерокарпин может служить иммуногеном без модификации. Альтернативно, «высокий» иммунный ответ может быть индуцирован, если гетерокарпин связан с транспортным протеином, таким как бычий сывороточный альбумин или гемоцианин пателлы. Иммуноген инъецируют животному-хозяину предпочтительно согласно предопределенной схеме и животных периодически обескровливают. Таким образом, специфичные к гетерокарпину поликлональные антитела могут быть очищены, исходя из таких антисывороток, например, путем аффинной хроматографии, используя гетерокарпин, связанный с адекватным твердым носителем.
Фармацевтические композиции, предназначенные для высвобождения GHRH
Эти композиции, в частности, могут быть получены из гетерокарпина и GHRH согласно одному из способов, описанных в обзоре De Wolf и Brett, Pharmacological Reviews, 52, 207-236 (2000) и цитированных там ссылках.
Все технические и научные термины, используемые в настоящем контексте, если только они не определены другим образом, имеют такое же значение, как и обычно понятное специалисту в области, к которой относится настоящее изобретение. Точно так же все публикации, заявки на патенты, все патенты и все другие ссылки, указанные в настоящем контексте, включены в настоящее описание путем ссылки.
Следующие примеры даны для пояснения вышеуказанных методик и ни в коем случае не должны рассматриваться как ограничивающие объем охраны изобретения.
Получение гетерокарпина
Пример 1
Культивирование клеток in vitro
Семя Pilocarpus Heterophyllus проращивают и образующийся в результате этого проращивания стебель извлекают. Вышеуказанный стебель культивируют в среде Гамборга (Gamborg и др., Nutrient requirements of suspension cultures of Soybean root cells, Exp.Cell Res., 50 (1), 151-158 (1968)), к которой добавлено 30 г/л сахарозы, 1 мг/л 2,4-дихлорфеноксиуксусной кислоты и 0,06 мг/л кинетина. Культивирование осуществляют в пробирках при температуре 23°С и в темноте. Пересевы осуществляют все 6 недель в обычных условиях. Штаммы гранулированного внешнего вида имеют бежевую окраску.
Кинетику роста штаммов, базирующуюся на увеличении массы свежего и сухого вещества биомассы, реализовали в течение 8 недель. Каллусы из двух пробирок объединяли, и они образуют производимый два раза в неделю сбор, причем первый сбор осуществляют во время 0. Каллусы и агар затем собирали и лиофилизировали. Констатируют, что рост является экспоненциальным вплоть до 6 недель культивирования до появления стационарной фазы роста.
Экстракция клеточных культур
25 г лиофилизированных клеток Pilocarpus Heterophyllus экстрагировали 2 раза путем погружения в 375 мл воды при температуре 4°С и выдерживали в течение ночи при температуре 4°С, затем в 250 мл воды при температуре 4°С в течение 4 часов и, наконец, промывали с помощью 125 мл воды при температуре 4°С. Каждый таким образом полученный раствор фильтровали под вакуумом через стеклянный пористый фильтр со слоем целита для отделения остатков клеток от водного раствора. Таким образом комбинированные водные растворы затем подвергали лиофилизации, получая 9,4 г сухого вещества. Сухой лиофилизированный экстракт затем растворяли в 31 мл воды при температуре 20°С, получая раствор, содержащий 30% сухого экстракта. Добавляли маленькими порциями при постоянном перемешивании с помощью магнитной мешалки 17,4 г сульфата аммония для преципитации протеиновой фракции. Протеиновый преципитат затем отделяли от раствора сульфата аммония путем центрифугирования со скоростью 3000 оборотов в минуту в течение 20 минут. Раствор сульфата аммония декантировали и осажденные протеины растворяли в 22 мл воды, снова центрифугировали и отфильтровывали для удаления нерастворимых частиц.
Полученный фильтрат затем подвергали хроматографии путем гель-фильтрации. Его вводили в колонку (Buchi №19678; L=230 мм; внутренний диаметр=26 мм), заполненную SuperdexTM 200 (Amersham Pharmacia Biotech, номер по каталогу 17-1043-01; частицы со средним диаметром 13 мкм), приготовленную согласно рекомендациям изготовителя, используя сверхчистую воду (Water's Milli-Q) в качестве элюирующего средства с расходом 5 мл в минуту. Таким образом собирали фракции по 40 мл и активный протеин обнаруживали в третьей и четвертой фракциях. Эти фракции подвергали лиофилизации, получая примерно 14,2 мг активного продукта.
Чистоту полученного продукта доказывали по появлению единственной полосы при электрофорезе в полиакриламидном геле с додецилсульфатом натрия (SDS PAGE). Соответствующий этой полосе продукт обозначали далее как гетерокарпин.
Пример 2
Клетки, культивированные in vitro по той же методике, что и описанная в вышеприведенном примере 1, экстрагировали согласно нижеописанному способу.
100 г лиофилизированных клеток Pilocarpus Heterophyllus экстрагировали с помощью 2 л деминерализованной воды при температуре 20°С, причем смесь выдерживали при перемешивании в течение ночи. Клетки и экстракт фильтровали под вакуумом через стеклянный пористый фильтр (пористость 3, диаметр 20 см), покрытый слоем целита (предварительно промытого кислотой; толщина слоя 1-2 см). Перед удалением рекуперированные клетки промывали с помощью 400 мл деминерализованной воды. Водный фильтрат затем подкисляли до рН 3,0 путем добавления примерно 10 мл 18%-ной соляной кислоты. Подкисленный раствор затем обезжиривали путем жидкофазной экстракции с помощью 400 мл дихлорметана. Дихлорметановую фазу декантировали, затем удаляли. Обезжиренный раствор подвергали выпариванию в ротационном испарителе для удаления остаточного дихлорметана. После этого к обезжиренному раствору (рН примерно 3,0) добавляли примерно 30 г поливинилпирролидона и смесь перемешивали в течение примерно 30 минут для удаления таннинов. Смесь фильтровали под вакуумом через стеклянный пористый фильтр (пористость 3, диаметр 10 см), покрытый смешанным слоем, образованным из 25 г целита (предварительно промытого кислотой) и 25 г поливинилпирролидона. Фильтрат затем пропускали через слой из 400 мл смолы Diaion (HP-20 (Mitsubishi Chemical Company), предварительно активированной согласно инструкциям изготовителя. Полученный в результате фильтрат затем подщелачивали (рН=10) путем добавления примерно 60 мл 20%-ного раствора гидроксида аммония. После выдерживания в течение 30 минут появляется незначительный осадок. 1 г целита (предварительно промытого кислотой) добавляли к щелочному раствору, который затем фильтровали под вакуумом через мембранный фильтр (0,22 мкм). После этого примерно 2 л фильтрата пропускали через колонку HiPrep (Q XL 16/10, установленную на очистителе Akta) и предварительно уравновешенную при рН 10,2 с помощью буфера пиперазин/0,1 М HCl, с расходом 0,5 мл в минуту (колонка HiPrep) и очиститель Akta®, оба представляют собой продукты фирмы Amersham Biosciences). Колонку затем последовательно промывали с помощью 6 колоночных объемов исходного буфера с рН 10, 2, 5 колоночных объемов того же самого буфера, содержащего концентрацию 0,2 М NaCl; и 10 колоночных объемов того же самого буфера, содержащего концентрацию 1 М NaCl. Преобладающую долю гетерокарпина рекуперировали в трех первых 3 колоночных объемах буфера, содержащего концентрацию 1 М NaCl. Активные фракции обессоливали путем пропускания через колонку с Sephadex® G25 (объем слоя: 260 мл), используя деминерализованную воду в качестве элюирующего средства. Активные фракции, обнаруженные в первом колоночном объеме, соответствующем мертвому объему, затем лиофилизировали, получая 170 мг гетерокарпина. Таким образом полученный гетерокарпин представляет собой практически монополосу на геле при электрофорезе в полиакриламидном геле с додецилсульфатом натрия.
Исследование гетерокарпина
Анализ и микросеквенирование
Образцы наносили на 10%-ный полиакриламидный гель. После миграции гели фиксировали и окрашивали с помощью кумасси-синего.
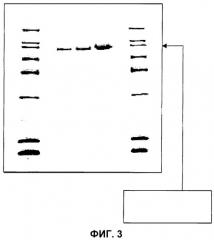
Следы на геле, представленном на фигуре 3, соответствующие следам 1, 2, 3, 4 и 5, представляют собой соответственно маркер молекулярной массы (Amersham), 0,5, 1 и 2 мкг содержания в конечной фракции гетерокарпина, полученного в примере 1, и маркер молекулярной массы (Amersham). Определение молекулярной массы по стандартной кривой маркера молекулярной массы при использовании классических «инструментов» для получения информации, хорошо известных специалисту (как, например, пакет программ Bio-Profil Bio1D фирмы Viber Lourmat) позволяет установить, что гетерокарпин обладает молекулярной массой 90,9 килодальтон (±1,6 килодальтон).
Для анализа путем микросеквенирования протеина полиакриламидную полосу, содержащую протеин, вырезали и рестриктировали в 300 мкл буфера для рестрикции, содержащего 50 ммоль Трис (рН 8,6), 0,03% додецилсульфата натрия, при температуре 35°С в течение 18 часов в присутствии 0,4 мкг эндолизина-С (Sigma). Полученные пептиды разделяли путем высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке серии DEAE-C18 диаметром 1 мм. Градиент разделения базировался на смеси ацетонитрила (от 2 до 70%) и 0,1%-ной трифторуксусной кислоты (ТФУК). Затем осуществляли секвенирование при использовании секвенатора Procise (Applied Biosystem). Таким образом были секвенированы три пика, позволяющие охарактеризовать исключительно гетерокарпин. Согласно настоящей заявке соответствующие последовательности идентифицированы как последовательности SEQ.ID.№1, SEQ.ID.№2, SEQ.ID.№3 (приведены в конце описания).
Анализ гликопротеинов осуществляли путем определения «сахарных» структур гликопротеинов, выделенных с помощью геля SDS-PAGE. Эта система детектирования представляет собой модификацию методов «Шик-реакция» и приводит к появлению полос пурпурного цвета, выявляющих гликопротеины (Sigma). Для гетерокарпина, полученного в примере 1, получают результат, представленный на фигуре 4.
Фармакологические свойства гетерокарпина
Стабильные трансфекции человеческого GHRH-рецептора (hGHRH-R)
Человеческие эмбриональные клетки почек, НЕК-293 (клеточная линия, открытая Dr. Stuart Sealfon, Mount Sinai Medical School, Нью-Йорк), стабильно экпрессирующие человеческий GHRH-рецептор, были получены Dr. Kelly Mayo (Northwestern University, Чикаго, IL).
Клеточная культура и мембранный препарат
Клетки НЕК-293, стабильно трансфицированные человеческим GHRH-рецептором, описанные выше, культивировали в DMEM (модифицированная по способу Дульбекко среда Игла; высокое содержание глюкозы; выпускается фирмой Life technologies), дополненной 0,4 мг/мл G418 (Life technologies), в присутствии 10% фетальной телячьей сыворотки и 4 ммоль L-глутамина (Life technologies). Клетки гомогенизировали в буфере А, содержащем 50 ммоль ГЕПЕС (рН 7,4), 5 ммоль хлорида магния (MgCl2), 2 ммоль этиленгликоль-бис(2-аминоэтил)-N,N,N',N'-тетрауксусной кислоты (EGTA) и 50 мкг/мл бацитрацина, затем подвергали обработке ультразвуком в том же самом буфере А. Таким образом гомогенизированные клетки центрифугировали при температуре 4°С с ускорением 39000 g в течение 10 минут, суспендировали в буфере А и снова центрифугировали при температуре 4°С с ускорением 40000 g в течение 10 минут. Все мембранные протеины количественно анализировали по методу Брэдфорда. Полученные в виде осадков после центрифугирования мембраны таким образом хранили при температуре -80°С для последующего использования.
Тест на конкурентное связывание с hGHRH-R
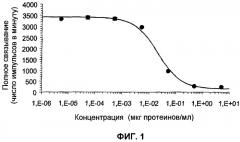
Мембраны клеток НЕК-293, стабильно трансфицированных человеческим GHRH-рецептором, разводили до концентрации 100 мкг/мл в реакционном буфере, содержащем 50 ммоль ГЕПЕС (рН 7,4), 5 ммоль MgCl2, 2 ммоль EGTA, 50 мкг/мл бацитрацина и 0,5% бычьего сывороточного альбумина. Мембраны инкубировали с 0,05 нмоль [125I]GHRH(1-44 амид) (Amersham) в конечном объеме 200 мкл в присутствии возрастающих концентраций гетерокарпина в течение 2 часов при температуре 23°С. Реакцию прекращали путем быстрой фильтрации при использовании 96-луночных фильтров GF/C, предварительно нагруженных 0,1% полиэтиленимина. Фильтры затем промывали три раза при температуре 4°С буфером для промывки, содержащим 50 ммоль Трис (рН 7,4), используя 96-луночную установку для фильтрации фирмы Packard. Таким образом высушенные фильтры погружали в 20 мкл сцинтиллирующей смеси (Микросцинт О; фирма Packard) и подвергали подсчету на Тор-счетчике (Packard). Неспецифическую активность определяли в присутствии 100 нмоль hGHRH. Для hGHRH строили кривую доза-ответ (0,001 нмоль - 100 нмоль); полученные результаты представлены на фигуре 1.
Конкурентное образование циклического аденозинмонофосфата
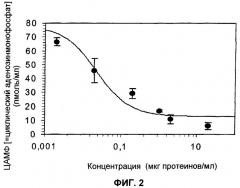
Стабильно трансфицированные человеческим GHRH-рецептором клетки НЕК-293 распределяли на 48-луночных культуральных планшетах и культивировали в течение 3 дней. Культуральную среду затем извлекали и заменяли средой В, содержащей 250 мкл DMEM (модифицированная по способу Дульбекко среда Игла; высокое содержание глюкозы; выпускается фирмой Life technologies) в присутствии 0,5% бычьего сывороточного альбумина, 0,5 ммоль 3-изобутил-1-метилксантина и предварительно инкубировали в течение 5 минут при температуре 37°С. По окончании периода прединкубации гетерокарпин тестировали в течение дополнительных 20 минут. Наблюдаемые концентрации представлены на фигуре 2. Инкубацию прекращали путем добавления 100 мкл 0,1 М HCl и аликвотные доли анализировали на содержание в них циклического аденозинмонофосфата, используя набор «FlashPlate» (New England Nuclear).
Количественный анализ гормона роста (GH) у крыс
Содержания GH у крыс (самцы, Sprague Dawley) определяли в пробах крови с помощью энзимоиммунологического теста, разработанного фирмой Spi-Bio (Spi-Bio, Франция). Крыс обрабатывали путем внутривенной инъекции гетерокарпина в возрастающих дозах (один эксципиент, 1, 3 и 10 нмоль), затем, спустя 10 минут, путем внутривенной инъекции 10 мкг (3 нмоль) hGHRH. Спустя десять минут после инъекции hGHRH в пробах крови определяли содержания гормона роста, как описано выше. Полученные результаты представлены на фигуре 5.
Краткое описание фигур:
на фигуре 1 представлена кривая ингибирования фиксации человеческого GHRH на человеческом GHRH-рецепторе в зависимости от возрастающих концентраций гетерокарпина;
на фигуре 2 представлена кривая ингибирования продуцирования циклического АМФ в стабильно трансфицированных человеческим GHRH-рецептором клетках в присутствии 10 нмоль человеческого GHRH в зависимости от возрастающих концентраций гетерокарпина;
на фигуре 3 представлена гелевая пластинка с протеином согласно SDS-PAGE, показывающая наличие гетерокарпина с молекулярной массой 90,9 кДа;
на фигуре 4 представлена гелевая пластинка с протеином согласно SDS-PAGE, показывающая, что гетерокарпин является гликопротеином (панель В);
на фигуре 5 представлено в форме гистограмм ингибирование синтеза GH у крысы в присутствии 10 мкг человеческого GHRH в зависимости от возрастающих концентраций гетерокарпина.
1. Выделенный протеин из растения Pilocarpus heterophyllus, имеющий свойства антагониста действия (человеческого рилизинг-фактора гормона роста (GHRH), характеризующийся тем, что он имеет молекулярную массу около 90,9 кДа и включает фрагменты идентифицированных пептидных последовательностей 1, 2 и 3, причем вышеуказанный протеин может находиться в гликозилированной или негликозилированной форме.
2. Протеин по п.1, отличающийся тем, что он получен из экстракта клеток растения Pilocarpus heterophyllus, культивированных in vitro.
3. Лекарственное средство для противодействия эффектам GHRH, представляющее собой протеин по п.1 или 2.
4. Моноклональное антитело, специфически фиксирующее выделенный из растения Pilocarpus heterophyllus протеин-антагонист действия GHRH, полученное с использованием протеина по п.1.
5. Лекарственное средство для противодействия эффектам GHRH, представляющее собой моноклональное антитело, специфически фиксирующее выделенный протеин по п.1.
6. Фармацевтическая композиция для противодействия эффектам GHRH, включающая терапевтически эффективное количество протеина по п.1 и фармацевтически приемлемый носитель.
7. Применение протеина по п.1 или 2 для получения лекарственного средства, предназначенного для противодействия эффектам GHRH.
8. Применение протеина по п.1 или 2 для получения лекарственного средства, предназначенного для лечения пролиферативного заболевания, в особенности рака.
9. Применение протеина по п.1 или 2 для получения лекарственного средства, предназначенного для лечения акромегалии.
10. Применение протеина по п.1 или 2 для получения лекарственного средства, предназначенного для лечения диабетических ретинопатий и нефропатий.
11. Способ выделения протеина по п.1 из клеток растения Pilocarpus heterophyllus, включающий экстракцию водой из клеток растения Pilocarpus heterophyllus при температуре 0-50°С, разделение полученного раствора вакуумной фильтрацией, осаждение экстрагированных протеинов, центрифугирование и хроматографию, с получением таким образом указанного протеина.
12. Способ выделения протеина по п.1 из клеток растения Pilocarpus heterophyllus, включающий экстракцию водой из клеток Pilocarpus heterophyllus при температуре 0-50°С, разделение полученного раствора вакуумной фильтрацией, обезжиривание полученного раствора, удаление танинов, подщелачивание полученного фильтрата, фильтрацию через анионообменную смолу и удаление солей с получением таким образом указанного протеина.