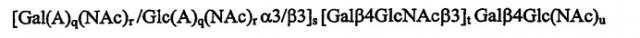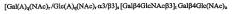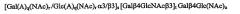Новые рецепторы для helicobacter pylori и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к медицине и фармации и описывает соединение или рецептор, включающий связывающую Helicobacter pylori олигосахаридную последовательность [Gal(A)q(Nac)r/Gal(A)q(NAc)rα3/β3]s[Galβ4GlcNAcβ3]tGalβ4Glc(NAc)u, в которой q, r, s, t и u каждый независимо равен 0 или 1, и аналогов или производных указанной олигосахаридной последовательности в качестве эпитопа, связывающегося с Helicobacter pylori, их применение, например, в фармацевтической и пищевой композициях для лечения состояний, вызванных присутствием Helicobacter pylori. Изобретение обеспечивает повышение эффективности лечения. 4 н. и 14 з.п. ф-лы, 11 ил., 2 табл.
Реферат
Область изобретения
Настоящее изобретение относится к соединению или рецептору, связывающему с Helicobacter pylori, и его применению, например, в фармацевтических и пищевых композициях для лечения состояний, обусловленных присутствием Helicobacter pylori. Данное изобретение также направлено на применение рецептора для диагностики Helicobacter pylori.
Предпосылки изобретения
Helicobacter pylori участвуют в развитии нескольких заболеваний желудочно-кишечного тракта, включая хронический гастрит, заболевание желудка, связанное с приемом нестероидных противовоспалительных средств (НСПВС), двенадцатиперстной кишки и язвы желудка, лимфому из лимфоидной ткани слизистой желудка и аденокарциному желудка (Axon, 1993; Blaser, 1992; DeCross and Marshall, 1993; Dooley, 1993; Dunn et al., 1997; Lin et al., 1993; Nomura and Stemmermann, 1993; Parsonnet et al., 1994; Sung et al., 2000; Wotherspoon et al., 1993). Заболевания, совсем или частично не относящиеся к желудочно-кишечным, включают синдром внезапной младенческой смерти (Kerr et al., 2000 и патент США № 6083756), аутоиммунные заболевания, такие как аутоиммунный гастрит, и пернициозную анемию (Appelmelk et al., 1998; Chmiela et al., 1998; Clayes et al., 1998; Jassel et al., 1999; Steininger et al., 1998) и некоторые заболевания кожи (Rebora et al., 1995), заболевания поджелудочной железы (Correa et al., 1990), заболевания печени, включая аденокарциному (Nilsson et al., 2000; Avenaud et al., 2000), и заболевания сердца, такие как атеросклероз (Farsak et al., 2000). Имеется обзор по многочисленным заболеваниям, вызванным или связанным с Helicobacter pylori (Pakodi et al., 2000). Наибольший интерес в отношении бактериальной колонизации и инфицирования представляет механизм(ы) адгезии бактерий на поверхность эпителиальных клеток слизистой желудка.
Сообщалось, что гликоконъюгаты как на основе липидов, так и на основе белков, служат в качестве рецепторов для связывания данных микроорганизмов, например, в виде сиалилированных гликоконъюгатов (Evans et al., 1988), сульфатида и GM3 (Saitoh et al., 1991), Leb-детерминант (Boren et al., 1993), полигликозилкерамидов (Miller-Podraza et al., 1996; 1997a), лактозилкерамида (Engström et al., 1998) и ганглиотетраозилкерамида (Lingwood et al., 1992; Engström et al., 1998). Другие потенциальные рецепторы Helicobacter pylori включают полисахарид гепарансульфат (Ascensio et al., 1993), а также фосфолипид фосфатидилэтаноламин (Lingwood et al., 1992).
В патентах США, Zopf et al.: № 5883079 (март 1999 г.), № 5753630 (май 1998 г.) и № 5514660 (май 1996 г.) описываются Neu5Acα3Gal-содержащие соединения в качестве ингибиторов адгезии Helicobacter pylori. Молекула сиалил-лактозы ингибирует связывание Helicobacter pylori с линиями человеческих клеток желудочно-кишечного тракта (Simon et al., 1999) и также эффективна на модели инфекции на макаках-резусах (Mysore et al., 2000). Соединение проходит клинические испытания.
В патенте США, Krivan et al. № 5446681 (ноябрь 1995 г.) описываются конъюгаты рецептора бактерий и антибиотика, включающие асиалоганглиозид, связанный с антибиотиком пенициллином. В особенности заявляется лечение инфекций, вызванных Helicobacter pylori, с помощью конъюгата амоксиллин-асиало-GM1. Описанные в изобретении олигосахаридные последовательности/гликолипиды не относятся к ганглиопроизводным гликолипидов.
В патентах США, Krivan et al.: № 5386027 (январь 1995 г.) и № 5217715 (июнь 1993 г.) описано применение олигосахаридных последовательностей или гликолипидов для ингибирования нескольких патогенных бактерий, однако, обсуждаемая здесь специфичность связывания там не упомянута, и Helicobacter pylori не входит в перечень рассмотренных или заявленных бактерий.
Сахаридная последовательность GlcNAcβ3Gal была описана в качестве рецептора Streptococcus (Andersson et al., 1986). У некоторых бактерий специфичности связывания могут перекрываться, и невозможно предсказать характер связывания даже у очень близких бактериальных адгезинов. В случае Helicobacter pylori сахаридные связывающие молекулы неизвестны, за исключением связывающего белка Lewis b.
Краткое описание изобретения
Настоящее изобретение относится к применению соединения или рецептора, связывающегося с Helicobacter pylori, включающего олигосахаридную последовательность.
в которой каждый из g, r, s, t и u независимо равен 0 или 1,
так, что когда t=0 и u=0, то тогда олигосахаридная последовательность связана с поливалентным носителем или находится в виде свободного олигосахарида в высокой концентрации, и аналоги или производные указанной олигосахаридной последовательности, обладающие активностью связывания с Helicobacter pylori, для производства композиции, обладающей активностью связывать или ингибировать Helicobacter pylori.
Среди объектов изобретения находится применение связывающихся с Helicobacter pylori олигосахаридных последовательностей, описанных в изобретении, в качестве лекарственного препарата и их применение для производства фармацевтической композиции, в частности, для лечения любого состояния, обусловленного присутствием Helicobacter pylori.
Настоящее изобретение также относится к способам лечения состояний, обусловленных присутствием Helicobacter pylori. Изобретение также направлено на применение рецептора(ов), описанного в изобретении, в качестве связывающего или ингибирующего Helicobacter pylori соединения для диагностики Helicobacter pylori.
Другим объектом изобретения является обеспечение соединений, фармацевтических композиций и пищевых добавок или композиций, содержащих связывающую Helicobacter pylori олигосахаридную последовательность(и).
Другими объектами изобретения являются применение вышеуказанных связывающих Helicobacter pylori соединений для идентификации бактериального адгезина, типирование Helicobacter pylori и анализы связывания Helicobacter pylori.
Еще одним объектом изобретения является применение вышеуказанных связывающих Helicobacter pylori соединений для производства вакцины против Helicobacter pylori.Краткое описание фиг.1А и 1В. EI*
Электроионизация.
/MC перметилированных олигосахаридов, полученных в результате расщепления гексагликозилкерамида под действием эндогликокерамидазы. Хроматограмма, полученная при анализе газовой хроматографией олигосахаридов (вверху) и EI/MC-спектры соответственно пиков А и В (внизу).
Фиг.2А и 2В. Бомбардировка быстрыми атомамиFAB*
Бомбардировка быстрыми атомами.*-масс-спектры отрицательных ионов гекса-(2А) и пентагликозилкерамида (2В).
Фиг.3А и 3В. Протонные ЯМР-спектры, показывающие аномерную область гликолипида из шести сахаров (3А) и гликолипида из пяти сахаров (3В). Спектры были получены в течение ночи для хорошего соотношения сигнал-шум в целях детектирования минорного компонента типа 1.
Фиг.4А, 4В и 4С. Ферментативное расщепление гликосфинголипидов из тимуса кролика. Пластинки для тонкослойной хроматографии в силикагеле развивали в системе C/M/H2O (60:35:8, объемные соотношения). 4А и 4В, пластинки проявляли 4-метоксибензальдегидом. 4С, авторадиограмма после нанесения 35S-меченных Helicobacter pylori. 1, гептагликозилкерамид (структура 1, таблица I); 2, десиалилированный гептагликозилкерамид (полученный после обработки кислотой); 3, десиалилированный гептагликозилкерамид, обработанный β4-галактозидазой; 4, гептагликозилкерамид, обработанный сиалидазой и β4-галактозидазой; 5, стандарты гликосфинголипидов из эритроцитов человека (лактозилкерамид, тригексозилкерамид и глобозид); 6, десиалилированный гептагликозилкерамид, обработанный β4-галактозидазой и β-гексозаминидазой; 7, гептагликозилкерамид, обработанный сиалидазой, β4-галактозидазой и β-гексозаминидазой.
Фиг.5А и 5В. ТСХ продуктов, полученных после частичного кислотного гидролиза гептагликозилкерамида из тимуса кролика (структура 1, таблица I). Развивающий растворитель был такой же, как для фиг.4А, 4В и 4С. 5А, проявленная 4-метоксибензальдегидом пластинка; 5В, авторадиограмма после нанесения 35S-меченных Helicobacter pylori. 1, гептагликозилкерамид; 2, десиалилированный гептагликозилкерамид (обработка кислотой); 3, пентагликозилкерамид; 4, гидролизат; 5, стандарты гликосфинголипидов (как для фиг.4А, 4В и 4С).
Фиг.6А и 6В. Серийные разведения гликосфинголипидов. Связывающую активность на пластинках для ТСХ определяли методом нанесения бактерий. Развивающий растворитель для ТСХ был такой же, как для фиг.4А, 4В и 4С. Различные гликолипиды наносили на пластинки в эквимолярных количествах. Количественное определение гликолипидов проводили по содержанию гексозы. 6А, гекса- и пентагликозилкерамиды (структуры 2 и 3, таблица I); 6В, пента- и тетрагликозилкерамиды (структуры 4 и 5, таблица I). Количества гликолипидов (выраженные в пмолях) были следующими: 1,1280 (каждого); 2,640; 3,320; 4,160; 5,80; 6,40; 7,20 пмоль (каждого).
Фиг.7А и 7В. Тонкослойная хроматограмма разделенных гликосфинголипидов при проявлении 4-метоксибензальдегидом (7А) и авторадиограмма после связывания с меченными радиоактивным изотопом Helicobacter pylori штамма 032 (7В). Гликосфинголипиды разделяли на пластинках с силикагелем 60 для ТСХ на алюминиевой подложке HPTLC (Merck) с использованием смеси хлороформ/метанол/вода 60:35:8 (объемные соотношения) в качестве системы растворителей. Анализ связывания проводили, как описано в разделе «Материалы и методы». Авторадиографию проводили в течение 72 ч. Полосы содержали:
полоса 1) Galβ4GlcNAcβ3Galβ4Glcβ1Cer
(неолактотетраозилкерамид); 4 мкг;
полоса 2) Galα3Galβ4GlcNAcβ3Galβ4Glcβ1Cer (гликосфинголипид В5), 4 мкг;
полоса 3) Galα3Galβ4GlcNH2β3Galβ4Glcβ1Cer, 4 мкг;
полоса 4) Galα3(Fucα2)Galβ4GlcNAcβ3Galβ4Glcβ1Cer
(гликосфинголипид типа 2 В6), 4 мкг;
полоса 5) GlcNAcβ3Galβ4GlcNAcβ3Galβ4Glcβ1Cer, 4 мкг;
полоса 6) Galβ4GlcNAcβ3Galβ4GlcNAcβ3Galβ1Cer, 4 мкг;
полоса 7) GalNAcβ3Galβ4GlcNAcβ3Galβ4Glcβ1Cer
(х2-гликосфинголипид), 4 мкг;
полоса 8) NeuAcα3GalNAcβ3Galβ4GlcNAcβ3Galβ4Glcβ1Cer (NeuAc-x2), 4 мкг;
полоса 9) Fucα2Galβ4GlcNAcβ3Galβ4Glcβ2Cer (гликосфинголипид типа 2 H5), 4 мкг;
полоса 10) NeuAcα3Galβ4GlcNAcβ3Galβ4Glcβ1Cer
(сиалилнеолактотетраозилкерамид), 4 мкг.
Источники гликосфинголипидов являются теми же, что представлены в таблице 2.
Фиг.8А, 8В, 8С и 8D.Рассчитанные конформации с минимальной энергией трех гликосфинголипидов, которые связывают Helicobacter pylori:
GalNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer (8А),
GalNAcα3Galβ4GlcNAcβ3Galβ4GlcβCer (8В) и
Galα3Galβ4GlcNAcβ3Galβ4GlcβCer (8С). Также представлена несвязывающая структура Galα3Galβ4GlcNH2β3Galβ4GlcβCer (8D). Также показан вид сверху олигосахаридного фрагмента каждой рассчитанной структуры с минимальной энергией. Несмотря на различия в аномерности, отсутствие или наличие ацетамидной группы, аксиальное или экваториальное положение 4-ОН в концевом сахаре и тот факт, что плоскость кольца соединений с концевой α3-связью несколько приподнята по сравнению с соответствующей плоскостью в соединениях с β3-связью, имеется значительная топографическая аналогия между данными структурами, и также GlcNAcβ3-концевой структурой, полученной из тимуса кролика (фиг.9А), что таким образом объясняет их сходную аффинность для бактериального адгезина. В противоположность ацетамидная группа внутреннего GlcNAcβ3 важна для связывания (сравни 8С и 8D).
Фиг.9А, 9В, 9С и 9D.Рассчитанные конформации с минимальной энергией активных в отношении связывания гликосфинголипидов GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer (9А) и
Galβ4GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer (9В) и несвязывающих гликосфинголипидов NeuAcα3GalNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer (9С) и Galα3(Fucα2)Galβ4GlcNAcβ3Galβ4GlcβCer (9D). У двух последних удлиненных последовательностей (9С и 9D) отсутствует связывание Helicobacter pylori, в то время как у первой (9В) имеется, но пониженная аффинность. Наряду с установлением того, что де-N-ацилирование ацетамидной группы внутреннего GlcNAc в В5 (фиг.8А, 8В, 8С и 8D) полностью ликвидирует связывание, участок, составляющий связывающий эпитоп, должен состоять из конечного трисахарида В5, показанного на фиг.8С, поскольку ацетамидная группа концевого N-ацетилгалактозамина не является важной.
Фиг.10. Конформер с минимальной энергией соединения NeuGcα3Galβ4GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer из семи сахаров представлен в двух проекциях, находящихся под углом 90° друг к другу. Концевой атом углерода гликолильной группы сиаловой кислоты, а также углеродные атомы метила ацетамидных групп двух внутренних остатков GlcNAc отмечены черным только для облегчения ориентации зрителя. Для связи GlcβCer обоснованно была выбрана удлиненная конформация для представления, но минимальная связывающая последовательность GlcNAcβ3Galβ4GlcNAcβ3 наиболее подходит для связи с адгезином в конформациях GlcβCer, чем другая показанная здесь.
Фиг.11А, 11В и 11С.Связывание моноклональных антител ТН2 (11В) и лектина из E.cristagalli (11С) с цельными некислотными фракциями гликосфинголипидов из эпителиальных клеток слизистой желудка человека, гранулоцитов человека и эритроцитов человека, разделенных на хроматограммах, полученных тонкослойной хроматографией. На фиг.11А показаны те же фракции, окрашенные 4-метоксибензальдегидом. Авторадиографию в случае (11В) и (11С) проводили в течение 12 ч. Для полос 1-6 наносили 80 мкг цельных некислых фракций из эпителиальных клеток слизистой желудка человека от индивидуумов с пятью различными группами крови А, в то время как для полосы 6 наносили 40 мкг цельной некислотной фракции из гранулоцитов человека и для полосы 7-40 мкг цельной некислотной фракции из эритроцитов человека. Тесты с нанесением проводили, как описано в разделе «Материалы и методы».
Подробное описание изобретения
Настоящее изобретение относится к группе специфических олигосахаридных последовательностей, связывающихся с Helicobacter pylori. Провели скрининг многочисленных естественных гликосфинголипидов тонкослойной хроматографией с нанесением бактерий (таблица 2). Структуры использованных гликосфинголипидов характеризовали протонной ЯМР и масс-спектрометрией. Для сравнительного анализа трехмерной структуры соединений, связывающихся с Helicobacter pylori, использовали молекулярное моделирование.
Новая специфичность связывания была показана при сравнении четырех пентасахаридных гликолипидов. Было установлено, что замена концевого сахарида невосстанавливающего конца в GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer на GalNAcβ3 (краткое название х2GSL), GalNAcα3 или Galα3 (В5) приводило к связыванию Helicobacter pylori, несмотря на имеющиеся различия в аномерности, отсутствие или наличие ацетамидной группы и аксиальное/экваториальное положение 4-ОН. Специфичность также включает структуры с более слабым связыванием Helicobacter pylori: более короткую форму Galβ4GlcNAcβ3Galβ4GlcβCer и β4-удлиненные формы гликолипида с концевым N-ацетилглюкозамином: Galβ4GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer и
NeuGcα3Galβ4GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer.
В противоположность ранее известной зависимой от сиаловой кислоты специфичности (Evans et al., 1988; Miller-Podraza et al., 1996; 1997a), N-гликолилнейраминовую кислоту у последнего указанного гликосфинголипида можно удалить, не влияя при этом на связывание Helicobacter pylori.
Связывание с GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer носило в значительной степени воспроизводимый характер, хотя в целом на связывание сахаридов с Helicobacter pylori оказывали влияние фазовые изменения бактерий, и высокую аффинность связывания можно было наблюдать в тесте с нанесением бактерий в низких пикомолярных количествах гликолипида.
Установили длину связывающего эпитопа и было показано, что GlcNAcβ3Galβ4GlcβCer, Galβ4GlcNβ3Galβ4GlcβCer и
Galα3Galβ4GlcNβ3Galβ4GlcβCer (укороченная и N-дезацетилированная формы активных соединений) не связывались с Helicobacter pylori. Этими данными было установлено, что внутренний остаток GlcNAc участвует в связывании, но один он не приводит к достаточно прочному связыванию. Было установлено, что связывающим эпитопом является концевой трисахарид в пентасахаридных эпитопах, которые обсуждались выше. Когда присутствуют только два остатка, как в Galβ4GlcNAcβ3Galβ4GlcβCer, то связывание является более слабым, и в гликолипиде из шести сахаридов,
Galβ4GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer, концевой Galβ4 ингибирует связывание, что объясняет более слабую активность. Гликолипид из семи сахаридов, имеющий Galα3 в менее активной структуре гликолипида из шести сахаридов,
Galα3Galβ4GlcNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer, обладал более высокой активностью, что также указывает на то, что для высокой связывающей активности необходимы концевые трисахаридные эпитопы.
Специфичность связывания исследовали при анализе изомеров и модифицированных форм активных соединений. Удлиненные формы Galβ4GlcNAcβ3Galβ4GlcβCer, имеющие следующие модификации концевого Gal: Fucα2 (краткое название H5-2), Fucα2 и Gal/GalNAcα3 (B6-2, A6-2), Neu5Acα3 или Neu5Acα6 (сиалилпараглобозиды) или Galα4 (P1) были неактивны в анализе связывания с Helicobacter pylori. Связывание также нарушалось при наличии β6-связанного внутреннего ответвления из галактозы, представленного структурой
Galβ4GlcNAcβ3(Galβ4GlcNAcβ6)Galβ4GlcβCer. Было показано, что ответвление изменяет представление Galβ4GlcNAcβ3-эпитопа, и дисахаридный связывающий сайт, возможно, имеет стерические затруднения (Teneberg et al., 1994). (Однако результаты показывают, что внутренний остаток галактозы, с которым связаны дисахаридные или трисахаридные связывающие эпитопы, связан β3-связью, может также вносить свой вклад в связывание.) Кроме того, оказалось, что Neu5Acα3GalNAcβ3Galβ4GlcNAcβ3Galβ4GlcβCer (удлиненная форма активного x2-гликосфинголипида) или GalNAcβ3Galα3Galβ4GlcNAсβ3Galβ4Glcβ3Cer (удлиненный GSL B5) не связываются с Helicobacter pylori.
Для сравнения активных связывающих структур и неактивных соединений использовали молекулярное моделирование. На примере рассчитанных конформеров с минимальной энергией четырех пентасахаридных гликосфинголипидов (Galβ4GlcNAcβ3Galβ4GlcβCer с удлинением на GlcNAcβ3, GalNAcβ3, GalNAcα3 или Galα3) было показано, что конформации соединений могут в значительной степени быть сходными друг с другом. Конформации неактивных гликолипидов были другими. Несмотря на то, что концевые сахариды также могут различаться по их аномерной связи (два с альфа- и два с бета-связями), при молекулярном моделировании было установлено, что структуры с минимальной энергией топографически являются очень близкими. Различия концевых структур заключаются в том, что в Galα3 отсутствует ацетамидная группа, имеющаяся в трех других, Gal и GalNAc имеют 4-ОН в аксиальном положении и GlcNAc - в экваториальном положении, плоскости кольца альфа аномерного конца несколько приподняты по сравнению с соответствующей плоскостью бета-аномерных производных. Возможно удлинение конца в положении 4 в GlcNAc, указывая на то, что 4-ОН не имеет такого важного значения для связывания, хотя удлинение Galβ4 оказывает стерическое влияние. В итоге оказалось, что ни положение 4-OH, ни отсутствие/наличие ацетамидной группы, ни аномерная структура концевого моносахаридного остатка не являются решающими для связывания, поскольку все четыре пентасахаридных гликолипида имеют аналогичную аффинность для адгезина Helicobacter pylori.
В свете этих закономерностей связывания четыре других концевых моносахарида в связывающем соединении можно также обеспечить трисахаридными связывающими эпитопами: Galβ3Galβ4GlcNAc, GlcNAcα3Galβ4GlcNAc, Glcβ3Galβ4GlcNAc и Glcα3Galβ4GlcNAc. Они аналогичны исследованным последовательностям и имеют единственные различия в аномерной, 4-эпимерной или C2 NAc/OH структурах. Первая имеется в гликолипиде из эритроцитов человека, в то время как о наличии последних трех в тканях человека до сих пор неизвестно, и в большей степени они могут представлять аналоги естественного рецептора.
Было показано, что связывающий эпитоп включает концевой трисахаридный элемент активных гликолипидов из пяти сахаридов и, по меньшей мере, в более крупных повторяющихся N-ацетилактозаминах эпитоп также может находиться в середине сахаридной цепи. Заявители понимают, что связывающие эпитопы могут быть представлены различными путями в естественных и полученных биосинтетическим путем гликоконъюгатах и олигосахаридах таких, как О-связанные или N-связанные гликаны гликопротеинов, или в олигосахаридах производных поли-N-ацетилактозамина. В результате химического или ферментативного синтеза, особенно в области углеводов, получали почти бесконечное количество производных и аналогов. Размер связывающего эпитопа позволяет провести некоторые модификации, например, в положениях С1, С2 и С4 концевого моносахарида, удалением невосстанавливающего концевого моносахарида или удлинением от положения С4 концевого GlcNAc в GlcNAcβ3Galβ4GlcNAc, например, положение С4 в GlcNAcβ3 может быть связано с олигосахаридной цепью гликозидной связью. Когда олигосахаридной последовательностью является
GlcNAcβ3Galβ4GlcNAcβ3Galβ4Glc, то положение С4 в концевом GlcNAcβ3 можно связать с Galβ1- или олигосахаридной цепью гликозидной связью. Для получения производных или олигомерных, или полимерных конъюгатов, обладающих активностью связываться с Helicobacter pylori, особенно можно использовать С2- и С4-положения моносахаридного остатка невосстанавливающего концевого в трисахаридном эпитопе и восстанавливающие концы эпитопа. Также для получения производных и аналогов можно использовать С6-положения моносахаридных остатков, особенно предпочтительным являются С6-положение невосстанавливающего концевого остатка в трисахаридной последовательности и восстанавливающий концевой остаток ди- и трисахаридных связывающих соединений.
В данном изобретении термины «аналог» и «производное» определяются следующим образом. По настоящему изобретению, возможно сконструировать структурные аналоги или производные связывающих Helicobacter pylori олигосахаридных последовательностей. Таким образом, изобретение также относится к структурным аналогам соединений по изобретению. Структурные аналоги по изобретению включают структурные элементы, имеющие значение для связывания Helicobacter pylori с олигосахаридными последовательностями. Для конструирования эффективных структурных аналогов важно знать, какой структурный элемент имеет значение для связывания Helicobacter pylori и сахаридов. Предпочтительно, чтобы важные структурные элементы были не модифицированы, или модифицировались таким образом, чтобы они были очень подобны важному структурному элементу. Данные элементы предпочтительно включают 4- и 6-гидроксильные группы остатка Galβ4 в трисахаридном и дисахаридном эпитопах. Также важным структурным элементом является расположение связей между кольцевыми структурами. Для высокой аффинности связывания предпочтительной является ацетамидная группа или группа, подобная ацетамидной, в положении, соответствующем ацетамидной группе восстанавливающего конца-GalNAc ди- или трисахаридных эпитопов. Группа, подобная ацетамидной, может быть другим амидом, например, алкиламидо, ариламидо, вторичным амином, предпочтительно N-этилом или N-метилом, О-ацетилом, или О-алкилом, например, О-этилом или О-метилом. Для высокой аффинности связывания предпочтительными являются амиды по карбоксильной группе концевой уроновой кислоты и ее аналогов. Полагается, что активность немодифицированной уроновой кислоты возрастает при уменьшении значения рН.
Структурные производные по изобретению являются олигосахаридными последовательностями по изобретению, химически модифицированные таким образом, что связывание с Helicobacter pylori сохраняется или повышается. Предпочтительно по изобретению дериватизировать одну или несколько гидроксильных или ацетамидных групп олигосахаридных последовательностей. В изобретении описывается несколько положений молекул, по которым можно провести изменения для получения аналогов или производных. Гидроксильная или ацетамидная группы, для которых допускается, по меньшей мере, несколько модификаций, обозначены R-группами в формуле 1.
Крупные или кислотные заместители и другие структуры, такие как моносахаридные остатки, являются неустойчивыми по меньшей мере, когда находятся в положении С2-, С3- или С6-гидроксильных групп Galβ4GlcNAc и в С3-гидроксильной группе моносахара невосстанавливающего концевого моносахарида трисахаридных эпитопов. Способы получения олигосахаридных аналогов для связывания лектина являются хорошо известными. Например, были получены многочисленные аналоги сиалил-Lewis × олигосахарида, представляющие различный скелет активных функциональных групп, смотри страницу 12090 у Sears и Wong, 1996. Подобные аналоги олигосахаридов на основе гепарина получены корпорацией Sanofi, и ингибиторы, подобные сиаловой кислоте, такие как занамивир и тамифлу (Relenza) для сиалидазы были получены многочисленными группами. Предпочтительно олигосахаридный аналог получают на основе молекулы, включающей по меньшей мере 5- или 6-членную кольцевую структуру, более предпочтительно аналог включает по меньшей мере две кольцевые структуры, состоящие из 6 или 5 атомов. Предпочтительный тип аналогов олигосахарида включает амид концевой уроновой кислоты или аналог, связанный со структурой, подобной Galβ4GlcNAc-сахариду. Альтернативно амид концевой уроновой кислоты является 1-3-связанным с Gal, который связан со структурой, подобной GlcNAc. В подобных структурах моносахаридные кольца могут быть замещены кольцами такими, как циклогексан или циклопентан, ароматическими кольцами, включая бензольное кольцо, гетероциклические кольцевые структуры могут включать помимо атома кислорода, например, атомы азота и серы. Для сохранения активных конформаций колец кольцевые структуры можно связать между собой устойчивыми линкерами. Типичная подобная структура также может включать пептидные аналоги-структуры для олигосахаридной последовательности или ее части.
Влияние активных групп на связывающую активность является кумулятивным, и отсутствие одной группы может быть компенсировано добавлением активного остатка с другой стороны молекулы. Для получения структур-аналогов для связывающих Helicobacter pylori олигосахаридных последовательностей по изобретению можно использовать молекулярное моделирование, предпочтительно осуществляемое с помощью компьютера. Данные молекулярного моделирования нескольких олигосахаридных последовательностей представлены в примерах, и такие же или подобные методы, помимо ЯМР и рентгеновской кристаллографии, можно применять для получения структур для других олигосахаридных последовательностей по изобретению. Для поиска аналогов олигосахаридные структуры можно «соединить» со связывающей молекулой(ами) углеводорода Helicobacter pylori, наиболее вероятно с лектинами бактерий, и можно найти возможные дополнительные связывающие взаимодействия.
Также следует отметить, что одновалентные, олиговалентные или поливалентные олигосахариды можно активировать для получения более высокой активности в отношении лектинов получением производного олигосахарида комбинаторной химией. Когда библиотека создана замещением одного или нескольких остатков в олигосахаридной последовательности, ее можно рассматривать в качестве библиотеки производных, альтернативно тому, когда библиотека создана из аналогов олигосахаридных последовательностей, описанных в изобретении. Библиотеку комбинаторной химии можно создать на основе олигосахарида или его предшественника, или гликоконъюгатов по изобретению. Например, можно получить олигосахариды с различным восстанавливающим концом с помощью так называемой карбогибридной технологии.
В предпочтительном воплощении библиотека комбинаторной химии конъюгирована со связывающими Helicobacter pylori соединениями, описанными в изобретении. В более предпочтительном воплощении библиотека включает, по меньшей мере, 6 различных молекул. Предпочтительно модификации комбинаторной химии получают с помощью различных амидов по карбоциклической группе в R8 формулы 1. Группа для модификации в R8 может также представлять альдегид или амин, или другой тип реакционноспособной группы. Такая библиотека является предпочтительной для применения при анализе связывания микроорганизмов с олигосахаридными последовательностями по изобретению. Аминокислоты или группы органических амидов являются промышленно доступными, эти соединения можно использовать для синтеза комбинаторной библиотеки амидов уроновой кислоты. С помощью комбинаторной библиотеки можно идентифицировать связывающее соединение с высокой аффинностью, например, при использовании теста ингибирования, в котором соединения из библиотеки применяются для ингибирования связывания бактерий с гликолипидами или гликоконъюгатами, описанными в изобретении. Предпочтительные структурные аналоги и производные по изобретению могут ингибировать связывание Helicobacter pylori со связывающими Helicobacter pylori олигосахаридными последовательностями по изобретению.
Стерическое затруднение за счет липидной части или близость поверхности силикагеля, возможно, ограничивает определение эпитопа GlcNAcβ3Galβ4Gal в имеющемся тесте TCX. В недавно проведенном исследовании невозможно было поставить тест определения активности данной последовательности с токсином А из Clostridium difficile, который специфически распознает такие же четыре трисахаридных эпитопа, описанных для Helicobacter pylori (Teneberg et al., 1996). Однако другими исследователями было показано связывание Galα3Galβ4Glc с токсином А при использовании модифицированного крупным полимерным спейсером конъюгата сахарида (Castagliuolo et al., 1996). Также принимая во внимание вклад, который вносит концевой трисахарид в связывание, можно поместить Glc в восстанавливающий конец эпитопа; возможно, в неактивной N-дезацетилированной форме положительный заряд свободной аминогруппы в большей степени препятствует связыванию, чем присутствие гидроксильной группы. Трисахаридные эпитопы с Glc на восстанавливающем конце рассматриваются как эффективные аналоги связывающего Helicobacter pylori соединения, когда находятся в олиговалентной или более предпочтительно в поливалентной форме. Одним воплощением настоящего изобретения являются сахариды с Glc на восстанавливающем конце, которые используются в виде свободных восстанавливающих сахаридов в высокой концентрации, предпочтительно в пределах 1-100 г/л, более предпочтительно 1-20 г/л. Понятно, что данные сахариды могут обладать минимальной активностью в пределах концентраций 0,1-1 г/л.
В последующем связывающая Helicobacter pylori последовательность описана в виде олигосахаридной последовательности. Олигосахаридная последовательность, определенная здесь, может быть частью естественного или синтетического гликоконъюгата или свободным олигосахаридом, или частью свободного олигосахарида. Подобные олигосахаридные последовательности можно связать с различными моносахаридами или олигосахаридами, или полисахаридами в полисахаридных цепях, например, если сахаридная последовательность экспрессируется в виде части бактериального полисахарида. Кроме того, известны многочисленные естественные модификации моносахаридов, примерами являются О-ацетильное или сульфатированное производное олигосахаридных последовательностей. Связывающее Helicobacter pylori соединение, определенное здесь, может включать описанную олигосахаридную последовательность в виде части естественного или синтетического гликоконъюгата или соответствующего свободного олигосахарида, или части свободного олигосахарида. Связывающее Helicobacter pylori соединение также может включать смесь связывающих Helicobacter pylori олигосахаридных последовательностей.
Несколько производных рецепторных олигосахаридных последовательностей обладают связыванием ниже порога чувствительности используемого в данном случае теста, проявляя тем самым специфичность распознавания. Данные по связыванию показывают, что если в указанных олигосахаридных последовательностях имеется GalNAcβ3, связанный с Galα3Galβ4GlcNAc (замещенная последовательность: GalNAcβ3Galα3Galβ4GlcNAc) или Neu5Acα3, связанный с GalNAcβ3Galβ4GlcNAc (замещенная последовательность: Neu5Acα3GalNAcβ3Galβ4GlcNAc), то соединения неактивны. Когда указанная олигосахаридная последовательность представляет Galβ4GlcNAc, то это не α4-галактозилированная (последовательность не является Galα4Galβ4GlcNAc), α3- или α6-сиалилированная (последовательность не является Neu5Acα3/6Galβ4GlcNAc), α2- или α3-фукозилированная [указанная последовательность не является Fucα2Galβ4GlcNAc или Galβ4(Fucα3)GlcNAc или Fucα2Galβ4(Fucα3)GlcNAc, α3-фукозилирование относится к фукозилированию остатков GlcNAc лактозамина, образующего Lewis х, Galβ4(Fucα3)GlcNAc]. Сахариды, имеющие структуры, в которых Galβ3 связан с GlcNAcβ3 (такие, как Galβ3GlcNAcβ3Galβ4GlcNAc/Glc), имеют другие конформации по сравнению со связывающими Helicobacter pylori соединениями, описанными здесь, и отдельно изучалась специфичность их связывания. Связывающие Helicobacter pylori соединения могут быть частью сахаридной цепи или гликоконъюгата, или смеси гликосоединений, включающих другие известные связывающие Helicobacter pylori эпитопы, с другими сахаридными последовательностями и конформациями такими, как Lewis b (Fucα2Galβ3(Fucα4)GlcNAc) или Nue5Acα3Galβ4Glc/GlcNAc. Для терапии может быть полезным использование нескольких связывающих соединений вместе.
Связывающие Helicobacter pylori олигосахаридные последовательности можно синтезировать ферментативно под действием гликозилтрансфераз, или получить трансгликозилированием, катализируемым гликозидазой или трансгликозидазой (Ernst et al., 2000). Можно заложить специфичность данных ферментов и применение кофакторов. Специфические модифицированные ферменты можно использовать для проведения более эффективного синтеза, например, гликосинтазу модифицируют только для проведения трансгликозилирования. Органический синтез сахаридов и конъюгатов или конъюгатов, описанный здесь, аналогичен известным способам (Ernst et al., 2000). Сахариды можно выделить из естественных источников и превратить химически или ферментативно в связывающие Helicobacter pylori соединения. Естественные олигосахариды можно выделить из молока, продуцированного различными жвачными. Для получения сахаридов можно использовать трансгенных животных таких, как коровы или микроорганизмы, экспрессирующих ферменты гликозилирования.
Моносахаридные остатки уроновой кислоты, описанные в изобретении, можно получить способами, известными в данной области. Например, гидроксильную группу при 6-углероде N-ацетилглюкозамина или N-ацетилгалактозаминов можно окислить химическим путем в карбоновую кислоту. Окисление можно провести с надлежаще защищенным олигосахаридом или моносахаридом.
В предпочтительном воплощении незащищенный полимер или олигомер, включающий гексозы, N-ацетилгексозамины или гексозамины, в которых связь между моносахаридами, не находится между 6 атомами углерода, представляет:
1) окисленный в соответствующий полимер остатков уроновой кислоты или полимер, включающий мономеры 6-альдегидомоносахаридов;
2) необязательно дериватизированный из карбоксильной группы или 6-альдегидной группы предпочтительно в амид или амин и
3) гидролизованный до моносахаридов уроновой кислоты или моносахаридов производных уроновой кислоты.
Способы окисления моносахаридных остатков в уроновые кислоты и гидролиза амина или полимеров уроновой кислоты химическим или ферментативным путем хорошо известны в данной области. Особо предпочтительно использовать способ для олигомеров или полимеров целлюлозы, крахмала или других гликанов с 1-2- или 1-3-, или 1-4-связями, хитина (GlcNAc-полимера) или хитозана (GlcN-полимера), которые являются промышленно доступными в больших количествах, или полисахариды на основе N-ацетилгалактозамина/галактозамина (например, происходящие из бактерий) окисляют в соответствующий 1-4-связанный сахарид. Данный способ можно также применить к полимерам галактана. Производные уроновой кислоты можно также получить из естественных полимеров, включающих уроновые кислоты, таких, как пектины или глюкуроновая кислота, содержащие полисахариды бактерий, включая N-ацетилгепарин, экзополисахариды бактериального типа, производные гиалуроновой кислоты и хондроитина. Данный способ включает:
1) дериватизацию карбоксильных групп полисахарида, предпочтительно