Способ диагностики рака
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к онкологии. Способ обеспечивает возможность исследования живых, неокрашенных и неактивированных клеток в автоматическом режиме, за счет чего повышается достоверность выявления раковых клеток, точность и воспроизводимость измерений. Осуществляют диагностику рака путем исследования прижизненной динамики клеток с помощью динамической когерентной фазовой микроскопии. Определяют интенсивность и спектральные характеристики флуктуации фазовой толщины ядрышек клеток и при наличии характерных спектральных компонентов в диапазоне 8,0-20,0 Гц диагностируют присутствие в образце клеток рака. 7 ил.
Реферат
Изобретение относится к медицине, в частности к способам физического анализа биологических материалов, и может быть использовано для диагностики рака в цитологических или гистологических образцах ткани.
Известен способ спектроскопического определения характеристик биологического материала, включающий исследование функционального состояния по крайней мере одного компонента крови или другой физиологической жидкости путем взаимодействия образца клеток с активирующим агентом, непосредственного воздействия ИК-луча света на образец клеток, анализ ИК-спектра образца по крайней мере в одном интервале частот (WO 1997/032194). Недостатком известного способа является использование активирующего агента, предшествующее воздействию ИК-луча света на образец клеток, что с большой вероятностью может привести к искажению характеристик жизнеспособности исследуемых клеток. Кроме того, в описании известного способа декларирована возможность идентификации раковых клеток, однако, не представлено никаких параметров, характеризующих присутствие таковых в исследуемом образце.
Известен также способ диагностики онкологических заболеваний (RU 2219549 публ. 20.12.2003 Бюл. №35), в соответствии с которым проводят исследование слабого водного раствора нативной плазмы или нативной сыворотки крови пациента методом лазерной корреляционной спектроскопии. Определяют вероятностную плотность распределения амплитуды флуктуации интенсивности светорассеяния в полосе частот 1:180 Гц. Выявляют ядро распределения и определяют его характеристические параметры: положение максимума, интенсивность, ширину и диагностический показатель, равный корреляционному произведению упомянутых характеристических параметров. Диагностируют онкологическое заболевание при выходе диагностического показателя за пределы интервала, принимаемого за норму. Недостатками известного способа являются большое количество параметров, используемых при диагностике онкологического заболевания. При этом величина каждого из них зависит от субъективных факторов, в частности от условий приготовления исследуемого препарата. Кроме того, исследованию подвергают лиофизированные препараты, прошедшие обработку кислотным и щелочным растворами. Перечисленные обстоятельства значительно снижают достоверность окончательного результата исследований.
Наиболее близким к заявляемому изобретению способом того же назначения является способ дифференциальной диагностики стадий канцерогенеза (RU 2234099, публ. 10.08.2004, Бюл. №22), включающий исследование гистологических срезов ткани новообразования на компьютерном анализаторе. На полученном изображении выделяют ядра малых лимфоцитов, определяют их плоидность, принимают ее за стандарт, с использованием которого проводят компьютерное определение средней плоидности ядер клеток ростковых зон новообразования. Принят за прототип.
Недостатками известного способа, препятствующими достижению указанных ниже технических результатов, являются:
- методика требует специальной окраски по Фельгену, что исключает возможность работы с «живыми» нефиксированными клетками (исследованию подвергают фиксированные клетки, утратившие жизнеспособность);
- необходимость предварительно установленного стандарта плоидности ядер малых лимфоцитов.
Заявляемое изобретение направлено на решение задачи диагностики рака в цитологических или гистологических образцах ткани.
Использование в клинической практике заявляемого способа позволяет достичь нескольких технических результатов:
- возможность исследования живых, неокрашенных и неактивированных клеток;
- повышение достоверности выявления раковых клеток в цитологических или гистологических образцах ткани,
- повышение точности и воспроизводимости измерений,
- возможность проведения точных морфометрических измерений в автоматическом режиме.
Указанные технические результаты при осуществлении изобретения достигаются за счет того, что так же как в известном способе диагностику рака осуществляют путем исследования ядер клеток с помощью компьютерного анализатора Особенность изобретения заключается в том, что осуществляют исследование прижизненной динамики клеток путем динамической когерентной фазовой микроскопии (далее -ДКФМ), определяют интенсивность и спектральные характеристики флуктуации фазовой толщины ядрышек клеток и при наличии характерных спектральных компонентов в диапазоне 8,0 - 20,0 Гц диагностируют присутствие в образце клеток рака
Сущность изобретения заключается в следующем.
Способ ДКФМ позволяет получить количественные данные о морфометрических параметрах ядрышка отдельно взятой клетки - его поперечном размере, профиле фазовой толщины (далее - ФТ), а также произвести анализ прижизненной динамики клеток, в частности интенсивности локальных флуктуаций ФТ ядрышка.
Способ осуществляют с помощью когерентного фазового микроскопа (далее - КФМ), например «Эйрискан», который обеспечивает представление локальной разности хода лучей в цифровом виде, пригодном для обработки на компьютере. Локальное искривление волнового фронта, обусловленное оптическими свойствами клетки, измеряют в каждой точке изображения компенсационным методом путем сравнения с плоским волновым фронтом опорной волны. В КФМ клетка представлена фазовым изображением, подобным изображению рельефа на гипсометрических географических картах. Более плотные органеллы клетки (ядро и ядрышки) в фазовом изображении представлены участками большей ФТ по сравнению с цитоплазмой и окружающим фоном. Высокая точность и воспроизводимость измерений ФТ позволяет обнаружить ее систематические изменения, связанные с внутренним метаболизмом или внешними факторами, например, введением лекарственных препаратов.
При исследовании образца клеток в качестве источника света используют гелий-неоновый лазер (632,8 нм). Для регистрации интерференционного сигнала и его аналого-цифрового преобразования в локальные значения фазы используют координатно-чувствительный фотоприемник, например Ли 620, и электронный блок. Анализ фазовых изображений и флуктуации оптической разности хода проводят на компьютере.
Компьютерная обработка позволяет получить фазовые изображения клеток в нормированных на длину волны значениях (топограммы), в которых ФТ закодирована в цветовой гамме. На фазовом изображении клетки оптически более плотное ядрышко проявляется в виде локального увеличения кажущейся толщины, более заметное в трехмерном 3-D изображении или в профиле ФТ, полученном в результате диаметрального сечения 3-D вдоль скан-линии изображения. В профиле фазовой толщины отчетливо виден рельеф ядра клетки и выступающее ядрышко. В результате в сечении профиля ядра могут быть измерены основные морфометрические параметры ядрышка - его поперечный размер и ФТ.
Способ ДКФМ не только позволяет изучать строение отдельных клеток и их органелл с высоким пространственным разрешением (50-100 нм), но и следить за изменением их функционального состояния с временным разрешением 1-10 мс.
КФМ «Эйрискан» позволяет также использовать способ ДКМФ для наблюдения за процессом флуктуаций ФТ ядрышка и измерения ФТ путем многократного периодического сканирования вдоль фиксированной на изображении клетки или ядрышка скан-линии.
Изменения ФТ ядрышка отдельной клетки можно наблюдать в реальном времени на экране монитора. Для записи динамических процессов на фазовом изображении клетки проводят линию сечения (скан-линия), вдоль которой последовательно во времени записывают значения ФТ ядрышка. Информация об изменениях ФТ на ограниченном скан-лииией участке ядрышка может быть представлена после компьютерной обработки в виде двумерных массивов трек-диаграмм.
Компьютерный анализ трек-диаграмм временных изменений ФТ ядрышка вдоль скан-линии позволяет получить следующие динамические количественные показатели жизнедеятельности для нормальных и раковых клеток:
- распределение интенсивности флуктуации в пределах ширины профиля ФТ;
- пространственно-временные характеристики «событий»;
- спектр флуктуаций с выделением наиболее интенсивных спектральных компонентов.
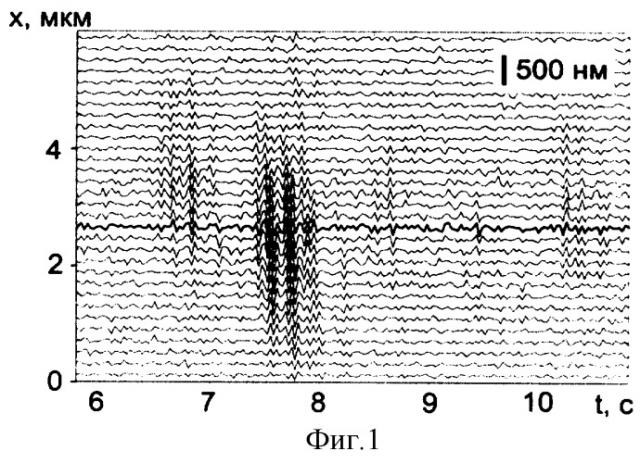
На фиг.1 представлен участок пространственно-временного портрета с сигналами в виде локальных «событий».
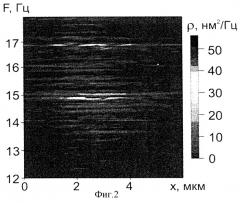
Сечение трек-диаграммы вдоль оси времени представляет собой регистограмму изменения ФТ в выбранной точке скан-линии, проведенной на изображении клетки. Пространственно-временная характеристика «событий» представляет собой совокупность регистограмм изменений ФТ в различных точках изображения клетки. Затем каждую из полученных регистограмм подвергают спектральному анализу и строят спектры флуктуации с выделением наиболее характерных спектральных компонент. Данную процедуру проводят для различных областей клетки, при этом совокупность таких спектров позволяет построить спектральный портрет. фиг.2 представляет собой спектр флуктуаций ядрышка, на котором отчетливо просматриваются компоненты с высокой локальной спектральной плотностью.
Использование метода ДКФМ предоставляет следующие преимущества для исследования микроскопических изображений клеток. Прежде всего это возможность исследования живых, неокрашенных клеток, что значительно уменьшает вероятность искажения реальной картины и увеличивает достоверность диагностики. Высокое пространственное разрешение (50-100 нм) используемой аппаратуры предоставляет возможность получения четкого изображения контуров структурных элементов клетки: цитоплазмы, ядра, ядрышек, что, в свою очередь, позволяет проводить точные морфометрические измерения в автоматическом режиме. При исследовании клеток рака молочной железы установлено, что их размер составляет от 8 до 24 мкм в зависимости от гистологической формы рака, обнаруживаются ядрышки, размер которых составляет 2 мкм. В то же время размер нормальных клеток составляет от 9 до 16 мкм, ядрышки обнаруживаются редко. Таким образом, традиционная морфометрия не позволяет отличить нормальные клетки от опухолевых. ДКФМ предоставляет возможность исследования оптических свойств ядра и цитоплазмы, позволяет более детально изучать структуру цитоплазмы, хроматина, определять внутриядерные и цитоплазменные включения. В частности, при использовании заявляемого способа установлено, что в клетках рака молочной железы хроматин грубозернистый, распределен неравномерно, в ядре иногда обнаруживались включения цитоплазменной природы, в цитоплазме четко определяются включения слизи. У нормальных клеток хроматин мелкозернистый, распределен равномерно, внутриядерные и внутрицитоплазменные включения, как правило, отсутствуют. Использование КФМ предоставляет возможность получения объемных изображений клеток и исследования поверхности клетки и ядра, а также произвести измерения ФТ ядрышка отдельной клетки и интенсивности ее флуктуаций.
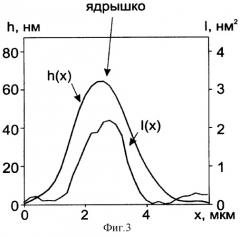
Авторами изобретения установлена зависимость интенсивности флуктуаций и спектра флуктуации ФТ от функционального состоянии клеток и от характера метаболических процессов, протекающих в нормальных клетках и клетках рака. На фиг.3 представлено распределение интенсивности флуктуации ФТ l(х)) относительно профиля фазовой толщины клетки h(x). При исследовании интенсивности флуктуации ФТ в профиле ФТ видна локализация наибольших ее значений вблизи центра ядрышка. Обнаружена четкая корреляция между спектрами флуктуации ФТ, определенными на ядрышках, и функциональным состоянием клеток. Установлено, что в спектрах флуктуации здоровых клеток преобладают более низкочастотные компоненты по сравнению с клетками рака. Для нормальных клеток характерные частоты наиболее интенсивных спектральных компонент находятся в интервале 0,2-5,7 Гц и преимущественно имеют значение 0,8 и 1,6 Гц.
Для клеток рака характерны спектральные компоненты в интервале более высоких частот 8,0-20,0 Гц.
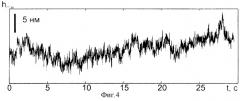
На фиг.4 и фиг.5 представлены регистограмма флуктуаций ФТ ядрышка здоровой клетки и ее Фурье-спектр, на котором отчетливо прослеживаются характерные частоты наиболее интенсивных спектральных компонент, имеющие значения 0,8; 1,6 и 3.9 Гц.
На фиг.6 и фиг.7 представлены регистограмма флуктуаций ФТ ядрышка клетки рака молочной железы и ее Фурье-спектр, на котором отчетливо прослеживаются характерные частоты наиболее интенсивных спектральных компонент, имеющие значения 8,0; 11,0; 11,5 и 17,3 Гц.
Заявляемый способ диагностики рака позволяет получить недоступную другим методам информацию о процессах в клетке, получить объективные и достоверные данные для принятия диагностических решений, не требует предварительной трудоемкой подготовки образца исследуемых клеток.
Способ осуществляют следующим образом.
Материалом для исследования послужили 55 препаратов: 43 препарата рака молочной железы и 12 препаратов окружающих тканей молочной железы, полученные от 11 больных раком молочной железы.
Для осуществления КФМ необходимо выполнение следующих условий:
- достаточная концентрация клеток (не менее 8,0·106 клеток в 800 мкл);
- получение монослоя;
- сохранение жизнеспособности клеток в течение процедуры микроскопирования.
Жизнеспособность клеток определяют по наличию у них динамических показателей, в частности флуктуации фазовой толщины, отражающих наличие внутреннего метаболизма. Для приготовления препарата используют операционный материал. Возможно использование клеточного материала, полученного с помощью тонкоигольной биопсии. С только что удаленной опухоли, а также с окружающей опухоль ткани скальпелем делают соскоб или вырезают кусочек ткани. Содержимое соскоба (кусочек ткани) помещают в среду Хенкса не более чем на сутки. Микроскопию проводят в день взятия материала.
Материал для исследования представляет собой суспензию клеток, которую оставляют при комнатной температуре не менее чем на два часа для осаждения клеток. Если материал представляет собой кусочек ткани, то его механически расщепляют.
По периметру полированной кремниевой подложки ватной палочкой наносят тонкий слой воска для предотвращения растекания и испарения препарата. Затем 3-4 мкл неокрашенной клеточной суспензии помещают на кремниевую подложку и накрывают покровным стеклом. Приготовленный таким образом препарат помещают в камеру (зазор 20 мкм), которая располагается на предметном столе КФМ, имеющего оптическое устройство, позволяющее идентифицировать отдельные клетки для дальнейшего измерения стационарных и динамических показателей. Для исследования пригодны клетки с хорошо различимой цитоплазмой, ядром и ядрышком. В каждом препарате исследованию подвергают не менее пяти клеток.
Далее производят исследование морфологии и прижизненной динамики клеток.
Анализ получаемых фазовых изображений и флуктуаций ФТ производят в соответствии со специальной компьютерной программой.
В фазовом изображении клетки оптически более плотное ядрышко проявляется в виде уплотнения, четко выделяются цитоплазма, ядро, ядрышко.
Проводят сечения трехмерного изображения клеток, позволяющие получить профили фазовой толщины вдоль ядрышек и вычислить их основные морфометрические параметры: поперечный размер и ФТ
С помощью КФМ «Эйрискан» осуществляют ДКФМ - измеряют величину флуктуаций ФТ вдоль скан-линии-S, фиксированной на изображении клетки в области ядрышка, определяют параметры флуктуаций ФТ ядрышка путем периодического во времени сканирования вдоль выбранной скан-линии-S. Длина скан-линий составляет от 6 до 64 пикселей. Продолжительность каждого измерения 30 сек. Изменение ФТ наблюдают в реальном времени на экране монитора или после обработки двухмерных массивов трек-диаграмм, которые содержат информацию об изменениях ФТ на участке ядрышка, ограниченном скан-линией. Сечение трек-диаграммы вдоль оси времени представляет собой регистограмму изменения ФТ в выбранной точке скан-линий, проведенной на изображении клетки в области ядрышка. Затем регистограмму подвергают спектральному анализу и строят спектры флуктуаций с выделением наиболее характерных спектральных компонент.
Клинический пример
В двух случаях у больных С.(36 лет) и К. (39 лет) до операции цитологически поставлены диагнозы фиброаденомы с предраковой пролиферацией эпителия и фиброаденомы, подозрительной по переходу в рак. Обе пациентки прооперированы. Сразу после операции скальпелем сделаны соскобы с опухолей и клеточный материал помещен в две пробирки (эппиндорф) со средой Хенкса. Микроскопия была проведена через два часа после взятия клеточного материала. Материал для исследования представлял собой суспензию клеток. Были приготовлены два препарата, т.е. по одному для каждой больной. На две полированные кремниевые подложки, по периметру ватной палочкой был нанесен тонкий слой воска для предотвращения растекания и испарения препаратов. Затем из каждой пробирки 3-4 мкл клеточной суспензии были нанесены на кремниевую подложку, которая накрывалась покровным стеклом. Каждый из приготовленных таким образом препаратов был подвергнут визуальному контролю через специальное оптическое приспособление, встроенное в КФМ для обнаружения отдельно лежащих клеток. В каждом препарате исследованию было подвергнуто от 5 до 10 клеток, после чего проводилась микроскопия с применением КФМ. Жизнеспособность клеток определялась по наличию изменений оптических свойств в течение времени.
Анализ фазовых изображений и флуктуаций ФТ проводился на компьютере. Вдоль фиксированной на изображении ядрышка скан-линии проводилось многократное периодическое во времени сканирование. Каждое измерение продолжалось 30 с. Изменение ФТ наблюдались в реальном времени на экране монитора и строились трек-диаграммы, содержащие информацию об изменении ФТ на ограниченном скан-линией участке ядра.
При сопоставлении полученных спектров флуктуаций, представленных трек-диаграммами, были выявлены характерные различия. Для всех клеток, содержащихся в препарате пациентки С., было обнаружено, что частоты наиболее интенсивных спектральных компонентов находятся в интервале 0,2-6,0 Гц. Таким образом, у больной С.был подтвержден диагноз фиброаденомы. У больной К. характерные частоты наиболее интенсивных спектральных компонентов находились в интервале 8,0-20 Гц. У больной в итоге поставлен диагноз высокодифференцированного протокового рака молочной железы. Оба диагноза затем были подтверждены гистологически.
Таким образом, заявляемый способ обладает значительными преимуществами по сравнению с известными способами того же предназначения и отвечает критериям патентоспособности.
Способ диагностики рака, включающий исследование ядер клеток с помощью компьютерного анализатора, отличающийся тем, что осуществляют исследование прижизненной динамики клеток путем динамической когерентной фазовой микроскопии, определяют интенсивность и спектральные характеристики флуктуации фазовой толщины ядрышек клеток, и при наличии характерных спектральных компонентов в диапазоне 8,0-20,0 Гц диагностируют присутствие в образце клеток рака.